2. 达州职业技术学院, 达州 635000;
3. 云南农业大学香料研究所, 昆明 650201
2. Dazhou Vocational and Technical College, Dazhou 635000, China;
3. Institute of Spices Yunnan Agricultural University, Kunming 650201, China
养猪业在我国农业产业经济中占据主导地位[1]。仔猪是现代化养猪生产的核心,其健康状况对后期的生长发育具有极其重要的影响[2]。其中,肠道健康是仔猪生长发育和快速生长的基础[3]。天然植物及其提取物作为饲料添加剂具有来源天然和不易产生耐药性的特点,同时又具有促进畜禽生长、提高免疫力、抗应激、改善肠道健康的作用。
博落回可用于治疗疥癣、阴道滴虫及杀虫灭蛆等,最早记载于唐人陈藏器撰写的《本草拾遗》中[4]。从博落回中分离得到的血根碱(sanguinarine,SG)是一种苯菲啶异喹啉生物碱,具有抗炎、抑菌、提高机体免疫力、改善肠道健康等功能[5-7]。SG作为饲料添加剂可部分替代抗生素,且SG的吸收快、分布快、代谢快,生物利用度较低,机体残留量少[8-10]。研究发现SG使鸡小肠中CD3细胞数量减少,黏膜损伤减轻,从而有助于预防肠道细菌感染[11]。肉鸡饲粮中添加SG可提高肉鸡的生长性能[12]。断奶仔猪饲粮中添加SG可提高仔猪空肠和回肠绒毛高度,改善肠黏膜形态,提高小肠黏膜免疫功能,从而提高仔猪的平均日增重和平均日采食量[13-14]。
核转录因子-κB(nuclear factor kappa B,NF-κB)是细胞核内重要的核转录因子,它在许多细胞刺激介导的细胞信息转录调控中起核心作用。NF-κB家族的转录亚基包括p65、p50、p52、RelB和c-Rel,所有成员间可形成同源或异源二聚体,在细胞中主要以p50/p65二聚体形式存在,其中p65亚基含有转录激活结构域[15-16]。NF-κB介导的信号通路参与体内多种反应过程,被认为是经典的炎症相关信号通路[17]。目前,SG影响仔猪肠道炎症的作用机制尚不清楚。因此,本研究提出SG通过NF-κB信号通路调控仔猪小肠黏膜上皮细胞(IPEC-J2细胞)抗炎功能的设想,旨在阐明SG通过抑制NF-κB信号通路减轻IPEC-J2细胞炎症的分子机制,以期为SG作为猪用饲料添加剂调控仔猪肠道健康提供理论依据。
1 材料与方法 1.1 试验材料SG,分子式为C20H14NO4,相对分子质量为332.33,含量为99.7%,购自上海源叶生物科技有限公司;IPEC-J2细胞购自北纳创联生物技术研究院;过硫酸胺、二甲基亚砜(dimethyl sulfoxide,DMSO)、脂多糖(lipopolysaccharide,LPS)购自Sigma公司;胎牛血清(fetal bovine serum,FBS)购自Gibco公司,DMEM高糖培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、胰蛋白酶购自Biological公司;白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)试剂盒购自上海羽朵生物有限公司;核转录因子-κB抑制蛋白(inhibitor of NF-κB,IκB)α、p65、辣根过氧化物酶(horseradish peroxidase,HRP)抗体购自Cell Signaling Technology公司;β-肌动蛋白(ACTB)购自上海茁彩生物科技有限公司。
1.2 试验方法 1.2.1 试验设计与分组首先采用单因素试验设计,研究SG对IPEC-J2细胞促生长作用的适宜浓度和时间以及构建IPEC-J2细胞致炎模型LPS的适宜浓度和时间。首先,以不同浓度(0、0.125、0.250、0.500、1.000、2.000 μg/mL)SG处理IPEC-J2细胞24 h,研究其对IPEC-J2细胞活性的影响;并进一步研究0.500 μg/mL SG下不同时间(0、8、16、24、32、40 h)对IPEC-J2细胞活性的影响。其次,以不同浓度(0、0.2、1.0、5.0、25.0、125.0 μg/mL)LPS处理IPEC-J2细胞24 h,研究其对IL-6、IL-8 mRNA相对表达量和细胞上清中IL-6、IL-8含量的影响;并进一步研究5.0 μg/mL LPS下不同时间(1、3、6、9、12 h)对IPEC-J2细胞IL-8 mRNA相对表达量和细胞上清中IL-8含量的影响。
在确定SG对IPEC-J2细胞的适宜浓度、时间和构建LPS对IPEC-J2细胞致炎模型的基础上[18-20],分别检测对照组(无添加)、LPS致炎模型细胞组(LPS组,5.0 μg/mL LPS处理1 h)和适宜浓度SG+LPS致炎模型细胞组(SG+LPS组,5.0 μg/mL LPS处理1 h和0.500 μg/mL SG处理24 h)在NF-κB信号通路中相关基因和蛋白表达及其产物含量。
1.2.2 IPEC-J2细胞培养IPEC-J2细胞采用含5 mL培养基(含0.1%青链霉素抗体、10%FBS和90%DMEM高糖培养基)的培养皿(25 cm2)培养于37 ℃、5%的CO2培养箱,2 d传代1次。
1.2.3 细胞活性检测台盼蓝染色计数法:取对数生长期的IPEC-J2细胞,PBS清洗2~3次,胰蛋白酶消化4~6 min;加入含血清与双抗的培养基3~4 mL悬浮细胞,充分混匀,静置待用;取200 μL的细胞液和200 μL的台盼蓝进行充分混匀,混合液静置;使用细胞计数板前需用酒精棉球进行清理,取10 μL的混合液打入细胞计数板,选取细胞计数板上四个角的方格进行计数,并取平均值。
1.2.4 引物设计与合成根据GenBank中猪的ACTB、IL-8、IL-6、核转录因子-κB1(NF-κB1)、核转录因子-κB2(NF-κB2)、RelB、核转录因子-κB亚基1(NF-κB1A)、核转录因子-κB激酶抑制剂ε(IKKε)、肿瘤坏死因子-α诱导蛋白3(TNFAIP3)相关基因序列信息,利用Primer Premier 5.0设计引物,由上海捷瑞生物工程有限公司合成,引物序列如表 1所示。
|
|
表 1 基因引物序列 Table 1 Primer sequences of genes |
实时荧光定量PCR体系见表 2。实时荧光定量PCR反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃变性30 s,反应40个循环。
|
|
表 2 实时荧光定量PCR体系 Table 2 Quantitative real-time PCR system |
按照IL-6、IL-8和TNF-α的ELISA检测试剂盒操作步骤进行检测。
1.2.7 蛋白质免疫印迹(Western Blot)分别提取IPEC-J2细胞总蛋白、胞浆蛋白和核蛋白。采用10%聚丙烯酰氨凝胶电泳分离蛋白。湿转法将蛋白转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上。将膜用TBS-吐温20(TTBS)中漂洗,漂洗后用5%脱脂奶封闭1 h。分别用IκBα、p65一抗4 ℃孵育过夜,ACTB作为内参,选用HRP标记的羊抗鼠抗体4 ℃孵育2 h,暗室曝光显影。
1.3 统计分析采用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),差异显著者采用Duncan氏法进行多重比较,各组数据以“平均值±标准误”表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 SG对IPEC-J2细胞活性的影响 2.1.1 不同浓度SG对IPEC-J2细胞活性的影响由图 1可见,1.000和2.000 μg/mL的SG处理IPEC-J2细胞24 h,细胞明显皱缩和死亡(图 1-E~图 1-F),0~0.500 μg/mL的SG处理IPEC-J2细胞24 h后细胞形态无明显变化(图 1-A~图 1-D)。由表 3可见,2和4倍稀释条件下,与0 μg/mL SG组相比,1.000和2.000 μg/mL SG组的细胞数量显著或极显著减少(P < 0.01),0.500 μg/mL SG组细胞数量极显著增加(P < 0.01)。
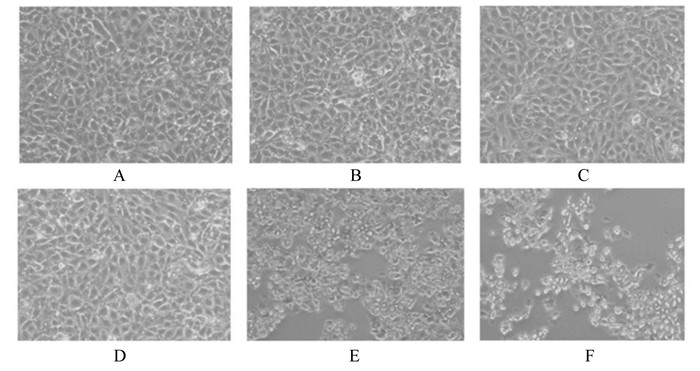
|
A~F的SG浓度分别为:0、0.125、0.250、0.500、1.000、2.000 μg/mL。 SG concentrations of A to F were: 0, 0.125, 0.250, 0.500, 1.000 and 2.000 μg/mL. 图 1 不同浓度SG处理IPEC-J2细胞24 h的图片 Fig. 1 Pictures of different concentrations of SG affected on IPEC-J2 cells for 24 h (200×) |
|
|
表 3 不同浓度SG对IPEC-J2细胞24 h活性的影响 Table 3 Effects of different concentrations of SG on IPEC-J2 cells activity for 24 h |
由表 4可见,与0 h时相比,IPEC-J2平均细胞数量在16、24、32、40 h时极显著升高(P < 0.01),且在24 h时达到最高值。
|
|
表 4 0.5 μg/mL的SG在不同时间对IPEC-J2细胞活性的影响 Table 4 Effects of 0.5 μg/mL SG on IPEC-J2 cell activity in different time |
由图 2可见,与0 μg/mL LPS组相比,1.0、5.0、25.0、125.0 μg/mL LPS组IPEC-J2细胞IL-6 mRNA相对表达量极显著上调(P < 0.01),1、5、25 μg/mL LPS组IL-8 mRNA相对表达量显著或极显著上调(P < 0.05或P < 0.01),且5 μg/mL LPS组IL-6、IL-8 mRNA相对表达量最高。不同浓度LPS组细胞上清液中IL-6、IL-8含量均高于对照组,5 μg/mL LPS组细胞上清液中IL-6和IL-8含量极显著高于对照组(P < 0.01)。
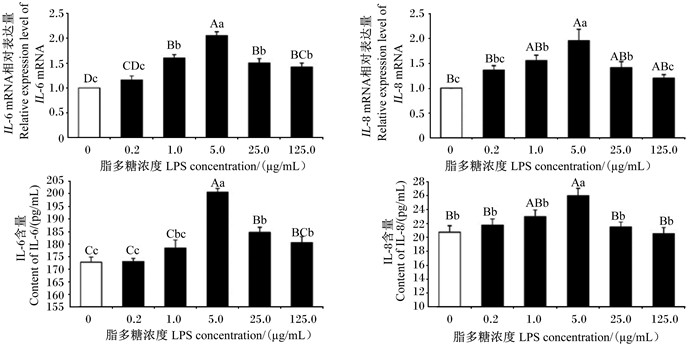
|
数据柱形标注不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01)。下图同。 Value columns with different small letters mean significant difference (P < 0.05), with different capital letter superscripts mean significant difference (P < 0.01). The same as below. 图 2 不同浓度LPS处理IPEC-J2细胞24 h对IL-6、IL-8 mRNA相对表达量和细胞上清液中IL-6、IL-8含量的影响 Fig. 2 Effects of different concentrations of LPS on IL-6, IL-8 mRNA relative expression levels and cell supernatant IL-6, IL-8 contents in IPEC-J2 cells for 24 h (n=3) |
由图 3可见,5 μg/mL LPS处理IPEC-J2细胞1、3、6 h的IL-8 mRNA相对表达量均极显著高于0 h(P < 0.01),5 μg/mL LPS处理IPEC-J2细胞1 h时细胞上清液中IL-8含量极显著高于0 h(P < 0.01),且5 μg/mL LPS处理IPEC-J2细胞1 h时IL-8 mRNA相对表达量和细胞上清液中IL-8含量最高。
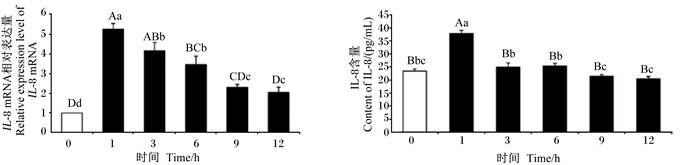
|
图 3 5 μg/mL LPS处理不同时间对IPEC-J2细胞IL-8 mRNA相对表达量和细胞上清液中IL-8含量的影响 Fig. 3 Effects of 5 μg/mL LPS treatment on IL-8 mRNA relative expression level and cell supernatant IL-8 content in IPEC-J2 cells at different time (n=3) |
由图 4可见,与对照组相比,LPS组细胞中IL-6、IL-8、NF-кB1A、NF-кB2、TNFAIP3、IKKε、NF-кB1、RelB mRNA相对表达量均极显著升高(P < 0.01);与LPS组相比,SG+LPS组细胞中IL-6、NF-кB1A、NF-кB2、TNFAIP3、IKKε、NF-кB1 mRNA相对表达量均极显著降低(P < 0.01),IL-8 mRNA相对表达量显著降低(P < 0.05)。
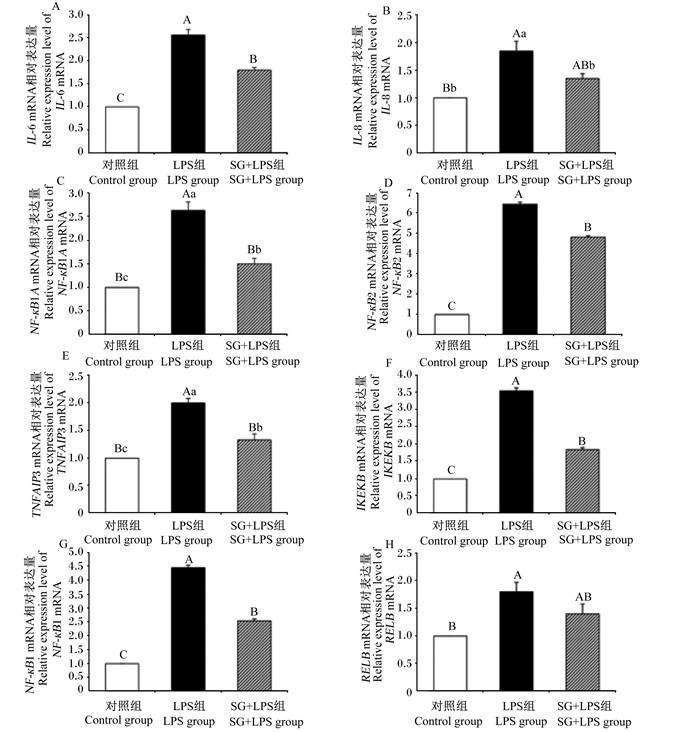
|
图 4 SG对IPEC-J2细胞NF-κB信号通路相关基因mRNA相对表达量的影响 Fig. 4 Effects of SG on relative expression levels of NF-κB signaling pathway related genes mRNA in IPEC-J2 cells (n=3) |
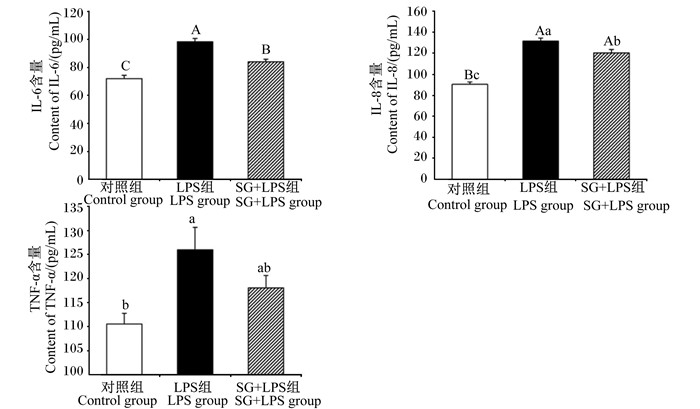
由图 5可见,与对照组相比,LPS组细胞上清液中IL-6、IL-8含量均极显著升高(P < 0.01),细胞上清液中TNF-α含量显著升高(P < 0.05);与LPS组相比,SG+LPS组细胞上清液中IL-6、IL-8含量显著或极显著降低(P < 0.05或P < 0.01)。
|
图 5 SG对IPEC-J2细胞上清液中IL-6、IL-8和TNF-α含量的影响 Fig. 5 Effects of SG on contents of IL-6, IL-8 and TNF-α in cell supernatant in IPEC-J2 cells (n=3) |
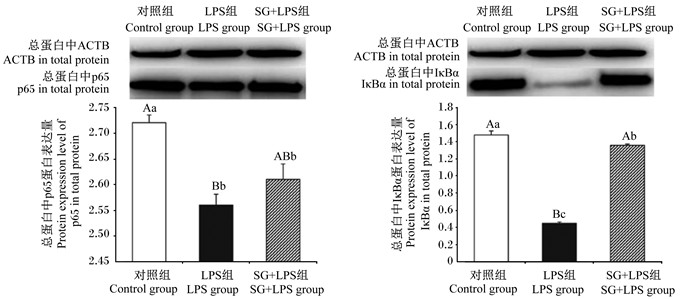
由图 6可见,与对照组相比,LPS组细胞总蛋白中IκBα、p65蛋白表达量极显著降低(P < 0.01);与LPS组相比,SG+LPS组细胞总蛋白中的IκBα蛋白表达量极显著升高(P < 0.01)。
|
图 6 SG对IPEC-J2细胞总蛋白中p65、IκBα蛋白表达量的影响 Fig. 6 Effects of SG on protein expression levels of p65, IκBα in total protein in IPEC-J2 cells (n=3) |
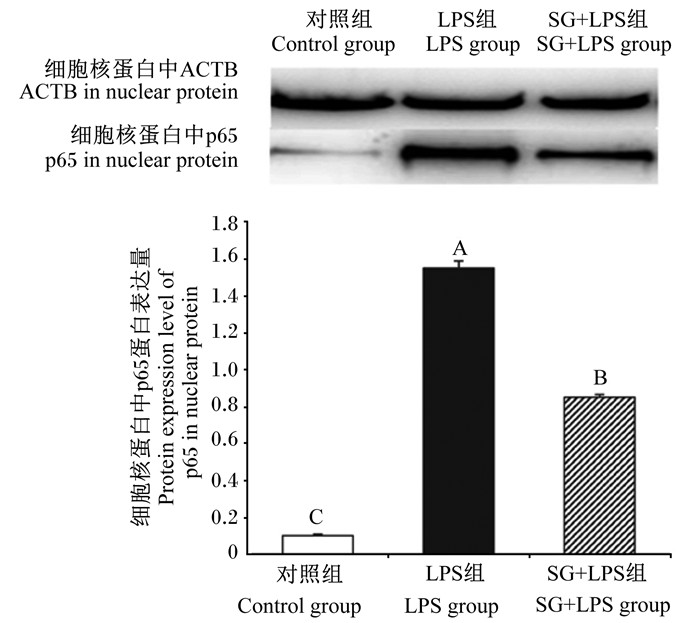
由图 7可见,与对照组相比,LPS组细胞核蛋白中p65蛋白表达量极显著升高(P < 0.01);与LPS组相比,SG+LPS组细胞核蛋白中p65蛋白表达量极显著降低(P < 0.01)。
|
图 7 SG对IPEC-J2细胞核蛋白中p65蛋白表达量的影响 Fig. 7 Effects of SG on protein expression level of p65 in nuclear protein in IPEC-J2 cells (n=3) |
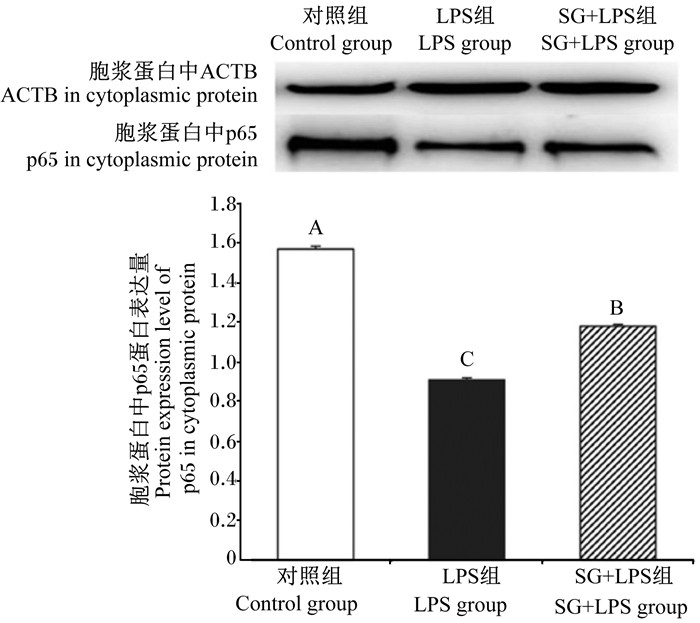
由图 8可见,与对照组相比,LPS组胞浆蛋白中p65蛋白表达量极显著降低(P < 0.01);与LPS组相比,SG+LPS组胞浆蛋白中p65蛋白表达量极显著升高(P < 0.01)。
|
图 8 8SG对IPEC-J2细胞胞浆蛋白中p65蛋白表达量的影响 Fig. 8 Effects of SG on protein expression level of p65 in cytoplasmic protein in IPEC-J2 cells (n=3) |
博落回提取物的主要有效成分SG早在1999年经农业部批准可作为饲用添加剂[21]。以SG为主要成分的博落回提取物开发注册为二类新中兽药[(2011)新兽药证字34号)],并获得了兽药添字批准文号[兽药添字(2012)180415250],2019年12月农业农村部组织修订的《药物饲料添加剂品种目录及使用规范》依然将博落回提取物作为药物饲料添加剂使用,成为饲料添加剂抗生素替代产品之一[22]。博落回提取物主要有效物质SG显著影响猪的增重、饲料转化率[23],其与益生菌联合应用具有预防肉鸡坏死性肠炎的作用[24]。SG具有抑菌、抗炎、促生长、抗寄生虫等多种生物活性,适用于鸡、猪、鱼的健康养殖,对我国养殖业和国民食品安全具有重要意义[7, 25-26]。
SG在体内外均有明显的抗炎作用,可减轻猪肠黏膜损伤,有助于预防肠道细菌感染[27],同时SG具有减少仔猪肠上皮细胞的水分流失和/或增强肠道水分和营养素吸收的功能[28]。研究发现,高浓度的SG对于细胞生长具有抑制作用,SG终浓度为5~10 μmol/L时可明显降低人乳腺癌MCF-7细胞存活率,并升高细胞内活性氧(reactive oxygen species,ROS)含量和含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-8、Caspase-9活性[29]。通过SG对IPEC-1细胞增殖影响的研究表明,0.25~4.00 μg/mL的SG对IPEC-1细胞的增殖有显著的抑制作用;而0.006 25~0.100 000 μg/mL的SG对IPEC-1细胞的增殖具有显著的促进作用,由此可见,低浓度的SG具有促进IPEC-1细胞增殖的作用[30]。本研究以0.5 μg/mL SG处理IPEC-J2细胞24 h后细胞数量达到最高值,表明SG对IPEC-J2细胞促生长作用的适宜浓度和时间分别为0.500 μg/mL和24 h。该结果的差异可能是不同细胞株对SG的耐受性不同所导致。
LPS作为一种典型肠毒素可引起猪产生细菌感染症状,是研究猪肠道炎症反应的常用药物[31]。本研究以5 μg/mL LPS处理IPEC-J2细胞1 h,IL-8 mRNA相对表达量最高,表明构建IPEC-J2细胞致炎模型LPS的适宜浓度和时间分别为5.0 μg/mL和1 h。
NF-кB信号通路是经典的炎症相关通路,激活后的NF-кB进入细胞核,与DNA模块上的特异蛋白结合,指示细胞形成具有炎症功能的蛋白复合物,最后这些蛋白激活炎症并介导炎症反应信号转导[32-33]。其活化途径是由LPS和致炎细胞因子如白细胞介素-1β(IL-1β)、TNF-α、细菌感染等触发,细胞表面的模式识别受体(pattern recognition receptor,PRR)识别病原体相关分子模式(pathogen-associated molecular patterns,PAMP),将侵袭信号传递给免疫细胞,诱导NF-κB表达增加,刺激因子产生的白细胞介素-1(IL-1)、IL-6、IL-8和TNF-α等细胞因子与受体结合,信号传导至核转录因子-κB抑制蛋白激酶(IKK)复合物,从而激活炎症反应[34]。IKK复合物一旦激活,IκB在丝氨酸(Ser)32和Ser36位被磷酸化[35],并通过26S蛋白酶体被降解,NF-κB二聚体从IκB/p50/p65复合物中解离,活化的NF-κB转移至细胞核中,与核内多种靶基因的启动子区结合,活化的NF-κB可调节细胞因子(IL-6、IL-8和TNF-α等)、细胞黏附分子和抗原递呈细胞表面主要组织相容性复合物-Ⅱ(MHC-Ⅱ)协同刺激因子的表达,还可刺激诱导型一氧化氮合酶(induced nitrogen monoxide synthase,iNOS)和其自身抑制物IкBα的表达[36]。研究表明,活化的NF-κB引起的炎症反应最终导致肠黏膜损伤[37]。所以,NF-κB活化是引起肠道黏膜损伤的关键生理因子。进一步的研究发现,中国钩吻中生物碱-钩吻碱子可抑制NF-κB活化,从而减轻肠道炎症反应[38]。本研究中SG+LPS组细胞中NF-κB1A、IKKε、NF-κB1等mRNA相对表达量及IL-6、IL-8含量显著或极显著低于LPS组,表明SG通过抑制IPEC-J2细胞炎症模型的NF-κB信号通路相关基因表达,减少IL-6、IL-8的分泌,减轻肠上皮细胞炎症损伤,降低了IPEC-J2细胞炎症症状。
在正常情况下,NF-κB位于细胞胞浆内,一般有2个功能亚单位,即p65和p50。NF-κB通常与IκB结合成无活性的形式存在于胞质中,当受氧化剂、细菌、毒素、炎症细胞因子的刺激后被激活,经历快速磷酸化后IκB被非特异性蛋白酶水解,从而使p65蛋白的核定位信号暴露,导致NF-κB快速向细胞核转移,结合在被诱导基因启动子序列上与之相同的κB位点,启动基因的转录和相应蛋白质的合成[39]。因此,p65蛋白的核转移是NF-κB活化的重要前提与关键步骤。研究发现,SG是NF-κB活化、IκBα磷酸化和降解的抑制剂[40],同时p65、p50等亚基蛋白的核转移有利于NF-κB的激活与炎症的发展[18]。本研究显示,与对照组相比,LPS组细胞总蛋白中IκBα蛋白表达量极显著降低,可能是因为IκBα发生了磷酸化,细胞核蛋白中p65蛋白表达量显著增加和胞浆中p65蛋白表达量极显著减少,提示LPS使NF-κB激活从而促进p65的核转移;与LPS组相比,SG+LPS组细胞核蛋白中p65蛋白表达量极显著下降,细胞胞浆蛋白中p65和细胞总蛋白中IκBα蛋白表达量极显著升高,说明SG抑制了p65核转移,降低IκBα磷酸化,进而抑制LPS致炎IPEC-J2细胞的NF-κB信号通路活化来降低炎症的表达。
4 结论SG可通过下调NF-κB信号通路中NF-κB1A、IKKε、NF-κB1、NF-κB2、TNFAIP3、IL-6、IL-8的表达,减少IL-6、IL-8的分泌,进而增强IPEC-J2细胞的抗炎能力;SG上调LPS致炎IPEC-J2细胞总蛋白中IκBα和胞浆蛋白中p65的蛋白表达,降低细胞核蛋白中p65的蛋白表达,抑制了p65向细胞核内转移,进而抑制NF-κB信号通路活化,减轻IPEC-J2细胞的炎症反应。
| [1] |
陆健, 王志刚, 黄萌萌, 等. 环保型健康养猪关键技术简述[J]. 中国畜牧业, 2019(4): 40-42. LU J, WANG Z G, HUANG M M, et al. Brief introduction of key technologies of environment-friendly and healthy pig raising[J]. China Animal Industry, 2019(4): 40-42 (in Chinese). |
| [2] |
夏欢, 张彩云, 高天增, 等. 饲喂方式和饲养温度对断奶仔猪生长性能的影响[J]. 中国畜牧杂志, 2010, 46(9): 56-59. XIA H, ZHANG C Y, GAO T Z, et al. Effects of feeding mode and room temperature on performances of weaning piglets[J]. Chinese Journal of Animal Science, 2010, 46(9): 56-59 (in Chinese). |
| [3] |
赵芳芳, 张爱忠, 姜宁, 等. 淀粉对动物胃肠道菌群影响的研究进展[J]. 黑龙江畜牧兽医, 2015(8): 71-74. ZHAO F F, ZHANG A Z, JIANG N, et al. Research progress in the effect of starch on the gastrointestinal microflora in animals[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(8): 71-74 (in Chinese). |
| [4] |
吴茂旺, 朱建华. 博落回药理研究与应用概况[J]. 基层中药杂志, 2002, 16(3): 46-48. WU M W, ZHU J H. General situation of pharmacological research and application of macleaya cordata[J]. Research and Practice on Chinese Medicines, 2002, 16(3): 46-48 (in Chinese). |
| [5] |
LIU Y, JIAO R, MA Z G, et al. Sanguinarine inhibits angiotensin Ⅱ-induced apoptosis in H9c2 cardiac cells via restoring reactive oxygen species-mediated decreases in the mitochondrial membrane potential[J]. Molecular Medicine Reports, 2015, 12(3): 3400-3408. DOI:10.3892/mmr.2015.3841 |
| [6] |
FU C X, GUAN G P, WANG H B. The anticancer effect of sanguinarine: a review[J]. Current Pharmaceutical Design, 2018, 24(24): 2760-2764. DOI:10.2174/1381612824666180829100601 |
| [7] |
KOSINA P, WALTEROVÁ D, ULRICHOVÁ J, et al. Sanguinarine and chelerythrine: assessment of safety on pigs in ninety days feeding experiment[J]. Food and Chemical Toxicology, 2004, 42(1): 85-91. DOI:10.1016/j.fct.2003.08.007 |
| [8] |
HU N X, CHEN M, LIU Y S, et al. Pharmacokinetics of sanguinarine, chelerythrine, and their metabolites in broiler chickens following oral and intravenous administration[J]. Journal of Veterinary Pharmacology and Therapeutics, 2019, 42(2): 197-206. DOI:10.1111/jvp.12729 |
| [9] |
ZDARILOVA A, VRUBLOVA E, VOSTALOVA J, et al. Natural feed additive of Macleaya cordata: safety assessment in rats a 90-day feeding experiment[J]. Food and Chemical Toxicology, 2008, 46(12): 3721-3726. DOI:10.1016/j.fct.2008.09.054 |
| [10] |
岳龙, 易孟霞, 贺朝, 等. 血根碱在不同畜禽机体内残留量评定的研究[J]. 饲料工业, 2015, 36(18): 53-55. YUE L, YI M X, HE C, et al. Study on sanguinarine residues in different animal's body[J]. Feed Industry, 2015, 36(18): 53-55 (in Chinese). |
| [11] |
PICKLER L, BEIRÃO B C B, HAYASHI R M, et al. Effect of sanguinarine in drinking water on Salmonella control and the expression of immune cells in peripheral blood and intestinal mucosa of broilers[J]. Journal of Applied Poultry Research, 2013, 22(3): 430-438. DOI:10.3382/japr.2012-00649 |
| [12] |
LEE K W, KIM J S, OH S T, et al. Effects of dietary sanguinarine on growth performance, relative organ weight, cecal microflora, serum cholesterol level and meat quality in broiler chickens[J]. The Journal of Poultry Science, 2015, 52(1): 15-22. DOI:10.2141/jpsa.0140073 |
| [13] |
CHEN J S, KANG B J, ZHAO Y R, et al. Effects of natural dietary supplementation with Macleaya cordata extract containing sanguinarine on growth performance and gut health of early-weaned piglets[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(6): 1666-1674. DOI:10.1111/jpn.12976 |
| [14] |
陈家顺, 康宝聚, 曾建国, 等. 血根碱对断奶仔猪生长性能、肠道形态结构及小肠黏膜免疫功能的影响[J]. 动物营养学报, 2018, 30(5): 1845-1853. CHEN J S, KANG B J, ZENG J G, et al. Effects of dietary sanguinarine on growth performance, intestinal mucosal morphology and immune function of small intestinal mucosa of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2018, 30(5): 1845-1853 (in Chinese). |
| [15] |
KARIN M, LIN A N. NF-κB at the crossroads of life and death[J]. Nature Immunology, 2002, 3(3): 221-227. DOI:10.1038/ni0302-221 |
| [16] |
LAWRENCE T. The nuclear factor NF-κB pathway in inflammation[J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6): a001651. |
| [17] |
FORMAN K, VARA E, GARCÍA C, et al. Influence of aging and growth hormone on different members of the NF-κB family and IκB expression in the heart from a murine model of senescence-accelerated aging[J]. Experimental Gerontology, 2016, 73: 114-120. DOI:10.1016/j.exger.2015.11.005 |
| [18] |
余长松, 贾刚, 邓秋红, 等. 胰高血糖素样肽-2对脂多糖应激的IPEC-J2细胞形态和紧密连接相关基因表达的影响[J]. 畜牧兽医学报, 2015, 46(4): 592-599. YU C S, JIA G, DENG Q H, et al. The effects of GLP-2 on cell morphology and the gene expression of tight junction in LPS stressed IPEC-J2 cells[J]. Chinese Journal of Animal and Veterinary Sciences, 2015, 46(4): 592-599 (in Chinese). |
| [19] |
肖定福, 钟佳, 刘进辉, 等. 壳寡糖对脂多糖诱导猪空肠上皮细胞氧化损伤的作用[J]. 动物营养学报, 2016, 28(7): 2090-2095. XIAO D F, ZHONG J, LIU J H, et al. Effects of chitooligosaccharide on lipopolysaccharide induced oxidative damage in epithelial cells of pig jejunum[J]. Chinese Journal of Animal Nutrition, 2016, 28(7): 2090-2095 (in Chinese). |
| [20] |
SHI L, FANG B, YONG Y H, et al. Chitosan oligosaccharide-mediated attenuation of LPS-induced inflammation in IPEC-J2 cells is related to the TLR4/NF-κB signaling pathway[J]. Carbohydrate Polymers, 2019, 219: 269-279. DOI:10.1016/j.carbpol.2019.05.036 |
| [21] |
张卫兵, 张蓉, 屠焰, 等. 血根碱的作用机制及其在动物营养上的应用效果[J]. 动物营养学报, 2017, 29(1): 27-33. ZHANG W B, ZHANG R, TU Y, et al. Sanguinarine: mechanism and its application in animal feeding[J]. Chinese Journal of Animal Nutrition, 2017, 29(1): 27-33 (in Chinese). |
| [22] |
侯博, 曾建国. 血根碱的生物学活性及博落回提取物在动物生产中的应用[J]. 动物营养学报, 2018, 30(2): 413-420. HOU B, ZENG J G. Biolological activities of sanguinarine and application of macleaya cordata extract in animal production[J]. Chinese Journal of Animal Nutrition, 2018, 30(2): 413-420 (in Chinese). |
| [23] |
BOROOJENI F G F, MÄNNER K, ZENTEK J. The impacts of Macleaya cordata extract and naringin inclusion in post-weaning piglet diets on performance, nutrient digestibility and intestinal histomorphology[J]. Archives of Animal Nutrition, 2018, 72(3): 178-189. DOI:10.1080/1745039X.2018.1459342 |
| [24] |
HUSSEIN E O S, AHMED S H, ABUDABOS A M, et al. Ameliorative effects of antibiotic-, probiotic- and phytobiotic-supplemented diets on the performance, intestinal health, carcass traits, and meat quality of Clostridium perfringens-infected broilers[J]. Animals, 2020, 10(4): 669. DOI:10.3390/ani10040669 |
| [25] |
ZHANG C, LING F, CHI C, et al. Effects of praziquantel and sanguinarine on expression of immune genes and susceptibility to Aeromonas hydrophila in goldfish (Carassius auratus) infected with Dactylogyrus intermedius[J]. Fish & Shellfish Immunology, 2013, 35(4): 1301-1308. |
| [26] |
ZHANG S M, COULTAS K A. Identification of plumbagin and sanguinarine as effective chemotherapeutic agents for treatment of schistosomiasis[J]. International Journal for Parasitology: Drugs and Drug Resistance, 2013, 3: 28-34. DOI:10.1016/j.ijpddr.2012.12.001 |
| [27] |
NI H J, MARTÍNEZ Y, GUAN G P, et al. Analysis of the impact of isoquinoline alkaloids, derived from Macleaya cordata extract, on the development and innate immune response in swine and poultry[J]. BioMed Research International, 2016, 2016: 1352146. |
| [28] |
KONG X F, WU G Y, LIAO Y P, et al. Dietary supplementation with Chinese herbal ultra-fine powder enhances cellular and humoral immunity in early-weaned piglets[J]. Livestock Science, 2007, 108(1/2/3): 94-98. |
| [29] |
路玉盼, 董宪喆, 冯霞, 等. 血根碱抑制人乳腺癌细胞MCF-7增殖的机制研究[J]. 中国药理学通报, 2016, 32(6): 858-862. LU Y P, DONG X Z, FENG X, et al. Sanguinarine inhibits cell proliferation in MCF-7 human mammary adenocarcinoma cells[J]. Chinese Pharmacological Bulletin, 2016, 32(6): 858-862 (in Chinese). |
| [30] |
李杰, 伍树松, 熊兴耀, 等. 博落回生物碱对猪肠上皮细胞增殖的影响[J]. 动物营养学报, 2014, 26(6): 1632-1637. LI J, WU S S XIONG X Y, XIONG X Y, et al. Effects of macleaya cordata alkaloids on intestinal porcine epithelial cells proliferation[J]. Chinese Journal of Animal Nutrition, 2014, 26(6): 1632-1637 (in Chinese). |
| [31] |
LIU Y L, HAN J, HUANG J J, et al. Dietary L-arginine supplementation improves intestinal function in weaned pigs after an Escherichia coli lipopolysaccharide challenge[J]. Asian-Australasian Journal of Animal Sciences, 2009, 22(12): 1667-1675. DOI:10.5713/ajas.2009.90100 |
| [32] |
OECKINGHAUS A, HAYDEN M S, GHOSH S. Crosstalk in NF-κB signaling pathways[J]. Nature Immunology, 2011, 12(8): 695-708. DOI:10.1038/ni.2065 |
| [33] |
SUN S C. The noncanonical NF-κB pathway[J]. Immunological Reviews, 2012, 246(1): 125-140. DOI:10.1111/j.1600-065X.2011.01088.x |
| [34] |
HAYDEN M S, GHOSH S. Signaling to NF-κB[J]. Genes & Development, 2004, 18(18): 2195-2224. |
| [35] |
TRAENCKNER E B, PAHL H L, HENKEL T, et al. Phosphorylation of human Ⅰ kappa B-alpha on serines 32 and 36 controls Ⅰ kappaB-alpha proteolysis and NF-kappa B activation in response to diverse stimuli[J]. The EMBO Journal, 1995, 14(12): 2876-2883. DOI:10.1002/j.1460-2075.1995.tb07287.x |
| [36] |
ANDRESEN L, JØRGENSEN V L, PERNER A, et al. Activation of nuclear factor κB in colonic mucosa from patients with collagenous and ulcerative colitis[J]. Gut, 2005, 54(4): 503-509. DOI:10.1136/gut.2003.034165 |
| [37] |
PENG C L, CAO C M, HE M C, et al. Soybean glycinin- and β-conglycinin-induced intestinal damage in piglets via the p38/JNK/NF-κB signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2018, 66(36): 9534-9541. DOI:10.1021/acs.jafc.8b03641 |
| [38] |
WU J, YANG C L, SHA Y K, et al. Koumine alleviates lipopolysaccharide-induced intestinal barrier dysfunction in IPEC-J2 cells by regulating Nrf2/NF-κB pathway[J]. The American Journal of Chinese Medicine, 2020, 48(1): 127-142. DOI:10.1142/S0192415X2050007X |
| [39] |
YAMAMOTO Y, GAYNOR R B. Therapeutic potential of inhibition of the NF-κB pathway in the treatment of inflammation and cancer[J]. The Journal of Clinical Investigation, 2001, 107(2): 135-142. DOI:10.1172/JCI11914 |
| [40] |
CHATURVEDI M M, KUMAR A, DARNAY B G, et al. Sanguinarine (Pseudochelerythrine) is a potent inhibitor of NF-κB activation, IκBα phosphorylation, and degradation[J]. The Journal of Biological Chemistry, 1997, 272(48): 30129-30134. DOI:10.1074/jbc.272.48.30129 |




