2. 湖南中医药大学科技创新中心, 长沙 410208
2. Science and Technology Innovation Center, Hunan University of Chinese Medicine, Changsha 410208, China
肝脏是机体重要的代谢器官,参与许多生物过程,包括新陈代谢、免疫反应、蛋白质合成、解毒和抗菌防御等[1]。多种刺激如病原微生物感染、毒素等可诱导肝脏发生炎症反应,造成慢性肝损伤,如不及时治疗可导致肝纤维化、肝硬化和肝细胞功能不全甚至肝癌等[2-3]。脂多糖(LPS)又称内毒素,是革兰氏阴性菌细胞壁的主要成分。肠道源性细菌内毒素是导致多种肝病炎症的重要机制之一,肝脏中LPS水平的增加会导致肝细胞损伤,刺激肝巨噬细胞释放许多促炎症因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1、IL-6等,诱导肝脏免疫反应,促进肝脏发生炎症、细胞发生凋亡甚至死亡等[4-7]。研究表明许多植物功能成分对肝脏损伤具有很好的保护作用[8-9]。由于植物功能成分具有安全、无应激、无残留等特性,深入研究其抗炎作用效果并了解其作用机制可为肝脏炎症的防治提供理论基础。白藜芦醇(RES)是一种非黄酮类多酚化合物,广泛存在于葡萄、花生、虎杖等70余种植物或其果实中,其可减轻因许多因素诱导的肝脏损伤[10-11]。李向阳等[12]研究发现,在卡介苗和LPS联合诱导的小鼠急性肝损伤模型中,RES可降低小鼠血清中丙氨酸转氨酶的活性及肝脏组织中丙二醛的含量,同时可提高肝脏组织中超氧化物歧化酶的活性和血清中一氧化氮的含量,对肝脏起到较好的保护作用。在四氯化碳诱导的急性肝损伤模型中,RES可通过抑制Nod样受体家族3(NLRP3)炎性体的活化及其下游的炎症级联反应减少肝小叶内坏死灶、中性粒细胞浸润及肝细胞的受损面积,从而减轻肝脏的损伤[13]。另外,RES可通过体内外抑制凋亡在多种组织和细胞中发挥其抗凋亡作用。在肝脏缺血再灌注损伤(HIRI)大鼠模型中,RES联合异丙酚抑制肝脏细胞凋亡,对HIRI大鼠肝脏产生了一定的保护作用[14]。本课题组前期研究发现,利用LPS急性暴露可破坏机体中炎症因子的平衡,诱导全身性的炎症反应[15],但RES预处理对LPS单独诱导的急性肝脏损伤的作用尚不完全明确。本研究利用LPS诱导小鼠急性肝脏损伤,研究不同浓度的RES预处理对肝脏组织病理学损伤、相关细胞凋亡因子及促炎症细胞因子表达的影响,探讨RES对肝脏损伤的预防效果及其可能的作用机制,以期为肝脏损伤的防治及RES在动物营养中的应用提供参考。
1 材料与方法 1.1 试验材料LPS[来源于大肠杆菌(Escherichia coli)O111∶B4]和RES购自美国Sigma公司;RIPA裂解液和苯甲基磺酰氟(PMSF)购自Solarbio公司;苏木精-伊红(HE)染液购自武汉赛维尔生物科技有限公司;TRIzolTM购自Invitrogen公司;HiScript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒、ChamQTM SYB® qPCR Master Mix试剂盒购自南京诺唯赞生物科技有限公司;BCA蛋白定量试剂盒和TUNEL染色试剂盒购自碧云天生物技术有限公司;3-磷酸甘油醛脱氢酶(GAPDH)、Bax和Bcl-2抗体购自Abcam公司;辣根过氧化物酶(HRP)标记的二抗购自Santa Cruz Biotechnology公司;聚偏氟乙烯(PVDF)膜购自Merck Millipore公司。
1.2 试验方法 1.2.1 试验动物分组及处理试验动物为健康的8周龄ICR系雄性小鼠,体重30~35 g,购于湖南斯莱克景达实验动物有限公司,自由摄食和饮水。适应性饲养1周后,将小鼠随机分为5组,即对照组、LPS组、RES-L+LPS组、RES-M+LPS组、RES-H+LPS组,每组10只。RES溶解于0.5%羧甲基纤维素钠溶液中,用时根据小鼠体重稀释为10(低剂量)、20(中剂量)和40 mg/kg BW(高剂量)3个剂量。RES-L+LPS组、RES-M+LPS组、RES-H+LPS组每天分别灌胃300 μL含10、20和40 mg/kg BW RES的0.5%羧甲基纤维素钠溶液,连续灌胃28 d,期间对照组和LPS组灌胃等体积的0.5%羧甲基纤维素钠溶液。预处理结束后,3个RES+LPS组和LPS组腹腔注射200 μL LPS(5.0 mg/kg BW),该剂量根据本课题组前期研究结果[15]确定,对照组腹腔注射等体积生理盐水,12 h后称重(20:00注射LPS,第2天08:00采样),脱颈处死,收集肝脏并称重,计算肝脏指数(肝脏指数=100×肝脏湿重/小鼠体重)。取所有小鼠肝脏组织,部分用10%多聚甲醛固定,用于制作石蜡切片;部分保存于-80 ℃,用于目的基因mRNA和目的蛋白表达分析。
1.2.2 HE染色法观察肝脏组织病理学将固定好的肝脏组织用常规梯度酒精进行脱水,二甲苯透明,浸蜡,石蜡包埋后切片,厚度为5 μm。将石蜡切片放入二甲苯脱蜡,依次经梯度酒精处理至复水后,分别用HE染液进行染色,脱水,中性树胶封片,在显微镜观察肝脏组织的病理学变化。
1.2.3 原位缺口末端标记(TUNEL)法检测肝脏细胞凋亡情况根据试剂盒提供的说明书进行操作,将肝脏组织石蜡切片二甲苯脱蜡2次,每次10 min,无水乙醇5 min,90%酒精2 min,70%酒精2 min,蒸馏水2 min。用20 μg/mL的蛋白酶K工作液室温作用20 min,磷酸盐缓冲液(PBS)洗涤3次,每次3 min;在样品上滴加50 μL预先配制的TUNEL检测液,于湿盒内37 ℃避光孵育1 h,PBS洗涤3次;滴加50 μL 4′, 6-二脒基-2-苯基吲哚(DAPI)染色液染核,用抗荧光淬灭剂封片后于荧光显微镜下观察,红色荧光为凋亡信号。利用Image J软件对荧光信号强度进行分析。
1.2.4 实时荧光定量PCR(RT-qPCR)法检测肝脏中炎症因子和凋亡相关基因的mRNA表达水平TRIzol法提取肝脏组织总RNA,并用NanoDrop 2000测定总RNA的浓度和纯度。用HiScript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒将总RNA进行反转录,获得的cDNA作为模板用于RT-qPCR检测。采用ChamQTM SYBR® qPCR Master Mix试剂盒进行RT-qPCR。β-肌动蛋白(β-actin)、TNF-α和IL-6引物信息同前期研究[12]所述,Bax和Bcl-2引物用Primer Premier 5.0软件进行设计,由华大基因股份有限公司合成,其中Bax引物序列(参考基因序列号NM_007527.3):上游引物5′-AGGATGCGTCCACCAAGAA-3′,下游引物5′-CAAAGTAGAAGAGGGCAACCAC-3′;Bcl-2引物序列(参考基因序列号NM_007527.3):上游引物5′-GGCTACGAGTGGGATGCT-3′,下游引物5′-TCAGGCTGGAAGGAGAAGAT-3′。以β-actin作为内参基因,采用2-△△Ct法计算目的基因的mRNA表达水平。
1.2.5 蛋白质免疫印迹(Western Blot)法检测肝脏中凋亡相关蛋白的表达水平取少量肝脏组织,加入RIPA细胞裂解液(含1% PMSF)后用匀浆机进行匀浆,冰上放置30 min,4 ℃、12 000 r/min离心10 min后吸取上清,进行蛋白质浓度测定、变性、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离以及转印。待蛋白转印至PVDF膜上后用0.2%明胶(溶于TBST)室温封闭1 h;随后加入一抗(Bax,1∶1 000稀释;Bcl-2,1∶1 000稀释;GAPDH,1∶1 000稀释)4 ℃孵育过夜;TBST充分洗涤后加入相应的HRP标记的二抗(1∶5 000稀释)室温孵育1 h,TBST洗涤;ECL发光液进行显色,于ChemiDocTM XRS+成像系统中检测蛋白质条带并用Image Lab软件条带灰度进行分析,目的蛋白以GAPDH为内参进行校正。
1.3 数据统计分析试验数据以平均值±标准差(mean±SD)表示,利用SPSS 17.0统计软件中的单因素方差分析(one-way ANOVA),两两比较采用LSD法检验,P < 0.05为差异显著,P < 0.01为差异极显著,用GraphPad Prism 5软件作图。
2 结果与分析 2.1 RES预处理对LPS诱导小鼠体重和肝脏指数的影响RES预处理对LPS诱导小鼠体重和肝脏指数的影响如表 1所示。低、中、高3个剂量的RES预处理小鼠28 d后,对小鼠的体重均无显著影响(P>0.05);用LPS诱导后,相对于对照组,LPS组和3个RES+LPS组小鼠体重均显著下降(P>0.05),但LPS组和3个RES+LPS组间无显著差异(P>0.05)。同时,LPS诱导后使小鼠肝脏湿重显著增加(P < 0.05);肝脏指数结果显示,LPS诱导可导致小鼠肝脏指数显著上升(P < 0.05),而低、中、高3个剂量的RES预处理均可显著或极显著下调肝脏指数(P < 0.05或P < 0.01),并可达到与对照组差异不显著的水平(P>0.05)。
|
|
表 1 RES预处理对LPS诱导小鼠体重和肝脏指数的影响 Table 1 Effects of resveratrol pretreatment on body weight and liver index of mice induced with LPS |
肝脏组织病理学观察结果如图 1所示。对照组小鼠肝脏组织、肝血窦以及中央静脉无明显变化,肝细胞轮廓清晰;LPS诱导后,肝脏中央静脉出现充血,红细胞堆集等情况,肝细胞发生肿胀,部分细胞核深染。3个RES预处理组,中央静脉随RES剂量增加其充血减少,肝细胞肿胀也明显减少,以高剂量RES组效果较好。以上结果说明RES能够在一定程度上预防由LPS诱导所引起的肝脏组织病理损伤。
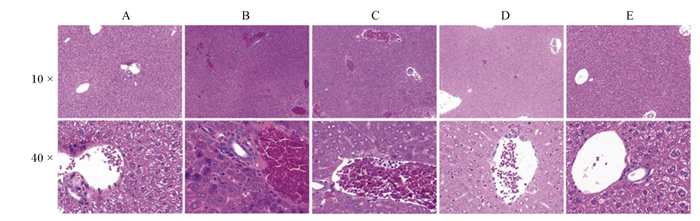
|
A:对照组CON group;B:LPS组LPS group;C:RES-L+LPS组RES-L+LPS group;D:RES-M+LPS组RES-M+LPS group;E:RES-H+LPS组RES-H+LPS group。下图同The same as below。 图 1 RES预处理对LPS诱导小鼠肝脏组织形态的影响 Fig. 1 Effects of resveratrol pretreatment on liver histopathology of mice induced with LPS |
TUNEL凋亡染色如图 2所示。与对照组相比,LPS诱导后可观察到红色荧光信号的细胞显著增多,肝细胞凋亡比例极显著增加(P < 0.01);RES预处理作用效果显示,低剂量的RES对LPS诱导的肝脏细胞凋亡无显著作用,其肝细胞凋亡比例与LPS组相比无显著变化(P>0.05),而中、高剂量的RES均能显著抑制LPS诱导所致的肝脏细胞发生凋亡,其肝细胞凋亡比例与LPS组相比极显著降低(P < 0.01),且以高剂量的RES预防作用效果较好。上述结果说明RES能在一定程度上减少LPS引起的肝脏细胞凋亡。
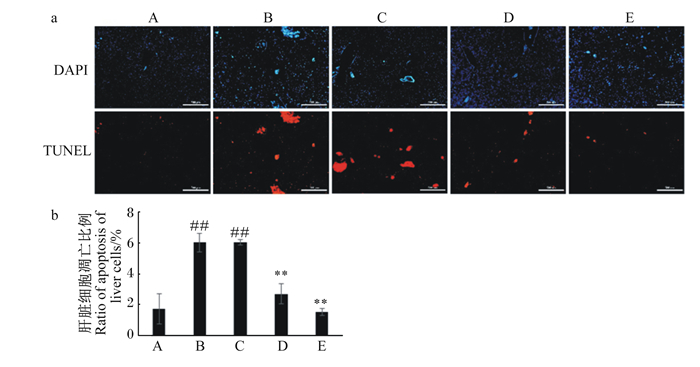
|
图a:TUNEL染色肝脏组织。DAPI:肝脏细胞核染色(蓝色);TUNEL:凋亡细胞或血细胞染色(红色)。标尺大小500 μm。图b:TUNEL染色阳性细胞的量化和统计分析。 数据柱标注“#”和“##”分别表示与对照组(A)相比差异显著(P < 0.05)和极显著(P < 0.01);数据柱标注“*”和“**”分别表示与LPS组(B)相比差异显著(P < 0.05)和极显著(P < 0.01)。下图同。 Figure a: TUNEL staining of liver tissue. DAPI: staining of nucleus of liver cells with DAPI (as blue); TUNEL: staining of apoptotic cells or blood cells with TUNEL reagent (as red). Scale bar=500 μm. Figure b: quantification and statistical analysis of positive cells stained with TUNEL reagent. Data columns with "#" and "##" mean significant (P < 0.05) and extremely significant difference (P < 0.01) compared with the control group, respectively; data columns with "*" and "**" mean significant (P < 0.05) and extremely significant difference (P < 0.01) compared with the control group, respectively. The same as below. 图 2 RES预处理对LPS诱导小鼠肝脏细胞凋亡的影响 Fig. 2 Effects of resveratrol pretreatment on liver apoptosis of mice induced with LPS |
本试验检测了肝脏中炎症因子IL-6和TNF-α mRNA的表达水平的变化,结果如图 3所示。LPS诱导后,肝脏中IL-6和TNF-α mRNA的表达水平均极显著升高(P < 0.01);各剂量RES预处理组肝脏中IL-6和TNF-α mRNA的表达水平极显著低于LPS组(P < 0.01),但仍极显著高于对照组(P < 0.01)。上述结果说明RES可在一定程度上通过下调肝脏中部分促炎因子的表达减轻由LPS诱导所致的肝脏炎性损伤。
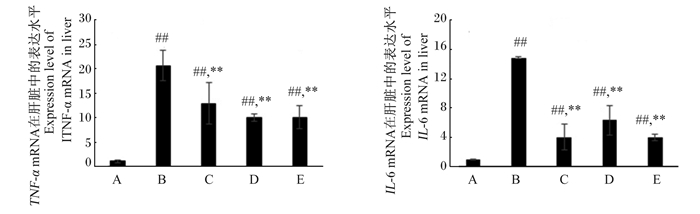
|
图 3 RES预处理对LPS诱导小鼠肝脏中IL-6和TNF-α mRNA表达的影响 Fig. 3 Effects of resveratrol pretreatment on expression of IL-6 and TNF-α mRNA in liver of mice induced with LPS |
本试验检测了肝脏中凋亡因子Bcl-2和Bax mRNA和蛋白的表达水平,结果如图 4所示。LPS诱导可极显著提高促凋亡基因Bax mRNA的表达水平(P < 0.01),同时极显著抑制抗凋亡基因Bcl-2 mRNA的表达水平(P < 0.01);用RES进行预处理,LPS对Bax和Bcl-2 mRNA表达的诱导作用受到抑制,3种剂量的RES预处理均可极显著提高Bcl-2 mRNA的表达水平(P < 0.01),且可达到与对照组无显著差异的水平(P>0.05);3种剂量的RES预处理可显著或极显著降低Bax mRNA的表达水平(P < 0.05或P < 0.01),但仍极显著高于对照组(P < 0.01)。LPS对Bax蛋白的作用其mRNA类似,使得Bax蛋白的表达水平极显著升高(P < 0.01),但Bax蛋白的表达水平受RES的抑制作用更强烈,3种剂量的RES预处理均使Bax蛋白的表达水平极显著降低(P < 0.01),且可使其下降到与对照组无显著差异的水平(P>0.05);与其对Bcl-2 mRNA的作用相反,LPS诱导使得Bcl-2蛋白的表达水平极显著上升(P < 0.01),当用不同剂量RES预处理时,对Bcl-2蛋白的表达水平无显著影响(P>0.05)。
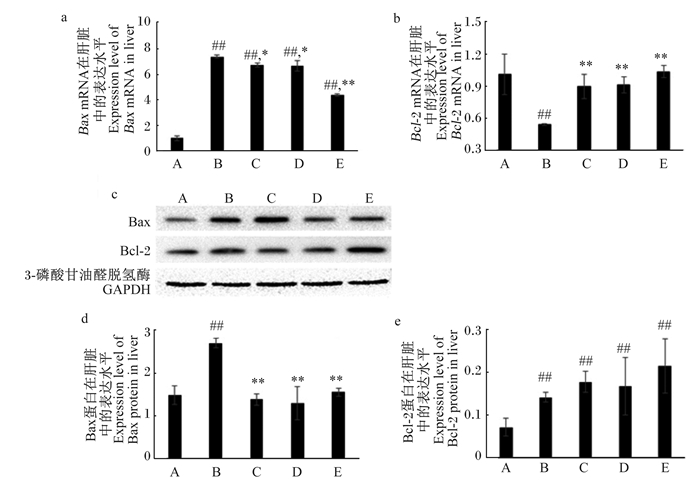
|
图 4 RES预处理对LPS诱导小鼠肝脏中Bcl-2和Bax mRNA和蛋白表达的影响 Fig. 4 Effects of RES pretreatment on mRNA and protein expression of Bax and Bcl-2 in liver of mice induced with LPS |
研究表明LPS进入机体会使许多器官产生不同程度的损伤,当进入肝细胞时会刺激巨噬细胞释放大量的炎症因子,产生细胞毒作用,通过细胞凋亡等多种途径损伤肝细胞[16-17]。在付凌等[18]利用牛磺酸抗LPS诱导的小鼠肝脏损伤研究中,腹腔注射LPS(L18716,10 mg/kg BW)诱导24 h可导致体重下降、肝脏指数上升并出现明显的肝脏损伤。本课题组前期研究结果显示,腹腔注射较低剂量(5 mg/kg BW)的LPS诱导小鼠12 h后就可导致其体重显著下降[15],而在本试验中进一步发现LPS诱导后也可显著增加小鼠的肝脏指数,诱导所需的剂量和时间较短,这可能与不同来源LPS的毒力不同有关。肝脏指数的上升是由于LPS导致促炎因子(如TNF-α、IL-6)水平的上升,肝脏充血,肝细胞肿胀等炎症的发生,使肝脏湿重增加,此外,与体重下降也密切相关。
RES作为一种具有重要活性的多酚类化合物,对多种刺激诱导所致的肝脏损伤具有较好的保护作用。TNF-α是肝衰竭的早期炎症因子,通过转导肝细胞凋亡信号,诱导其他相关炎症因子级联反应,从而加重肝坏死[19]。IL-6是IL家族的核心成员,在B细胞分化、T细胞增殖等方面发挥着重要的作用,是反映机体炎症和疾病严重程度的指标之一。当肝脏中TNF-α和IL-6 mRNA表达水平升高时,被认为是肝脏损伤的一个标志[20]。夏玉敬等[21]研究发现,RES对刀豆蛋白诱导引起的急性肝脏损伤有明显的保护作用,可降低炎症因子IL-2、IL-6和TNF-α mRNA的表达。周薏等[13]研究发现,RES可通过抑制NLRP3炎性体活化及其下游炎症级联反应,显著减轻四氯化碳诱导的急性肝脏损伤。本试验中也发现RES可在一定程度上预防LPS诱导所致的肝脏组织病理变化,且高剂量的RES效果较好;RES预处理可显著抑制肝脏中促炎因子IL-6和TNF-α mRNA表达水平的上升。
在正常情况下,氧化应激可使机体适应各种刺激保护细胞免受损伤,多种有害刺激可以打破氧化应激的平衡状态,促使细胞发生凋亡甚至导致病理损伤。细胞凋亡又称细胞程序性死亡,在凋亡信号诱导下,胞质中的促凋亡蛋白Bax形成Bax-Bax二聚体,破坏线粒体外膜的完整性,使细胞色素C向细胞质中释放,激活半胱天冬酶-3(Caspase-3)导致细胞凋亡[22]。存在于线粒体外膜上的抗凋亡蛋白Bcl-2可竞争性的与Bax结合,形成Bax-Bcl-2二聚体,从而中和Bax的促凋亡作用[23]。本研究通过检测Bax和Bcl-2的mRNA和蛋白表达水平验证RES能否抑制LPS对小鼠肝脏细胞的凋亡,发现LPS使Bax的mRNA和蛋白表达水平均极显著升高,不同剂量的RES预处理均使Bax蛋白的表达水平极显著降低,且可使其下降到与对照组无显著差异的水平;而LPS诱导对Bcl-2的mRNA和蛋白表达水平的影响不一致,LPS诱导使得Bcl-2 mRNA表达水平极显著降低,而使Bcl-2蛋白的表达水平显著上升,可能是由于mRNA转录与蛋白质翻译水平不一致所造成的。RES可诱导多种癌细胞发生凋亡,发挥其体内外抗肿瘤作用[24],但对多种因素诱导的正常细胞凋亡具有显著的抑制作用。孙菁等[25]研究发现,刀豆素A诱导的小鼠自身免疫性肝炎(AIH)模型中,肝脏组织中出现大量的凋亡细胞,RES预处理后能够显著减少AIH小鼠肝脏的细胞凋亡比例。在肝切除术的大鼠模型中,RES可降低术后肝脏损伤,维持肝脏结构,减少细胞凋亡,体外试验发现其可能是通过上调沉默信息调节因子2相关酶1(SIRT1)和降低高迁移率族蛋白1(HMGB1)的乙酰化来实现的[26]。本研究通过TUNEL原位检测发现LPS诱导可导致肝脏细胞凋亡比例增加,而RES预处理时可显著抑制细胞发生凋亡,在一定程度抑制促凋亡基因Bax的表达。目前,RES虽在预防和治疗多种慢性疾病,包括心血管疾病、炎症性疾病、代谢性疾病、神经系统疾病和皮肤疾病及各种传染病方面作用效果较好[27],但阐明其在多种生理条件下的作用机制还需进一步探索。
4 结论RES预处理可在一定程度上抑制LPS的炎症诱导作用,通过抑制肝脏中炎症因子TNF-α和IL-6的表达降低炎性损伤,并通过抑制肝脏中促凋亡基因Bax的表达减少细胞凋亡,对肝脏损伤起到较好的保护作用。
| [1] |
ROBINSON M W, HARMON C, O'FARRELLY C. Liver immunology and its role in inflammation and homeostasis[J]. Cellular & Molecular Immunology, 2016, 13(3): 267-276. |
| [2] |
YOUNOSSI Z M. Non-alcoholic fatty liver disease—a global public health perspective[J]. Journal of Hepatology, 2019, 70(3): 531-544. DOI:10.1016/j.jhep.2018.10.033 |
| [3] |
RAMADORI G, MORICONI F, MALIK I, et al. Physiology and pathophysiology of liver inflammation, damage and repair[J]. Journal of Physiology and Pharmacology, 2008, 59(Suppl. 1): 107-117. |
| [4] |
DENG X M, LUYENDYK J P, GANEY P E, et al. Inflammatory stress and idiosyncratic hepatotoxicity: hints from animal models[J]. Pharmacological Reviews, 2009, 61(3): 262-282. DOI:10.1124/pr.109.001727 |
| [5] |
王华. 细菌脂多糖诱导小鼠急性凋亡性肝损伤的分子机制[D]. 硕士学位论文. 合肥: 安徽医科大学, 2009. WANG H.Molecular mechanism of acute apoptotic liver injury induced by lipopolysaccharide in mice[D].Master's Thesis.Hefei: Anhui Medical University, 2009.(in Chinese) |
| [6] |
SEO H Y, KIM M K, LEE S H, et al. Kahweol ameliorates the liver inflammation through the inhibition of NF-κB and STAT3 activation in primary Kupffer cells and primary hepatocytes[J]. Nutrients, 2018, 10(7): 863. DOI:10.3390/nu10070863 |
| [7] |
CZAJA A J. Hepatic inflammation and progressive liver fibrosis in chronic liver disease[J]. World Journal of Gastroenterology, 2014, 20(10): 2515-2532. DOI:10.3748/wjg.v20.i10.2515 |
| [8] |
LAM P, CHEUNG F, TAN H Y, et al. Hepatoprotective effects of Chinese medicinal herbs: a focus on anti-inflammatory and anti-oxidative activities[J]. International Journal of Molecular Sciences, 2016, 17(4): 465. DOI:10.3390/ijms17040465 |
| [9] |
WANG S, MOUSTAID-MOUSSA N, CHEN L X, et al. Novel insights of dietary polyphenols and obesity[J]. The Journal of Nutritional Biochemistry, 2014, 25(1): 1-18. DOI:10.1016/j.jnutbio.2013.09.001 |
| [10] |
SALEHI B, MISHRA A P, NIGAM M, et al. Resveratrol: a double-edged sword in health benefits[J]. Biomedicines, 2018, 6(3): 91. DOI:10.3390/biomedicines6030091 |
| [11] |
FAGHIHZADEH F, HEKMATDOOST A, ADIBI P. Resveratrol and liver: a systematic review[J]. Journal of Research in Medical Sciences, 2015, 20(8): 797-810. DOI:10.4103/1735-1995.168405 |
| [12] |
李向阳, 李月梅, 唐明增, 等. 白藜芦醇对卡介苗和脂多糖所致小鼠肝损伤的保护作用[J]. 中国热带医学, 2016, 6(2): 218-219. LI X Y, LI Y M, TANG M Z, et al. Protective effect of resveratrol on liver injury induced by BCG and LPS in mice[J]. China Tropical Medicine, 2016, 6(2): 218-219 (in Chinese). |
| [13] |
周薏, 阙任烨, 李勇, 等. 白藜芦醇对急性肝损伤小鼠NLRP3炎性体表达的影响[J]. 世界临床药物, 2020, 41(2): 104-110, 142. ZHOU Y, QUE R Y, LI Y, et al. Effect of resveratrol on expression of NLRP3 inflammatory body in mice with acute liver injury[J]. World Clinical Drugs, 2020, 41(2): 104-110 (in Chinese). |
| [14] |
申新, 赵鸽, 王瑞, 等. 异丙酚和白藜芦醇预处理对大鼠肝脏缺血再灌注损伤时细胞凋亡的影响及机制[J]. 南方医科大学学报, 2013, 33(1): 80-85. SHEN X, ZHAO G, WANG R, et al. Effect and mechanism of propofol and resveratrol pretreatment on apoptosis in rat liver ischemia-reperfusion injury[J]. Journal of Southern Medical University, 2013, 33(1): 80-85 (in Chinese). |
| [15] |
张逢, 陈指龙, 易思亮, 等. 细菌脂多糖急性暴露通过炎症反应诱导小鼠睾丸损伤[J]. 畜牧兽医学报, 2019, 50(5): 1099-1105. ZHANG F, CHEN Z L, YI S L, et al. Acute bacterial lipopolysaccharide exposure induces testicular injury in mice through inflammatory response[J]. Chinese Journal of Animal and Veterinary Sciences, 2019, 50(5): 1099-1105 (in Chinese). |
| [16] |
DING W X, YIN X M. Dissection of the multiple mechanisms of TNF-α-induced apoptosis in liver injury[J]. Journal of Cellular and Molecular Medicine, 2004, 8(4): 445-454. DOI:10.1111/j.1582-4934.2004.tb00469.x |
| [17] |
ROY S, SANNIGRAHI S, MAJUMDAR S, et al. Resveratrol regulates antioxidant status, inhibits cytokine expression and restricts apoptosis in carbon tetrachloride induced rat hepatic injury[J]. Oxidative Medicine and Cellular Longevity, 2011, 2011: 703676. |
| [18] |
付凌, 宋剑波, 胡春燕, 等. 牛磺酸对脂多糖诱导的小鼠肝脏损伤的缓解作用[J]. 动物营养学报, 2015, 27(3): 989-996. FU L, SONG J B, HU C Y, et al. Alleviating effect of taurine on lipopolysaccharide induced liver injury in mice[J]. Chinese Journal of Animal Nutrition, 2015, 27(3): 989-996 (in Chinese). |
| [19] |
BOURLIOUX P, KOLETZKO B, GUARNER F, et al. The intestine and its microflora are partners for the protection of the host: report on the Danone Symposium "The Intelligent Intestine"held in Paris, June 14, 2002[J]. The American Journal of Clinical Nutrition, 2003, 78(4): 675-683. DOI:10.1093/ajcn/78.4.675 |
| [20] |
SCHMID A, KOPP A, HANSES F, et al. C1q/TNF-related protein-3 (CTRP-3) attenuates lipopolysaccharide(LPS)-induced systemic inflammation and adipose tissue Erk-1/-2 phosphorylation in mice in vivo[J]. Biochemical and Biophysical Research Communications, 2014, 452(1): 8-13. DOI:10.1016/j.bbrc.2014.06.054 |
| [21] |
夏玉敬, 林春蕾, 周莹群, 等. 白藜芦醇对小鼠ConA肝脏损伤的保护作用[J]. 世界临床药物, 2014, 35(5): 300-304. XIA Y J, LIN C L, ZHOU Y Q, et al. Protective effect of resveratrol on ConA induced liver injury in mice[J]. World Clinical Drugs, 2014, 35(5): 300-304 (in Chinese). |
| [22] |
HIKITA H, TAKEHARA T.Regulation of apoptosis by Bcl-2 family proteins in liver injury[M]//DING W X, YIN X M.Molecules, systems and signaling in liver injury.Cham, Switzerland: Springer, 2017: 75-85.
|
| [23] |
ASHKENAZI A, FAIRBROTHER W J, LEVERSON J D, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nature Reviews Drug Discovery, 2017, 16(4): 273-284. DOI:10.1038/nrd.2016.253 |
| [24] |
KO J H, SETHI G, UM J Y, et al. The role of resveratrol in cancer therapy[J]. International Journal of Molecular Sciences, 2017, 18(12): 2589. DOI:10.3390/ijms18122589 |
| [25] |
孙菁, 王世卉. 白藜芦醇对刀豆素A诱导小鼠自身免疫性肝炎的保护作用[J]. 贵州医科大学学报, 2018, 43(7): 768-774. SUN J, WANG S H. Protective effect of resveratrol on Con A induced autoimmune hepatitis in mice[J]. Journal of Guizhou Medical University, 2018, 43(7): 768-774 (in Chinese). |
| [26] |
YU S, ZHOU X L, XIANG H, et al. Resveratrol reduced liver damage after liver resection in a rat model by upregulating sirtuin 1 (SIRT1) and inhibiting the acetylation of high mobility group box 1 (HMGB1)[J]. Medical Science Monitor, 2019, 25: 3212-3220. DOI:10.12659/MSM.913937 |
| [27] |
MALAGUARNERA L. Influence of resveratrol on the immune response[J]. Nutrients, 2019, 11(5): 946. DOI:10.3390/nu11050946 |




