2. 南京农业大学动物科技学院, 动物科学类国家级试验教学示范中心, 南京 210095
2. National Experimental Teaching Center for Animal Science, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China
菜籽粕(rapeseed meal,RSM)是油菜籽榨油之后的副产品,我国年产量高达926万t,位居世界第一[1]。菜籽粕因其较高的粗蛋白质含量而具有替代动物饲粮中豆粕的潜力[2]。然而,菜籽粕中纤维含量(26.7%~28.3%)约为豆粕的3倍,其中不溶性纤维含量占总碳水化合物的45.22%,无法被畜禽充分消化吸收[3-4]。
据报道,纤维降解酶能有效地降低植物源饲料原料中的纤维含量,释放小分子糖[5-6]。然而,目前关于菜籽粕纤维降解的研究较少。菜籽粕纤维以果胶(10.7%~14.5%)为主要成分,其次是纤维素(5.0%~7.0%)和少量的半纤维素[3, 7],它们共同构成复杂的细胞壁结构。虽然果胶是菜籽粕纤维的主要成分,但纤维素的存在阻碍了果胶酶与果胶活性位点的结合[8]。此外,细胞壁的降解不仅能释放包裹在内的小分子蛋白质,还能产生可溶性糖[9]。酶解产生的可溶性糖经过微生物发酵可转化为乳酸等发酵产物[10]。综上可知,纤维素酶和果胶酶共同作用降解菜籽粕纤维,具有提高菜籽粕利用价值的潜力。
酶解条件如pH、温度、酶解时间和底物浓度对酶解效率有显著影响[9]。纤维素酶和果胶酶单独酶解的最优酶解条件已被报道[11-12],而有关2种酶复合后酶解菜籽粕条件的研究较少,因此优化复合纤维降解酶酶解菜籽粕的条件对酶解菜籽粕规模化生产的技术可行性具有重大意义。常规单因素试验优化酶解条件不仅耗时,且需要大量的试验,也没有考虑变量之间的交互作用[13]。响应面法(response surface method)是一种用于多变量建模和优化的数学统计方法,能够综合评价一组变量与响应值(因变量)的关系,可用于优化酶解条件[14]。
本研究以还原糖转化率为指标,利用响应面法优化复合纤维降解酶酶解菜籽粕的条件,以期提高菜籽粕的还原糖产量、降低其纤维含量。
1 材料与方法 1.1 试验材料 1.1.1 菜籽粕本试验所用菜籽粕(由甘蓝型油菜籽制成)由江苏某饲料有限公司提供,粉碎后过40目筛备用。
1.1.2 酶制剂本试验所用果胶酶、纤维素酶均由广东某生物科技有限公司提供。试验前,将酶粉用柠檬酸缓冲液(0.05 mol/L,pH 4.8)溶解,8 000 r/min离心10 min后取上清,并检测酶液活性。纤维素酶活性参照Ghose[15]的方法检测,以滤纸酶活力单位(FPU)表示,果胶酶活性参考Li等[16]的方法进行检测,以酶活力单位(U)表示。
1.2 试验方法 1.2.1 复合纤维降解酶的确定将5 g菜籽粕加入到125 mL发酵瓶中,加水47 mL混匀,使用1 mol/L HCl将pH调节至4.8,灭菌后备用;将过滤除菌(0.22 μm)酶液(3 mL)添加至发酵瓶中,菜籽粕浓度为100 g/L,试验设3个组,每组设4个重复,各组发酵瓶中所加酶的具体情况如下:1)纤维素酶(10 FPU/g RSM);2)果胶酶(10 U/g RSM);3)纤维素酶(10 FPU/g RSM)+果胶酶(10 U/g RSM)。将发酵瓶置于50 ℃、150 r/min的恒温摇床培养箱进行24 h的酶解,酶解结束后转移至90 ℃恒温水浴锅中10 min终止反应;试验结束后检测菜籽粕的还原糖转化率。
1.2.2 响应面试验优化酶解菜籽粕条件采用响应面试验对复合纤维降解酶酶解菜籽粕的条件进行优化,以酶解菜籽粕中还原糖转化率作为响应值,pH、温度、酶解时间、底物浓度(即菜籽粕浓度)作为自变量,各因素设3个水平(表 1);根据Box-Behnken设计4因素3水平响应面试验,共29个处理,其中5个处理为中心点重复试验,每个处理设4个重复。以多元回归方法将试验数据拟合:
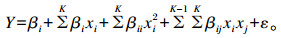
|
|
|
表 1 响应面试验的因素和水平 Table 1 Experimental factors and levels of response surface method |
式中:Y为试验响应值;βi、βii、βij分别为线性、二次和交互作用的系数;xi、xj, …, xk为独立变量;K为变量数量;ε为随机误差。
利用失拟检验(lack-of-fit test)以检验所建立的模型是否足以描述所观察到的数据;根据所建立的模型绘制响应曲面图和响应的等高线图,将响应与变量之间的关系可视化;统计软件Design-Expert 9用于上述试验数据的回归分析以及图的绘制。
1.2.3 最优酶解条件对菜籽粕纤维含量的影响利用Design-Expert软件对模型方程进行分析,得出复合纤维降解酶酶解菜籽粕的最优条件,探究此条件下菜籽粕的纤维含量。试验共分为3组:1)优化组,按最优酶解条件进行;2)对照组,按优化前酶解条件(pH 4.8、温度50 ℃、酶解时间24 h、底物浓度100 g/L)进行;3)空白组,按对照组酶解条件进行,以等量的无菌水替代酶液。酶解结束后于90 ℃恒温水浴锅中10 min以终止酶解反应。试验结束后离心(8 000 r/min,10 min)取上清检测还原糖转化率;离心后剩余样品置于65 ℃烘箱中24 h,烘干后采用滤袋法[17]检测粗纤维、中性洗涤纤维和酸性洗涤纤维含量,采用凯氏定氮法[18]检测粗蛋白质含量,采用氯化钯法[19]测定硫代葡萄糖苷含量。
1.3 还原糖转化率测定使用二硝基水杨酸法[20]检测上清中还原糖含量,参考Loman等[9]的方法计算还原糖转化率,计算公式如下:
还原糖转化率(%)=100×还原糖含量/菜籽粕浓度。
1.4 统计分析数据以平均值±标准差(mean±SD)表示,采用GraphPad Prism 7.0软件作图,通过SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),并采用Tukey’s法进行显著性检验,P<0.05为差异显著,P<0.01为差异极显著。
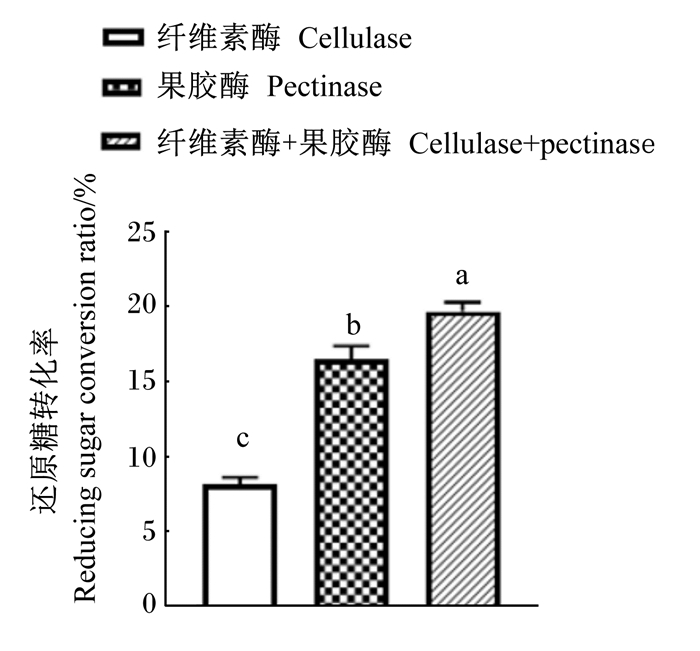
2 结果与分析 2.1 复合纤维降解酶的确定如图 1所示,果胶酶组酶解菜籽粕中还原糖转化率显著高于纤维素酶组(P<0.05)。与2个单酶相比,复合纤维降解酶(果胶酶+纤维素酶)酶解可显著提高菜籽粕中还原糖转化率(P<0.05)。
|
数据柱标注不同字母表示差异显著(P < 0.05)。 Data columns with different letter mean significant difference (P < 0.05). 图 1 不同酶对还原糖转化率的影响 Fig. 1 Effects of different enzymes on reducing sugar conversion ratio |
使用复合纤维降解酶在不同酶解条件下对菜籽粕进行酶解,27个处理的试验结果如表 2所示。通过回归分析获得的模型如下:
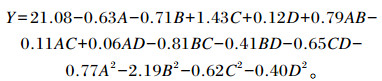
|
|
|
表 2 4个独立变量的响应面试验设计及还原糖转化率结果 Table 2 Experimental design of response surface with four independent variables and reducing sugar conversion ratio results |
式中:Y为复合纤维降解酶酶解菜籽粕中还原糖转化率;A、B、C、D分别为pH、温度、酶解时间、底物浓度。
方差分析结果如表 3所示。该模型R2=0.916>0.80,意味着该模型可以解释约91.6%的反应可变性;模型失拟项(lack of fit)P=0.092>0.05,说明该模型拟合度高。基于方差分析结果,线性系数中的pH(A)、温度(B)和酶解时间(C)对响应值的影响为极显著(P<0.01);交互作用中pH与温度(AB)、温度与时间(BC)对响应值的影响为显著(P<0.05)。上述结果说明pH、温度和酶解时间是影响酶解菜籽粕中还原糖转化率的主要因素。
|
|
表 3 变量之间关于还原糖转化率响应的方差分析 Table 3 Analysis of variance for variables pertaining to response of reducing sugar conversion ratio |
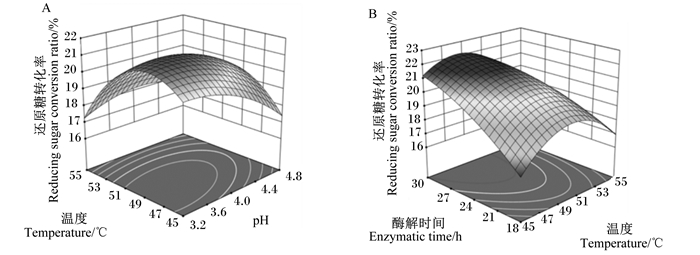
如图 2-A所示,当pH为3.2~4.0、温度为45~49 ℃时还原糖转化率最高,pH和温度的升高均会使还原糖转化率降低,三维响应面图较陡峭,说明pH和温度这2个因素间存在正向交互作用;如图 2-B所示,温度和酶解时间的响应面呈马鞍状,温度在47~51 ℃时,还原糖转化率达到峰值所需要的时间较短(24 h),当温度超过此范围时,还原糖转化率达到峰值所需的时间增加(30 h),说明温度和酶解时间之间存在正向交互作用。
|
图 2 pH与温度(A)、温度与酶解时间(B)对酶解菜籽粕还原糖转化率的响应面 Fig. 2 Response surfaces of pH×temperature and temperature×enzymatic time on reducing sugar conversion ratio of enzymatic hydrolyzed rapeseed meal |
利用Design Expert软件进行分析,得到各因素的最优值为:pH 3.98、温度49.62 ℃、酶解时间28.16 h、底物浓度200 g/L。在此条件下,还原糖转化率的预测值为21.11%,为便于操作,将最优条件设置为:pH 4.0、温度50 ℃、酶解时间28 h、底物浓度200 g/L。如表 4所示,优化组还原糖转化率达23.13%,与预测值接近,且显著高于对照组的19.80%(P<0.05);与对照组相比,优化组中性洗涤纤维和酸性洗涤纤维含量显著降低(P<0.05);酶解对菜籽粕中粗蛋白质和抗营养因子硫代葡萄糖苷含量无显著影响(P>0.05)。
|
|
表 4 最优条件下酶解对菜籽粕还原糖转化率和化学成分含量的影响 Table 4 Effects of enzymatic hydrolysis on reducing sugar conversion ratio and chemical component contents of rapeseed meal in optimal condition |
纤维素酶主要包含内切葡聚糖酶、外切葡聚糖酶和β-糖苷酶活性,它们的共同作用是能够通过打破纤维素中的1, 4-β-糖苷键将纤维素降解为葡萄糖[21];而果胶酶主要由同质半乳糖降解酶和鼠李半乳糖降解酶组成,能够分解果胶多糖产生以半乳糖为主的降解产物[22]。葡萄糖和半乳糖均属于还原糖,以还原糖转化率为指标能够有效的描述这2种酶的酶解效率。本试验结果表明,纤维素酶和果胶酶同时添加时的还原糖转化率(19.71%)优于两者单独添加时(纤维素酶:8.19%;果胶酶:16.45%)。这与前人研究结果一致,Matsuo[23]指出,纤维素酶和果胶酶同时酶解豆渣纤维释放可溶性糖的含量高于各酶单独添加;Spagnuolo等[24]也发现纤维素酶替代部分果胶酶能够显著提高酶解甜菜渣纤维释放单糖的效率,说明这2种酶共同使用能够使酶解效率最大化。
3.2 响应面法优化酶解菜籽粕的条件pH可影响酶的空间结构,从而改变酶的构象及活性,本研究中pH约为4.0时还原糖转化率最高。有研究报道,升高酶解反应的温度可促进纤维溶解,从而提高还原糖转化率,温度过低则会抑制酶的活性,降低酶解效率[25]。本研究结果表明,复合纤维降解酶的最适温度为50 ℃,过高或过低均会降低酶解效率。Loman等[9]利用复合纤维降解酶酶解豆粕,温度在48~51 ℃时总可溶性糖和还原糖的转化率最高。
增加底物浓度可提高酶解过程中还原糖的含量。本研究中,在所试范围内(100~200 g/L),底物浓度对还原糖转化率无显著影响,表明在此范围内更高的底物浓度能够在不影响酶解效率的情况下获得更多的还原糖。优化后的酶解时间为28 h,类似的研究表明,利用复合纤维降解酶对豆粕进行酶解,将酶解时间由24 h延长至48 h对总可溶性糖和还原糖转化率无促进作用[9],说明选择合适的酶解时间有利于生产成本的控制。
本研究发现pH与温度之间还存在正向交互作用。温度越低,pH越低,酶解菜籽粕还原糖转化率越高;酶解时间与温度之间也存在正向交互作用,当酶解温度在49 ℃、酶解时间为24 h时,还原糖转化率达到最高,增加酶解时间会使还原糖转化率降低,说明在优化酶解温度的同时,时间成本也得到控制。类似的交互作用已被报道,Loman等[9]利用响应面法优化复合纤维降解酶酶解豆粕条件,发现pH和温度对总可溶性糖和还原糖的转化率具有正向交互作用;Mudgil等[26]利用响应面法优化纤维素酶酶解豆粕条件,发现酶解时间和温度具有正向交互作用,说明在考察多个变量时,响应面法是优化酶解条件的有力工具。
3.3 最优条件下酶解对菜籽粕还原糖转化率和纤维含量的影响与优化前的酶解条件相比,酶解条件优化后还原糖转化率显著提高(19.80% vs. 23.13%),说明酶解条件优化是一种可行的提高菜籽粕纤维酶解效率的策略。Chen等[11]优化了纤维素酶酶解玉米芯多糖的酶解时间和底物浓度,使还原糖转化率提高了7.5%。Gao等[27]研究显示,由于优化后的酶解条件中底物浓度提高了2倍(200 g/L vs. 100 g/L),酶解产物中还原糖含量是优化前的2.34倍(19.80 g/L vs. 46.27 g/L);而高浓度的可发酵糖有利于酶解产物进一步发酵转化为其他高价值化学品。酶解降低了菜籽粕中粗纤维、酸性洗涤纤维(包括纤维素和木质素)和中性洗涤纤维(包括纤维素、半纤维素和木质素)的含量,说明纤维的降解是还原糖产生的主要原因。此外,与对照组相比,在最优条件下酶解提高了中性洗涤纤维和酸性洗涤纤维的降解程度,这也进一步证实了酶解条件优化的有效性。酶解对菜籽粕中粗蛋白质和硫代葡萄糖苷含量无显著影响。有研究发现,乳酸杆菌等复合菌发酵菜籽粕能够使菜籽粕的粗蛋白质含量提高12.08%,硫代葡萄糖苷含量降低85.05%[28]。本研究使用的复合纤维降解酶能够降解纤维,而乳酸杆菌发酵则利用底物进行生长并产生代谢产物,两者对菜籽粕的营养价值均有改善作用,而酶解与发酵结合是否能够进一步改善菜籽粕营养价值,还需进一步研究。
4 结论利用响应面法优化复合纤维降解酶(纤维素酶+果胶酶)酶解菜籽粕的条件后可有效提高菜籽粕的还原糖产量,降低其纤维含量。优化后的酶解条件为pH 4.0、温度50 ℃、酶解时间28 h、底物浓度200 g/L。
| [1] |
INDEXMUNDI.Rapeseed meal production[DB/OL].[2020-06-24].https://www.indexmundi.com/agriculture/?commodity=rapeseed-oilseed&graph=production.
|
| [2] |
HANSEN J V, SKREDE A, MYDLAND L T, et al. Fractionation of rapeseed meal by milling, sieving and air classification-effect on crude protein, amino acids and fiber content and digestibility[J]. Animal Feed Science and Technology, 2017, 230: 143-153. DOI:10.1016/j.anifeedsci.2017.05.007 |
| [3] |
BELL J M. Factors affecting the nutritional value of canola meal: a review[J]. Canadian Journal of Animal Science, 1993, 73(4): 689-697. DOI:10.4141/cjas93-075 |
| [4] |
XIN H S, YU P Q. Chemical profile, energy values, and protein molecular structure characteristics of biofuel/bio-oil co-products (carinata meal) in comparison with canola meal[J]. Journal of Agricultural and Food Chemistry, 2013, 61(16): 3926-3933. DOI:10.1021/jf400028n |
| [5] |
CHEN H Z, LIU Z H. Enzymatic hydrolysis of lignocellulosic biomass from low to high solids loading[J]. Engineering in Life Sciences, 2017, 17(5): 489-499. DOI:10.1002/elsc.201600102 |
| [6] |
AL LOMAN A, ISLAM S M M, LI Q, et al. Enzyme recycle and fed-batch addition for high-productivity soybean flour processing to produce enriched soy protein and concentrated hydrolysate of fermentable sugars[J]. Bioresource Technology, 2017, 241: 252-261. DOI:10.1016/j.biortech.2017.05.118 |
| [7] |
ERIKSSON I, ANDERSSON R, ÅMAN P. Extraction of pectic substances from dehulled rapeseed[J]. Carbohydrate Research, 1997, 301(3/4): 177-185. |
| [8] |
LOQUÉ D, SCHELLER H V, PAULY M. Engineering of plant cell walls for enhanced biofuel production[J]. Current Opinion in Plant Biology, 2015, 25: 151-161. DOI:10.1016/j.pbi.2015.05.018 |
| [9] |
LOMAN A A, JU L. Optimization of enzymatic process condition for protein enrichment, sugar recovery and digestibility improvement of soy flour[J]. Journal of the American Oil Chemists' Society, 2016, 93(8): 1063-1073. DOI:10.1007/s11746-016-2854-1 |
| [10] |
LOMAN A A, ISLAM S M M, JU L K. Production of arabitol from enzymatic hydrolysate of soybean flour by Debaryomyces hansenii fermentation[J]. Applied Microbiology and Biotechnology, 2018, 102(2): 641-653. DOI:10.1007/s00253-017-8626-5 |
| [11] |
CHEN X H, XU F, QIN W D, et al. Optimization of enzymatic clarification of green asparagus juice using response surface methodology[J]. Journal of Food Science, 2012, 77(6): C665-C670. DOI:10.1111/j.1750-3841.2012.02738.x |
| [12] |
BELTRAMINO F, RONCERO M B, TORRES A L, et al. Optimization of sulfuric acid hydrolysis conditions for preparation of nanocrystalline cellulose from enzymatically pretreated fibers[J]. Cellulose, 2016, 23(3): 1777-1789. DOI:10.1007/s10570-016-0897-y |
| [13] |
DEY G, MITRA A, BANERJEE R, et al. Enhanced production of amylase by optimization of nutritional constituents using response surface methodology[J]. Biochemical Engineering Journal, 2001, 7(3): 227-231. DOI:10.1016/S1369-703X(00)00139-X |
| [14] |
CHENG Z Y, SONG H Y, YANG Y J, et al. Optimization of microwave-assisted enzymatic extraction of polysaccharides from the fruit of Schisandra chinensis Baill[J]. International Journal of Biological Macromolecules, 2015, 76: 161-168. DOI:10.1016/j.ijbiomac.2015.01.048 |
| [15] |
GHOSE T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2): 257-268. DOI:10.1351/pac198759020257 |
| [16] |
LI Q, COFFMAN A M, JU L K. Development of reproducible assays for polygalacturonase and pectinase[J]. Enzyme and Microbial Technology, 2015, 72: 42-48. DOI:10.1016/j.enzmictec.2015.02.006 |
| [17] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [18] |
BRADSTREET R B. Kjeldahl method for organic nitrogen[J]. Analytical Chemistry, 1954, 26(1): 185-187. DOI:10.1021/ac60085a028 |
| [19] |
WANG X S, JIN Q Z, TONG W, et al. Screening of glucosinolate-degrading strains and its application in improving the quality of rapeseed meal[J]. Annals of Microbiology, 2012, 62(3): 1013-1020. DOI:10.1007/s13213-011-0341-3 |
| [20] |
MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428. DOI:10.1021/ac60147a030 |
| [21] |
SADHU S, MAITI T K. Cellulase production by bacteria: a review[J]. British Microbiology Research Journal, 2013, 3(3): 235-258. DOI:10.9734/BMRJ/2013/2367 |
| [22] |
SHARMA N, RATHORE M, SHARMA M. Microbial pectinase: sources, characterization and applications[J]. Reviews in Environmental Science and Bio-Technology, 2013, 12(1): 45-60. DOI:10.1007/s11157-012-9276-9 |
| [23] |
MATSUO M. Saccharification of okara fiber by plant dietary fiber hydrolases[J]. Journal of Nutritional Science and Vitaminology, 2004, 50(4): 291-294. DOI:10.3177/jnsv.50.291 |
| [24] |
SPAGNUOLO M, CRECCHIO C, PIZZIGALLO M D R, et al. Synergistic effects of cellulolytic and pectinolytic enzymes in degrading sugar beet pulp[J]. Bioresource Technology, 1997, 60(3): 215-222. DOI:10.1016/S0960-8524(97)00013-8 |
| [25] |
BRAGA M E M, MORESCHI S R M, MEIRELES M A A. Effects of supercritical fluid extraction on Curcuma longa L. and Zingiber officinale R. starches[J]. Carbohydrate Polymers, 2006, 63(3): 340-346. DOI:10.1016/j.carbpol.2005.08.055 |
| [26] |
MUDGIL D, BARAK S, KHATKAR B S. Optimization of enzymatic hydrolysis of guar gum using response surface methodology[J]. Journal of Food Science and Technology, 2014, 51(8): 1600-1605. DOI:10.1007/s13197-012-0678-z |
| [27] |
GAO K, REHMANN L. ABE fermentation from enzymatic hydrolysate of NaOH-pretreated corncobs[J]. Biomass and Bioenergy, 2014, 66: 110-115. DOI:10.1016/j.biombioe.2014.03.002 |
| [28] |
WANG Y, LIU J, WEI F, et al. Improvement of the nutritional value, sensory properties and bioavailability of rapeseed meal fermented with mixed microorganisms[J]. LWT-Food Science and Technology, 2019, 112: 108238. DOI:10.1016/j.lwt.2019.06.005 |



