2. 中国科学院亚热带农业生态研究所, 动物营养生理与代谢过程湖南省重点实验室, 长沙 410125;
3. 湖南师范大学生命科学学院, 动物肠道功能湖南省重点实验室, 长沙 410081;
4. 中国科学院大学, 北京 101408
2. Key Laboratory of Animal Nutritional Physiology and Metabolic Process of Hunan, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China;
3. Hunan International Joint Laboratory of Animal Intestinal Ecology and Health, Laboratory of Animal Nutrition and Human Health, Hunan Provincial Key Laboratory of Animal Intestinal Function and Regulation, College of Life Sciences, Hunan Normal University, Changsha 410081, China;
4. University of Chinese Academy of Sciences, Beijing 101408, China
在养猪生产过程中,因在妊娠、分娩、泌乳期母猪机体分解代谢增强,极易引发围产期母猪氧化应激,产生过量活性氧自由基(ROS),从而导致母猪产仔性能和泌乳能力下降[1],且妊娠母猪发生氧化应激时会限制胎盘和胎儿发育,甚至引起胎儿早产[2-3],而泌乳母猪发生氧化应激时可破坏机体能量平衡和降低产奶量,进而影响哺乳仔猪生长发育,降低仔猪断奶重[4]。目前缓解围产期母猪氧化应激有多种调控策略,如稳定环境条件、改变饲料成分、添加功能性抗氧化物质(如植物提取物、功能性氨基酸等)[5]。研究显示,谷氨酰胺可通过促进磷酸戊糖途径活性,提高妊娠母猪体内还原型辅酶Ⅱ和谷胱甘肽(GSH)含量来缓解氧化应激[5];母猪饲粮补充精氨酸可提高母猪血液中一氧化氮(NO)含量[6],显著提高肝脏抗氧化酶活性,抑制脂质过氧化反应和过氧化物的释放[7]。
丝氨酸(Ser)作为重要的功能性氨基酸,也是甘氨酸和半胱氨酸的前体物质,有助于体内GSH的合成和过量ROS的清除,在缓解氧化应激方面发挥着重要作用[8]。前期研究表明,补充1% Ser可通过提高GSH含量,消除过量的ROS来缓解敌草快诱导的小鼠氧化应激[9];同时,Ser亦可通过表观遗传机制调节GSH合成相关基因的表达,并激活腺苷酸活化蛋白激酶来预防高脂饲粮诱导的小鼠氧化应激[10];饲粮补充0.2% Ser可通过减缓早期断奶仔猪的炎症和氧化应激反应,提高仔猪的生长性能和肠道健康[11]。尽管如此,关于补充Ser对围产期母猪抗氧化能力的影响及其抗氧化功能能否传递给哺乳仔猪的研究报道仍有限。因此,本试验通过在围产期母猪饲粮中补充不同水平的Ser,探讨其对泌乳母猪和哺乳仔猪机体抗氧化能力的影响,旨在为改善仔猪生长发育和母猪健康状况提供依据。
1 材料与方法 1.1 试验设计饲养试验在湖南龙华农牧发展有限公司茶陵母猪养殖场进行,养殖场为全封闭式猪舍,漏缝金属材质地板,不锈钢可调式料槽,乳头式饮水器。试验开始前,对猪舍进行彻底消毒。试验开始后,按照猪场标准饲养管理程序对试验猪进行驱虫和免疫处理。按单因子试验设计,选择胎次、体况相近、健康状况良好的妊娠85日龄的二元杂交(长白×约克夏)母猪100头,随机分为4组,每组25头,每头为1个重复。根据NRC(2012)母猪营养需要标准配制妊娠和泌乳母猪玉米-豆粕型基础饲粮,其组成及营养水平见表 1。对照组饲喂基础饲粮(妊娠后期母猪饲粮Ser含量为0.55%,泌乳期母猪饲粮Ser含量为0.66%),试验组则饲喂补充不同水平Ser的试验饲粮。各组妊娠后期和泌乳期母猪饲粮Ser补充量见表 2。其中,L-Ser组是将基础饲粮Ser含量提高25%,即妊娠后期母猪饲粮Ser含量为0.69%,泌乳期母猪饲粮Ser含量为0.83%;M-Ser组是将基础饲粮Ser含量提高50%,即妊娠后期母猪饲粮Ser含量为0.83%,泌乳期母猪饲粮Ser含量为0.99%;H-Ser组是将基础饲粮Ser含量提高100%,即妊娠后期母猪饲粮Ser含量为1.10%,泌乳期母猪饲粮Ser含量为1.32%。从妊娠85日龄开始给母猪持续补充Ser,直至哺乳21 d为止。为保障每窝哺乳仔猪头数一致性,每头母猪哺乳仔猪数控制为10头,妊娠母猪采取限饲,泌乳母猪自由采食,均自由饮水,并需一直保持料槽的清洁和饲料的新鲜度。每天记录母猪采食量并注意观察母猪和哺乳仔猪的健康状况。
|
|
表 1 妊娠后期和泌乳期母猪基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets for sows during late pregnant period and lactating period (air-dry basis) |
|
|
表 2 妊娠后期和泌乳期母猪饲粮Ser补充量 Table 2 Serine supplementation in diets for sows during late pregnant period and lactating period |
在泌乳期第11天对空腹泌乳母猪采集耳缘静脉血液10 mL,自然凝固后于3 000 r/min、4 ℃离心10 min,分离血清于-20 ℃冻存。母猪分娩5头仔猪以后,采集母猪第4或者第5对乳房的初乳10 mL,于-20 ℃冻存。哺乳仔猪在21日龄采集前腔静脉血10 mL,自然凝固后于3 000 r/min、4 ℃离心10 min,分离血清于-20 ℃冻存。仔猪21日龄颈动脉放血处死,屠宰后打开腹腔,取出空肠,用冰浴的生理盐水洗净外壁及内容物,取空肠中段3 cm左右于锡箔纸中,立即放入液氮中保存。
1.3 测定指标及方法 1.3.1 血清生化指标的检测用罗氏C311全自动生化分析仪(德国)测定血清中总蛋白(TP)、尿素氮(UN)、葡萄糖(GLU)和钙(Ca)含量以及谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性。测定步骤按照罗氏生化试剂盒操作说明进行。
1.3.2 初乳和血清中Ser、甘氨酸(Gly)以及半胱氨酸(Cys)含量的检测将0.5 mL初乳样品置于1.5 mL离心管中,3 000 r/min、4 ℃离心5 min,准确吸取上清液于另一1.5 mL离心管中,加入等体积的10%磺基水杨酸,振荡混匀,于4 ℃静置1 h;于10 000 r/min离心15 min后取上清液,过0.22 μm滤膜后调整至合适浓度,用L-8900型高效氨基酸自动分析仪(日立公司,日本)测定Ser、Gly以及Cys含量。血清中Ser、Gly和Cys含量的检测方法同上。
1.3.3 血清氧化应激指标的检测采用酶联免疫吸附测定(ELISA)试剂盒(江苏酶免实业有限公司)检测血清中谷胱甘肽过氧化物酶(GPx)活性以及丙二醛(MDA)和GSH含量。检测步骤按照试剂盒说明书进行。
1.3.4 空肠中抗氧化酶mRNA相对表达量的检测提取空肠组织中总RNA并反转录后,进行实时荧光定量PCR[12]。具体步骤如下:将空肠组织与Trizol(Invitrogen,美国)匀浆后,用氯仿提取其中总RNA,沉淀、洗涤后,用1.5%琼脂糖凝胶电泳验证RNA的完整性,并核酸仪检测浓度。使用Prime ScriptTM RT Reagent Kit with gDNA Eraser试剂盒(TaKaRa),按操作说明书对所提取的RNA进行除DNA和反转录操作,最后以所获得的cDNA为模板,用TB GreenTM Premix Ex TaqTM试剂盒(TaKaRa)按操作说明进行实时荧光定量PCR。通过Primer 6.0软件设计引物,具体引物序列见表 3。反应结束后,以β-肌动蛋白(β-actin)为内参,根据2-△△Ct法计算各目的基因的mRNA相对表达量。
|
|
表 3 引物序列 Table 3 Primer sequences |
试验数据经Excel 2010初步整理后,用SPSS 19.0软件中的ANOVA程序作单因素方差分析,并用Duncan氏法进行多重比较,数据均以平均值±标准误(mean±SE)表示。P < 0.05表示差异显著,P < 0.01表示差异极显著,0.05≤P < 0.10表示有差异趋势。
2 结果 2.1 围产期母猪饲粮补充Ser对泌乳母猪和哺乳仔猪血清生化指标的影响由表 4可知,M-Ser组泌乳母猪血清TP含量显著低于对照组、L-Ser组和H-Ser组(P < 0.05);其余生化指标各组间均无显著差异(P>0.05)。
|
|
表 4 围产期母猪饲粮补充Ser对泌乳母猪血清生化指标的影响 Table 4 Effects of Ser supplementation in diets for perinatal sows on serum biochemical indices of lactating sows (n=8) |
由表 5可知,围产期母猪饲粮补充不同水平Ser对21日龄哺乳仔猪血清ALT、AST和ALP活性以及TP、UN和GLU含量虽无显著影响(P>0.05),但L-Ser组和M-Ser组哺乳仔猪血清ALT活性较对照组分别提高了3.7%和7.8%,而H-Ser组则较对照组降低了7.0%;3个Ser补充组哺乳仔猪血清AST活性较对照组分别降低了23.5%、21.2%和38.1%,血清GLU含量较对照组分别降低了5.8%、2.5%和6.5%;L-Ser组和H-Ser组仔猪血清ALP活性较对照组分别降低了7.8%和12.6%,血清UN含量较对照组分别升高了28.4%和14.2%,而M-Ser组血清ALP活性较对照组却升高了14.6%,血清UN含量较对照组降低了12.9%。
|
|
表 5 围产期母猪饲粮补充Ser对哺乳仔猪血清生化指标的影响 Table 5 Effects of Ser supplementation in diets for perinatal sows on serum biochemical indices of suckling piglets (n=6) |
由表 6可知,M-Ser组和H-Ser组初乳Ser含量显著高于L-Ser组(P < 0.05);M-Ser组和H-Ser组初乳Gly含量极显著高于对照组和L-Ser组(P < 0.01);L-Ser组初乳Cys含量极显著低于其他3组(P < 0.01)。H-Ser组哺乳仔猪血清Ser含量极显著高于其他3组(P < 0.01);L-Ser组和M-Ser组哺乳仔猪血清Gly含量显著高于对照组(P < 0.05);L-Ser组哺乳仔猪血清Cys含量显著高于对照组和H-Ser组(P < 0.05)。
|
|
表 6 围产期母猪饲粮补充Ser对初乳和哺乳仔猪血清中Ser、Gly和Cys含量的影响 Table 6 Effects of Ser supplementation in diets for perinatal sows on Ser, Gly and Cys contents in colostrum and suckling piglets' serum (n=6) |
由表 7可知,M-Ser组泌乳母猪血清MDA含量极显著低于其他3组(P < 0.01);M-Ser组和H-Ser组泌乳母猪血清GPx活性极显著高于对照组和L-Ser组(P < 0.01);泌乳母猪血清GSH含量各组间无显著差异(P>0.05)。3个Ser补充组哺乳仔猪血清MDA含量极显著低于对照组(P < 0.01);3个Ser补充组哺乳仔猪血清GPx活性与GSH含量与对照组虽无显著差异(P>0.05),但GPx活性分别提高了3.9%、13.6%和10.0%,GSH含量分别提高了6.9%、19.7%和21.9%。
|
|
表 7 围产期母猪饲粮补充Ser对泌乳母猪和哺乳仔猪血清氧化应激指标的影响 Table 7 Effects of Ser supplementation in diets for perinatal sows on serum oxidative stress indices of lactating sows and suckling piglets (n=6) |
如图 1所示,L-Ser组和M-Ser组哺乳仔猪空肠谷氨酸半胱氨酸连接酶修饰亚基(GCLM)和谷胱甘肽过氧化物酶4(GPx4)的mRNA相对表达量显著高于对照组和H-Ser组(P < 0.05),而H-Ser组空肠GCLM和GPx4的mRNA相对表达量与对照组差异不显著(P>0.05);虽然哺乳仔猪空肠铜锌超氧化物歧化酶(CuZnSOD)和烟酰胺腺嘌呤二核苷酸磷酸醌氧化还原酶1(NQO1)的mRNA相对表达量各组间无显著差异(P>0.05),但3个Ser补充组的空肠CuZnSOD mRNA相对表达量较对照组分别提高了72%、73%和77%,而空肠NQO1 mRNA相对表达量则较对照组分别降低了25%、34%和31%。
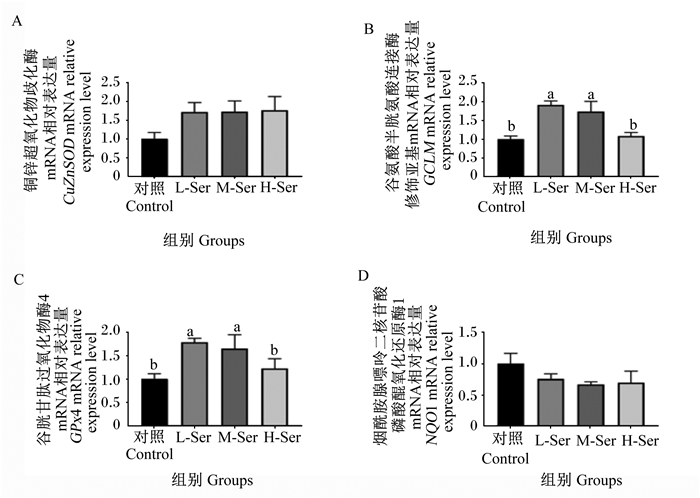
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 围产期母猪饲粮补充Ser对哺乳仔猪空肠中抗氧化酶基因mRNA相对表达量的影响 Fig. 1 Effects of Ser supplementation in diets for perinatal sows on mRNA relative expression levels of antioxidant enzyme genes in jejunum of suckling piglets (n=6) |
本团队前期研究显示,在围产期母猪饲粮中额外补充Ser可显著提高仔猪初生窝重、初生平均重、断奶窝重和断奶平均重,缩短母猪发情间隔,且补充低剂量时效果最佳[13],这表明母源添加Ser对提高母猪繁殖性能和仔猪生长性能具有一定改善作用,其具体机制需要进一步探究。众所周知,血清生化指标的变化与机体的新陈代谢密切相关,可以间接地反映机体的生理健康和代谢状况。血清ALT、AST和ALP是常用于判断肝功能是否产生损伤的指标,本研究结果显示,围产期母猪饲粮补充中剂量Ser(妊娠后期母猪饲粮Ser含量为0.83%,泌乳期母猪饲粮Ser含量为0.99%)可有效降低泌乳母猪血清中ALT、AST和ALP活性,在一定程度上保护了泌乳母猪肝功能和因自身代谢增强引发的应激损伤。有研究表明,机体血清GLU含量在正常的情况下保持相对稳定,过高或过低则反映机体代谢加强或减弱[14]。UN是机体内源性蛋白质代谢的终产物,血清UN和TP含量均可反映机体蛋白质代谢水平[15]。在本试验中,围产期母猪饲粮补充不同水平Ser均可提高泌乳母猪血清GLU和UN含量,表明Ser可有效促进母猪机体新陈代谢和提供更多的ATP,以及提高机体内蛋白质的合成速率。此外,本试验还发现M-Ser组泌乳母猪血清中TP含量较对照组显著降低,但L-Ser组和H-Ser组则无显著变化,这可能是由于适量的Ser可促进泌乳母猪碳水化合物和蛋白质的分解代谢,以满足其较高的泌乳需要,从而导致血清中TP含量的暂时性降低,具体机理仍需进一步研究。
3.2 围产期母猪饲粮补充Ser对初乳和哺乳仔猪血清中Ser、Gly和Cys含量的影响研究表明,Ser在代谢途径中与同型半胱氨酸结合生成Cys,也可在丝氨酸羟甲基转移酶(SHMT)作用下生成Gly[16-17]。本研究结果表明,在围产期母猪饲粮中额外补充Ser可以提高初乳和哺乳仔猪血清中Ser和Gly含量,进而可能导致母猪泌乳量提高,从而促进仔猪蛋白质合成,改善仔猪生长性能。同时,本团队已有研究结果也表明,母源添加Ser可显著影响母乳和哺乳仔猪血清中有关核苷酸代谢、鞘脂和磷脂代谢以及GSH和牛磺酸代谢的代谢产物的改变,这些功能性物质对母猪繁殖性能和哺乳仔猪生长性能具有有效的改善作用[13]。L-Ser和M-Ser组仔猪血清中Ser含量与对照组无显著差异,但L-Ser组血清Cys含量和M-Ser组血清Gly含量显著高于对照组,这可能是由于大部分的Ser已经转化为了Cys和Gly,参与了GSH的合成[16-17],提高哺乳仔猪抗氧化的能力。
3.3 围产期母猪饲粮补充Ser对泌乳母猪和哺乳仔猪血清氧化应激指标的影响本团队前期研究表明,Ser可为同型半胱氨酸甲基化提供一碳单元,促进GSH合成和维持蛋氨酸循环,进而缓解氧化应激[9]。MDA是一种脂质过氧化损伤的标志物,而GSH是细胞合成的最重要的低分子抗氧化剂[18],可清除体内多余的自由基[19],GPx是哺乳动物体内一种重要的抗氧化酶,可清除过氧化氢和脂质过氧化物,保护机体免受氧化损伤[20]。在本试验中,在围产期母猪饲粮中补充中剂量Ser可显著降低泌乳母猪血清中MDA含量,而补充低剂量和高剂量的Ser,对泌乳母猪血清中MDA含量无显著影响。这表明饲粮中补充中剂量Ser可缓解泌乳母猪体内的氧化应激反应,而补充低剂量和高剂量Ser对泌乳母猪体内氧化应激反应的影响不显著,这可能是由于Ser不足或过量均会对母猪围产期氧化应激产生影响,具体原因有待进一步研究。本试验结果还显示,在围产期母猪饲粮中补充中剂量Ser可显著提高泌乳母猪血清中GSH含量与GPx活性,这与我们前期研究得出的Ser可通过支持GSH合成和激活核因子E2相关因子2(Nrf2)信号通路来缓解氧化应激的研究结果[12]一致。
3.4 围产期母猪饲粮补充Ser对哺乳仔猪空肠中抗氧化酶基因表达的影响研究显示,妊娠母猪饲粮添加甲基供体蛋氨酸可提高初生仔猪血液和肝脏抗氧化酶表达和活性[21],提示在妊娠期和泌乳期对母猪进行营养调控,抗氧化物质可通过胎盘或乳汁传递给仔猪,从而增强仔猪的抗氧化能力,改善其生长性能[22]。我们前期研究发现,给母鼠饲喂缺乏Ser饲粮后,其所产断奶小鼠更易遭受氧化应激的损害,说明母源Ser对维持断奶子代的抗氧化功能十分重要[23]。在本试验中,围产期母猪饲粮补充Ser可有效提高21日龄哺乳仔猪血清中GPx活性及GSH含量和降低血清中MDA含量,同时可显著提高哺乳仔猪空肠中GCLM和GPx4基因的mRNA相对表达量,且CuZnSOD基因的mRNA相对表达量也有一定提高,而GPx4、GCLM和CuZnSOD基因表达量的提高说明ROS和过氧化物分解速度加快,还原性GSH合成速度提高,机体抗氧化能力增强[24]。这就进一步证实,母源补充Ser可能通过胎盘或母乳传递抗体或抗氧化相关物质,进而提高哺乳仔猪的抗氧化能力,促进其生长发育。
4 结论围产期母猪饲粮补充适量Ser,使得妊娠后期饲粮Ser含量为0.83%、泌乳期饲粮Ser含量为0.99%时,可有效提高泌乳母猪血清抗氧化酶活性,从而缓解围产期母猪的应激损伤,并可能通过乳汁将抗氧化物质传递给哺乳仔猪,提高哺乳仔猪的抗氧化能力。
致谢:
感谢中国科学院亚热带农业生态研究所公共技术服务中心实验室所提供的试验支持,以及湖南龙华农牧发展有限公司为本试验提供的试验动物及场所。
| [1] |
TAN C Q, WEI H K, SUN H Q, et al. Effects of dietary supplementation of oregano essential oil to sows on oxidative stress status, lactation feed intake of sows, and piglet performance[J]. Biomed Research International, 2015, 2015: 525218. |
| [2] |
PRATER M R, LAUDERMILCH C L, LIANG C, et al. Placental oxidative stress alters expression of murine osteogenic genes and impairs fetal skeletal formation[J]. Placenta, 2008, 29(9): 802-808. DOI:10.1016/j.placenta.2008.06.010 |
| [3] |
SCHOOTS M H, GORDIJN S J, SCHERJON S A, et al. Oxidative stress in placental pathology[J]. Placenta, 2018, 69(Suppl.20): 153-161. |
| [4] |
KIM S W, WEAVER A C, SHEN Y B, et al. Improving efficiency of sow productivity: nutrition and health[J]. Journal of Animal Science and Biotechnology, 2013, 4: 26. DOI:10.1186/2049-1891-4-26 |
| [5] |
郝翔宇, 王浩, 李绮琪, 等. 氧化应激与母仔猪肠道菌群的互作及其营养调控[J]. 中国饲料, 2019(17): 16-21. HAO X Y, WANG H, LI Q Q, et al. Interaction between oxidative stress and gut microbiota: role in sows and its offspring and nutritional regulation[J]. China Feed, 2019(17): 16-21 (in Chinese). |
| [6] |
ZHU C, GUO C Y, GAO K G, et al. Dietary arginine supplementation in multiparous sows during lactation improves the weight gain of suckling piglets[J]. Journal of Integrative Agriculture, 2017, 16(3): 648-655. DOI:10.1016/S2095-3119(16)61426-0 |
| [7] |
GALLI F. Amino acid and protein modification by oxygen and nitrogen species[J]. Amino Acids, 2012, 42(1): 1-4. DOI:10.1007/s00726-010-0670-8 |
| [8] |
LOCASALE J W. Serine, glycine and one-carbon units: cancer metabolism in full circle[J]. Nature Reviews Cancer, 2013, 13(8): 572-583. DOI:10.1038/nrc3557 |
| [9] |
ZHOU X H, HE L Q, WU C R, et al. Serine alleviates oxidative stress via supporting glutathione synthesis and methionine cycle in mice[J]. Molecular Nutrition & Food Research, 2017, 61(11): 1700262. |
| [10] |
ZHOU X H, HE L Q, ZUO S N, et al. Serine prevented high-fat diet-induced oxidative stress by activating AMPK and epigenetically modulating the expression of glutathione synthesis-related genes[J]. Biochimica et Biophysica Acta: Molecular Basis of Disease, 2018, 1864(2): 488-498. DOI:10.1016/j.bbadis.2017.11.009 |
| [11] |
ZHOU X, ZHANG Y, WU X, et al. Effects of dietary serine supplementation on intestinal integrity, inflammation and oxidative status in early-weaned piglets[J]. Cellular Physiology and Biochemistry, 2018, 48(3): 993-1002. DOI:10.1159/000491967 |
| [12] |
HE L Q, LONG J, ZHOU X H, et al. Serine is required for the maintenance of redox balance and proliferation in the intestine under oxidative stress[J]. The FASEB Journal, 2020, 34(3): 4702-4717. DOI:10.1096/fj.201902690R |
| [13] |
HE L Q, LIU Y H, LONG J, et al. Maternal serine supply from late pregnancy to lactation improves offspring performance through modulation of metabolic pathways[J]. Food & Function, 2020, 11(9): 8089-8098. |
| [14] |
SHIRAYAMA H, OHSHIRO Y, KINJO Y, et al. Acute brain injury in hypoglycaemia-induced hemiplegia[J]. Diabetic Medicine, 2004, 21(6): 623-624. DOI:10.1111/j.1464-5491.2004.01185.x |
| [15] |
贾义平. 四川荥经县赤腹松鼠生理生化指标的变化研究[D]. 硕士学位论文. 雅安: 四川农业大学, 2017. JIA Y P. The changes of physiological and biochemical indexes in red-bellied squirrel (Callosciurus erythraeus) from Yingjing county, Sichuan province[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2017. (in Chinese) |
| [16] |
AMELIO I, CUTRUZZOLÁ F, ANTONOV A, et al. Serine and glycine metabolism in cancer[J]. Trends in Biochemical Sciences, 2014, 39(4): 191-198. DOI:10.1016/j.tibs.2014.02.004 |
| [17] |
DE KONING T J. Treatment with amino acids in serine deficiency disorders[J]. Journal of Inherited Metabolic Disease, 2006, 29(2/3): 347-351. |
| [18] |
FORMAN H J, ZHANG H Q, RINNA A. Glutathione: overview of its protective roles, measurement, and biosynthesis[J]. Molecular Aspects of Medicine, 2009, 30(1/2): 1-12. |
| [19] |
冉玲, 黄琰, 曾红棱, 等. 酚酸与谷胱甘肽的抗氧化活性及联合抗氧化作用[J]. 现代食品科技, 2020, 36(3): 48-55. RAN L, HUANG L, ZENG H L, et al. Antioxidant activity and combined antioxidant effect of phenolic acids and glutathione[J]. Modern Food Science and Technology, 2020, 36(3): 48-55 (in Chinese). |
| [20] |
马森. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10): 53-56. MA S. Progress on GSH-Px and GST[J]. Progress in Veterinary Medicine, 2008, 29(10): 53-56 (in Chinese). DOI:10.3969/j.issn.1007-5038.2008.10.015 |
| [21] |
MOU D L, WANG J, LIU H, et al. Maternal methyl donor supplementation during gestation counteracts bisphenol A-induced oxidative stress in sows and offspring[J]. Nutrition, 2018, 45: 76-84. DOI:10.1016/j.nut.2017.03.012 |
| [22] |
尹杰, 韩慧, 刘泽民, 等. 功能性氨基酸调控猪氧化应激的研究进展[J]. 中国科学(生命科学), 2019, 49(3): 193-201. YIN J, HAN H, LIU Z M, et al. Regulation of functional amino acids on oxidative stress in pigs[J]. Scientia Sinica (Vitae), 2019, 49(3): 193-201 (in Chinese). |
| [23] |
HE L Q, ZHANG H W, ZHOU X H. Weanling offspring of dams maintained on serine-deficient diet are vulnerable to oxidative stress[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 8026496. |
| [24] |
王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展[J]. 中国生物工程杂志, 2014, 34(7): 89-95. WANG W W, TANG L, ZHOU W L, et al. Progress in the biosynthesis and metabolism of glutathione[J]. China Biotechnology, 2014, 34(7): 89-95 (in Chinese). |




