乳腺组织的基本功能是产乳,为后代的生长和发育提供营养,牛奶的主要成分是乳蛋白、乳脂和乳糖[1]。乳蛋白是衡量牛奶质量的重要指标之一,也是牛奶作为高营养食品的基本条件。乳糖是牛奶中的主要碳水化合物,是影响牛奶产量高低的决定因素。乳糖产量与乳产量呈高度的正相关[2-3]。必需氨基酸作为乳蛋白合成的重要前体物,可同时促进奶牛乳腺上皮细胞(BMECs)内乳蛋白和乳糖的合成[4]。蛋氨酸(Met)是乳蛋白合成的必需氨基酸,也是奶牛的第一限制性氨基酸。因此,深入探讨Met对乳蛋白和乳糖合成的影响及其机理对提高产奶量和改善乳品质有重要意义。奶牛饲粮添加过瘤胃蛋氨酸可显著提高产奶量、乳蛋白率[5]和乳糖含量[6]。体外研究发现,0.4 mmol/L的Met可以促进BMECs内乳蛋白合成和乳糖分泌[7]。可见Met调节乳蛋白合成的同时,对乳糖合成也有一定的影响。然而,前人的研究多偏重于Met对奶牛乳成分尤其是乳蛋白合成的影响效果,研究其对乳蛋白合成的影响机理较少,尤其对乳糖合成的影响机理探索则更少,有必要对此进行深入研究。鉴于此,本研究以BMECs为模型,从基因和蛋白质水平研究Met对乳蛋白和乳糖合成的影响,为深入研究Met对乳蛋白和乳糖合成的调节机理提供理论基础。
1 材料与方法 1.1 试验设计采用胶原酶消化法培养BMECs,具体参照Sheng等[8]的方法进行,原代细胞贴壁率达约90%后进行纯化和传代。试验采用单因子随机试验设计,将第3代BMECs培养24 h后随机分为6个组,每组6个重复。根据课题组前期的试验结果[9]选取不同浓度的Met,分别为0.13(对照)、0.26、0.39、0.52、0.65和0.78 mmol/L,DMEM/F12培养基(Gibco)中Met浓度为0.13 mmol/L,是王新朋[10]报道中奶牛动脉血中Met浓度的5倍。BMECs贴壁率为80%~90%时,无血清DMEM/F12培养基饥饿12 h后每孔加入含不同浓度Met的培养基。37 ℃、5% CO2培养48 h,研究Met对BMECs内乳蛋白和乳糖合成的影响机理。
1.2 测试指标与方法 1.2.1 细胞活力的测定细胞活力采用噻唑兰(MTT)法测定[8],用细胞相对增殖率(RGR)表示。在培养结束前4 h,每孔加入20 μL的5 mg/mL MTT(Amresco),培养结束后弃上清液,每孔加入100 μL二甲基亚枫(DMSO),振荡10 min,使用全自动酶标仪(Synergy H4,Bio-Tek)于490 nm波长下检测培养孔的吸光值(OD)。
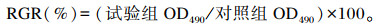
|
BMECs培养液中乳糖含量采用酶联免疫法,按照试剂盒(厦门慧嘉生物科技有限公司)说明书进行测定。将细胞悬液以2×105个/mL的密度接种于6孔培养板,按试验设计培养48 h后收集培养液,3 000×g离心20 min,收集上清。将标准品分别稀释至1 200、800、400、200和100 μg/L,分别取50 μL加入标准样品孔内。待测样品孔内加入40 μL稀释液和10 μL待测样品,37 ℃温育30 min后清洗5次。加入酶标试剂50 μL,37 ℃温育30 min,洗涤5次;然后加入显色剂A和B各50 μL,混匀,37 ℃避光显色15 min,加入50 μL终止液。使用全自动酶标仪(Synergy H4,Bio-Tek),450 nm波长下空白调零后,测定OD,根据标准曲线计算样品中乳糖的含量。
1.2.3 BMECs内ATP含量采用化学发光法测定BMECs内的ATP含量[11]。BMECs于工作液培养基中培养48 h后弃培养基,每孔加入200 μL裂解液,4 ℃、15 455×g离心5 min,取上清备用。用检测裂解液将标准溶液稀释至0.01、0.03、0.10、0.30、1.00、3.00和10.00 μmmol/L。将稀释液和检测试剂按照1 ∶ 9混合后作为工作液。最后孔内加入100 μL工作液,室温放置3 min后加入20 μL样品或标准品,迅速混匀,使用酶标仪(Synergy H4,Bio-Tek)测定闪光值。根据标准曲线计算样品中ATP的含量,以nmol/mg prot形式表示。
1.2.4 基因的表达和磷酸化水平的测定总RNA提取采用Trizol法[11],RNA反转录使用PrimeScript RT reagent Kit(TaKaRa)试剂盒并按说明书进行。依据SYBY Premix Ex TaqTM Ⅱ(TaKaRa)试剂盒说明书,采用实时荧光定量PCR检测乳蛋白和乳糖合成相关基因的表达,基因引物序列详见表 1。管家基因为磷酸甘油醛脱氢酶(GAPDH)和β-肌动蛋白(ACTB)。采用2-△△Ct法计算目的基因相对表达量。
|
|
表 1 乳蛋白和乳糖合成相关基因的引物序列 Table 1 Primer sequence of genes related with milk protein and lactose synthesis |
采用Western Blotting法[11]测定哺乳动物雷帕霉素靶蛋白(mTOR)、核糖体蛋白S6激酶1(S6K1)、真核起始因子4E结合蛋白1(4EBP1)、真核起始因子4E(eIF4E)和腺苷酸活化蛋白激酶(AMPK)的磷酸化水平。使用Quantity one软件进行灰度值分析。

|
mTOR、p-mTOR、eIF4E、p-eIF4E、S6K1、p-S6K1、4EBP1、p-4EBP1抗体购自Abcam公司。
1.3 数据处理所有数据通过Excel 2010进行计算和整理,采用SAS 9.0分析软件的方差分析(ANOVA)程序进行显著性检验。使用回归统计程序进行一次线性与二次曲线回归分析。P < 0.05表示差异显著,0.05 < P < 0.10表示差异趋于显著。
2 结果 2.1 Met对BMECs的RGR、ATP和乳糖含量及相关基因相对表达量的影响如表 2可知,随着Met浓度的增加,RGR呈一元二次增加的趋势(P=0.062,R2=0.843 4),其中,0.39~0.65 mmol/L组显著高于0.13和0.78 mmol/L组(P < 0.05)。ATP含量随着Met浓度增加呈显著的一元二次增加(P=0.027,R2=0.550 7),以0.52 mmol/L组最高,0.78 mmol/L组最低。0.39 mmol/L组BMECs乳糖含量与0.65 mmol/L组差异不显著(P>0.05),但显著高于其他组(P < 0.05)。
|
|
表 2 Met对BMECs RGR、ATP和乳糖合成的影响 Table 2 Effects of Met on RGR, ATP and lactose synthesis of BMECs |
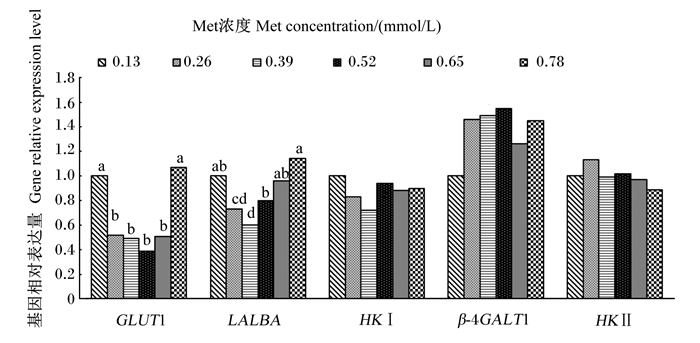
如图 1可知,葡萄糖转运蛋白1(GLUT1)和α-乳清白蛋白(LALBA)基因相对表达量随Met浓度的增加呈显著的一元二次下降(P=0.019,P=0.020;R2=0.930 0,R2=0.925 4)。GLUT1基因相对表达量以0.13和0.78 mmol/L组较高,显著高于其他组(P < 0.05);LALBA基因相对表达量以0.39和0.52 mmol/L组较低,显著低于其他组(P < 0.05)。己糖激酶Ⅰ(HKⅠ)、己糖激酶Ⅱ(HKⅡ)和β-1,4-半乳糖基转移酶-1(β-4GALT1)基因相对表达量与Met浓度无显著的剂量依赖关系(P>0.05);但0.13和0.52 mmol/L组HKⅠ基因相对表达量有高于0.39 mmol/L组的趋势(0.05 < P < 0.10);0.39~0.52 mmol/L组的β-4GALT1基因相对表达量有高于0.13 mmol/L组的趋势(0.05 < P < 0.10)。
|
GLUT1:葡萄糖转运蛋白1 glucose transporter 1;LALBA:α-乳清白蛋白alpha-lactalbumin;HKⅠ:己糖激酶Ⅰ hexokinase Ⅰ;HKⅡ:己糖激酶Ⅱ hexokinase Ⅱ;β-4GALT1:β-1,4-半乳糖基转移酶-1 β-1, 4-galactosyltransferase-1。数据柱标注不同字母表示差异显著(P < 0.05),无字母或相同字母表示差异不显著(P>0.05)。下图同。 Value columns with different letter superscripts mean significant difference (P < 0.05), while with no letter or the same letter superscripts mean no significant difference (P>0.05). The same as below. 图 1 Met对BMECs内乳糖合成相关基因相对表达量的影响 Fig. 1 Effects of Met on relative expression levels of genes involved lactose synthesis in BMECs |
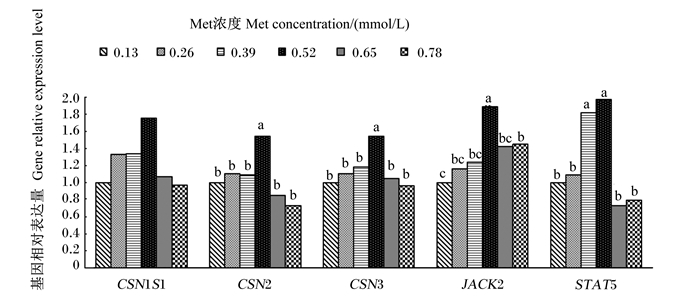
如图 2所示,αS-1酪蛋白(CSN1S1)和κ-酪蛋白(CSN3)基因相对表达量随Met浓度的增加呈显著的一元二次增加(P < 0.001,P=0.004,R2=0.978 8;R2=0.890 4),CSN3基因相对表达量以0.52 mmol/L组最高,0.78 mmol/L组最低;β-酪蛋白(CSN2)基因相对表达量与Met浓度无显著的回归关系(P>0.05),但0.52 mmol/L组显著高于其他组(P < 0.05)。酪氨酸激酶2(JACK2)和信号转导和转录因子5(STAT5)基因相对表达量随Met浓度的增加呈显著的一元二次增加(P=0.001,P < 0.001;R2=0.947 9,R2=0.977 2),0.52 mmol/L组JACK2基因表达量显著高于其他组(P < 0.05);0.39~0.52 mmol/L组STAT5基因相对表达量显著高于其他组(P < 0.05),其他组间差异不显著(P>0.05)。
|
CSN1S1:αS-1酪蛋白αS1-casein;CSN3:κ-酪蛋白κ-casein;CSN2:β-酪蛋白β-casein;JACK2:酪氨酸激酶2 Janus kinase 2;STAT5:信号转导和转录因子5 signal transducer and activator of transcription 5。 图 2 Met对BMECs内乳蛋白合成相关基因相对表达量的影响 Fig. 2 Effects of Met on relative expression levels of genes involved milk protein synthesis in BMECs |
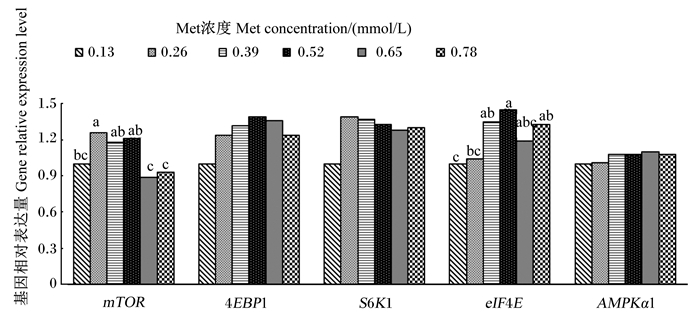
如图 3所示,mTOR、eIF4E和4EBP1基因相对表达量随Met浓度的增加呈显著的一元二次增加(P=0.006,P < 0.001,P=0.020;R2=0.868 4,R2=0.961 0,R2=0.792 8),mTOR基因相对表达量以0.26~0.52 mmol/L组较高,0.65~0.78 mmol/L组较低;eIF4E基因相对表达量0.39~ 0.52 mmol/L组显著高于0.13 mmol/L组(P < 0.05)。S6K1基因相对表达量随Met浓度增加呈显著的一次线性增加(P=0.038,R2=0.675 6),0.26~0.78 mmol/L组有高于0.13 mmol/L组的趋势(0.05 < P < 0.10)。
|
mTOR:哺乳动物雷帕霉素靶蛋白mammalian target of rapamycin;S6K1:核糖体蛋白S6激酶1 ribosomal protein S6 kinase beta 1;4EBP1:真核起始因子4E结合蛋白1 eukaryotic translation initiation factor 4E-binding protein 1;eIF4E:真核起始因子4E eukaryotic translation initiation factor 4E;AMPKα1:腺苷酸活化蛋白激酶α 1 AMP-activated protein kinase α1。下图同the same as below。 图 3 Met对BMECs内mTOR信号通路相关基因相对表达量的影响 Fig. 3 Effects of Met on relative expression levels of genes involved mTOR signaling pathway in BMECs |
如图 4所示,mTOR、S6K1、eIF4E和AMPK磷酸化水平随Met浓度的增加呈显著的一元二次增加(P=0.001, P=0.001, P=0.003,P=0.002;R2=0.607 3,R2=0.649 6,R2=0.544 1,R2=0.571 1),mTOR磷酸化水平0.39~0.78 mmol/L组显著高于0.13和0.26 mmol/L组(P < 0.05);S6K1磷酸化水平以0.52 mmol/L组最高,0.26~0.52 mmol/L组eIF4E磷酸化水平显著高于其他组(P<0.05),尤以0.39 mmol/L组最高;AMPK磷酸化水平以0.52 mmol/L组最低,0.78 mmol/L组最高,显著高于其他组(P < 0.05)。Met浓度对4EBP1磷酸化水平影响不显著(P>0.05)。
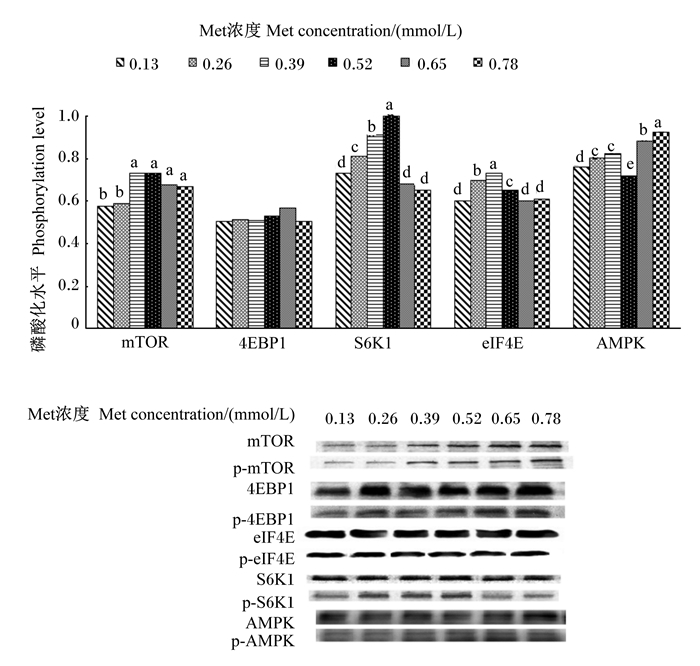
|
图 4 Met对BMECs内mTOR信号通路磷酸化水平的影响 Fig. 4 Effects of Met on phosphorylation level of mTOR signaling pathway in BMECs |
氨基酸作为细胞生长的营养素,可以调节细胞的生长。适宜浓度的氨基酸与细胞的增殖存在时间和浓度的最优化效应,若低于或高于该值,增殖率就相应下降[12],常晨城[9]研究指出,0.52 mmol/L的Met提高细胞增殖率。乳蛋白的合成很大程度上受细胞增殖的影响,祁昊等[13]发现Met可通过激活mTOR信号通路促进BMECs的增殖。本研究得出相似的结果,0.39~0.52 mmol/L组细胞增殖率和mTOR磷酸化水平较高,0.78 mmol/L组均较低,说明适宜浓度Met促进细胞增殖,高浓度反而有抑制作用。
Met是蛋白质合成的第一限制性氨基酸,Nan等[14]发现,与无氨基酸组相比,0.5 mmol/L Met显著促进BMECs内CSN1S1和CSN3的基因表达,但对CSN3基因表达影响不显著。常晨城[9]指出,与0.13 mmol/L Met组相比,0.52 mmol/L Met显著上调BMECs内CSN1S1和CSN3的基因表达量,但不影响CSN2的基因表达量。本研究结果表明,Met对于酪蛋白的合成调控有显著的作用,0.52 mmol/L的Met显著上调CSN1S1和CSN3的基因相对表达量,但0.78 mmol/L的Met抑制其表达。JACK2/STAT5和mTOR信号通路是参与乳蛋白调控的2条重要通路。BMECs内生长激素可以通过激活STAT5调控CSN1S1、CSN1S2和CSN2 mRNA表达[15]。与无Met组相比,0.5 mmol/L的Met显著上调BMECs内JACK2和STAT5基因表达[14],JACK2/STAT5信号通路是Met促进酪蛋白合成的重要途径[16]。本研究中,0.39~0.52 mmol/L Met对JACK2和STAT5基因相对表达量有较好的促进效果,因此,Met通过JACK2/STAT5通路在转录水平上调控乳蛋白合成。
mTOR通路及下游元件共同参与氨基酸调控乳蛋白的合成。有研究发现,与氨基酸组相比,0.5 mmol/L的Met对BMECs内mTOR和S6K1基因表达均无显著的促进作用,但mTOR磷酸化水平显著增加,Met对蛋白合成的影响主要在转录后的翻译阶段[14]。本研究发现,mTOR、eIF4E、4EBP1和S6K1基因相对表达量及mTOR和S6K1磷酸化水平与Met浓度呈剂量依赖关系,以0.39~0.52 mmol/L组较高,0.78 mmol/L抑制mTOR的表达和磷酸化水平,说明适宜浓度的Met通过激活mTOR信号通路促进酪蛋白合成。mTOR信号通路上游的元件AMPK是细胞内能量的主要调节器,调节能量的供应与需求的平衡[17],其活性与mTOR介导的合成代谢信号通路呈负相关[18]。当细胞内ATP含量下降和AMP含量增加时AMPK被激活,抑制ATP的消耗[19]。本研究发现,0.26~0.65 mmol/L组ATP含量较高,AMPK磷酸化水平较低,mTOR基因相对表达量和磷酸化水平和酪蛋白基因表达较高;相反高浓度Met组ATP含量较低,AMPK磷酸化水平较高,mTOR磷酸化水平和酪蛋白基因表达下降,说明适宜浓度的Met可以通过促进细胞内ATP含量抑制AMPK磷酸化水平,进而激活mTOR信号通路促进乳蛋白的合成。
3.2 Met对BMECs内乳糖合成及相关基因表达的影响葡萄糖是乳糖合成的主要前体物,由于乳腺内缺少葡萄糖-6-磷酸酶,不能通过糖异生合成葡萄糖[20]。所以,在体外研究中,乳腺内氨基酸对乳糖合成的影响只能通过调控作用来完成。血液中总葡萄糖的60%~85%被乳腺吸收[21]。所以,乳腺对葡萄糖的吸收是控制乳产量的限速步骤。GLUT是牛乳腺中主要的葡萄糖转运蛋白,牛乳腺中主要表达的转运蛋白是GLUT1,泌乳期其表达上调几百倍[22]。GLUT1表达的下调导致葡萄糖用于合成乳糖的利用率降低[23]。鸡和大鼠的胸腺中,随着葡萄糖利用率增加,GLUT1 mRNA的表达也增加[24]。本研究发现,0.26~0.65 mmol/L组GLUT1基因相对表达量较低,提示0.26~0.65 mmol/L的Met抑制细胞对葡萄糖的摄取。乳糖合成酶是由β-4GALT1与LALBA构成的二聚体,是乳糖合成和分泌的限速酶。有研究指出,奶牛饲粮添加过瘤胃蛋氨酸对血浆葡萄糖含量影响不显著[25],乳糖含量的变化也较小[26]。但体外研究发现,0.4 mmol/L的Met组BMECs乳糖含量显著高于0.2 mmol/L组[8]。本研究发现,0.39 mmol/L组乳糖含量高于其他组。但0.26~0.52 mmol/L的Met抑制葡萄糖的摄取和乳糖合成酶LALBA基因相对表达量,这可能与β-4GALT1基因相对表达量增加有关。但目前,关于Met对乳糖合成的影响研究较少,确切的机理尚不清楚,有待于进一步研究探讨。
综合以上结果,Met浓度为0.39~0.52 mmol/L时对BMECs内乳蛋白和乳糖合成的促进效果较好。目前已有研究证实了体外细胞培养液的氨基酸浓度与血液氨基酸浓度有一定关系,Appuhamy等[18]研究中BMECs细胞培养液的氨基酸浓度大于奶牛血液氨基酸浓度。本研究中细胞培养液Met的最低浓度约为Rius等[27]和王新朋[10]报道的奶牛动脉血中Met浓度的5倍。在实际生产中,NRC(2001)推荐泌乳奶牛Met的供给量应占饲粮代谢蛋白质的2.4%,且有关奶牛饲粮添加Met的研究多侧重于研究乳成分含量的变化,而针对影响机理的研究较少,因此,本研究利用体外法得出的结果还需要在体内进一步验证。
4 结论Met对CSN1S1和CSN3基因表达的促进作用呈剂量依赖关系,以0.52 mmol/L组表达较好,0.78 mmol/L组抑制其表达;0.39~0.52 mmol/L组对JACK2/STAT5、mTOR通路相关基因的表达、mTOR和S6K1的磷酸化水平及ATP含量促进效果较好,但抑制AMPK的磷酸化水平。Met对GLUT1和LALBA基因表达的抑制作用呈显著的剂量依赖关系,0.52~0.65 mmol/L组的抑制作用较弱,但乳糖含量以0.39 mmol/L组最高。综合以上指标,Met浓度为0.39~0.52 mmol/L时对乳蛋白和乳糖合成的促进效果较好。
| [1] |
ANDERSON S M, RUDOLPH M C, MCMANAMAN J L, et al. Key stages in mammary gland development.Secretory activation in the mammary gland: it's not just about milk protein synthesis![J]. Breast Cancer Research, 2007, 9(1): 204. DOI:10.1186/bcr1653 |
| [2] |
JOHNSON D L, PETCH S F, WINKELMAN A M, et al. Genetics of milk characteristics in New Zealand dairy cattle[C]//Proceedings of the New Zealand society of animal production. Hamilton: New Zealand Society of Animal Production, 2000, 60: 318-319.
|
| [3] |
SNEDDON N W, LOPEZ-VILLALOBOS N, HICKSON R E, et al. Genetic parameters for lactose and its relationship with concentrations and ratios of other milk components[C]//Proceedings of the New Zealand society of animal production. Christchurch: New Zealand Society of Animal Production, 2012, 72: 76-80.
|
| [4] |
王立娜. 氨基酸与STAT5A基因互作对奶牛乳腺上皮细胞泌乳的调节作用及机理[D]. 博士学位论文. 哈尔滨: 东北农业大学, 2014. WANG L N. Effect of interaction between amino acid and STAT5A on lactation of dairy cow mammary epithelial cells and its mechanism[D]. Ph. D. Thesis. Harbin: Northeast Agricultural University, 2014. (in Chinese) |
| [5] |
NOFTSGER S, ST-PIERRE N R. Supplementation of methionine and selection of highly digestible rumen undegradable protein to improve nitrogen efficiency for milk production[J]. Journal of Dairy Science, 2003, 86(3): 958-969. DOI:10.3168/jds.S0022-0302(03)73679-0 |
| [6] |
PATE R T, LUCHINI D, MURPHY M R, et al. Effects of rumen-protected methionine on lactation performance and physiological variables during a heat stress challenge in lactating Holstein cows[J]. Journal of Dairy Science, 2020, 103(3): 2800-2813. DOI:10.3168/jds.2019-17305 |
| [7] |
王佳丽, 高学军, 李庆章, 等. 蛋氨酸对体外培养奶牛乳腺上皮细胞泌乳能力的影响[J]. 乳业科学与技术, 2012, 35(1): 8-10. WANG J L, GAO X J, LI Q Z, et al. Effect of methionine on lactation ability of dairy cow mammary epithelial cells cultured in vitro[J]. Journal of Dairy Science and Technology, 2012, 35(1): 8-10 (in Chinese). |
| [8] |
SHENG R, YAN S M, QI L Z, et al. Effect of the ratios of unsaturated fatty acids on the expressions of genes related to fat and protein in the bovine mammary epithelial cells[J]. In Vitro Cellular & Developmental Biology Animal, 2015, 51(4): 381-389. |
| [9] |
常晨城. 蛋氨酸及含蛋氨酸二肽对奶牛乳腺上皮细胞内乳蛋白合成相关基因表达的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2015. CHANG C C. Effect of methionine and dipeptides containing methionine on genes expression involved in milk protein synthesis in bovine mammary epithelial cells[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2015. (in Chinese) |
| [10] |
王新朋. 阴外动脉灌注氨基酸和脂肪酸对奶牛乳腺蛋白质合成和氨基酸摄取规律的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2015. WANG X P. The effects of external pudendal artery infusion of amino acid and fatty acid on protein synthesis and amino acid uptake in mammary glands of dairy cows[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2015. (in Chinese) |
| [11] |
ZHAO Y L, YAN S M, CHEN L, et al. Effect of interaction between leucine and acetate on the milk protein synthesis in bovine mammary epithelial cells[J]. Animal Science Journal, 2018, 90(1): 81-89. |
| [12] |
王志钢, 吴应积, 旭日干. mTOR信号通路与细胞生长调控[J]. 生物物理学报, 2007, 23(5): 333-342. WANG Z G, WU Y J, XU R G. The mTOR signaling pathway and the regulation of cell growth[J]. ACTA Biophysica Sinica, 2007, 23(5): 333-342 (in Chinese). DOI:10.3321/j.issn:1000-6737.2007.05.003 |
| [13] |
祁昊, 孟春雨, 高学军, 等. SNAT2介导蛋氨酸对牛乳腺上皮细胞增殖与自噬的调节作用[J]. 中国畜牧兽医, 2019(9): 2516-2525. QI H, MENG C Y, GAO X J, et al. SNAT2:a key mediator for methionine to regulate proliferation and autophagy in bovine mammary epithelial cells[J]. China Animal Husbandry and Veterinary Medicine, 2019(9): 2516-2525 (in Chinese). |
| [14] |
NAN X M, BU D P, LI X Y, et al. Ratio of lysine to methionine alters expression of genes involved in milk protein transcription and translation and mTOR phosphorylation in bovine mammary cells[J]. Physiological Genomics, 2014, 46(7): 268-275. DOI:10.1152/physiolgenomics.00119.2013 |
| [15] |
ZHOU Y, AKERS R M, JIANG H. Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J]. Journal of Dairy Science, 2008, 91(1): 100-108. DOI:10.3168/jds.2007-0509 |
| [16] |
代文婷. SARS介导蛋氨酸调节奶牛乳腺上皮细胞酪蛋白合成的机制研究[D]. 博士学位论文. 杭州: 浙江大学, 2018. DAI W T. Mechanism of seryl-tRNA sythetase-mediated methionine regulating casein synthsis in bovine mammary epithelial cells[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2018. (in Chinese) |
| [17] |
HARDIE D G. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy[J]. Nature Reviews Molecular Cell Biology, 2007, 8(10): 774-785. DOI:10.1038/nrm2249 |
| [18] |
APPUHAMY J A D R N, NAYANANJALIE W A, ENGLAND E M, et al. Effects of AMP-activated protein kinase (AMPK) signaling and essential amino acids on mammalian target of rapamycin (mTOR) signaling and protein synthesis rates in mammary cells[J]. Journal of Dairy Science, 2014, 97(1): 419-429. DOI:10.3168/jds.2013-7189 |
| [19] |
KAHN B B, ALQUIER T, CARLING D, et al. AMP-activated protein kinase: ancient energy gauge provides clues to modern understanding of metabolism[J]. Cell Metabolism, 2005, 1(1): 15-25. DOI:10.1016/j.cmet.2004.12.003 |
| [20] |
THREADGOLD L C, KUHN N J. Glucose-6-phosphate hydrolysis by lactating rat mammary gland[J]. International Journal of Biochemistry, 1979, 10(8): 683-685. DOI:10.1016/0020-711X(79)90212-X |
| [21] |
SUNEHAG A, TIGAS ST, HAYMOND M W. Contribution of plasma galactose and glucose to milk lactose synthesis during galactose ingestion[J]. The Journal of Clinical Endocrinology & Metabolism, 2003, 88(1): 225-229. |
| [22] |
ZHAO F Q, KEATING A F. Expression and regulation of glucose transporters in the bovine mammary gland[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E76-E86. |
| [23] |
BEN CHEDLY H, LACASSE P, MARNET P G, et al. Use of milk epithelial cells to study regulation of cell activity and apoptosis during once-daily milking in goats[J]. Animal, 2011, 5(4): 572-579. DOI:10.1017/S1751731110002284 |
| [24] |
HUMPHREY B D, RUDRAPPA S G. Increased glucose availability activates chicken thymocyte metabolism and survival[J]. The Journal of Nutrition, 2008, 138(6): 1153-1157. DOI:10.1093/jn/138.6.1153 |
| [25] |
CIVELEK T, BīRDANE F M, KABU M, et al. Effects of methionine and lysine on metabolic profile in dairy cattle during periparturient period[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2013, 19(3): 423-432. |
| [26] |
孙华, 张晓明, 王欣, 等. 过瘤胃保护蛋氨酸对奶牛生产性能的影响及经济效益分析[J]. 中国奶牛, 2010(11): 7-11. SUN H, ZHANG X M, WANG X, et al. Effect of supplementing rumen protected methionine on milk performance of dairy cow and economic benefits analysis[J]. China Dairy Cattle, 2010(11): 7-11 (in Chinese). |
| [27] |
RIUS A G, APPUHAMY J A D R N, CYRIAC J, et al. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids[J]. Journal of Dairy Science, 2010, 93(7): 3114-3127. DOI:10.3168/jds.2009-2743 |




