2. 山西农业大学动物科学学院, 太谷 030801
2. College of Animal Science, Shanxi Agricultural University, Taigu 030801, China
亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)是高产反刍动物群体中常见的营养代谢性疾病,绵羊育肥养殖过程中,为达最大生产性能常饲喂大量高精饲粮,高精饲粮发酵导致瘤胃内挥发性脂肪酸以及乳酸等有机酸积累,瘤胃pH长时间处于较低水平,绵羊发生SARA[1]。SARA会导致瘤胃液pH下降、瘤胃微生物菌群紊乱、机体组织器官产生炎症、生产性能降低、动物淘汰或死亡等情况发生[2-4]。SARA早期通常没有典型症状,诊断较为困难,瘤胃液pH 5.2~5.6持续3 h以上为SARA主要判定依据[5]。SARA发生机制包括乳酸中毒学说以及内毒素组胺中毒学说[6]。研究报道,奶牛SARA可引起瘤胃液乳酸、组胺和内毒素含量显著增加,但血液乳酸、组胺和内毒素含量变化不显著[7-8];而曾光[9]通过梯度增加精粗比诱导山羊SARA,发现瘤胃液及血液乳酸、组胺和内毒素含量均显著升高。瘤胃内环境失衡通常会导致瘤胃菌群发生改变,Kim等[10]饲喂高谷物饲粮诱导奶牛SARA,显示瘤胃菌群多样性指数下降,普雷沃氏菌属的相对丰度降低。目前,关于SARA的发生及其机制研究多集中于奶牛[11-13]和山羊[14-16],模型多以短期高谷物饲粮诱导,诱导过程与疾病发生发展不符,SARA绵羊瘤胃异常代谢产物及菌群、血气和血清生化指标等如何变化鲜有报道,其发生机制尚不清楚。因此,本研究通过逐步提升饲粮精粗比建立绵羊SARA模型,分析SARA对绵羊瘤胃异常代谢产物、瘤胃菌群、血气和血清生化指标的影响,探究绵羊SARA状态下瘤胃内环境和机体状况,为防治绵羊SARA提供理论依据。
1 材料与方法 1.1 试验动物选择50只2月龄同期断奶、平均体重(20.50±2.21) kg杜泊羊(♂)×湖羊(♀)F1代作为试验动物,公母各占1/2。
1.2 动物设计试验前绵羊分为2组,分别为SARA诱导组(n=35)与对照组(CK组,n=15)。预试期30 d,饲喂精粗比为50 ∶ 50的基础饲粮。SARA诱导组通过饲粮精粗比递增诱导绵羊发生SARA,饲粮精粗比依次为50 ∶ 50、70 ∶ 30、80 ∶ 20、90 ∶ 10和100 ∶ 0,各精粗比饲粮均饲喂7 d,瘤胃液pH 5.2~5.6持续3 h以上的绵羊构成SARA模型组;CK组饲喂精粗比为50 ∶ 50的基础饲粮。每日06:00和17:00饲喂,每只羊每日约采食1.55 kg饲粮。饲粮参照《肉羊饲养标准》(NY/T 816—2004)配制,各精粗比饲粮组成及营养水平见表 1。
|
|
表 1 各精粗比饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of each concentrate to forage ratio diets (air-dry basis) |
每日观察绵羊精神和粪便状态,采集瘤胃液时观察其颜色、气味和黏稠度,并记录。
1.3.2 样品采集于各饲喂期第7天晨饲后1、2、3、4、5、6和8 h使用瘤胃液口腔采样器(A1164K,武汉科立博牧业科技有限公司)抽取瘤胃液,每只50 mL,4层纱布过滤保存。模型构建成功后,于晨饲前用BD PresetTM采血器和含促凝剂的采血管采集颈静脉血液。
1.3.3 样品测定瘤胃液采集后,立即用便携pH计(AS-PH8,武汉中测宏图测量仪器有限公司)测定。随机选取3只羊同一天的瘤胃液样品混匀后用于菌群测定,5个混匀瘤胃液样本用于瘤胃异常代谢产物测定,5个血液样本用于血气和血清生化指标测定。瘤胃液菌群16S rRNA V3~V4区测序由天津诺禾致源公司完成。乳酸、组胺和内毒素含量分别使用南京建成生物工程研究所、江苏酶免实业有限公司和厦门鲎试剂生物科技股份有限公司生产的试剂盒测定。血液pH、二氧化碳分压(pCO2)、氧分压(pO2)、二氧化碳总量(tCO2)以及乳酸、实际碳酸氢盐(HCO3-)、阴离子间隙(AG)和全血碱剩余(BE-B)含量使用全自动血气分析仪(GEM Premier 4000,美国实验室仪器公司)检测。血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)活性及尿素(UN)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)和葡萄糖(GLU)含量使用全自动生化分析仪(TBA-120 FR,日本)检测。
1.4 数据分析测序数据使用Qiime 1.9.1软件进行处理分析。有效测序数据以97%的一致性聚类成为操作分类单元(operational taxonomic units,OTUs),使用SILVA 132数据库进行物种注释。Alpha分析使用wilcox秩和检验进行统计分析。数据使用Excel 2019整理,统计分析应用SPSS 26.0软件中独立样本t检验及单因素方差分析,多重比较采用Duncan氏法。数据以平均值±标准差(mean±SD)表示。
2 结果 2.1 SARA绵羊模型建立由表 2可见,SARA诱导组瘤胃液pH随饲粮精粗比提高而降低,精粗比为100 ∶ 0时共有27只绵羊瘤胃液pH在5.2~5.6持续3 h以上。临床观察,CK组绵羊未见明显异常,瘤胃液较稀薄,气味微臭,色泽偏绿(图 1-A),粪便为较硬颗粒状(图 1-C);SARA诱导组在精粗比为100 ∶ 0时部分绵羊瘤胃液较浓稠,气味恶臭,色泽偏黄(图 1-B),轻度腹泻,粪便稀软不成形(图 1-D),精神状态未见明显异常。综上判定,SARA诱导组的27只绵羊在精粗比为100 ∶ 0时发生SARA,构成SARA模型组[5]。
|
|
表 2 SARA对绵羊瘤胃液pH的影响 Table 2 Effects of SARA on rumen fluid pH of sheep |

|
A:健康绵羊瘤胃液rumen fluid of healthy sheep;B:SARA绵羊瘤胃液rumen fluid of SARA sheep;C:健康绵羊粪便feces of healthy sheep;D:SARA绵羊粪便feces of SARA sheep。 图 1 SARA对绵羊瘤胃液及粪便的影响 Fig. 1 Effects of SARA on rumen fluid and feces of sheep |
由表 3可见,瘤胃液乳酸、组胺和内毒素含量随饲粮精粗比提高而增加,SARA模型组瘤胃液乳酸、组胺和内毒素含量均显著高于CK组(P<0.05)。
|
|
表 3 SARA对绵羊瘤胃液乳酸、组胺和内毒素含量的影响 Table 3 Effects of SARA on contents of lactic acid, histamine and endotoxin in rumen fluid of sheep |
由表 4可见,随饲粮精粗比提高,瘤胃菌群丰富度指数(Chao1指数)和多样性指数(Shannon指数)下降。SARA模型组Chao1指数显著低于CK组(P<0.05)。
|
|
表 4 SARA对绵羊瘤胃菌群Alpha多样性的影响 Table 4 Effects of SARA on Alpha diversity of rumen bacterial flora of sheep |
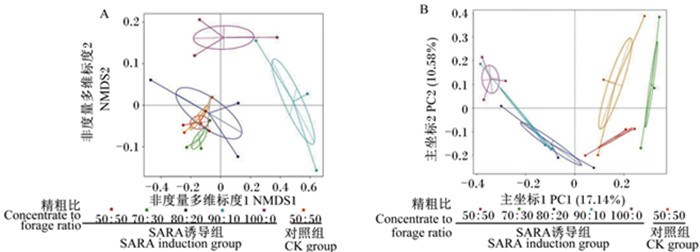
非度量多维标度(non-metric multidimensional scaling,NMDS)分析基于Weighted Unifrac距离,SARA模型组位于第1及第4象限,与CK组距离较远(图 2-A);主坐标分析(principal coordinates analysis,PCoA)基于Bray Curtis距离,获得主坐标1(PC1)的贡献率为17.14%,SARA模型组位于第4象限,样本较为集中,与CK组距离较远(图 2-B)。
|
A:非度量多维标度分析NMDS analysis;B:主坐标分析PCoA。 图 2 SARA对绵羊瘤胃菌群Beta多样性的影响 Fig. 2 Effects of SARA on Beta diversity of rumen bacterial flora of sheep |
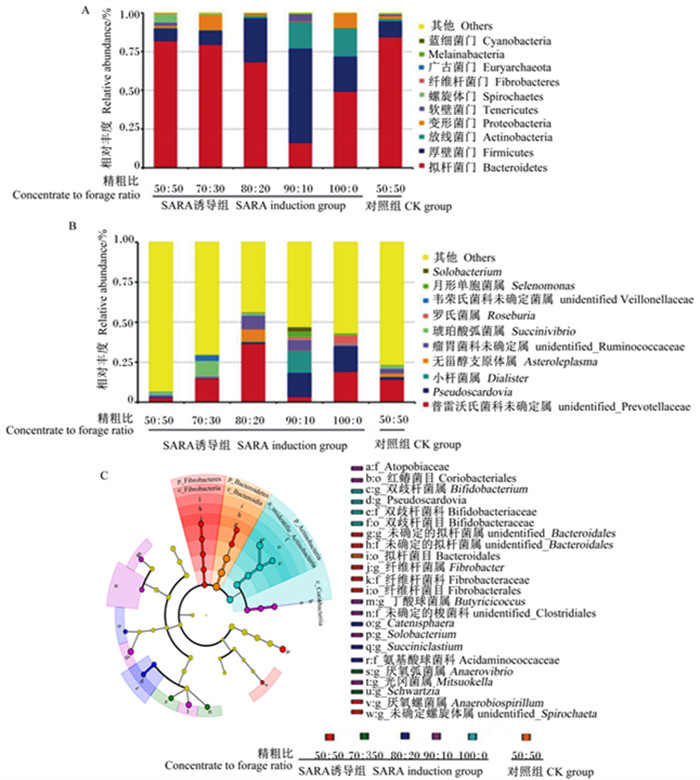
门水平下,SARA诱导组在精粗比为90 ∶ 10时最优菌门为厚壁菌门(Firmicutes),其余各组最优菌门为拟杆菌门(Bacteroidetes);与CK组相比,SARA模型组厚壁菌门、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)相对丰度增加,拟杆菌门相对丰度降低(图 3-A)。属水平下,SARA诱导组在精粗比为90 ∶ 10时最优菌属为Pseudoscardovia,其余各组最优菌属为普雷沃氏菌科未确定菌属(unidentified Prevotellaceae);与CK组相比,SARA模型组普雷沃氏菌科未确定菌属、罗氏菌属(Roseburia)和Pseudoscardovia相对丰度增加(图 3-B)。SARA模型组在属水平下,双歧杆菌属(Bifidobacterium)和Pseudoscardovia为具有生物学及统计学意义的差异物种(图 3-C)。
|
A:门水平菌群结构堆积柱状图stacking histogram of bacterial community structure at phylum level;B:属水平菌群结构堆积柱状图stacking histogram of bacterial community structure at genus level;C:线性判别分析分枝进化图LEfSe analysis branching evolution diagram。 图 3 SARA对绵羊瘤胃菌群结构的影响 Fig. 3 Effects of SARA on rumen bacterial flora structure of sheep |
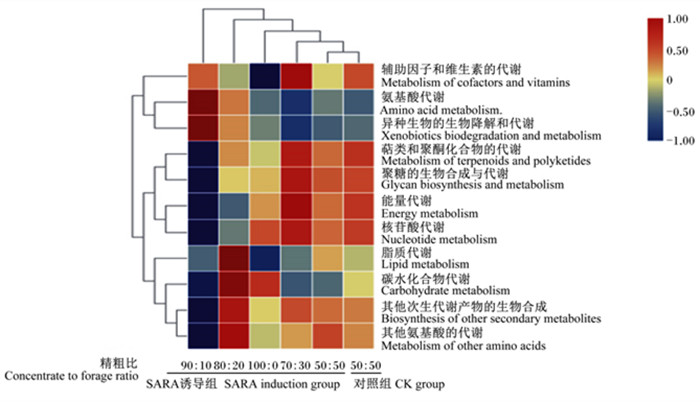
由图 4可见,SARA模型组瘤胃菌群代谢相关二级功能层基因富集存在差异,与CK组相比,主要体现在碳水化合物代谢相关基因的相对丰度升高,辅助因子和维生素的代谢、脂质代谢、其他次生代谢产物的生物合成和其他氨基酸的代谢相关基因的相对丰度降低。
|
图 4 代谢相关功能基因预测热图 Fig. 4 Heatmap of metabolism-related functional gene prediction |
由表 5可见,血气分析结果显示,SARA模型组血液乳酸含量显著高于CK组(P<0.05),SARA模型组血液二氧化碳总量、实际碳酸氢盐及全血碱剩余含量均显著低于CK组(P<0.05)。
|
|
表 5 SARA对绵羊血气分析的影响 Table 5 Effects of SARA on blood gas analysis of sheep |
由表 6可见,SARA模型组血清组胺和内毒素含量显著高于CK组(P<0.05),血清谷丙转氨酶活性显著低于CK组(P<0.05),其余血清生化指标与CK组差异不显著(P>0.05)。
|
|
表 6 SARA对绵羊血清生化指标的影响 Table 6 Effects of SARA on serum biochemical indexes of sheep |
瘤胃pH受饲粮影响,一般情况下,反刍动物瘤胃pH维持在6.5~7.5[17]。瘤胃菌群变化与饲粮组成、饲养环境和管理模式等相关[18-19]。动物长期采食高精料饲粮,瘤胃异常发酵,导致瘤胃pH下降,瘤胃菌群改变[20]。Plaizier等[21]诱导奶牛SARA,发现瘤胃微生物区系丰富度和多样性降低。众多研究发现,反刍动物瘤胃最优菌门为拟杆菌门,最优菌属为普雷沃氏菌属[22-27]。李小玉等[27]研究急性瘤胃酸中毒山羊,发现瘤胃厚壁菌门相对丰度增加,拟杆菌门相对丰度降低。研究表明,SARA奶牛普雷沃氏菌属相对丰度提升[28],瘤胃壁菌群碳水化合物代谢相关基因高表达[29]。本研究与上述结果相似,瘤胃内酸性环境导致瘤胃菌群发生变化,大量瘤胃细菌因不适酸性环境而死亡,进而菌群丰富度和多样性降低,造成瘤胃健康破坏和生产效能降低[30]。SARA模型组瘤胃厚壁菌门相对丰度增加,主要为降解纤维类物质和碳水化合物的菌种,进而引起菌群碳水化合物相关代谢基因富集,有助于反刍动物瘤胃代谢[24]。绵羊发生SARA后,瘤胃内毒素含量显著升高,因拟杆菌门内革兰氏阴性细菌大量死亡,拟杆菌门相对丰度降低,细菌裂解释放内毒素[25]。罗氏菌属相对丰度提升,瘤胃液乳酸含量显著增加,表明SARA会增加瘤胃乳酸产生菌,导致瘤胃乳酸积累,pH下降。
SARA模型组血气分析结果与胡红莲[14]和苑学[31]研究结果一致,血液pH、二氧化碳分压、实际碳酸氢盐和全血碱剩余含量降低,氧分压含量升高。SARA绵羊血液乳酸含量显著升高,表明瘤胃液乳酸吸收超过肝脏处理能力,导致血液pH下降,血液过多的氢离子(H+)由血液实际碳酸氢盐缓冲,进而降低机体碱储,发生代谢性酸中毒。SARA模型组瘤胃内毒素积累,促进炎症介质组胺的产生,二者同时进入血液循环,血液与瘤胃液内毒素和组胺含量显著升高,可能会引发一系列炎症反应[32]。血清生化指标可以反映机体营养代谢状况以及肝肾功能状况。孙燕勇等[33]研究发现,SARA山羊有一定程度的肝功能损伤,本研究未发现肝脏损害,各项血清生化指标均处于正常范围,可能与SARA持续时间有关。
4 结论本研究通过逐步递增饲粮精粗比成功构建绵羊SARA模型。绵羊发生SARA时,瘤胃内环境改变,瘤胃菌群丰富度降低,厚壁菌门、放线菌门、变形菌门、普雷沃氏菌科未确定菌属、罗氏菌属和Pseudoscardovia相对丰度增加,拟杆菌门相对丰度下降,血液和瘤胃液乳酸、内毒素和组胺含量升高,机体碱储降低,发生代谢性酸中毒。
致谢:
感谢山西保森畜牧有限公司提供的试验场地。
| [1] |
KLEEN J L, HOOIJER G A, REHAGE J, et al. Subacute ruminal acidosis (SARA): a review[J]. Journal of Veterinary Medicine A, 2003, 50(8): 406-414. DOI:10.1046/j.1439-0442.2003.00569.x |
| [2] |
GIGER-REVERDIN S. Recent advances in the understanding of subacute ruminal acidosis (SARA) in goats, with focus on the link to feeding behaviour[J]. Small Ruminant Research, 2018, 163: 24-28. DOI:10.1016/j.smallrumres.2017.08.008 |
| [3] |
JIN D, CHANG G J, ZHANG K, et al. Rumen-derived lipopolysaccharide enhances the expression of lingual antimicrobial peptide in mammary glands of dairy cows fed a high-concentrate diet[J]. BMC Veterinary Research, 2016, 12: 128. DOI:10.1186/s12917-016-0755-z |
| [4] |
STEFAŃSKA B, NOWAK W, KOMISAREK J, et al. Prevalence and consequence of subacute ruminal acidosis in Polish dairy herds[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(4): 694-702. DOI:10.1111/jpn.12592 |
| [5] |
ABDELA N. Sub-acute ruminal acidosis (SARA) and its consequence in dairy cattle: a review of past and recent research at global prospective[J]. Achievements in the Life Sciences, 2016, 10(2): 187-196. DOI:10.1016/j.als.2016.11.006 |
| [6] |
NAGARAJA T G, TITGEMEYER E C. Ruminal acidosis in beef cattle: the current microbiological and nutritional outlook[J]. Journal of Dairy Science, 2007, 90(Suppl.1): E17-E38. |
| [7] |
GOLDER H M, LEAN I J, RABIEE A R, et al. Effects of grain, fructose, and histidine feeding on endotoxin and oxidative stress measures in dairy heifers[J]. Journal of Dairy Science, 2013, 96(12): 7881-7891. DOI:10.3168/jds.2013-7113 |
| [8] |
KHAFIPOU E, KRAUSE D O, PLAIZIER J C. Alfalfa pellet-induced subacute ruminal acidosis in dairy cows increases bacterial endotoxin in the rumen without causing inflammation[J]. Journal of Dairy Science, 2009, 92(4): 1712-1724. DOI:10.3168/jds.2008-1656 |
| [9] |
曾光. 酵母复合微生态制剂对SARA山羊模型的调控作用[D]. 硕士学位论文. 长春: 吉林大学, 2016: 16-31. ZENG G. Regulatory effect of the yeast complex micro ecological agents on the model of SARA goats[D]. Master's Thesis. Changchun: Jilin University, 2016: 16-31. (in Chinese) |
| [10] |
KIM Y H, NAGATA R, OHKUBO A, et al. Changes in ruminal and reticular pH and bacterial communities in Holstein cattle fed a high-grain diet[J]. BMC Veterinary Research, 2018, 14: 310. DOI:10.1186/s12917-018-1637-3 |
| [11] |
TSUCHIYA Y, CHIBA E, SUGINO T, et al. Changes in rumen fermentation, bacterial community, and predicted functional pathway in Holstein cows with and without subacute ruminal acidosis during the periparturient period[J]. Journal of Dairy Science, 2020, 103(5): 4702-4716. DOI:10.3168/jds.2019-17546 |
| [12] |
杜春梅, 孙福昱, 蒋林树, 等. 饲粮中添加硫胺素缓解奶牛亚急性瘤胃酸中毒的研究进展[J]. 动物营养学报, 2019, 31(2): 530-535. DU C M, SUN F Y, JIANG L S, et al. Research progress on thiamine supplementation alleviates subacute ruminal acidosis in dairy cows[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 530-535 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.02.006 |
| [13] |
ZEITZ J O, GUERTLER P, PFAFFL M W, et al. Effect of non-starch-polysaccharide-degrading enzymes as feed additive on the rumen bacterial population in non-lactating cows quantified by real-time PCR[J]. Journal of Animal Physiology & Animal Nutrition, 2013, 97(6): 1104-1113. |
| [14] |
胡红莲. 奶山羊亚急性瘤胃酸中毒营养生理机制的研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2008: 40-45. HU H L. Study on the nutritional and physiological mechanism of subacute ruminal acidosis in dairy goats[D]. Ph. D. Thesis. Huhhot: Inner Mongolia Agricultural University, 2008: 40-45. (in Chinese) |
| [15] |
赵晨旭. 人工诱导SARA山羊瘤胃微生物区系的变化及微生态制剂的调控作用[D]. 硕士学位论文. 长春: 吉林大学, 2013: 18-40. ZHAO C X. Regulation of microecologic preparation on ruminal microbial flora in artificial induced SARA goat[D]. Master's Thesis. Changchun: Jilin University, 2013: 18-40. (in Chinese) |
| [16] |
SUN Y Y, CHENG M, XU M, et al. The effects of subacute ruminal acidosis on rumen epithelium barrier function in dairy goats[J]. Small Ruminant Research, 2018, 169: 1-7. DOI:10.1016/j.smallrumres.2018.09.017 |
| [17] |
FANIYI T O, ADEGBEYE M J, ELGHANDOUR M M M Y, et al. Role of diverse fermentative factors towards microbial community shift in ruminants[J]. Journal of Applied Microbiology, 2019, 127(1): 2-11. DOI:10.1111/jam.14212 |
| [18] |
郭威, 郭晓军, 周贤, 等. 复合菌剂发酵玉米秸秆对绵羊瘤胃液细菌多样性的影响[J]. 畜牧兽医学报, 2018, 49(4): 736-745. GUO W, GUO X J, ZHOU X, et al. Effect of corn stalk fermented by complex bacterial on rumen bacteria diversity in sheep[J]. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(4): 736-745 (in Chinese). |
| [19] |
李永洙, 韩照清, 金太花, 等. 代乳粉对沂蒙黑山羊羔羊早期生长性能及其瘤胃微生物区系的影响[J]. 动物营养学报, 2019, 31(8): 3600-3611. LI Y Z, HAN Z Q, JIN T H, et al. Effects of milk replacer on growth performance and rumen microflora in early weaning yimeng black lambs[J]. Chinese Journal of Animal Nutrition, 2019, 31(8): 3600-3611 (in Chinese). |
| [20] |
NORDLUND K V, COOK N B, OETZEL G R. Investigation strategies for laminitis problem herds[J]. Journal of Dairy Science, 2004, 87(Suppl.1): E27-E35. |
| [21] |
PLAIZIER J C, LI S C, DANSCHER A M, et al. Changes in microbiota in rumen digesta and feces due to a grain-based subacute ruminal acidosis (SARA) challenge[J]. Microbial Ecology, 2017, 74(2): 485-495. DOI:10.1007/s00248-017-0940-z |
| [22] |
LIU K Z, XU Q, WANG L Z, et al. The impact of diet on the composition and relative abundance of rumen microbes in goat[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(4): 531-537. |
| [23] |
WANNG L Z, XU Q, KONG F L, et al. Exploring the goat rumen microbiome from seven days to two years[J]. PLoS One, 2016, 11(5): e0154354. DOI:10.1371/journal.pone.0154354 |
| [24] |
金磊, 王立志, 王之盛, 等. 基于高通量测序技术对山羊盲肠细菌多样性的分析[J]. 微生物学通报, 2019, 46(6): 1423-1433. JIN L, WANG L Z, WANG Z S, et al. Analysis of cecum bacterial diversity of goat based on Illumina MiSeq sequencing[J]. Microbiology China, 2019, 46(6): 1423-1433 (in Chinese). |
| [25] |
MAO S Y, ZHANG R Y, WANG D S, et al. Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J]. Anaerobe, 2013, 24: 12-19. DOI:10.1016/j.anaerobe.2013.08.003 |
| [26] |
JAMI E, MIZRAHI I. Composition and similarity of bovine rumen microbiota across individual animals[J]. PLoS One, 2012, 7(3): e33306. DOI:10.1371/journal.pone.0033306 |
| [27] |
李小玉, 苏思毅, 钟富超, 等. 山羊急性瘤胃酸中毒前后瘤胃菌群结构与组成变化分析[J]. 动物营养学报, 2019, 31(11): 5367-5377. LI X Y, SU S Y, ZHONG F C, et al. Analysis on structure and composition of rumen bacterial flora before and after acute rumen acidosis in goats[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5367-5377 (in Chinese). |
| [28] |
MCCANN J C, LUAN S Y, CARDOSO F C, et al. Induction of subacute ruminal acidosis affects the ruminal microbiome and epithelium[J]. Frontiers in Microbiology, 2016, 7: 701. |
| [29] |
MANN E, WETZELS S U, WAGNER M, et al. Metatranscriptome sequencing reveals insights into the gene expression and functional potential of rumen wall bacteria[J]. Frontiers in Microbiology, 2018, 9: 43. DOI:10.3389/fmicb.2018.00043 |
| [30] |
ZHANG R Y, YE H M, LIU J H, et al. High-grain diets altered rumen fermentation and epithelial bacterial community and resulted in rumen epithelial injuries of goats[J]. Applied Microbiology and Biotechnology, 2017, 101(1): 6981-6992. |
| [31] |
苑学. 肉牛亚急性瘤胃酸中毒微生态制剂的研制及其效果评价[D]. 博士学位论文. 长春: 吉林大学, 2011: 59-66. YUAN X. Development of microecologic preparation for subacute ruminal acidosis of beef cattle and its effects[D]. Ph. D. Thesis. Changchun: Jilin University, 2011: 59-66. (in Chinese) |
| [32] |
OETZEL G R. Diagnosis and management of subacute ruminal acidosis in dairy herds[J]. Veterinary Clinics of North America: Food Animal Practice, 2017, 33(3): 463-480. DOI:10.1016/j.cvfa.2017.06.004 |
| [33] |
孙燕勇, 徐明, 高民, 等. 不同NFC/NDF比日粮对奶山羊血浆代谢产物及生化指标的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集. 武汉: 中国农业大学出版社, 2016: 537. SUN Y Y, XU M, GAO M, et al. Effects of different NFC/NDF ration on plasma metabolites and biochemical indexes of dairy goats[C]//Proceedings of the twelfth symposium on animal nutrition of the animal nutrition branch of the Chinese Society of Animal Husbandry and Veterinary Medicine. Wuhan: China Agricultural University Press, 2016: 537. (in Chinese) |




