2. 西华大学食品与生物工程学院, 成都 610039
2. School of Food and Biological Engineering, Xihua University, Chengdu 610039, China
益生菌是一类在适当剂量下可以对机体健康产生有利作用的活的微生物。益生菌产品的使用在提高动物生产性能及预防、治疗动物疾病方面发挥了重要作用。在实践中,益生菌主要通过口服方式进入动物的胃肠道,在进入动物胃肠道过程中常常受到包括低pH、胆盐、共生菌、致病菌竞争等不利因素的影响,导致有效活菌数量下降[1]。进一步提高益生菌的口服利用度、提升肠道定植成功率是益生菌利用研究的关键。被多糖蛋白复合物包裹的生物被膜态细菌,显示出比浮游态细菌更好的肠上皮细胞黏附性能[2]及对酸、胆盐等不利环境因素的耐受能力[3],通过胃肠道后的存活率与荷载量大大提高[4],为益生菌开发提供了新的思路。生物被膜成分包括细胞外DNA、蛋白质、多糖和脂类等物质[5],与机体免疫、细菌黏附、定植、群体行为等密切相关,具有浮游状态不可比拟的优势[6]。研究表明,用黏附在生物相容性葡聚糖微球上的被膜态罗伊氏乳杆菌预防坏死性结肠炎,单次预防剂量给药可使疾病的发生率降低50%,显示出生物被膜态益生菌开发利用的光明前景[7]。此外,植物乳杆菌(Lactobacillus plantarum)被膜成分的胞外多糖可以拮抗致病菌对细胞的黏附,抑制致病菌生物被膜形成,发挥调节宿主免疫及肠道菌群结构的功能[8]。然而,目前关于被膜态益生菌对宿主免疫功能及肠道菌群结构的研究尚极其匮乏,亟待深化研究。因此,本研究旨在比较被膜态与浮游态植物乳杆菌LR-39的耐酸和耐胆盐能力及其对比格犬血清免疫指标及肠道菌群结构影响的差异,并进一步通过相关性分析揭示肠道菌群结构与免疫因子之间的关联,为揭示被膜态益生菌的调节作用研究提供参考,并为动物用新型益生菌制剂的研发提供新的思路。
1 材料与方法 1.1 试验材料 1.1.1 试验动物15只比格犬,3.5月龄,由扬州四方实验动物科技有限公司提供,笼养于江苏农牧科技职业学院实验动物房,自由饮水,早晚各采食比瑞吉品牌全价小型犬幼年期犬粮1次。
1.1.2 试验菌种植物乳杆菌LR-39,保存在中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),保藏编号为CICC No.24811,其全基因组序列已提交至GenBank,登录号为VRKS00000000。
1.1.3 试验试剂酶联免疫吸附测定(ELISA)试剂盒均购自武汉默沙克生物科技有限公司,具体货号如下:免疫球蛋白G(IgG)ELISA Kit(No.69-58623)、分泌型免疫球蛋白A(sIgA)ELISA Kit(No.69-71642)、白细胞介素-6(IL-6)ELISA Kit(No.69-52361)、肿瘤坏死因子-α(TNF-α)ELISA Kit(No.69-22538)。Qiagen粪便肠道微生物DNA提取试剂盒购自杭州沃森生物技术有限公司,货号:QlAamp DNA Stool Mini Kit(No.51604)。
1.1.4 试验仪器多功能酶标仪(Thermo公司,型号:VARIOSKAN LUX)、超低温冰箱(Thermo公司,型号:905)、纯水系统(Millipore公司,型号:Milli-Q Direct 8)、低温离心机(湘仪离心机有限公司,型号:H1650R)、超低温冷冻干燥机(上海田枫实业有限公司,型号:TF-FD-1L压盖型)。
1.2 试验方法 1.2.1 被膜态与浮游态植物乳杆菌LR-39制备被膜态植物乳杆菌LR-39制备:将活化的植物乳杆菌LR-39按1 ∶ 100比例接种于MRS液体培养基,置于细胞培养板中,37 ℃静置培养36 h,5 000 r/min离心10 min收集菌体,磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3次,冻干保护剂重悬菌体至终浓度1×109 CFU/mL,分装至西林瓶。-80 ℃冰箱内预冻10 h后,置于真空冷冻干燥机中,-40 ℃、40 MPa冷冻干燥24 h,制备得冻干菌粉,以备后续试验使用。
浮游态植物乳杆菌LR-39制备:将活化的植物乳杆菌LR-39按1 ∶ 100比例接种于MRS液体培养基,37 ℃、200 r/min培养36 h,5 000 r/min离心10 min收集菌体,PBS洗涤3次,冻干保护剂重悬菌体至终浓度1×109 CFU/mL,分装至西林瓶。-80 ℃冰箱内预冻10 h后,置于真空冷冻干燥机中,-40 ℃、40 MPa冷冻干燥24 h,制备得冻干菌粉,以备后续试验使用。
1.2.2 被膜态与浮游态植物乳杆菌LR-39耐酸及耐胆盐能力评价制备浮游态和被膜态植物乳杆菌LR-39,将收集到的菌体分别重悬于pH为2.5的MRS培养基中,处理1 h,以测定被膜态与浮游态植物乳杆菌LR-39的耐酸能力;将被膜态与浮游态植物乳杆菌LR-39菌体分别重悬于胆盐含量为0.2%(质量体积比)的MRS培养基中,处理0.5 h,以测定菌株的耐胆盐能力。处理结束后通过平板计数法计算活菌数。试验每组3个平行,且进行5次生物学重复。存活率计算公式如下:

|
15只比格犬随机分为被膜组、浮游组和对照组3个组,每组5只。被膜组、浮游组于每日早上采食犬粮后分别灌饲被膜态与浮游态植物乳杆菌LR-39菌液1 mL(1×109 CFU/mL),对照组灌饲等体积PBS,连续灌饲28 d。
1.2.4 血清免疫指标检测试验进行28 d后,经前肢静脉采集各组试验犬的血液制备血清。依据ELISA试剂盒说明书测定血清IgG、sIgA、IL-6、TNF-α含量。
1.3 肠道菌群微生物多样性分析 1.3.1 肠道菌群16S rDNA测序试验结束后,无菌采集犬新鲜粪便,按照Qiagen粪便肠道微生物DNA提取试剂盒说明书进行总DNA提取。取质量合格的基因组DNA样品30 ng及对应的融合引物配制PCR反应体系,设置PCR反应参数进行PCR扩增,使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于洗脱缓冲液,贴上标签,完成建库。
使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq平台进行测序,得到原始数据。
1.3.2 生物信息学分析对测序原始数据进行数据过滤、Tags拼接、操作分类单元(OTUs)聚类,并与GreenGene数据库比对、物种注释;基于OTUs和注释结果进行样品物种复杂度分析、组间物种差异分析以及关联分析等。
1.4 数据分析运用SPSS 21.0统计软件进行数据分析,试验数据采用平均值±标准差表示。血清免疫指标的比较进行单因素方差分析(one-way ANOVA)和LSD法检验;耐酸、耐盐能力比较进行独立样本t检验;肠道菌群指标的比较采用Mann-Whitney检验;肠道菌群指标与血清免疫指标的相关性用Spearman相关系数表示。0.05≤P<0.10表示有显著趋势,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 被膜态与浮游态植物乳杆菌LR-39的耐酸及耐胆盐能力菌株经口服摄入会通过消化道环境,胃肠道中的酸性及胆盐环境会对菌株形成压力。因此,菌株耐受胃肠道不良环境的拮抗能力对于菌株保持活性非常重要。本研究对植物乳杆菌LR-39在被膜态及浮游态2种状态下的耐酸和耐胆盐能力进行了比较分析。如图 1所示,被膜态植物乳杆菌LR-39经酸性和胆盐环境处理后,其存活率显著或极显著高于浮游态植物乳杆菌LR-39(P<0.05或P<0.01)。以上结果表明,被膜态植物乳杆菌LR-39具有更强的抗环境胁迫能力。
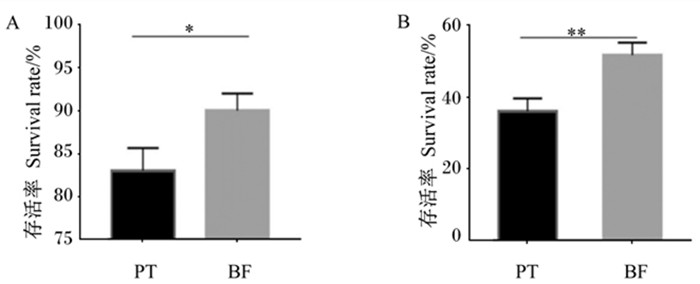
|
PT:浮游组;BF:被膜组。*表示差异显著(P<0.05),* *表示差异极显著(P<0.01)。 PT: planktonic group; BF: biofilm group. * mean significant difference (P < 0.05), * * mean extremely significant difference (P < 0.01). 图 1 被膜态与浮游态植物乳杆菌LR-39经酸性(A)和胆盐(B)环境下的存活率 Fig. 1 Survival rates of biofilm and planktonic Lactobacillus plantarum LR-39 under of acid (A) and bile salt (B) environment |
由表 1可知,与对照组相比,被膜组血清IgG和sIgA含量极显著提高(P<0.01);与浮游组相比,被膜组血清sIgA含量极显著提高(P<0.01),血清IL-6含量有下降趋势(0.05≤P<0.10);与对照组相比,浮游组血清IgG、sIgA、IL-6、TNF-α含量无显著差异(P>0.05)。以上结果表明,被膜态与浮游态植物乳杆菌LR-39对犬的免疫激活效果不同,被膜态植物乳杆菌LR-39能够提高犬血清IgG、sIgA含量,并降低炎性因子IL-6含量;而浮游态植物乳杆菌LR-39对犬的血清免疫指标则无显著影响。
|
|
表 1 各组血清免疫指标的比较 Table 1 Comparison of serum immune indexes in different groups |
通过Illumina HiSeq平台进行测序后以相似度在97%的以上的Tags聚类划分OTUs,结果见图 2-A。由图可知,各组OTUs数量从高到低依次为浮游组(256个)、被膜组(252个)、对照组(249个),3组共有OTUs数量为227个。稀释曲线如图 2-B所示,随着测序深度增加,各样本物种数量趋于饱和。
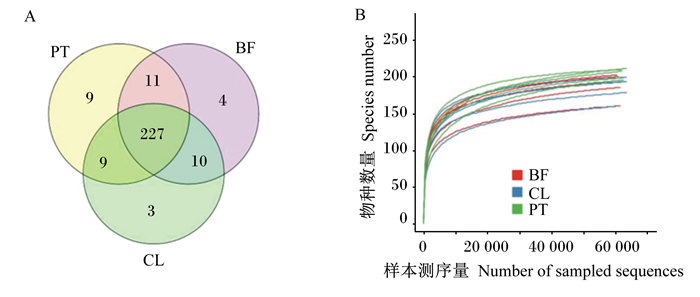
|
CL:对照组;PT:浮游组;BF:被膜组。下图同。 CL: control group; PT: planktonic group; BF: biofilm group. The same as below. 图 2 各样本OTUs韦恩图(A)和稀释曲线图(B) Fig. 2 OTUs venn digram (A) and dilution curve (B) of each sample |
α多样性是对单个样品中物种多样性的分析,包括Observed species指数、Chao指数、Ace指数、Shannon指数、Simpson指数等[9]。Observed species指数、Chao指数、Ace指数反映样品中菌群的丰富度(species richness),即简单指菌群中物种的数量。与对照组相比,灌饲浮游态与被膜态植物乳杆菌LR-39,均能提高样本物种数量(图 3-A、图 3-B、图 3-C)。Shannon指数与Simpson指数反映菌群的多样性(species diversity),Shannon指数越大说明菌群的多样性越高,Simpson指数越大说明菌群的多样性越低。灌饲被膜态植物乳杆菌LR-39能够提高菌群的多样性,而灌饲浮游态植物乳杆菌LR-39则降低菌群多样性(图 3-D、图 3-E)。覆盖度反映了样品文库的覆盖率,该数值越高,样品中序列没有被测出来的概率越低。各组测序覆盖度均达到99%以上(图 3-F),表明本试验16S rDNA测序量可以满足后续生物信息学分析。
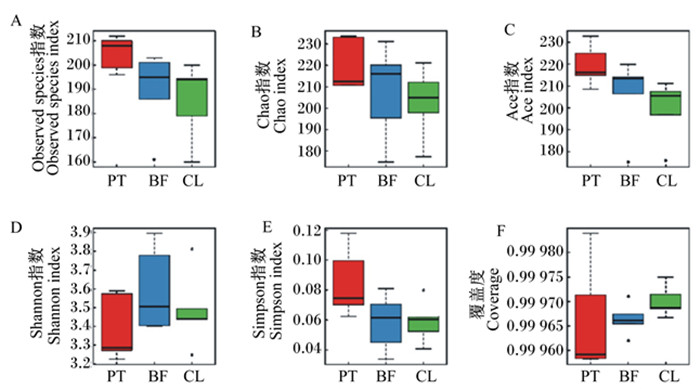
|
图 3 被膜态与浮游态植物乳杆菌LR-39对犬肠道菌群α多样性的影响 Fig. 3 Effects of biofilm and planktonic Lactobacillus plantarum LR-39 on intestinal microbiota α diversity of dogs |
β多样性分析是用来比较样品间多样性方面存在的差异大小[10-12]。主坐标分析(PCoA)可用来研究样本菌群组成的相似性或相异性。PCo1和PCo2的主要贡献率分别为43.71%、16.71%,3组样本在PCo1有明显聚类现象(图 4)。以上结果表明,被膜态与浮游态植物乳杆菌LR-39均能够改变宿主肠道菌群结构,且2种生物状态的益生菌对菌群结构的影响也明显不同。
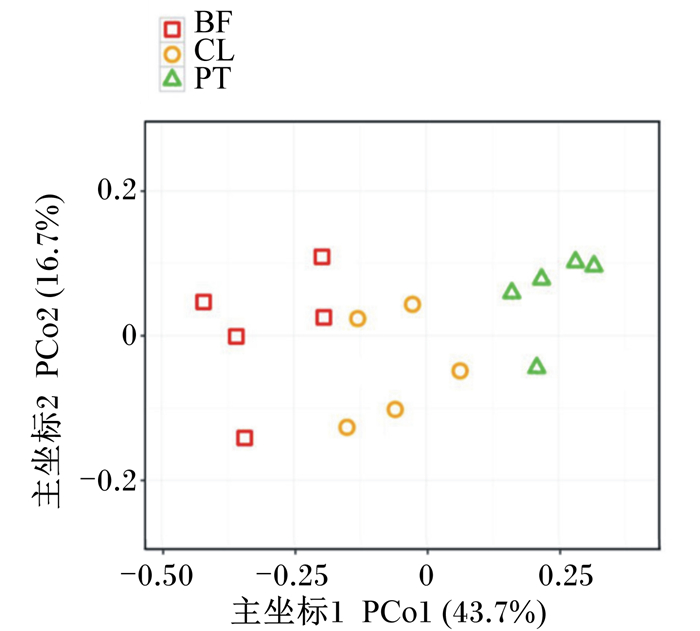
|
图 4 被膜态与浮游态植物乳杆菌LR-39对犬肠道菌群β多样性的影响 Fig. 4 Effects of biofilm and planktonic Lactobacillus plantarum LR-39 on intestinal microbiota β diversity of dogs |
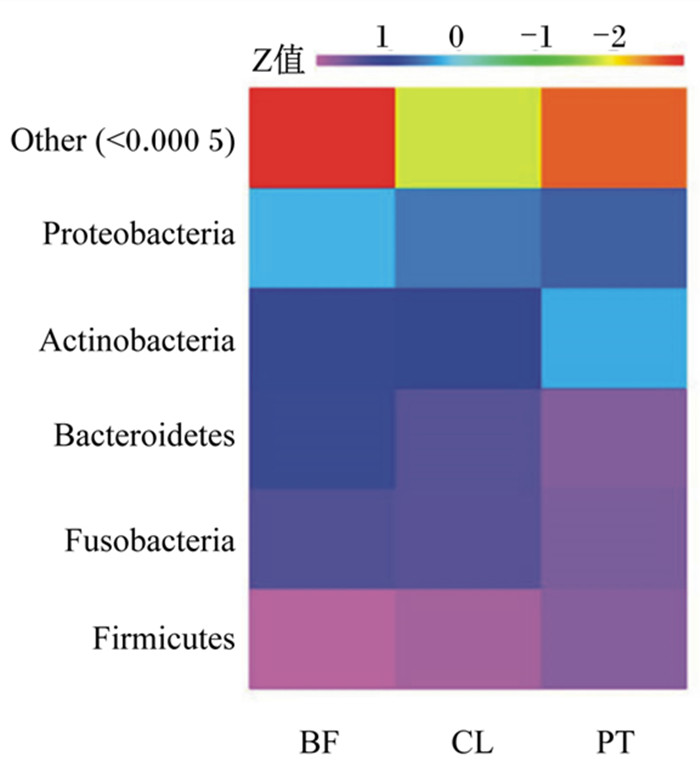
主要菌门相对丰度比较见图 5,列代表分组,行代表菌门,颜色块代表细菌相对丰度,颜色越紫代表细菌的相对丰度越高,颜色越红代表细菌的相对丰度越低。在门水平,3组样本都包含5个门,分别是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)和厚壁菌门(Firmicutes)。被膜组肠道Firmicutes相对丰度较浮游组、对照组提高;浮游组肠道Bacteroidetes、Fusobacteria相对丰度较被膜组、对照组提高。
|
Other:其他;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Bacteroidetes:拟杆菌门;Fusobacteria:梭杆菌;Firmicutes:厚壁菌门。 图 5 3组的肠道菌群在门水平的相对丰度 Fig. 5 Relative abundance of intestinal microbiota at phylum level of three groups |
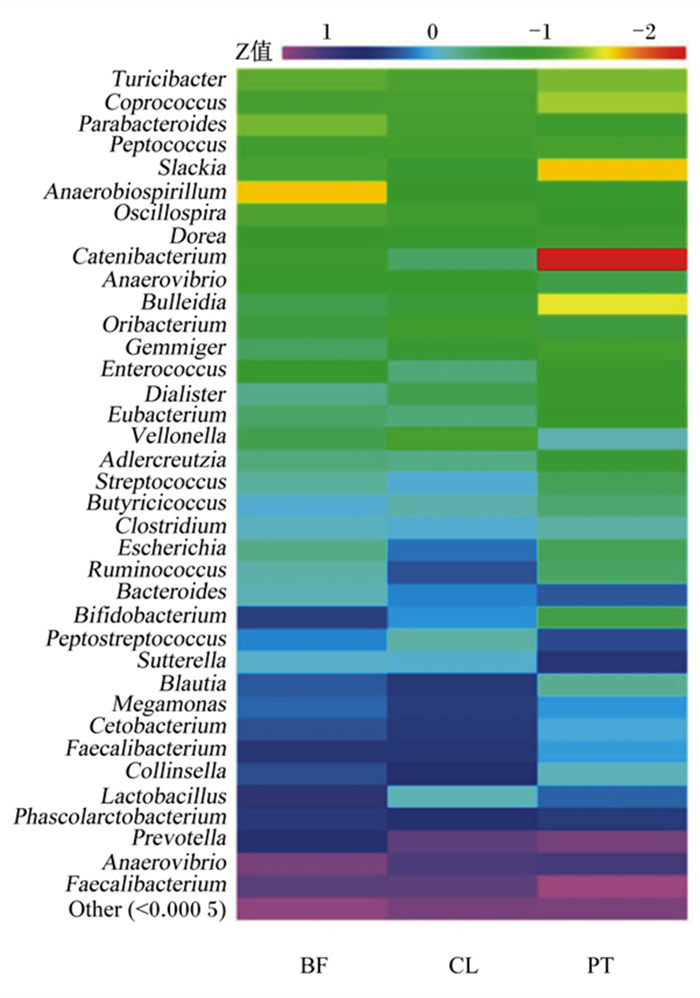
由图 6可见,各组样本菌群共鉴定出37个属,与对照组相比,浮游组乳杆菌属(Lactobacillus)、梭杆菌属(Fusobacterium)、消化链球菌属(Peptostreptococcus)、普雷沃菌属(Prevotella)、萨特氏菌属(Sutterella)相对丰度提高,其他菌属相对丰度降低或无明显变化;被膜组Lactobacillus、Allobaculum、消化链球菌属(Peptostreptococcus)、韦荣氏球菌属(Veillonella)、双歧杆菌属(Bifidobacterium)、丁酸球菌属(Butyricicoccus)、戴阿利斯特杆菌属(dialiste)等相对丰度提高。以上结果表明,浮游态与被膜态植物乳杆菌LR-39对犬肠道菌群结构的影响存在差异。
|
Faecalibacterium:粪杆菌属;Adlercreutzia:安德克氏菌属;Coprococcus:粪球菌属;Eubacterium:真杆菌属;Bulleidia:布雷德菌属;Cetobacterium:醋酸杆菌属;Clostridium:芽胞梭菌属;Slackia:斯莱克氏菌属;Blautia:劳特氏菌属;Catenibacterium:链型杆菌属;Collinsella:柯林斯氏菌属;Turicibacter:弯曲菌属;Streptococcus:链球菌属;Butyricicoccus:丁酸球菌属;Peptococcus:消化球菌属;Dialister:戴阿利斯特杆菌属;Bifidobacterium:双歧杆菌属;Gemmiger:吉米菌属;Escherichia:埃希氏杆菌属;Enterococcus:肠球菌属;Megamonas:巨单胞菌属;Ruminococcus:瘤胃球菌属;Phascolarctobacterium:考拉杆菌属;Other:未分类;Lactobacillus:乳杆菌属;Peptostreptococcus:消化链球菌属;Vellonella:韦荣球菌属;Fusobacterium:梭杆菌属;Sutterella:萨特氏菌属;Anaerovibrio:厌氧弧菌属;Prevotella:普雷沃菌属;Parabacteroides:副拟杆菌属;Bacteroides:拟杆菌属;Oscillospira:颤螺菌属;Anaerobiospirillum:厌氧螺菌属。 图 6 3组的肠道菌群在属水平的相对丰度 Fig. 6 Relative abundance of intestinal microbiota at genus level of three groups |
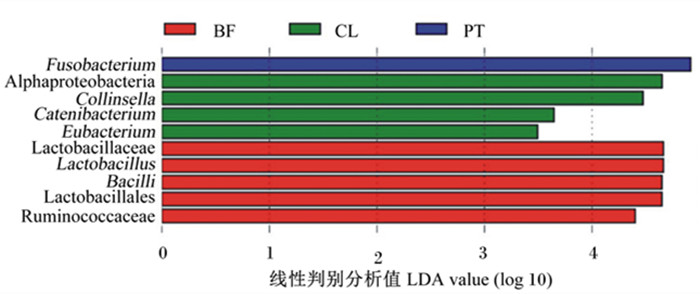
为了找出各组间具有差异的生物标志物(biomarker),通过非参数因子Kruskal-Wallis秩和检验进行LEfSe分析,结果见图 7。由图可以看出,被膜组显著作用微生物类群包括杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、乳杆菌科(Lactobacillaceae)、Lactobacillus、瘤胃菌科(Ruminococcaceae);浮游组显著作用微生物类群包括Fusobacterium;对照组显著作用微生物类群包括α-变形菌纲(Alphaproteobacteria)、柯林斯氏菌属(Collinsella)、链型杆菌属(Catenibacterium)、真杆菌属(Eubacterium)。以上结果表明,与浮游态植物乳杆菌LR-39相比,被膜态植物乳杆菌LR-39能够增加犬肠道的Lactobacillus相对丰度。
|
Fusobacterium:梭杆菌属;Alphaproteobacteria:α-变形菌纲;Collinsella:柯林斯氏菌属;Catenibacterium:链型杆菌属;Eubacterium:真杆菌属;Bacilli:杆菌纲;Lactobacillales:乳杆菌目;Lactobacillaceae:乳杆菌科;Lactobacillus:乳杆菌属;Ruminococcaceae:瘤胃菌科。 图 7 各组菌群线性判别分析值分布柱状图 Fig. 7 Histogram of LDA value distribution in each group |
为进一步分析犬血清免疫指标的变化是否与肠道菌群结构变化相关,根据LEfSE分析结果,开展差异菌属与血清免疫指标之间的Spearman相关性分析。由表 2可知,血清IgG、sIgA、IL-6、TNF-α含量与肠道富集菌群相对丰度不存在显著的相关性(P>0.05)。以上结果提示,被膜组血清IgG、sIgA、IL-6含量变化可能与植物乳杆菌LR-39的生物被膜成分有关。
|
|
表 2 肠道菌属与血清免疫指标的Spearman秩相关系数 Table 2 Spearman rank correlation coefficient between intestinal bacteria genus and serum immune indexes |
益生菌经口服进入宿主体内,会遭遇胃肠道不良环境的胁迫,例如胃酸和胆盐。酸胁迫是指低pH对菌体生长和代谢产生的不利影响,它会引起菌体胞内pH下降,导致碳水化合物代谢途径中的某些酸敏感酶活性丧失,从而影响能量供给;酸胁迫还会对细胞膜和某些大分子物质的结构造成损伤[13]。胆盐胁迫对细菌最直接的危害是破坏细胞膜。低浓度的胆盐能够改变细胞膜的通透性和流动性,引起某些膜镶嵌酶类的失活和跨膜转运子的功能紊乱,还能改变细胞表面疏水性和电势等表面特性;而高浓度的胆盐可以迅速解离细胞质膜和膜蛋白,造成细胞质组分外泄,导致菌体死亡[14]。因此,耐酸和胆盐能力是评价益生菌性能非常重要的参数之一。本研究结果表明,被膜态植物乳杆菌LR-39的耐酸和耐胆盐能力均显著强于浮游态植物乳杆菌LR-39。这可能是由于生物被膜中的胞外多聚物将菌体包裹其中,使菌体生存环境与低pH和胆盐胁迫环境隔离开来,削弱二者对菌体细胞膜的直接破坏作用。此外,生物被膜中菌体形成立体的三维结构,其中的营养物质、渗透压及pH形成梯度,这可以对低pH和胆盐环境起到缓冲作用,提高菌体存活率。
本研究表明,不同生物状态的植物乳杆菌LR-39对犬的免疫影响存在差异。被膜态植物乳杆LR-39能够提高犬血清IgG、sIgA含量,降低血清IL-6、TNF-α含量,而浮游态植物乳杆LR-39则对上述免疫指标无显著影响。这种差异可能与肠道菌群结构变化有关,然而通过Spearman相关性分析发现,肠道优势菌属与免疫指标并不存在显著相关性,提示血清IgG、sIgA、IL-6、TNF-α含量变化与肠道菌群结构变化无明显关联性。Secor等[15]和Brady等[16]认为在生物膜群落中生长的细菌分泌细胞外基质,被膜态细菌在结构、代谢活性、表型等方面不同于浮游态细菌,推测可能会导致不同的免疫反应。构建鸡沙门氏菌生物被膜合成相关基因缺失株导致免疫产生的IgG含量极显著降低[17],被膜态嗜水气单胞菌口服免疫小鼠产生的抗体水平显著高于浮游态[18],被膜态金黄色葡萄球菌ATCC 25923及无枝菌酸棒状杆菌(C.amycolatum)ATCC 700207分别刺激Jurkat细胞产生的促炎因子白细胞介素-1β(IL-1β)、白细胞介素-12(IL-12)p70、IL-6、TNF-α及抗炎因子白细胞介素-10(IL-10)含量均低于浮游态[19],以上试验结果进一步印证了上述观点。此外,被膜态植物乳杆菌LR-39更强的耐酸、耐胆盐等抗环境胁迫能力导致其在肠道有效定植率提升,也可能是不同生物状态植物乳杆菌LR-39对犬产生不同免疫影响的原因。然而,被膜态与浮游态植物乳杆菌LR-39对机体免疫影响差异的具体原因还有待进一步研究。
本试验结果显示,植物乳杆菌LR-39的不同生物状态对犬的肠道菌群结构调整影响不同。灌喂被膜态植物乳杆菌LR-39后,肠道Lactobacillus相对丰度提高,成为肠道显著作用微生物菌群;而灌喂浮游态植物乳杆菌LR-39却导致Fusobacterium成为肠道显著作用微生物菌群。Secor等[15]和Brady等[16]对浮游态的致病菌常导致急性感染而被膜态的致病菌常导致慢性感染的原因进行分析,认为被膜态细菌处于生物被膜的内部并向外部缓慢释放游离菌,而游离态细菌则不具备此种优势。此外,本研究团队在该研究及过往研究[3]中分别比较了被膜态与浮游态植物乳杆菌LR-39和L-ZS9的抗环境胁迫能力、黏附性能,均显示被膜态抗环境胁迫能力及黏附率显著高于浮游态。综上所述,缓慢释放被膜态内部的游离菌及更高效率在肠道定植可能是导致饲喂被膜态植物乳杆菌LR-39能够使Lactobacillus成为肠道优势菌属的原因。
4 结论① 被膜态植物乳杆菌LR-39具有更强的耐酸及胆盐能力,能够提高血清IgG和sIgA含量,降低血清IL-6含量;而浮游态植物乳杆菌LR-39对血清免疫指标无显著影响。
② 被膜态植物乳杆菌LR-39主要提高肠道Lactobacillus相对丰度,而浮游态植物乳杆菌LR-39则主要提高肠道Fusobacterium相对丰度。
③ 肠道优势菌属与血清免疫指标无显著相关性。
致谢:
感谢江苏农牧科技职业学院宠物科技学院陆江教师、动物医学院胡新岗教授对文稿所提的宝贵意见。
| [1] |
SALAS-JARA M J, ILABACA A, VEGA M, et al. Biofilm forming Lactobacillus: new challenges for the development of probiotics[J]. Microorganisms, 2016, 4(3): 35. DOI:10.3390/microorganisms4030035 |
| [2] |
刘蕾, 武瑞赟, 李军, 等. 基于AI-2介导的类植物乳杆菌生物被膜态与浮游态抗胁迫能力比较与分析[J]. 食品科学, 2017, 38(22): 41-47. LIU L, WU R Y, LI J, et al. Stress resistance of biofilm and planktonic cells of Lactobacillus paraplantarum regulated by autoinducer 2[J]. Food Science, 2017, 38(22): 41-47 (in Chinese). |
| [3] |
刘蕾, 武瑞赟, 李军, 等. 类植物乳杆菌L-ZS9生物被膜态的黏附能力及形成影响因素[J]. 食品科学, 2016, 37(15): 136-143. LIU L, WU R Y, LI J, et al. Adhesion ability of Lactobacillus paraplantarum L-ZS9 and influencing factors of its biofilm formation[J]. Food Science, 2016, 37(15): 136-143 (in Chinese). |
| [4] |
TRUSH E A, POLUEKTOVA E A, BENIASHVILLI A G, et al. The evolution of human probiotics: challenges and prospects[J]. Probiotics and Antimicrobial Proteins, 2020. DOI:10.1007/s12602-019-09628-4 |
| [5] |
WATTERS C, FLEMING D, BISHOP D, et al. Host responses to biofilm[J]. Progress in Molecular Biology and Translational Science, 2016, 142: 193-239. |
| [6] |
FLEMMING H C, WINGENDER J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [7] |
NAVARRO J B, MASHBURN-WARREN L, BAKALETZ L O, et al. Enhanced probiotic potential of Lactobacillus reuteri when delivered as a biofilm on dextranomer microspheres that contain beneficial cargo[J]. Frontiers in Microbiology, 2017, 8: 489. |
| [8] |
LIU Z Q, ZHANG Z H, QIU L, et al. Characterization and bioactivities of the exopolysaccharide from a probiotic strain of Lactobacillus plantarum WLPL04[J]. Journal of Dairy Science, 2017, 100(9): 6895-6905. DOI:10.3168/jds.2016-11944 |
| [9] |
SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [10] |
LOZUPONE C, KNIGHT R. UniFrac: a new phylogenetic method for comparing microbial communities[J]. Applied and Environmental Microbiology, 2005, 71(12): 8228-8235. DOI:10.1128/AEM.71.12.8228-8235.2005 |
| [11] |
LOZUPONE C, LLADSER M E, KNIGHTS D, et al. UniFrac: an effective distance metric for microbial community comparison[J]. The ISME Journal, 2011, 5(2): 169-172. DOI:10.1038/ismej.2010.133 |
| [12] |
LOZUPONE C A, HAMADY M, KELLEY S T, et al. Quantitative and qualitative β diversity measures lead to different insights intofactors that structure microbial communities[J]. Applied and Environmental Microbiology, 2007, 73(5): 1576-1585. DOI:10.1128/AEM.01996-06 |
| [13] |
COTTER P D, HILL C. Surviving the acid test: responses of Gram-positive bacteria to low Ph[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453. DOI:10.1128/MMBR.67.3.429-453.2003 |
| [14] |
NOH D O, GILLILAND S E. Influence of bile on cellular integrity and β-galactosidase activity of Lactobacillus acidophilus[J]. Journal of Dairy Science, 1993, 76(5): 1253-1259. DOI:10.3168/jds.S0022-0302(93)77454-8 |
| [15] |
SECOR P R, JAMES G A, FLECKMAN P, et al. Staphylococcus aureus biofilm and planktonic cultures differentially impact gene expression, mapk phosphorylation, and cytokine production in human keratinocytes[J]. BMC Microbiology, 2011, 11: 143. DOI:10.1186/1471-2180-11-143 |
| [16] |
BRADY R A, MOCCA C P, PLAUT R D, et al. Comparison of the immune response during acute and chronic Staphylococcus aureus infection[J]. PLoS One, 2018, 13(3): e0195342. DOI:10.1371/journal.pone.0195342 |
| [17] |
满成连. 鸡白痢沙门菌LPS合成和生物被膜形成相关基因缺失株的构建及免疫效力评价[D]. 硕士学位论文. 江苏: 扬州大学, 2018. MAN C L. Construction of Salmonella entericaserovar pullorum deletion mutations with LPS and biofilm systhesis genes and evaluation of their immune efficacy[D]. Master's Thesis. Yangzhou: Yangzhou University, 2018. (in Chinese) |
| [18] |
冯富. 嗜水气单胞菌生物被膜疫苗诱导的免疫反应[D]. 硕士学位论文. 杭州: 浙江大学, 2018. FENG F. The immune response induced by Aeromonas hydrophila biofilm[D]. Master's Thesis. Hangzhou: Zhejiang University, 2018. (in Chinese) |
| [19] |
OLENDER A, BOGUT A, MAGRYŚ A, et al. Cytokine levels in the in vitro response of T cells to planktonic and biofilm Corynebacterium amycolatum[J]. Polish Journal of Microbiology, 2019, 68(4): 457-464. DOI:10.33073/pjm-2019-045 |




