2. 江苏农牧科技职业学院动物医学院, 泰州 225300;
3. 江苏省兽用生物制药高技术研究重点实验室, 泰州 225300
2. Department of Animal Medicine, Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300, China;
3. Jiangsu Provincial Key Laboratory of Veterinary Bio-Pharmaceutical High Technology Research, Taizhou 225300, China
随着人们生活水平的提高,伴侣动物犬也逐渐成为许多家庭中的一员。但因为不良的行为及饮食,导致犬能量过剩,使得肥胖症成为犬的常见疾病[1]。幸运的是,宠物饲养者已意识到肥胖给犬带来的健康问题,宠物减肥也成为宠物界关注的热点。饮食干预由于经济实惠、操作简便及无任何副作用等优点已逐渐成为宠物减肥产品开发的新趋势。高蛋白质饮食干预对肥胖及其相关并发症的预防和治疗具有重要意义[2]。
有研究发现,肥胖患者与瘦者的肠道菌群及其代谢产物短链脂肪酸(SCFAs)有显著差异,肥胖患者有更强的发酵碳水化合物的能力[3]。肥胖患者中肠道菌群的组成与脂肪组织褐变和胰岛素作用相关,可能通过其代谢产物SCFAs发挥作用[4],说明肠道菌群及SCFAs在肥胖症进程中起重要作用。然而,有关高蛋白质饮食对肥胖犬肠道菌群及SCFAs影响的报道甚少。因此,本研究比较不同蛋白质水平饲粮对肥胖犬粪便SCFAs浓度及肠道菌群结构的影响,探究高蛋白质饲粮对肥胖犬减重的可能新机制,为宠物减肥产品开发提供新的思路与方法。
1 材料与方法 1.1 试验动物肥胖型拉布拉多猎犬,(5±1)岁,雄性,由江苏省宠物繁育中心提供。肥胖型拉布拉多猎犬纳入标准[5]:通过双能X线骨密度检测仪(型号XR-600,美国Norland公司)检测体脂率,体脂率>34%者视为肥胖。
1.2 试验设计选取30只肥胖型拉布拉多猎犬,随机等分为3组:低蛋白质组(LP组)、中蛋白质组(MP组)和高蛋白质组(HP组)。所有犬均以商品化成年犬粮(冠能大型成年犬犬粮,规格12 kg/袋,雀巢普瑞纳宠物食品有限公司产品,粗蛋白质含量≥26%)进行15 d适应性饲喂。然后LP组、MP组和HP组分别饲喂含20.58%(低蛋白质饲粮)、27.77%(中蛋白质饲粮)和39.04%(高蛋白质饲粮)粗蛋白质的饲粮,试验期为45 d。整个试验过程中,所有犬均单笼饲养,每天09:00及16:00各喂食1次,进食时间为5 min,并且所有犬每天均在宠物训练场自由活动15 min左右。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
分别于试验开始和结束时用电子称称量各个试验犬空腹体重,同时用双能X线骨密度检测仪测定体脂率。
1.4 血清生化指标测定分别于试验开始和结束时空腹经头静脉采集各个试验犬的血液,3 000 r/min离心5 min得到血清。采血当天用试剂盒法测定血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量,试剂盒购于北京百奥莱博科技有限公司;用Catalyst Dx动物生化分析仪(美国爱德士生物科技公司)测定血清尿素氮(UN)和肌酐(Cr)含量。
1.5 粪便样本采集及粪便SCFAs浓度测定分别于试验开始和结束时无菌收集直肠中粪便,分为2份,分别放入10 mL冻存管并迅速放入液氮中保存。一份用于检测SCFAs浓度,另一份用于肠道菌群16S rDNA高通量测序。样品采集完毕后立即转移到-80 ℃冰箱保存备用。
粪便中SCFAs浓度的测定采用气相色谱法(Agilent 6890N气相色谱仪,美国)。准确称取1 g样品,加4 mL超纯水,振荡混匀30 min后,12 000 r/min将上清液转移,重复以上步骤1次,合并上清液并定容到10 mL离心管中。取4.5 mL上清液,按9 ∶ 1体积比在样品中加入25%偏磷酸,固定3 h以上,然后12 000 r/min离心10 min,45 μm滤膜过滤加入上机瓶。色谱条件:采用DB-1 ms毛细管柱进行分离,载气为氮气,流量为1 mL/min,辅助气为氢气,火焰离子检测器(FID)温度280 ℃, 分流比50 ∶ 1,进样量2 μL。色谱程序升温步骤如下:初始温度40 ℃,接着以5 ℃/min的速度升至70 ℃,维持3 min,再以20 ℃/min的速度升至160 ℃,维持3 min,最后以35 ℃/min的速度升至280 ℃,维持3 min。
1.6 肠道菌群16S rDNA高通量测序 1.6.1 粪便总DNA提取与PCR称取无菌粪便样品100 mg,采用Qiagen DNA试剂盒按说明书提取总DNA,再以获得的细菌DNA为模板对细菌16S rDNA的V3~V4可变区进行PCR扩增,上游引物序列为5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物序列为5′-GGACTACGCGGGTATCTAAT-3′。反应条件为:95 ℃预变性10 min,92 ℃变性45 s,50 ℃退火30 s,72 ℃延伸30 s,6个循环;92 ℃变性45 s,68 ℃退火30 s,72 ℃延伸30 s,30个循环;然后72 ℃扩展延伸10 min,4 ℃保存。采用生工生物工程(上海)股份有限公司的PCR产物纯化试剂盒对所得PCR产物进行纯化后,用于后续操作。
1.6.2 Illumina高通量测序及处理使用NEB NextⓇUltraTM DNA Library Prep Kit for Illumina建库试剂盒进行文库构建,构建好的文库经过Qubit定量和文库检测合格后,使用Illumina MiSeq PE300平台进行Paired-end测序。测序数据经QIIME(version 1.9.1)进行去除接头序列、低复杂度序列和低质量序列处理,得到高通量原始碱基序列,用RDF分类器将相似性大于97%的序列划分为1个操作分类单元(OTU),与GreenGene数据库进行比对,得到注释结果。
1.6.3 生物信息分析用QIIME(version 1.9.1)[7]分析肠道菌群α多样性,用基于weighted UniFrac matrices的主坐标分析(PCoA)进行β多样性分析[8],用STAMP分析组间差异菌群[9],用PICRUSt预测菌群基因组功能[10]。
1.7 数据处理与分析计量资料用“平均值±标准差”表示,采用SPSS 22.0统计软件的ANOVA程序进行单因素方差分析(one-way ANOVA)和组间两两比较,组内试验开始和结束时的差异比较采用配对t检验,肠道菌群丰度比较采用Kruskal-Wallis检验,用Pearson法分析相关性。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 不同蛋白质水平饲粮对肥胖犬体重及体脂率的影响从表 2可以看出,试验开始时各组犬的体重及体脂率均无显著差异(P>0.05);试验结束时HP组犬体重及体脂率均低于MP组和LP组(P<0.05),同时MP组也显著低于LP组(P<0.05)。与试验开始时相比,试验结束时HP组犬的体重(P=0.047)及体脂率(P=0.012)显著降低,LP组和MP组的体重及体脂率则无显著变化(P>0.05)。
|
|
表 2 体重及体脂率的变化 Table 2 Changes of body weight and body fat rate |
由表 3可知,试验开始时各组犬的血清生化指标均无显著差异(P>0.05);试验结束时HP组犬的血清TG、TC及LDL含量均显著低于MP组和LP组(P<0.05),同时MP组也显著低于LP组(P<0.05),其他血清生化指标在3组间无显著差异(P>0.05)。与试验开始时相比,HP组犬血清LDL含量极显著降低(P=0.001),血清TG含量显著降低(P=0.041),血清UN含量极显著升高(P=0.002),MP组和LP组各血清生化指标则无显著变化(P>0.05)。
|
|
表 3 血清生化指标的变化 Table 3 Changes of serum biochemical indexes |
由图 1可知,试验结束时HP组粪便中乙酸浓度极显著低于试验开始时(P<0.01),且极显著低于同期LP组和MP组(P<0.01,图 1-a);无论是试验开始时还是结束时,各组间丙酸浓度均无显著变化(P>0.05,图 1-b);试验结束时HP组粪便中丁酸浓度显著高于试验开始时(P<0.05),且显著低于同期LP组和MP组(P<0.05,图 1-c);试验结束时HP组粪便中总SCFAs浓度显著低于试验开始时(P<0.05),且显著低于同期LP组和MP组(P<0.05,图 1-d)。体脂率与粪便中总SCFAs (r=0.389)和乙酸浓度(r=0.752)呈正相关关系(图 1-e、图 1-f),与粪便中丁酸浓度呈负相关关系(r=-0.395,图 1-g)。
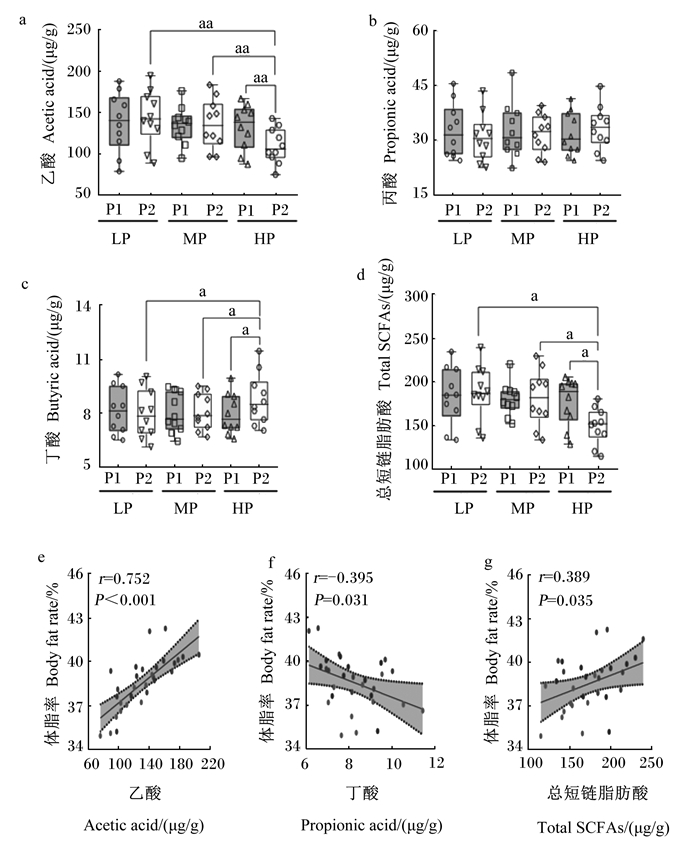
|
P1:试验开始;P2:试验结束。LP:LP组;MP:MP组;HP:HP组。“a”表示两组间差异显著(P<0.05),“aa”表示两组间差异极显著(P<0.01)。下图同。 P1: beginning of test; P2: end of test. LP: LP group; MP: MP group; HP: HP group. "a" mean the difference between two groups was significance (P < 0.05), while "aa" mean the difference between two groups was significance (P < 0.01). The same as below. 图 1 粪便中SCFAs浓度的变化(湿粪基础) Fig. 1 Changes of short chain fatty acid concentrations in feces (wet feces basis) |
观察物种数、Chao1指数及Simpson指数是反映肠道菌群ɑ多样性的主要指标。肠道菌群观察物种数、Chao1指数无论是组内试验开始与结束时比较还是同期组间比较均无显著差异(P>0.05,图 2-a、图 2-b);试验结束时HP组肠道菌群Simpson指数显著高于试验开始时以及同期LP组和MP组(P<0.05,图 2-c)。PCoA是反映肠道菌群β多样性的指标,可直观显示不同组间微生物进化上的相似性及差异性,距离越近相似性越高,距离越远差异性越大。试验开始时,3组样本间距离较近,主坐标成分1(PCo1)可以解释最大51.48%数据变化,说明各组犬肠道菌群在试验开始具有相似性(图 2-d);试验结束时,HP组样本远离LP组和MP组样本,说明HP组肠道菌群与LP组、MP组有差异(图 2-e)。
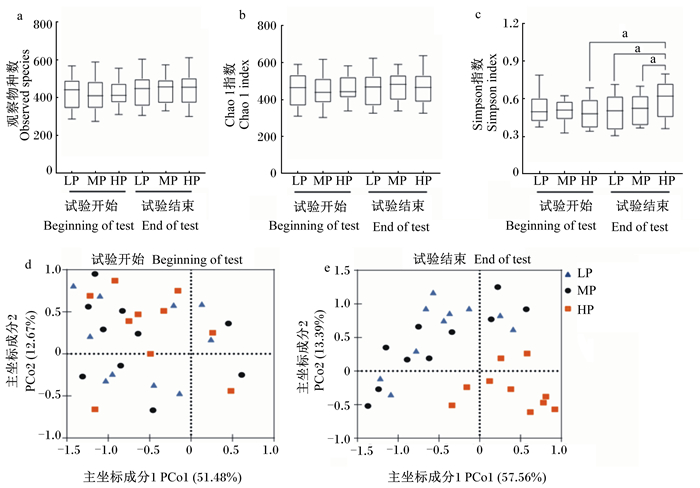
|
图 2 肠道菌群多样性的变化 Fig. 2 Changes of gut microbiota diversity |
在门水平,各组犬肠道优势菌群主要分布在5个门,分别是厚壁菌门、拟杆菌门、梭杆菌门、变形菌门和放线菌门(图 3-a)。试验结束时,与LP组、MP组比较,HP组拟杆菌门相对丰度显著降低(P<0.05,图 3-c),厚壁菌门相对丰度显著升高(P<0.05,图 3-d),拟杆菌门/厚壁菌门比值显著降低(P<0.05,图 3-e)。在科水平,梭杆菌科、拟杆菌科、普雷沃菌科等相对丰度较高,为各组犬肠道优势菌群(图 3-b)。在属水平,HP组梭菌属、瘤胃球菌属、普拉梭菌属及漫游球菌属相对丰度极显著高于LP组(P<0.01,图 4-a),梭菌属、多尔氏菌属、瘤胃球菌属、普拉梭菌属及拟杆菌属相对丰度极显著高于MP组(P<0.01,图 4-b);MP组普拉梭菌属、别样棒菌属及普雷沃菌群相对丰度极显著高于LP组(P<0.01,图 4-c)。
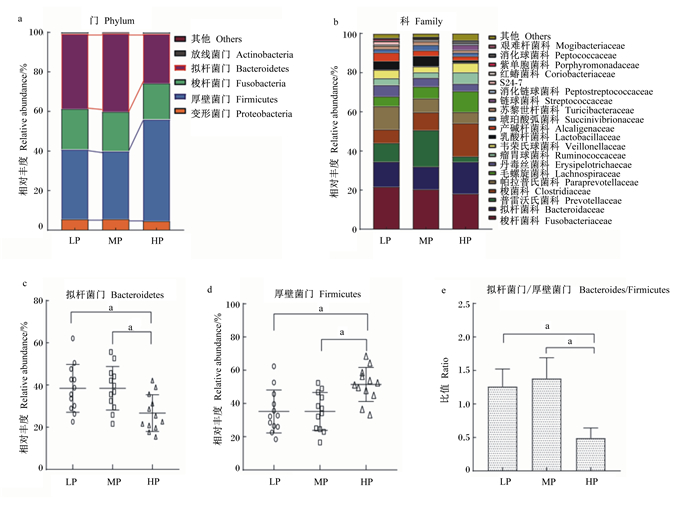
|
图 3 肠道菌群在门水平和科水平的组成 Fig. 3 Composition of gut microbiota at phylum and family levels |
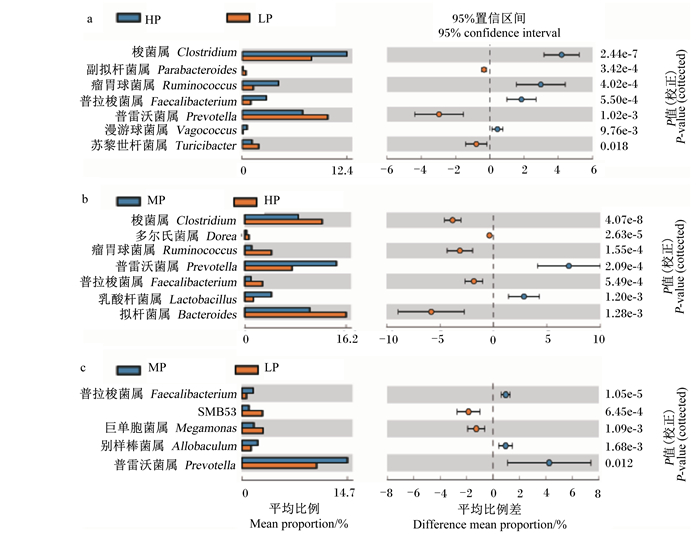
|
图 4 不同蛋白质水平饲粮对肥胖犬肠道菌属的影响 Fig. 4 Effects of diets with different protein levels on genera of gut microbiota in obese dogs |
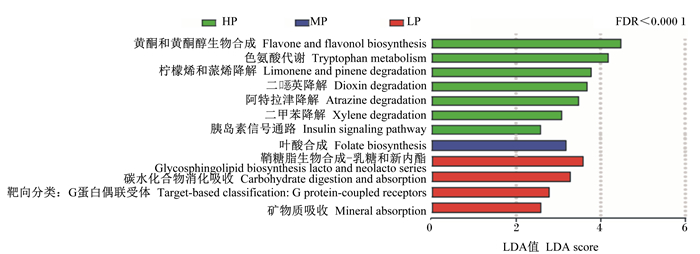
从图 5可以看出,在KEGG通路第3层级,HP组黄酮和黄酮醇生物合成、色氨酸代谢、柠檬烯和蒎烯降解、二英降解、阿特拉津降解、二甲苯降解及胰岛素信号通路等7个通路上调[线性判别分析(LDA)值>2.5],MP组仅叶酸合成通路上调,LP组鞘糖脂生物合成-乳糖和新内酯系列、碳水化合物消化吸收、靶向分类:G蛋白偶联受体及矿物质吸收等4个通路上调。
|
图 5 肠道菌群基因功能预测分析(KEGG通路第3层级) Fig. 5 Prediction analysis of gene function of gut microbiota (KEGG pathway, level 3) |
遗传因素和饮食模式是影响动物肥胖症发生发展的两大重要因素。现阶段,已有多种饮食干预方法用于超重和肥胖的治疗,如高蛋白质饮食。王双等[11]通过为期4周的短期高蛋白质饮食干预发现,受试者体重和体脂率均有所降低,且对肥胖患者血液中TG、LDL含量的改善效果更好。刘闯[12]研究发现,高蛋白质饲粮有助于降低高脂诱导肥胖SD大鼠体脂率。在本研究中,饲喂高蛋白质饲粮肥胖犬在试验结束时的体重、体脂率以及血清中TG与LDL含量均低于LP组、MP组及自身试验开始时,说明高蛋白质饲粮对肥胖犬具有减重效果,与上述报道结论相一致。此外,高蛋白质饲粮对肥胖犬血清Cr含量无显著影响,仅血清UN含量轻度升高,这可能与蛋白质摄入有关。
SCFAs是由回肠末端和结肠内细菌发酵膳食纤维产生的代谢产物,主要包括乙酸、丙酸、丁酸等,约95%的SCFAs经结肠吸收入血液循环,然后代谢为机体提供5%~10%的能量[13]。其中,丁酸被结肠上皮细胞利用作为其主要能量来源;丙酸则被吸收运送至肝脏进行糖、脂代谢,并且能够抑制胆固醇的合成;乙酸经血液循环进入肝脏代谢为乙酰辅酶A,是脂肪与胆固醇合成重要的底物[14]。研究发现,肥胖儿童粪便SCFAs的浓度比体重正常的人高[15],动物试验也表明肥胖鼠相比正常鼠粪便中SCFAs浓度更高[16],尤其是高浓度的乙酸,可激活副交感神经系统,促进胰岛素、胃饥饿素的分泌,进而引起食欲过盛、肥胖和相关后遗症[17]。也有研究表明,丁酸可以刺激胰腺分泌[18],增加胰高血糖素和胰岛素水平,提高胰岛素敏感性,从而改善糖、脂代谢,减少脂肪堆积。在肥胖小鼠模型中,口服丁酸盐可有效预防饮食诱导的肥胖、胰岛素抵抗、高甘油三酯血症和肝脏脂肪变性等[19]。本研究发现,肥胖犬体脂率与粪便中总SCFAs、乙酸浓度呈正相关,与丁酸浓度呈负相关,与上述研究结论相一致,提示SCFAs与犬肥胖有密切关系。高蛋白质饲粮可以降低肥胖犬粪便中总SCFAs及乙酸浓度,提高丁酸浓度。
动物胃肠道内有大量微生物,特别是结肠部位,微生物丰度最高,特定肠道微生物的代谢活动可能对动物的消化吸收、体重变化及一系列生理过程产生重要影响[20-21]。粪便菌群与结肠中菌群组成相似[22],且粪便样本易采集,因此通过粪便中菌群结构来反映肠道菌群结构是许多研究人员选用的方法[23]。本研究通过检测粪便中菌群多样性,发现高蛋白质饲粮未能改变肥胖犬肠道菌群的丰富度,但提高了肠道菌群的均匀度,与杨凤啸等[24]研究得出的高脂饲粮诱导肥胖小鼠肠道菌群多样性降低的结论相似。进一步的研究发现,不同蛋白质水平饲粮对肥胖犬在门水平的核心菌群组成影响不大,但菌群丰度发生改变,HP组厚壁菌门的相对丰度增加,拟杆菌门的相对丰度降低,拟杆菌门/厚壁菌门比值降低,这种变化可促进体重减轻[6]。在属水平,梭菌属及普拉梭菌属等细菌主要富集在HP组。梭菌属具有较强的产丁酸能力[25],这可能也是HP组粪便中丁酸浓度升高的主要原因,普拉梭菌属有改善肥胖的作用[26]。肠道菌群基因功能分析发现,HP组的黄酮和黄酮醇生物合成、色氨酸代谢及柠檬烯和蒎烯降解等第3层级KEGG通路上调,而这些通路均与机体脂肪代谢有关[27]。
4 结论高蛋白质饲粮可改善肥胖犬肠道菌群结构及短链脂肪酸代谢,有减重降脂作用。
| [1] |
JULIANNA T O, KATA V, KATALIN J V, et al. Factors affecting canine obesity seem to be independent of the economic status of the country-a survey on Hungarian companion dogs[J]. Animals, 2020, 10(8): 1267. DOI:10.3390/ani10081267 |
| [2] |
温昀斐, 岳凌生, 慈宏亮, 等. 高蛋白膳食干预对肥胖及相关慢性疾病的影响[J]. 生命科学, 2020, 32(2): 170-178. WEN J F, YUE L S, CI H L, et al. Effect of high protein diet intervention on obesity and related chronic diseases[J]. Chinese Bulletin of Life Sciences, 2020, 32(2): 170-178 (in Chinese). |
| [3] |
GOFFREDO M, MASS K, PARKS E J, et al. Role of gut microbiota and short chain fatty acids in modulating energy harvest and fat partitioning in youth[J]. The Journal of Clinical Endocrinology & Metabolism, 2016, 101(11): 4367-4376. |
| [4] |
MORENO-NAVARRETE J M, SERINO M, BLASCO-BAQUE V, et al. Gut microbiota interacts with markers of adipose tissue browning, insulin action and plasma acetate in morbid obesity[J]. Molecular Nutrition & Food Research, 2018, 62(3): 1700721. |
| [5] |
LI Q H, LAUBER C L, CZARNECKI-MAULDEN G, et al. Effects of the dietary protein and carbohydrate ratio on gut microbiomes in dogs of different body conditions[J]. mBio, 2017, 8(1): e01703-16. |
| [6] |
(美)国家研究委员会. 犬猫营养需要[M]. 丁丽敏, 夏兆飞, 译. 北京: 中国农业大学出版社, 2010: 32-34. NRC (USA). Nutritional needs of dogs and cats[M]. Translated by DING L M, XIA Z F. Beijing: China Agricultural University Press, 2010: 32-34. (in Chinese) |
| [7] |
SADAIAPPAN B, KANNAN S, PALANIAPPAN S, et al. Metagenomic 16S rDNA amplicon data of microbial diversity and its predicted metabolic functions in the Southern Ocean (Antarctic)[J]. Data in Brief, 2020, 28: 104876. DOI:10.1016/j.dib.2019.104876 |
| [8] |
YANO Y, HUA X, WAN Y H, et al. Comparison of oral microbiota collected using multiple methods and recommendations for new epidemiologic studies[J]. mSystems, 2020, 5(4): e00156-20. |
| [9] |
PARKS D H, TYSON G W, HUGENHOLTZ P, et al. STAMP: statistical analysis of taxonomic and functional profiles[J]. Bioinformatics, 2014, 30(21): 3123-3124. DOI:10.1093/bioinformatics/btu494 |
| [10] |
DOUGLAS G M, BEIKO R G, LANGILLE M G I. Predicting the functional potential of the microbiome from marker genes using PICRUSt[M]//BEIKO R, HSIAO W, PARKINSON J. Microbiome analysis. New York, NY: Humana Press, 2018, 1849: 169-177.
|
| [11] |
王双, 何晓琴, 燕飞, 等. 肥胖人群高蛋白代餐与限能量膳食干预的减重对照研究[J]. 现代实用医学, 2020, 32(1): 19-21. WANG S, HE X Q, YAN F, et al. Comparative study on weight loss between high protein meal substitute and limited energy diet intervention in obese population[J]. Modern Practical Medicine, 2020, 32(1): 19-21 (in Chinese). |
| [12] |
刘闯. 日粮蛋白质水平对大鼠体脂含量的影响及其机制的研究[D]. 博士学位论文. 北京: 中国农业大学, 2014. LIU C. Effects of dietary protein levels on adipose tissue content in rats and study of the underlying mechanisms[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2014. (in Chinese) |
| [13] |
CHAMBERS E S, MORRISON D J, GARY F. Control of appetite and energy intake by SCFA: what are the potential underlying mechanisms?[J]. Proceedings of the Nutrition Society, 2015, 74(3): 328-336. DOI:10.1017/S0029665114001657 |
| [14] |
MACFARLANE G T, MACFARLANE S. Bacteria, colonic fermentation, and gastrointestinal health[J]. Journal of AOAC International, 2012, 95(1): 50-60. DOI:10.5740/jaoacint.SGE_Macfarlane |
| [15] |
BARCZYŃSKA R, LITWIN M, SLIŻEWSKA K, et al. Bacterial microbiota and fatty acids in the faeces of overweight and obese children[J]. Polish Journal of Microbiology, 2018, 67(3): 339-345. DOI:10.21307/pjm-2018-041 |
| [16] |
PHETCHARABURANIN J, LEES H, MARCHESI J R, et al. Systemic characterization of an obese phenotype in the Zucker rat model defining metabolic axes of energy metabolism and host-microbial interactions[J]. Journal of Proteome Research, 2016, 15(6): 1897-1906. DOI:10.1021/acs.jproteome.6b00090 |
| [17] |
PERRY R J, PENG L, BARRY N A, et al. Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome[J]. Nature, 2016, 534(7606): 213-217. DOI:10.1038/nature18309 |
| [18] |
KASUBUCHI M, HASEGAWA S, HIRAMATSU T, et al. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation[J]. Nutrients, 2015, 7(4): 2839-2849. DOI:10.3390/nu7042839 |
| [19] |
TAN J, MCKENZIE C, POTAMITIS M, et al. The role of short-chain fatty acids in health and disease[J]. Advances in Immunology, 2014, 121: 91-119. |
| [20] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [21] |
GOMES A C, HOFFMANN C, MOTA J F. The human gut microbiota: metabolism and perspective in obesity[J]. Gut Microbes, 2018, 19(4): 308-325. |
| [22] |
武亚琦, 钟根深, 吴敏娜. 小鼠粪便及肠道各部位内容物细菌群落结构差异分析[J]. 中国实验动物学报, 2015, 23(3): 249-255. WU Y Q, ZHONG G S, WU M N. Differential analysis of the bacterial community composition in mouse feces and intestinal contents[J]. Acta Laboratorium Animalis Scientia Sinica, 2015, 23(3): 249-255 (in Chinese). |
| [23] |
ETXEBERRIA U, ARIAS N, BOQUÉ N, et al. Shifts in microbiota species and fermentation products in a dietary model enriched in fat and sucrose[J]. Beneficial Microbes, 2015, 6(1): 97-111. DOI:10.3920/BM2013.0097 |
| [24] |
杨凤啸, 卢敏莹. 高脂饮食诱发小鼠肥胖及其对肠道菌群结构影响的研究[J]. 现代医院, 2017, 17(6): 863-866, 871. YANG F X, LU M H. Effects of high fat diet on mouse obesity and its effect on intestinal microflora structure[J]. Modern Hospitals, 2017, 17(6): 863-866, 871 (in Chinese). |
| [25] |
JANG Y S, IM J A, CHOI S Y, et al. Metabolic engineering of Clostridium acetobutylicum for butyric acid production with high butyric acid selectivity[J]. Metabolic Engineering, 2014, 23: 165-174. DOI:10.1016/j.ymben.2014.03.004 |
| [26] |
黄金莉, 吕卉芸, 李华军. 普拉梭菌在肠道微生态中的功能及作用研究[J]. 胃肠病学和肝病学杂志, 2019, 28(3): 245-249. HUANG J L, LYU H Y, LI H J. Research of role and function of F.prausnitzii in intestinal microecology[J]. Chinese Journal of Gastroenterology and Hepatology, 2019, 28(3): 245-249 (in Chinese). |
| [27] |
GREENBLUM S, TURNBAUGH P J, BORENSTEIN E. Metagenomic systems biology of the human gut microbiome reveals topological shifts associated with obesity and inflammatory bowel disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(2): 594-599. |




