2. 青岛康大食品有限公司, 青岛 266555;
3. 山东省康复医院, 济南 250109;
4. 山东省农业科学院畜牧兽医研究所, 济南 250100
2. Qingdao Kangda Food Co., Ltd., Qingdao 266555, China;
3. Shandong Rehabilitation Hospital, Ji'nan 250109, China;
4. Animal Husbandry and Veterinary Institute, Shandong Academy of Agricultural Sciences, Ji'nan 250100, China
饲粮中添加锌能够有效提高生长期獭兔的生长性能和锌相关酶活性,有利于提高獭兔机体免疫力[1]。锌与脂肪代谢有密切关系,锌的摄入过多或过少均能干扰脂类代谢,引起血脂异常,影响肝脏胆固醇含量,增加氧化应激[2]。脂肪代谢分为合成代谢和分解代谢,其过程受到众多酶和因子的调控。肉碱脂酰转移酶1(CPT1)、脂肪酸合成酶(FAS)、过氧化物酶体增殖物激活受体(PPAR)和乙酰辅酶A羧化酶(ACC)是在脂肪酸氧化和合成过程中发挥重要作用的关键酶[3]。激素敏感脂酶(HSL)、脂蛋白脂酶(LPL)是动物体脂肪分解的关键酶[4]。脂肪酸结合蛋白(FABP)和脂肪酸转运蛋白(FATP)参与长链脂肪酸的结合、摄取和运输等过程[5]。锌可以诱导具有清除自由基和抗氧化作用的不同金属硫蛋白的合成,从而对脂肪酸的过氧化提供有效保护[6]。
研究发现,一定剂量的锌能够改善高脂血症大鼠的脂肪代谢,并降低血清脂联素的含量[7];饲粮中添加锌能够提升仔猪的消化机能,而缺锌导致仔猪发育迟缓[8]。已有研究表明,肥胖的机体中血清锌和锌指蛋白的含量较低,且编码该蛋白的基因表达量也低[9]。细胞锌状态的变化会影响多种转录因子,包括PPARγ,在脂质运输和代谢中起着重要作用[10],而PPARγ激活了大量与储存脂质生物合成和降解相关的基因[11]。据报道,如果饮食中锌含量增加到推荐膳食容许量(RDA)的2倍,健康儿童体内的脂肪含量会增加,这是因为锌促进脂肪沉积,增加了脂肪细胞的数量[12]。动物缺锌时会刺激葡萄糖在肌肉和脂肪细胞中的转运,机体对葡萄糖的处理能力下降,导致脂肪分解代谢增加,食欲变差[13-14]。锌的减少导致铁超载,从而直接激活了硬脂酰辅酶A去饱和酶(SCD)的转化活性,以促进脂质生物合成和积累[15]。补充锌会使脂肪代谢中甘油三酯、低密度脂蛋白的含量下降,高密度脂蛋白的含量升高[16]。肝脏是外源性和内源性脂肪代谢途径的交汇点及调节中心[17],在一些研究中,缺锌会加剧肝脏脂肪代谢,而补充锌则会增加肝细胞活性,改善肝脏脂肪代谢[18]。吴文杰[19]的研究显示,添加外源性硫酸锌不仅改善了糖尿病模型大鼠肝脏的病理损伤,还改善了其过氧化状态及脂肪代谢紊乱。相反,Weigand等[20]的研究则表明中度缺锌不改变高脂饮食大鼠肝脏脂肪含量和脂肪酸组成。综上可知,锌会影响动物机体的脂肪代谢, 但具体影响机制还不明确。鉴于此,本试验以生长獭兔为研究对象,研究饲粮中添加锌对其脂肪沉积以及脂肪代谢相关基因表达的影响,以探索锌参与脂肪代谢的相关机制。
1 材料与方法 1.1 试验饲粮基础饲粮参照NRC(2012)的兔营养标准和李福昌[21]推荐的家兔营养需要配制,其组成及营养水平见表 1。在基础饲粮的基础上分别添加0、40、80和120 mg/kg的锌(硫酸锌形式),配制4种试验饲粮,试验饲粮中锌含量的实测值分别为9.7、49.4、87.0和127.4 mg/kg。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选用160只3月龄、平均体重(1 908±105) g、健康状况良好的生长獭兔,按体重随机分成4组,每组40只,每只为1个重复。4组獭兔分别饲喂添加0(对照组)、40、80和120 mg/kg锌(硫酸锌形式)的试验饲粮。试验前进行彻底全面清洁消毒,试验兔单笼饲养,自由饮水。试验过程中采用常规饲养管理程序,保持自然采光和通风,3~5 d消毒兔舍1次。预试期7 d,正试期49 d。试验结束后每组随机取8只试验兔,采用颈椎错位法致死后屠宰,将肩胛脂肪、肾周脂肪剥离并称重,并采集样品放于液氮中,随后转移到-80 ℃保存,用于脂肪代谢相关基因表达的测定。
1.3 脂肪代谢相关基因表达的测定采用Trizol法提取脂肪组织样品总RNA,利用琼脂糖凝胶电泳和核酸分光光度计检测总RNA的质量和浓度。按照TaKaRa RNA反转录试剂盒说明书进行反转录,然后按照Roche荧光定量试剂盒操作,在美国AB7500系列实时荧光定量PCR仪上进行实时荧光定量PCR。参照Livak等[22]的方法,以β-肌动蛋白(β-actin)作为内参基因,用2-ΔΔCt法定量目标基因的mRNA相对表达量。相关基因的引物序列见表 2。
|
|
表 2 相关基因的引物序列 Table 2 Primer sequences of related genes |
试验数据用SAS 9.2软件进行方差分析,并用Duncan氏法进行多重比较,数据用平均值和均方根误差(R-MSE)表示,P < 0.05表示差异显著,0.05≤P < 0.10表示有差异趋势。
2 结果 2.1 饲粮中添加不同水平锌对生长獭兔脂肪沉积的影响由表 3可知,饲粮中添加不同水平锌对生长獭兔肩胛脂肪沉积量没有显著影响(P>0.05),但有降低肾周脂肪沉积量的趋势(P=0.095 3)。
|
|
表 3 饲粮中添加不同水平锌对生长獭兔脂肪沉积的影响 Table 3 Effects of dietary different addition levels of zinc on fat deposition of growing Rex rabbits (n=8) |
图 1显示,饲粮中添加不同水平锌对生长獭兔肩胛脂肪中PPARγ、FATP、FAS、ACC mRNA相对表达量没有显著影响(P>0.05)。与对照组相比,添加40 mg/kg锌组肩胛脂肪中FABP mRNA相对表达量的显著增加(P < 0.05),LPL mRNA相对表达量显著降低(P < 0.05);添加120 mg/kg锌组肩胛脂肪中FABP、CPT1、HSL mRNA相对表达量显著增加(P < 0.05)。此外,添加120 mg/kg锌组肩胛脂肪中PPARα mRNA相对表达量显著高于添加40 mg/kg锌组(P < 0.05),FABP、CPT1、HSL mRNA相对表达量显著高于添加80 mg/kg锌组(P < 0.05);添加80 mg/kg锌组肩胛脂肪中LPL mRNA相对表达量显著高于添加40 mg/kg锌组(P < 0.05)。
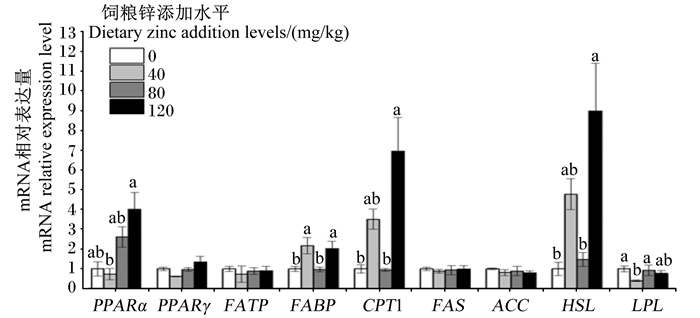
|
PPARα:过氧化物酶体增殖物激活受体α;PPARγ:过氧化物酶体增殖物激活受体γ;FATP:脂肪酸转运蛋白;FABP:脂肪酸结合蛋白;CPT1:肉碱脂酰转移酶1;FAS:脂肪酸合成酶;ACC:乙酰辅酶A羧化酶;HSL:激素敏感脂酶;LPL:脂蛋白脂酶。数据柱标注不同小写字母表示差异显著(P < 0.05)。图 2同。 PPARα: peroxisome proliferator-activated receptor α; PPARγ: peroxisome proliferator-activated receptor γ; FATP: fatty acid transport protein; FABP: fatty acid binding protein; CPT1: carnitine acyl transferase 1; FAS: fatty acid synthetase; ACC: acetyl-CoA carboxylase; HSL: hormone sensitive lipase; LPL: lipoprotein lipase. Value columns with different small letters mean significant difference (P < 0.05). The same as Fig. 2. 图 1 饲粮中添加不同水平锌对生长獭兔肩胛脂肪中脂肪代谢相关基因mRNA相对表达量的影响 Fig. 1 Effects of dietary different addition levels of zinc on mRNA relative expression levels of fat metabolism related genes in scapular fat of growing Rex rabbits (n=8) |
图 2显示,饲粮中添加不同水平锌对生长獭兔肾周脂肪中PPARα、PPARγ、FATP、FABP、FAS、ACC mRNA相对表达量没有显著影响(P>0.05)。与对照组相比,添加80 mg/kg锌组肾周脂肪中HSL mRNA相对表达量显著提高(P < 0.05);添加120 mg/kg锌组肾周脂肪中CPT1、HSL mRNA相对表达量显著提高,LPL mRNA相对表达量显著降低(P < 0.05)。
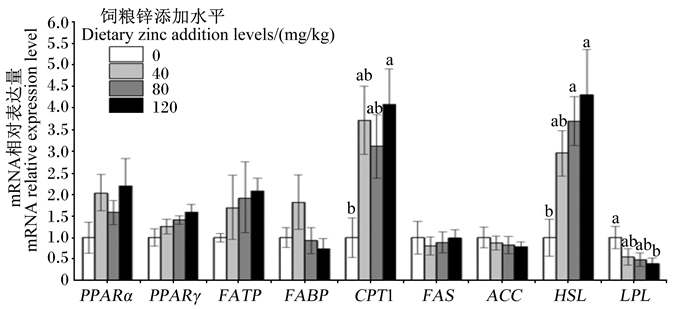
|
图 2 饲粮中添加不同水平锌对生长獭兔肾周脂肪中脂肪代谢相关基因mRNA相对表达量的影响 Fig. 2 Effects of dietary different addition levels of zinc on mRNA relative expression levels of fat metabolism related genes in shoulder fat of growing Rex rabbits (n=8) |
研究发现,膳食中补充高锌后显著降低了成年男性血液中高密度脂蛋白含量[23]。锌通过多种途径激活在脂肪代谢中发挥着重要调控作用的细胞自噬和脂噬,缓解黄颡鱼肝细胞中脂肪沉积,且呈现剂量依赖效应[24]。矛尾复虾虎鱼经水体锌暴露后,促进了脂肪分解,抑制了脂肪合成,从而减少了肝脏脂肪沉积[25]。本研究结果显示,饲粮中添加锌有使肾周脂肪沉积量降低的趋势,与上述研究结果相类似,说明锌的添加能降低机体中脂肪的沉积。
脂肪代谢的主要途径是线粒体脂肪酸β氧化,在此过程中游离脂肪酸与辅酶A酯化,进入线粒体基质,氧化生成乙酰辅酶羧化酶[26]。CPT1、酰基肉碱转运酶和肉碱脂酰转移酶2(CPT2)这3种蛋白组成的肉碱棕榈酸转移酶(CPT)系统介导长链酰基辅酶A酯向线粒体基质的转运[27]。CPT1锚定在线粒体外膜上,负责将酰基辅酶A转化为酰基肉碱,通过转运酶穿过线粒体膜,进入β氧化之前在线粒体内由CPT2将酰基肉碱再转换成酰基辅酶A[28]。CPT1被认为是脂肪酸β氧化的限速酶,它被脂肪生成的第1个中间体丙二酰辅酶A抑制,作为维持脂肪酸代谢平衡的关键调节机制[29]。HSL是脂肪分解代谢过程中的限速酶,其作用是将甘油三酯水解成甘油和脂肪酸,为机体供能[30]。研究表明,FAS与HSL表达量的比值与肌肉脂肪含量高低呈显著的正相关[31]。LPL是肌内脂肪形成和沉积的标志性蛋白,属于脂肪酶超家族,是脂肪细胞分化的一个早期标志物,在控制脂肪沉积上发挥核心作用,它直接调控所在组织的脂质底物配额相对量,决定了脂肪代谢的方向,影响机体脂质状况及畜类的肉品质[32]。
有研究报道,补充硫酸锌后小鼠主动脉中PPARα mRNA相对表达量显著升高,这说明补锌可能通过上调血管中PPARα的表达来增加脂肪酸氧化,进而减少甘油三酯的产生[33]。本试验结果显示,饲粮中添加120 mg/kg锌上调了生长獭兔肩胛脂肪和肾周脂肪中PPARα mRNA相对表达量。研究显示,饲粮中添加锌显著提高了肉鸡肝脏中FAS和LPL的活性和腹脂中LPL mRNA相对表达量[34-35];锌暴露上调了黄颡鱼肝脏中CPT1的表达,下调了肌肉中CPT1的表达[36]。而本试验结果显示,饲粮中添加不同水平锌对生长獭兔肩胛脂肪和肾周脂肪中FAS的表达没有产生显著影响,下调了LPL的表达,上调了CPT1的表达,与前人研究结果不一致,这可能是由于不同物种、不同组织之间,脂肪酸的氧化分解能力具有不同的特异性。据试验结果推测,参与脂肪合成的FAS基因可能不是锌起作用的靶基因。本试验中,饲粮中添加120 mg/kg锌使生长獭兔肩胛脂肪和肾周脂肪中HSL的表达上调,FAS与HSL mRNA相对表达量的比值下降,说明脂肪分解增加,从而使得脂肪沉积减少。
4 结论饲粮中添加120 mg/kg锌(硫酸锌形式)上调了生长獭兔脂肪分解过程中相关基因的表达,增加了脂肪分解和脂肪酸氧化进程,从而使脂肪沉积有降低的趋势。
| [1] |
杨翠军, 葛剑, 吴淑琴. 日粮锌水平对生长期獭兔生长性能和血清生化指标的影响[J]. 中国养兔, 2019(2): 4-5. YANG C J, GE J, WU S Q. Effects of dietary zinc level on growth performance and serum biochemical indexes of Rex rabbits[J]. Chinese Journal of Rabbit Farming, 2019(2): 4-5 (in Chinese). |
| [2] |
郑贵花, 夏广军, 尹宝珍. 乙酰辅酶A羧化酶在动物中的研究进展[J]. 现代农业研究, 2019(10): 109-112, 120. ZHEN G H, XIA G J, YIN B Z. Research progress of acetyl CoA carboxylase in animals[J]. Modern Agricultural Research, 2019(10): 109-112, 120 (in Chinese). |
| [3] |
NAVIDSHAD B, ROYAN M. Peroxisome proliferator-activated receptor alpha (PPARα), a key regulator of lipid metabolism in avians[J]. Critical Reviews in Eukaryotic Gene Expression, 2016, 26(4): 303-308. DOI:10.1615/CritRevEukaryotGeneExpr.2016016665 |
| [4] |
KERSTEN S. Physiological regulation of lipoprotein lipase[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2014, 1841(7): 919-933. DOI:10.1016/j.bbalip.2014.03.013 |
| [5] |
STAHL A. A current review of fatty acid transport proteins (SLC27)[J]. European Journal of Physiology, 2004, 447(5): 722-727. DOI:10.1007/s00424-003-1106-z |
| [6] |
POWELL S R. The antioxidant properties of zinc[J]. The Journal of Nutrition, 2000, 130(5): 1447S-1454S. DOI:10.1093/jn/130.5.1447S |
| [7] |
陶梦君, 周军, 金来润, 等. 微量元素锌对高脂血症模型大鼠脂代谢的影响[J]. 赣南医学院学报, 2019, 39(7): 658-661. TAO M J, ZHOU J, JIN L R, et al. Effect of trace element zinc on lipid metabolism in hyperlipidemia model rats[J]. Journal of Gannan Medical College, 2019, 39(7): 658-661 (in Chinese). DOI:10.3969/j.issn.1001-5779.2019.07.003 |
| [8] |
王惠康, 周世霞, 周金伟. 硫酸锌对仔猪摄食及消化机能的影响研究[J]. 浙江畜牧兽医, 2013, 38(6): 4-7. WANG H K, ZHOU S X, ZHOU J W. Effects of zinc sulfate on feeding and digestive function of piglets[J]. Zhejiang Journal of Animal Science and Veterinary Medicine, 2013, 38(6): 4-7 (in Chinese). DOI:10.3969/j.issn.1005-7307.2013.06.002 |
| [9] |
SEVERO J S, MORAIS J B S, BESERRA J B, et al. Role of zinc in zinc-α2-glycoprotein metabolism in obesity: a review of literature[J]. Biological Trace Element Research, 2020, 193(1): 81-88. DOI:10.1007/s12011-019-01702-w |
| [10] |
CARMAN G M, HAN G S. Regulation of phospholipid synthesis in the yeast Saccharomyces cerevisiae[J]. Annual Review of Biochemistry, 2011, 80: 859-883. DOI:10.1146/annurev-biochem-060409-092229 |
| [11] |
SEMPLE R K, CHATTERJEE V K K, O'RAHILLY S. PPARγ and human metabolic disease[J]. The Journal of Clinical Investigation, 2006, 116(3): 581-589. DOI:10.1172/JCI28003 |
| [12] |
PRENTICE A. Does mild zinc deficiency contribute to poor growth performance?[J]. Nutrition Reviews, 1993, 51(9): 268-270. |
| [13] |
赵霖. 缺锌对大鼠生长发育及脂代谢的影响[J]. 营养学报, 1996, 18(3): 305-312. ZHAO L. Effect of zinc deficiency on growth and IPID metabolism in rats[J]. Acta Nutrimenta Sinica, 1996, 18(3): 305-312 (in Chinese). DOI:10.3321/j.issn:0512-7955.1996.03.001 |
| [14] |
OLECHNOWICZ J, TINKOV A, SKALNY A, et al. Zinc status is associated with inflammation, oxidative stress, lipid, and glucose metabolism[J]. The Journal of Physiological Science, 2018, 68(1): 19-31. DOI:10.1007/s12576-017-0571-7 |
| [15] |
ZHANG J J, HAO J J, ZHANG Y R, et al. Zinc mediates the SREBP-SCD axis to regulate lipid metabolism in Caenorhabditis elegans[J]. Journal of Lipid Research, 2017, 58(9): 1845-1854. DOI:10.1194/jlr.M077198 |
| [16] |
LI H T, JIAO M, CHEN J, et al. Roles of zinc and copper in modulating the oxidative refolding of bovine copper, zinc superoxide dismutase[J]. Acta Biochimica et Biophysica Sinica, 2010, 42(3): 183-194. DOI:10.1093/abbs/gmq005 |
| [17] |
王福, 钱利纯, 崔华伟, 等. 高锌对仔猪肝脏脂肪代谢的影响[J]. 动物营养学报, 2010, 22(5): 1200-1206. WANG F, QIAN L C, CUI H W, et al. Effects of high zinc on liver fat metabolism in piglets[J]. Chinese Journal of Animal Nutrition, 2010, 22(5): 1200-1206 (in Chinese). DOI:10.3969/j.issn.1006-267x.2010.05.012 |
| [18] |
TAYEB W, NAKBI A, CHERAIEF I, et al. Alteration of lipid status and lipid metabolism, induction of oxidative stress and lipid peroxidation by 2, 4-dichlorophenoxyacetic herbicide in rat liver[J]. Toxicology Mechanisms and Methods, 2013, 23(6): 449-458. DOI:10.3109/15376516.2013.780275 |
| [19] |
吴文杰. 外源硫酸锌对糖尿病大鼠肝脏的保护作用[D]. 硕士学位论文. 长春: 吉林大学, 2009. WU W J. The protective effect of exogenous zinc sulfate on the liver of diabetic rats[D]. Master's Thesis. Changchun: Jilin University, 2009. (in Chinese) |
| [20] |
WEIGAND E, EGENOLF J. A moderate zinc deficiency does not alter lipid and fatty acid composition in the liver of weanling rats fed diets rich in cocoa butter or safflower oil[J]. Journal of Nutrition and Metabolism, 2017, 2017: 4798963. |
| [21] |
李福昌. 家兔营养[M]. 北京: 中国农业出版社, 2009. LI F C. Rabbit nutrition[M]. Beijing: China Agricultural Press, 2009 (in Chinese). |
| [22] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [23] |
CHANDRA R K. Excessive intake of zinc impairs immune responses[J]. Journal of the American Medical Association, 1984, 252(11): 1443-1446. DOI:10.1001/jama.1984.03350110043027 |
| [24] |
魏川川. 黄颡鱼自噬的分子特征及在锌影响脂类代谢中的调控机制[J]. 硕士学位论文. 武汉: 华中农业大学, 2018. WEI C C. Molecular characteristics of autophagy in Pelteobagrus fulvidraco and its regulatory mechanism in the effect of zinc on lipid metabolism[J]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2018. (in Chinese) |
| [25] |
黄超. 水体铜和锌暴露对矛尾复虾虎鱼肝脏脂代谢的影响[D]. 硕士学位论文. 武汉: 华中农业大学, 2015. HUANG C. Effects of copper and zinc exposure on lipid metabolism in liver of goby goby[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2015. (in Chinese) |
| [26] |
BERG J M, TYMOCZKO J L, STRYER L. Biochemistry[M]. 5th ed. New York: W.H. Freeman Publishing, 2002.
|
| [27] |
MCGARRY J D, BROWN N F. The mitochondrial carnitine palmitoyltransferase system-from concept to molecular analysis[J]. European Journal of Biochemistry, 1997, 244(1): 1-14. DOI:10.1111/j.1432-1033.1997.00001.x |
| [28] |
BONNEFONT J P, DJOUADI F, PRIP-BUUS C, et al. Carnitine palmitoyltransferases 1 and 2:biochemical, molecular and medical aspects[J]. Molecular Aspects of Medicine, 2004, 25(5/6): 495-520. |
| [29] |
SCHREURS M, KUIPERS F, VAN DER LEIJ F R. Regulatory enzymes of mitochondrial β-oxidation as targets for treatment of the metabolic syndrome[J]. Obesity Reviews, 2010, 11(5): 380-388. DOI:10.1111/j.1467-789X.2009.00642.x |
| [30] |
张雨, 施力光, 荀文娟, 等. 能量水平和激素对脂肪代谢酶基因的调控研究进展[J]. 动物营养学报, 2019, 31(8): 3505-3510. ZHANG Y, SHI L G, XUN W J, et al. Research progress on regulation of energy level and hormone on fat metabolism enzyme gene[J]. Chinese Journal of Animal Nutrition, 2019, 31(8): 3505-3510 (in Chinese). |
| [31] |
陈杰, 杨晓静, 佟辉, 等. FAS和HSL mRNA在猪背最长肌的表达及其与肌内脂肪含量的关系[J]. 农业生物技术学报, 2005, 12(4): 422-426. CHEN J, YANG X J, TONG H, et al. Expression of FAS and HSL mRNA in longissimus dorsi and their relationship with intramuscular fat content[J]. Journal of Agricultural Biotechnology, 2005, 12(4): 422-426 (in Chinese). |
| [32] |
董丽艳, 卢立志, 汤安, 等. 白羽王鸽脂蛋白脂肪酶基因的克隆、生物信息学及组织表达谱分析[J]. 中国畜牧杂志, 2016, 52(17): 19-23. DONG L Y, LU L Z, TANG A, et al. Cloning, bioinformatics and tissue expression profile analysis of lipoprotein lipase gene from white feather king pigeon[J]. Chinese Journal of Animal Science, 2016, 52(17): 19-23 (in Chinese). |
| [33] |
蒋金金, 汤嘉宁, 董闻平, 等. 硫酸锌对高脂喂养载脂蛋白E基因敲除小鼠主动脉PPARα和VCAM-1表达的影响[J]. 中国药物与临床, 2014, 14(1): 32-34. JIANG J J, TANG J N, DONG W P, et al. Effects of zinc sulfate on the expression of PPARα and VCAM-1 in aorta of apolipoprotein E gene knockout mice fed with high fat diet[J]. Chinese Remedies and Clinics, 2014, 14(1): 32-34 (in Chinese). |
| [34] |
刘泽辉, 吕林, 李素芬, 等. 饲粮添加不同形态锌源及锌水平对肉仔鸡血清生化指标和脂肪代谢的影响[C]//第六次全国饲料营养学术研讨会论文集. 杨凌: 中国畜牧兽医学会动物营养学分会, 2010. LIU Z H, LV L, LI S F, et al. Effects of dietary zinc sources and levels on serum biochemical indexes and lipid metabolism in broilers[C]//YAO J H. Proceedings of the 6th China academic symposium on feed nutrition. Yangling: Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary, 2010. (in Chinese) |
| [35] |
刘丽, 李文清, 郭慧, 等. 肌肽、肌肽锌对黄羽肉鸡脂肪代谢和FAS基因表达的影响[C]//全国动物生理生化第九次学术交流会论文摘要汇编. 广州: 中国畜牧兽医学会动物生理生化学分会, 2006. LIU L, LI W Q, GUO H, et al. Effects of carnosine and carnosine zinc on fat metabolism and FAS gene expression in yellow feathered broilers[C]//Proceedings of the 9th of academic symposium on animal physiology and biochemistry. Guangzhou: Branch of Animal Physiology and Biochemistry of Chinese Society of Animal Husbandry and Veterinary, 2006. (in Chinese) |
| [36] |
郑家浪. 虾虎鱼和黄颡鱼CPTⅠ的克隆、表达、动力学性质及对锌的响应研究[J]. 博士学位论文. 武汉: 华中农业大学, 2014. ZHEN J L. Cloning, expression, kinetic properties and response to zinc of CPTⅠ in goblet and Pelteobagrus fulvidraco[J]. Ph. D. Thesis. Wuhan: Huazhong University, 2014. (in Chinese) |




