仔猪早期断奶技术是现代规模化猪场普遍采用的关键技术,其重要性日益显著。然而早期断奶却是仔猪必须经历的一个重大创伤性事件,首当其冲是损害肠道健康。断奶应激极易造成仔猪肠道损伤,黏膜形态改变,消化酶活性降低,功能基因与蛋白表达异常,最终导致整个消化系统功能紊乱,严重阻碍了仔猪健康生长,给畜牧业造成严重的经济损失[1-3]。肠道健康是决定仔猪整体健康和后期生产力水平的关键因素,对肠道进行损伤修复一直是仔猪营养研究的重点。
表皮生长因子(epidermal growth factor,EGF)是一个含有53个氨基酸的单链多肽,分子质量为6.05 ku,属于促生长因子家族成员之一[4]。EGF是一种强有力的细胞有丝分裂原,可刺激细胞分裂、增殖,增加上皮组织的DNA与蛋白质合成,其独特作用是促进胃肠组织生长和发育[5]。研究显示,EGF可以刺激胃肠道上皮细胞增殖与分化,促进肠道生长发育,诱导小肠黏膜刷状缘消化酶表达,改善机体对养分的消化利用[6]。母乳是动物哺乳时期肠道EGF的主要来源,早期断奶使仔猪突然中断乳源性猪表皮生长因子(porcine epidermal growth factor,pEGF),此时通过外源补充pEGF极有可能是修复断奶仔猪肠道损伤、维护正常肠道功能屏障的一个有效途径。然而,关于pEGF对断奶仔猪肠道作用方面的报道还比较缺乏,有限的来源、昂贵的价格是制约其在畜牧业领域研究及应用的主要原因。
基因工程是获得pEGF来源的好方法。乳酸乳球菌(Lactococcus lactis,L. lactis)是乳酸菌的一个典型模式菌株,存在于人和动物的肠道中并发挥重要的生理功能,是公认的安全级微生物(generally recognized as safe,GRAS)[7]。L. lactis具有不产生内毒素、生长迅速和易于操作等优点,成为表达外源蛋白的理想候选者;另外,L. lactis表达的外源蛋白可保持天然构型,不需要进一步纯化可直接连同菌体一起服用[8]。目前,采用L. lactis载体系统已经表达出了多种外源抗原(出血性败血症病毒G蛋白、Ⅲ型鸭乙型肝炎病毒VP1蛋白)[9-10]、酶类(β-1, 4-葡聚糖内切酶egl3、L-乳酸脱氢酶)[11-12]和活性肽(胰岛素样生长因子-Ⅰ、牛乳铁蛋白肽)[13-14]等,并应用于食品工业、生物制药和疫苗等研究领域。pEGF的来源有限制约了其在断奶仔猪上的研究及应用,L. lactis表达系统已经发展成熟,鉴于此,本研究采用L. lactis高效诱导表达系统,构建表达pEGF的重组L. lactis,以葡聚糖硫酸钠(dextra sulfate sodium,DSS)诱导的结肠炎小鼠为模型动物,研究重组pEGF对肠道形态结构、通透性和细胞因子浓度的影响,评价其对损伤肠道的修复作用,为将表达pEGF重组L. lactis应用于断奶仔猪肠道保护提供重要的依据。
1 材料与方法 1.1 菌株和质粒乳酸链球菌素(Nisin)诱导型细胞内表达载体pNZ8148和宿主菌L. lactis NZ9000购自荷兰NIZO研究所。
1.2 主要试剂Nisin购自美国Sigma公司,限制性内切酶NcoⅠ、HindⅢ和T4 DNA连接酶购自美国NEB公司,兔抗EGF单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔二抗均购自美国Abcam公司,DSS(相对分子质量为36 00~50 000)购自上海MP公司,10%中性甲醛购自杭州长青化工有限公司。
1.3 pEGF基因设计与优化pEGF是一个由53个氨基酸组成的分子质量为6.05 ku的小分子蛋白质,为了增加表达量,根据GenBank中登录的pEGF基因序列,设计将3个拷贝数的pEGF基因同向串联,相邻pEGF序列之间通过柔性Linker(氨基酸序列为GGGGSG)连接。然后,基于L. lactis对密码子的偏好性进一步优化该序列,并在基因序列全长的5′端加入限制性内切酶NcoⅠ,3′端加入终止密码子(TAA)和限制性内切酶HindⅢ。总基因序列长度542 bp,重组蛋分子质量约19 ku。将设计好的基因序列送至上海生物工程有限公司合成。
1.4 重组L. lactis的构建将表达载体pNZ8148用限制性内切酶NcoⅠ、HindⅢ双酶切,纯化回收双酶切载体片段。将合成好的3pEGF基因与表达载体连接,电转化至感受态L. lactis NZ9000中,利用氯霉素(10 mg/mL)对转化子进行筛选,挑取白色菌落,培养重组菌,然后提取重组质粒,将重组质粒进行双酶切鉴定与DNA序列测定(由上海英俊生物技术有限公司完成)。鉴定正确的质粒命名为pNZ8148-3pEGF,重组菌命名为L. lactis NZ9000 (pNZ8148-3pEGF)。
1.5 重组pEGF的表达及Western blot检测将重组菌L. lactis NZ9000 (pNZ8148-3pEGF)接种于GM17液体培养基中,37 ℃厌氧培养至光密度(OD)=0.4~0.5,加入终浓度为5 μg/L的诱导剂Nisin,继续培养3 h;将培养物离心后收集菌体,向菌体中加入等体积的1倍上样缓冲液,沸水浴10 min后离心,上清液经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转印至硝酸纤维素膜上,以羊抗EGF单克隆抗体为一抗,HRP标记的山羊抗兔为二抗,对目的蛋白进行分析。
1.6 表达pEGF重组L. lactis对小鼠肠道损伤修复作用的研究将32只8周龄雌性BALB/c小鼠(购自上海斯莱克实验动物有限责任公司,体重为18~24 g)随机分为4组,每组8只。采用4%的DSS建立小鼠结肠炎模型,各组小鼠具体处理如下:正常对照组,试验第1~12天饮用自来水;DSS模型对照组,试验第1~7天饮用4%的DSS水溶液,第8~12天饮用自来水;L. lactis组,饮水按照DSS模型对照组处理,同时每天08:00口服(灌胃)1×1012 CFU L. lactis NZ9000 (pNZ8148),连续口服12 d;重组L. lactis组,饮水按照DSS模型对照组处理,同时每天08:00口服(灌胃)1×1012 CFU重组L. lactis NZ9000 (pNZ8148-3pEGF),连续口服12 d。饲养环境温度为(24±1) ℃、相对湿度40%~70%,光照周期12 h明、12 h暗。
1.7 小鼠样本采集及处理试验第13天,于小鼠眶下静脉采血,分离血清;颈椎脱臼法处死小鼠,沿腹中线打开腹腔,取出肠道组织,测定小鼠盲肠端至肛门的结肠长度;截取1 cm结肠组织放入10%中性甲醛溶液中,样品经石蜡包埋后切片,苏木精-伊红(hematoxylin-eosinstaining,HE)染色,显微镜下观察小鼠结肠形态结构,用于组织病理学分析。剩余的结肠放于-70 ℃冰箱保存待测其他指标。
1.8 结肠通透性相关指标及细胞因子浓度的测定准确称取小鼠结肠重量,加入灭菌生理盐水,机械匀浆后离心取上清,采用酶联免疫吸附试验(ELISA)法测定结肠闭锁蛋白(occludin)、白细胞介素-10(IL-10)、白细胞介素-4(IL-4)和肿瘤坏死因子-α(TNF-α)浓度,采用比色法测定小鼠血清二胺氧化酶(diamine oxidase,DAO)活性和D-乳酸(D-lactate,D-LAC)浓度。
1.9 统计分析试验数据采用SPSS 21.0软件进行单因素方差分析(one-way ANOVA)及Duncan氏法多重比较,试验数据以“平均值±标准差”表示,P < 0.05为差异显著,P < 0.01则为差异极显著。
2 结果 2.1 表达pEGF重组L. lactis的构建表达载体pNZ8148经限制性内切酶NcoⅠ、Hind Ⅲ双酶切后,与合成的3pEGF基因片段连接并转化至L. lactis NZ9000中,重组质粒经NcoⅠ、Hind Ⅲ双酶切鉴定,目的基因大小相符(图 1),证明外源基因3pEGF插入表达载体中。测序结果表明目的片段序列正确,3pEGF基因插入位置和方向与预期结果完全一致。
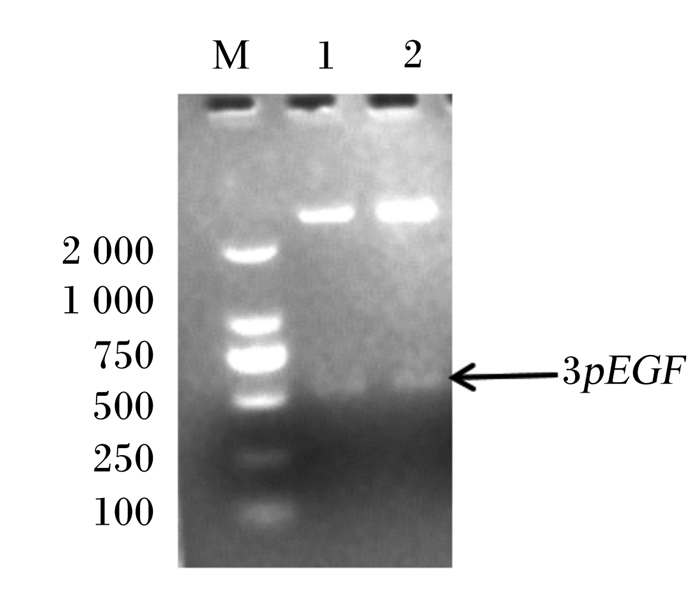
|
M:DNA分子量标准DNA marker;1、2:NcoⅠ、HindⅢ双酶切NcoⅠ and HindⅢ double digestion;3pEGF:3个拷贝数的猪表皮生长因子3 copies of porcine epidermal growth factor。 图 1 重组质粒pNZ8148-3pEGF双酶切鉴定 Fig. 1 Identification of pNZ8148-3pEGF by double enzyme digestion |
L. lactis NZ9000 (pNZ8148-3pEGF)经Nisin诱导表达后,菌体裂解液经SDS-PAGE后转印至硝酸纤维素膜上,采用Western blot方法检测重组蛋白,与L. lactis NZ9000 (pNZ8148)相比,膜上重组菌的位置出现特异性条带(图 2),说明L. lactis能够表达pEGF,且能与EGF单克隆抗体结合,初步证明重组pEGF具有生物活性。
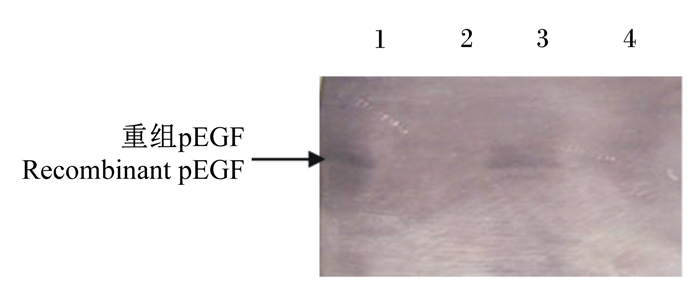
|
1、3:L. lactis NZ9000 (pNZ8148-3pEGF)菌体蛋白bacterial protein of L. lactis NZ9000 (pNZ8148-3pEGF);2、4:L. lactis NZ9000 (pNZ8148)菌体蛋白bacterial protein of L. lactis NZ9000 (pNZ8148)。 图 2 Western blot方法检测重组pEGF Fig. 2 Recombinant pEGF detected by Western blot method |
正常对照组小鼠采食、饮水、活动及精神状态均正常,皮毛顺滑有光泽,无便血。DSS模型对照组小鼠饮用4% DSS水溶液后,采食和饮水逐渐减少,活动迟缓,精神萎靡,皮毛蓬松无光泽,试验第6天全部出现直肠便血或水样稀便。L. lactis组小鼠采食和饮水也相应减少,皮毛蓬松,试验第6天直肠出现血便,个别出现稀便。重组L. lactis组小鼠皮毛顺滑,活动和精神状况较为正常,个别小鼠出现稀便。
2.4 试验小鼠结肠长度及形态与正常对照组相比,DSS模型对照组小鼠结肠长度显著降低(P<0.05),降低了34.77%(图 3)。与DSS模型对照组和L. lactis组相比,重组L. lactis组小鼠结肠长度显著增加(P<0.05),分别增加了34.32%和19.72%,并与正常对照组相比差异不显著(P>0.05)(图 3)。DSS模型对照组和L. lactis组间小鼠结肠长度差异不显著(P>0.05)。上述结果说明口服表达pEGF的重组L. lactis抑制了小鼠结肠的缩短。
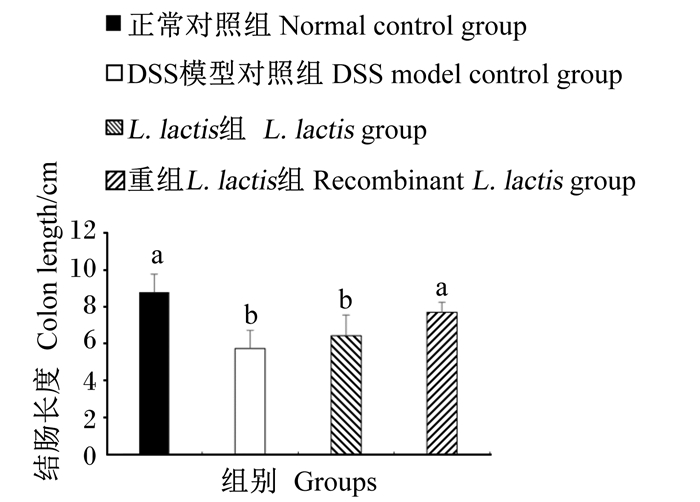
|
数据柱形标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。 Data values with the same letters mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05), and with different capital letters mean significant differrence (P < 0.01). 图 3 口服重组L. lactis对小鼠结肠长度的影响 Fig. 3 Effects of oral administration of recombinant L. lactis on colon length in mice |
HE染色结果(图 4)显示,正常对照组小鼠结肠结构清晰,黏膜层上皮细胞完整,未见脱落,未见炎症细胞浸润和溃疡等;DSS模型对照组小鼠结肠黏膜上皮细胞大量脱落,可见溃疡形成,较多的炎症细胞浸润,溃疡周边上皮细胞增生;L. lactis组小鼠结肠结构尚存在,黏膜层上皮细胞不完整,部分脱落,可见溃疡和少量炎症细胞浸润等;重组L. lactis组小鼠结肠黏膜上皮修复,未见糜烂和溃疡,仅见黏膜层内少量炎症细胞浸润。

|
组Ⅰ: 正常对照组normal control group;组Ⅱ: DSS模型对照组DSS model control group;组Ⅲ: L. lactis组L.lactis group;组Ⅳ: 重组L. lactis组recombinant L. lactis group。 图 4 口服重组L. lacits对小鼠结肠组织形态的影响 Fig. 4 Effects of oral administration of recombinant L. lactis on colonic morphology in mice (50×) |
由表 1可知,与正常对照组相比,DSS模型对照组小鼠结肠occludin浓度显著降低(P < 0.05),降低了30.43%,D-LAC浓度显著增加(P < 0.05),DAO活性极显著升高(P < 0.01),分别升高了60.81%和56.48%。与DSS模型对照组相比,L. lactis组小鼠结肠DAO活性、D-LAC和occludin浓度均差异不显著(P>0.05);重组L. lacits组小鼠结肠occludin浓度显著增加(P < 0.05),增加了40.63%,D-LAC浓度显著降低(P < 0.05),DAO活性极显著降低(P < 0.01),分别降低了36.13%和26.03%。重组L. lacits组小鼠结肠D-LAC浓度和DAO活性均显著低于L. lacits组(P < 0.05),分别降低了29.62%和17.27%。
|
|
表 1 口服重组L. lactis对小鼠结肠通透性相关指标及细胞因子浓度的影响 Table 1 Effects of oral administration of recombinant L. lactis on colonic permeability indexes and cytokine concentrations in mice |
由表 1可知,与正常对照组相比,DSS模型对照组小鼠结肠IL-10浓度极显著降低(P < 0.01),IL-4浓度显著降低(P < 0.05),分别降低了32.19%和21.94%,TNF-α浓度极显著增加(P < 0.01),增加了29.37%。与DSS模型对照组相比,L. lacits组小鼠结肠IL-10浓度极显著增加(P < 0.01),增加了36.21%,而IL-4和TNF-α浓度均差异不显著(P>0.05);重组L. lacits组小鼠结肠IL-10浓度极显著增加(P < 0.01),IL-4浓度显著增加(P < 0.05),分别增加了58.87%和27.86%,结肠TNF-α浓度有降低的趋势。与正常对照组和L. lactis组相比,重组L. lacits组小鼠结肠TNF-α、IL-10和IL-4浓度均差异不显著(P>0.05)。
3 讨论EGF是一种重要的细胞调控因子,可促进肠道上皮细胞增殖和分化,加速肠道创伤愈合,在消化道成熟、功能完善以及抵抗应激方面发挥重要作用。EGF具有较高的稳定性,对热、酸具有耐受性,能抵抗胃蛋白酶、胰蛋白酶和糜蛋白酶的消化,这对其在肠道发挥生物学作用具有重要意义[5]。然而,有限的来源是限制EGF在畜牧领域研究及应用的主要原因,基因工程是获得EGF的好方法。目前,已有报道采用大肠埃希菌(Escherichia coli,E. coli)和毕赤酵母(Pichia pastoris, P. pastoris)系统表达pEGF。Lee等[15]采用P. pastoris成功表达pEGF,并将pEGF分泌于上清液中。贺超等[16]构建了1、2和3个pEGF拷贝数的原核重组表达质粒,不同质粒转化E. coli后均表达了pEGF。但是采用E. coli表达pEGF多以包涵体形式存在,需经过提取、纯化及复性等繁琐处理,且内毒素较难去除;而采用P. pastoris表达系统需要甲醇诱导,还需进一步加工脱毒处理。L. lactis作为宿主菌的优势在于它属于食品级微生物,表达的外源蛋白以可溶性形式存在,可保持天然构型,连同菌体一起可直接口服,具有安全、方便和经济等特点。因此,本试验采用L. lactis高效诱导表达系统,将3个拷贝数的pEGF基因序列串联并优化,成功构建了表达pEGF的重组L. lactis,并且重组pEGF以可溶性形式存在,Western blot分析显示重组蛋白能够与特异性抗体结合,初步证明L. lactis表达的pEGF具有生物活性。
本研究采用DSS诱导小鼠结肠炎模型,并同时给小鼠口服重组L. lactis,以进一步验证重组pEGF的生物活性及对损伤肠道的修复作用。DSS结肠炎模型是目前应用最广的一种肠炎模型,通过给小鼠饮用4~7 d的2%~5%DSS水溶液来造模,造模成功的结肠炎模型小鼠会出现腹泻、便血、结肠缩短现象,病理检测显示结肠多灶性溃疡,黏膜炎症明显[17]。在本研究中,饮用4%DSS溶液7 d后小鼠全部出现腹泻及便血现象,结肠明显缩短,组织病理检测发现结肠严重溃疡,黏膜上皮细胞大量脱落,较多炎症细胞浸润,说明结肠炎模型构建成功。而口服表达pEGF重组L. lacits小鼠个别出现水样稀便,结肠长度显著增加,HE染色发现小鼠结肠黏膜上皮修复,未见糜烂和溃疡,仅见黏膜层内少量炎症细胞浸润。EGF是一类对肠道黏膜有营养、成熟和治疗性作用的缩氨酸,具有促进肠上皮细胞增殖和分化,加速肠道创伤愈合的重要作用[18-19]。本课题组前期研究结果显示,皮下注射EGF可改善DSS结肠炎模型小鼠结肠组织形态,降低结肠损伤程度评分[20]。林军等[21]研究显示,给结肠炎模型大鼠注射EGF并联合饲喂谷氨酰胺,可增加组织营养和能量供给,抑制炎症反应,对结肠黏膜具有保护作用。在本研究中,小鼠口服表达pEGF的重组L. lacits抑制了小鼠结肠的缩短,修复了肠道黏膜损伤,维持了结肠上皮结构的相对完整性。
肠道不仅是营养物质消化吸收的场所,也是阻止肠腔内细菌、毒素等有害物质入侵体内的重要屏障,屏障功能的完整性是维持肠道正常功能和动物健康的关键因素。occludin是肠道细胞间紧密连接(tight junction,TJ)的主要结构蛋白,与TJ的组装、稳定性和肠道屏障功能密切相关,其浓度降低会导致肠道通透性增加、肠道屏障功能障碍等[22]。EGF具有保护肠道屏障功能完整性的作用。研究显示,给坏死性肠炎大鼠补充EGF,EGF可通过促进杯状细胞的成熟和黏液的产生来维持肠道损伤部位的完整性,调节肠道TJ蛋白的表达水平,改善肠道屏障功能[23]。把肠上皮细胞Caco-2暴露在甲醛溶液中,可增加Caco-2对菊糖和脂多糖的细胞旁通透性,降低occludin浓度,而补充EGF可阻止甲醛对TJ与黏合连接的破坏,提高occludin浓度[24]。在本研究中,小鼠饮用4%的DSS水溶液显著降低了结肠occludin浓度,而口服表达pEGF的重组L. lacits显著增加了小鼠结肠occludin浓度,并与正常对照组相比差异不显著,说明DSS增加了结肠的通透性,破坏了肠道的屏障功能,给小鼠口服表达pEGF的重组L. lacits可降低结肠的通透性,缓解DSS对肠道屏障功能的破坏,这个结果与HE染色结果相一致。
血清DAO活性和D-LAC浓度被认为是反映肠道机械屏障完整性和受损伤程度的重要指标[25]。DAO是肠道绒毛中具有高度活性的细胞内酶,在组胺及多胺代谢中起作用;D-LAC是肠道细菌发酵产生的代谢产物。正常情况下DAO和D-LAC主要存在肠道内,当肠道屏障功能受到损伤,黏膜通透性增加,肠道内的DAO和D-LAC则通过受损的黏膜释放到血液中,导致血清中DAO活性和D-LAC浓度升高。研究显示,DSS能够增加肠道通透性,诱导大鼠或小鼠血浆DAO活性和D-LAC浓度显著升高[26-27]。在本研究中,DSS模型对照组小鼠血清DAO活性极显著高于正常对照组,血清D-LAC浓度显著高于正常对照组,说明了小鼠饮用4%的DSS水溶液导致肠道黏膜损伤,肠道黏膜通透性增加,而口服重组L. lacits则显著降低了血清D-LAC浓度,极显著降低了血清DAO活性,进一步提示表达pEGF的重组L. lacits改善了肠道的通透性,对肠道屏障具有保护作用。
细胞因子在调节肠道免疫反应中发挥重要作用,促炎性细胞因子与抗炎性细胞因子间的平衡失调是导致肠道免疫机能障碍的主要原因。研究显示,小鼠自由饮用3%的DSS水溶液10 d,结肠白细胞介素-8(IL-8)浓度显著升高,IL-10浓度显著降低[28];大鼠口服3%的DSS水溶液8 d,结肠IL-4浓度显著降低,TNF-α浓度显著升高[29]。目前关于DSS结肠炎的具体致病机制仍不清楚,可能与巨噬细胞的功能失调、细胞因子浓度改变,以及DSS对结肠上皮的毒性作用等多种因素有关。研究显示,IL-10具有很强的免疫调节作用,可调节Th1和Th2细胞因子的平衡,有效抑制白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-12(IL-12)和TNF-α等促炎细胞因子的产生[30]。肠上皮细胞缺失IL-10,可导致肠道黏膜屏障损伤[31]。IL-4是由肥大细胞或活化的Th2细胞产生,可抑制细胞因子IL-6、IL-8、IL-1和TNF-α等的产生,随着IL-4浓度升高,炎症抑制的效果更显著[32]。TNF-α是结肠炎致病的关键细胞因子,通过表达黏附分子、凝血因子等启动细胞毒性、凋亡和急性期反应等发挥作用。在结肠炎早期抑制TNF-α产生,可减轻或阻止结肠炎的发生[33]。在本研究中,与正常对照组相比,DSS模型对照组小鼠结肠TNF-α浓度极显著升高,IL-10浓度极显著降低,IL-4浓度显著降低;口服表达pEGF的重组L. lactis改善了结肠中细胞因子浓度,极显著提高了IL-10浓度,显著提高了IL-4浓度,并有降低TNF-α浓度的趋势,并且上述细胞因子浓度与正常对照组比较差异不显著。这些结果说明L. lactis表达的pEGF具有良好的生物活性,可以调节TNF-α、IL-10和IL-4浓度达到正常水平,显著抑制了肠道炎症反应,对损伤的肠道具有修护作用。
4 结论本试验成功构建了表达pEGF的重组L. lactis,重组pEGF具有良好生物活性;结肠炎模型小鼠口服表达pEGF的重组L. lactis,可抑制结肠的缩短,改善结肠的形态结构和通透性,调节细胞因子浓度达到正常水平,维护肠道屏障功能的相对完整性,对损伤肠道具有修复作用。
| [1] |
JI F J, WANG L X, YANG H S, et al. The roles and functions of glutamine on intestinal health and performance of weaning pigs[J]. Animal, 2019, 13(11): 2727-2735. DOI:10.1017/S1751731119001800 |
| [2] |
MOESER A J, KLOK C V, RYAN K A, et al. Stress signaling pathways activated by weaning mediate intestinal dysfunction in the pig[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2007, 292(1): G173-G181. DOI:10.1152/ajpgi.00197.2006 |
| [3] |
YIN J, LI F N, KONG X F, et al. Dietary xylo-oligosaccharide improves intestinal functions in weaned piglets[J]. Food & Function, 2019, 10(5): 2701-2709. |
| [4] |
HARDWICKE J, SCHMALJOHANN D, BOYCE D, et al. Epidermal growth factor therapy and wound healing-past, present and future perspectives[J]. The Surgeon, 2008, 6(3): 172-177. DOI:10.1016/S1479-666X(08)80114-X |
| [5] |
刘淑杰, 徐子伟, 齐珂珂, 等. 表皮生长因子对肠道功能调控的研究[J]. 动物营养学报, 2014, 26(3): 565-570. LIU S J, XU Z W, QI K K, et al. Regulation of epidermal growth factor on intestinal functions[J]. Chinese Journal of Animal Nutrition, 2014, 26(3): 565-570 (in Chinese). DOI:10.3969/j.issn.1006-267x.2014.03.002 |
| [6] |
WANG S J, GUO C H, ZHOU L, et al. Comparison of the biological activities of Saccharomyces cerevisiae-expressed intracellular EGF, extracellular EGF, and tagged EGF in early-weaned pigs[J]. Applied Microbiology and Biotechnology, 2015, 99(17): 7125-7135. DOI:10.1007/s00253-015-6468-6 |
| [7] |
LIU C Q, SU P, KHUNAJAKR N, et al. Development of food-grade cloning and expression vectors for Lactococcus lactis[J]. Journal of Applied Microbiology, 2005, 98(1): 127-135. DOI:10.1111/j.1365-2672.2004.02441.x |
| [8] |
STEIDLER L, VANDENBROUCKE K. Genetically modified Lactococcus lactis: novel tools for drug delivery[J]. International Journal of Dairy Technology, 2006, 59(2): 140-146. DOI:10.1111/j.1471-0307.2006.00255.x |
| [9] |
NADERI-SAMANI M, SOLTANI M, DADAR M, et al. Oral immunization of trout fry with recombinant Lactococcus lactis NZ3900 expressing G gene of viral hemorrhagic septicaemia virus (VHSV)[J]. Fish & Shellfish Immunology, 2020, 105: 62-70. |
| [10] |
SING S S, LI P F, ZHANG J H, et al. Oral vaccine of recombinant Lactococcus lactis expressing the VP1 protein of duck hepatitis A virus type 3 induces mucosal and systemic immune responses[J]. Vaccine, 2019, 37(31): 4364-4369. DOI:10.1016/j.vaccine.2019.06.026 |
| [11] |
刘秦华, 邵涛, 董志浩, 等. β-1, 4-葡聚糖内切酶egl3基因在乳酸乳球菌中分泌表达的研究[J]. 中国科技论文, 2017, 12(6): 633-638. LIU Q H, SHAO T, DONG Z H, et al. Research of β-1, 4-endoglucanase gene secreting expression in Lactococcus lactis subsp.lactis MG1363[J]. China Science Paper, 2017, 12(6): 633-638 (in Chinese). DOI:10.3969/j.issn.2095-2783.2017.06.007 |
| [12] |
周颖, 高晓峰, 刘飞, 等. L-乳酸脱氢酶基因在乳酸乳球菌KLDS4.0325中的表达[J]. 现代食品科技, 2015, 31(4): 63-68. ZHOU Y, GAO X F, LIU F, et al. Variations in the expression of the L-lactate dehydrogenase gene during the different phases of Lactococcus lactis KLDS4.0325 Growth[J]. Modern Food Science and Technology, 2015, 31(4): 63-68 (in Chinese). |
| [13] |
LIU S J, LI Y M, DENG B, et al. Recombinant Lactococcus lactis expressing porcine insulin-like growth factor Ⅰ ameliorates DSS-induced colitis in mice[J]. BMC Biotechnology, 2016, 16: 25. DOI:10.1186/s12896-016-0255-z |
| [14] |
宋丽影, 邵怡岚, 李雪纯, 等. 表达牛乳铁蛋白肽的重组乳酸乳球菌对雏鸡抗鸡白痢沙门氏菌感染的效果研究[J]. 中国预防兽医学报, 2017, 39(3): 206-209. SONG L Y, SHAO Y L, LI X C, et al. Effect of recombinant Lactococcus lactis expressing bovine lactoferrin peptide against Salmonella pullorum infection in chicken[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(3): 206-209 (in Chinese). |
| [15] |
LEE D N, KUO T Y, CHEN M C, et al. Expression of porcine epidermal growth factor in Pichia pastoris and its biology activity in early-weaned piglets[J]. Life Sciences, 2006, 78(6): 649-654. DOI:10.1016/j.lfs.2005.05.067 |
| [16] |
贺超, 邓璐, 汤承, 等. 猪表皮生长因子在大肠杆菌中的串联表达[J]. 西南民族大学学报(自然科学版), 2015, 41(2): 144-149. HE C, DENG L, TANG C, et al. Expression of tandem repeats of porcine epidermal growth factor in Escherichia coli[J]. Journal of Southwest University for Nationalities (Natrual Science Edition), 2015, 41(2): 144-149 (in Chinese). |
| [17] |
温红珠, 郝微微, 李佳, 等. 葡聚糖硫酸钠结肠炎模型影响因素的研究进展[J]. 世界华人消化杂志, 2011, 19(36): 3666-3671. HNONG Z W, WEI W H, JIA L, et al. Factors influencing the development of animal models of dextran sulphate sodium-induced colitis[J]. Journal of Clinical Investigation, 2011, 19(36): 3666-3671 (in Chinese). |
| [18] |
CLATK J A, LANE R H, MACLENNAN N K, et al. Epidermal growth factor reduces intestinal apoptosis in an experimental model of necrotizing enterocolitis[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2005, 288(4): G755-G762. DOI:10.1152/ajpgi.00172.2004 |
| [19] |
TANG X P, LIU H, YANG S F, et al. Epidermal growth factor and intestinal barrier function[J]. Mediators of Inflammation, 2016, 2016: 1927348. DOI:10.1155/2016/1927348 |
| [20] |
刘淑杰, 邓波, 徐子伟. 表皮生长因子对葡聚糖硫酸钠诱导的结肠炎模型小鼠肠道损伤的修复研究[J]. 动物营养学报, 2016, 28(6): 1735-1741. LIU S J, DENG B, XU Z W. Study on intestinal damage repair of epidermal growth factor on dextra sulfate sodium-induced colitis in mice[J]. Chinese Journal of Animal Nutrition, 2016, 28(6): 1735-1741 (in Chinese). DOI:10.3969/j.issn.1006-267x.2016.06.014 |
| [21] |
林军, 邓长生, 陈德基. 表皮生长因子与谷氨酰胺对大鼠乙酸性结肠炎的影响[J]. 中国病理生理杂志, 1997, 13(3): 278-281. LIN J, CHEN D J. Effect of epidermal growth factor and glutamine on acetic acid-induced colitis in rats[J]. Chinese Journal of Pathophysiology, 1997, 13(3): 278-281. (in Chinese) |
| [22] |
MIR H, MEENA A S, CHAUDHRY K K, et al. Occludin deficiency promotes ethanol-induced disruption of colonic epithelial junctions, gut barrier dysfunction and liver damage in mice[J]. Biochimica et Biophysica Acta: General Subjects, 2016, 1860(4): 765-774. DOI:10.1016/j.bbagen.2015.12.013 |
| [23] |
CLARK J A, DOELLE S M, HALPERN M D, et al. Intestinal barrier failure during experimental necrotizing enterocolitis: protective effect of EGF treatment[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2006, 291(5): G938-G949. DOI:10.1152/ajpgi.00090.2006 |
| [24] |
SHETH P, SETH A, THANGAVEL M, et al. Epidermal growth factor prevents acetaldehyde-induced paracellular permeability in Caco-2 cell monolayer[J]. Alcoholism-Clinical and Experimental Research, 2004, 28(5): 797-804. DOI:10.1097/01.ALC.0000125358.92335.90 |
| [25] |
胡红莲, 高民. 肠道屏障功能及其评价指标的研究进展[J]. 中国畜牧杂志, 2012, 48(17): 78-82. HU H L, GAO M. Research advance in intestinal barrier function and evaluation index[J]. Chinese Journal of Animal Science, 2012, 48(17): 78-82 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.17.021 |
| [26] |
黄婧渝, 农辉, 裴羡, 等. 四君子汤对溃疡性结肠炎小鼠模型肠黏膜屏障的作用机制[J]. 世界华人消化杂志, 2015, 23(27): 4326-4334. HUANG Q Y, NONG H, PEI X, et al. Mechanism underlying effect of Sijunzi decoction on intestinal mucosal barrier of mice with ulcerative colitis[J]. World Chinese Journal of Digestology, 2015, 23(27): 4326-4334 (in Chinese). |
| [27] |
WNAG R Q, WU G T, DU L D, et al. Semi-bionic extraction of compound turmeric protects against dextran sulfate sodium-induced acute enteritis in rats[J]. Journal of Ethnopharmacology, 2016, 192: 288-300. |
| [28] |
刘力, 张欢, 马文军. 马齿苋水煎剂对溃疡性结肠炎小鼠结肠组织中IL-8、IL-10表达的影响[J]. 辽宁中医药大学学报, 2012, 30(5): 18-20. LIU L, ZHANG H, MA W J. Effects of purslane water decoction on IL-8, IL-10 in colon tissue of ulcerative colitis in mice[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2012, 30(2): 78-81 (in Chinese). |
| [29] |
肖娴, 李秀琼, 刁建新, 等. 白芍总苷对葡聚糖硫酸钠致大鼠实验性结肠炎作用机制研究[J]. 佛山科学技术学院学报(自然科学版), 2012, 30(2): 78-81. XIAO X, LI X Q, DIAO J X, et al. Effects of tatol glucosides of paeony on rats' ulcerative colitis caused by dextran sulfate sodium[J]. Journal of Foshan University (Natural Science Edition), 2012, 30(2): 78-81 (in Chinese). DOI:10.3969/j.issn.1008-0171.2012.02.018 |
| [30] |
顾秋平, 白爱平. 白介素-10与炎症性肠病[J]. 世界华人消化杂志, 2011, 19(1): 57-61. GU Q P, BAI A P. Interleukin-10 and inflammatory bowel disease[J]. World Chinese Journal of Digestology, 2011, 19(1): 57-61 (in Chinese). |
| [31] |
JARRY A, BOSSARD C, BOU-HANNA C, et al. Mucosal IL-10 and TGF-beta play crucial roles in preventing LPS-driven, IFN-gamma-mediated epithelial damage in human colon explants[J]. Journal of Clinical Investigation, 2008, 118(3): 1132-1142. |
| [32] |
沈天天, 吴建新. 炎症性肠病与抗炎细胞因子[J]. 中华消化杂志, 2011, 31(2): 138-141. SHEN T T, WU J X. Inflammatory bowel disease and anti-inflammatory cytokines[J]. Chinese Journal of Digestion, 2011, 31(2): 138-140 (in Chinese). DOI:10.3760/cma.j.issn.0254-1432.2011.02.021 |
| [33] |
郑萍, 牛凤丽, 刘文忠, 等. 氧化苦参碱对葡聚糖硫酸钠诱导大鼠结肠炎的抗炎作用机制研究[J]. 中华消化杂志, 2003, 23(4): 207-210. ZHENG P, NIU F L, LIU W Z, et al. Study on the anti-inflammatory mechanism of oxymatrine in dextran sulfate sodium induced colitis of rats[J]. Chinese Journal of Digestion, 2003, 23(4): 207-210 (in Chinese). DOI:10.3760/j.issn:0254-1432.2003.04.004 |




