2. 韩国忠北国立大学动物生命科学学院, 清州361-763;
3. 韩国江原国立大学校动物生命科学学院, 春川200-701
2. College of Animal Life Sciences, Chungbuk National University, Cheongju 361-763, South Korea;
3. College of Animal Life Sciences, Gangwon National University, Chuncheon 200-701, South Korea
大量研究表明,油酸(OA)的生理作用已经远远超越了作为能量的作用,比如在调节细胞代谢、炎症、组织发育等方面[1-2]。Δ9位置的单个顺式双键使OA具有很高的溶解脂质的能力[3],实际上,OA是质膜流动性的主要决定因素[4],而质膜流动性显然与细胞间相互作用、膜转运和信号传递等重要功能有关。此外,OA可以直接与蛋白质结合,这被认为是许多细胞类型生长和分化的重要步骤[5]。OA可以调节脂质代谢[6],它整合在膜结构中,直接参与膜磷脂的脂肪酸组成。OA影响许多酶的运输和受体活性,以及必需脂肪酸的去饱和[7]。杨建梅等[8]发现,OA能够促进大鼠脂肪细胞的脂肪生成,并且是脂肪生成的一种重要的调控物质。宋沙等[9]研究发现,OA能提高肾周前脂肪细胞的数量,并且能够显著提高细胞内脂肪的含量以及脂肪酸合成酶(FAS)的活性。
骨骼肌卫星细胞通常以静息状态存在于肌纤维肌膜和基底膜之间,而不进行有丝分裂,即使在某些特定的情况下,也只有有限的基因表达和蛋白合成。随着研究的深入,人们对卫星细胞有了进一步的了解,发现肌卫星细胞可分化成为多种细胞,肌卫星细胞才被证实是具有多能性的干细胞。肌卫星细胞在不同的条件下可诱导分化为神经细胞、成骨细胞、心肌细胞等[10-11],说明肌卫星细胞是拥有自我更新能力的多能干细胞。Li等[12]用OA在过氧化物酶体增殖物激活受体γ(PPARγ)激动剂缺失的情况下增加牛肌肉卫星细胞的成脂基因表达,表明OA可促进PPARγ与受体结合,有效地增加卫星细胞中的成脂基因表达。闫研等[13]在添加环格列酮激活PPARγ对延边黄牛骨骼肌卫星细胞成脂转分化的影响中发现,环格列酮可以促进牛骨骼肌卫星细胞向脂肪细胞分化。张军芳等[14]验证不同种类脂肪酸对延边黄牛骨骼肌卫星细胞成脂转分化的影响中,发现添加脂肪酸可以诱导延边黄牛骨骼肌卫星细胞向脂肪细胞转分化。因此,为了明确OA是如何诱导延边牛骨骼肌卫星细胞向成脂方向分化,本试验通过转录组测序技术对OA诱导延边牛骨骼肌卫星细胞成脂分化途径相关基因进行分析,采用生物信息学方法筛选与分析差异表达基因(DEGs),并对这些DEGs进行注释与富集分析,为进一步研究OA引起延边牛骨骼肌卫星细胞成脂分化途径的分子调控机制提供分子理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验细胞来源试验所用的延边牛骨骼肌卫星细胞来源于12日龄犊牛,由延边大学东北寒区肉牛科技创新教育部工程研究中心分离鉴定并保存。
1.1.2 试验主要试剂及仪器DMEM高糖培养液、澳洲胎牛血清(FBS)、胰蛋白酶(0.25%)、马血清(HS)购自Gibco公司;油红O染色试剂盒、青链霉素混合液(PS)、磷酸盐缓冲液(PBS)购自Solarbio公司;OA购自Sigma公司;牛脂联素酶联免疫分析试剂盒购自Millibo公司;反转录和实时荧光定量试剂盒购自天根生化科技(北京)有限公司;实时荧光定量PCR仪(型号Mx3005P)购自Agilent公司。
1.1.3 OA及分化培养液的配制参照Li等[12]配制OA浓缩液及培养液。
OA浓缩液:无菌吸取0.793 mL OA加入到24.207 mL无水乙醇中,混匀,至浓度为100 mmol/L保存备用。
诱导分化培养液:无菌取5% HS和1% PS与97% DMEM混匀,4 ℃保存。
基础培养液:无菌取10% FBS和1% PS与89% DMEM混匀,4 ℃保存。
1.2 延边牛骨骼肌卫星细胞的诱导分化将保存于液氮中的细胞复苏后接种于细胞培养瓶中,置于37 ℃、5%的二氧化碳(CO2)培养箱中培养,每隔24 h更换1次细胞基础培养液。待骨骼肌卫星细胞生长密度达到80%后,用0.25%胰蛋白酶进行消化处理,传至8块6孔板中,分为4组,每孔加入基础培养液继续培养,待6孔板密度达到90%时,吸除培养液,用含1% PS的PBS清洗2遍,加入提前配制好的含有不同浓度OA的诱导分化培养液,进行分化处理。试验设1个空白对照组(CON组,5% HS),3个不同浓度OA诱导组:OAL组(5% HS+50 μmol/L OA)、OAM组(5% HS+100 μmol/L OA)、OAH组(5% HS+200 μmol/L OA),每组2块6孔板,每2 d换1次液,分化96 h,收集细胞及培养液用于后续试验。
1.3 油红O染色及脂滴面积分析骨骼肌卫星细胞分化96 h后,去除培养液,PBS清洗3遍,参照Li等[12]方法进行油红O染色,具体操作按照Solarbio公司的油红O染色试剂盒说明书进行。显微镜下镜检拍照,取拍好的油红O染色图片,利用Image J软件(Rawak Software, Inc., 德国)分析脂滴面积,用Graph Pad Prism 6.07软件(GraphPad Software Inc., 美国)进行分析作图,每个组随机选取12张图片。
1.4 脂联素(ADP)含量测定ADP是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,通过测定ADP含量可以作为鉴定成脂分化的一项指标。骨骼肌卫星细胞分化96 h后,参照Li等[12]方法用Millibo牛脂联素酶联免疫分析试剂盒进行ADP含量的测定,具体操作按照说明书进行。绘制标准曲线计算样品含量,用Graph Pad Prism 6.07软件进行分析作图。
1.5 转录组学测序分析为了分析延边牛骨骼肌卫星细胞成脂转分化过程中的差异表达基因,不同浓度OA诱导96 h后,加1 mL Trizol于CON组、OAL组、OAM组、OAH组中,将裂解下的细胞放于无菌EP管中,每组3个重复,低温保存运输,交由爱默基因公司测序分析。主要试验过程包括:总RNA提取,文库构建与检测,测序数据质控过滤,参考基因组比对,差异表达基因通过GO数据库和KEGG进行富集分析。KEGG-GO富集分析采用R: clusterProfiler 3.10.0软件(http://bioconductor.org/)进行分析。
1.6 实时荧光定量PCR验证用实时荧光定量PCR验证转录组测序分析结果。诱导分化96 h后提取总RNA,利用反转录试剂盒进行cDNA合成,利用实时荧光定量试剂盒进行基因定量检测,引物由生工生物工程(上海)股份有限公司合成,序列见表 1。每个待测样品设置3个重复,反应程序为:95 ℃预变性15 min;95 ℃变性10 s,55 ℃退火30 s,72 ℃延伸32 s,35个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
|
|
表 1 引物信息 Table 1 Primer information |
数据采用平均值±标准差表示,使用Excel 2010软件,用2-ΔΔCt数学模型对荧光定量PCR数据进行计算。采用Graphpad 6.0软件对试验数据进行单因素方差分析和多重比较,P < 0.05为差异显著。
2 结果与分析 2.1 不同浓度OA对延边牛骨骼肌卫星细胞脂滴形成的影响不同浓度OA诱导牛骨骼肌卫星细胞96 h后,油红O染色观察细胞内脂滴情况(图 1)。结果显示:CON组肌管形成明显,细胞间排列紧密,且无脂滴生成,OA组均可明显见到细胞核周围有大量的红色脂滴,随着培养时间的延长更为明显,并伴有不同程度的脂滴融合现象,且脂滴大小伴有剂量依赖关系,细胞逐渐变为圆形脂肪细胞形态。

|
图 1 各组细胞油红O染色 Fig. 1 Oil red O staining of cells in each group (200×) |
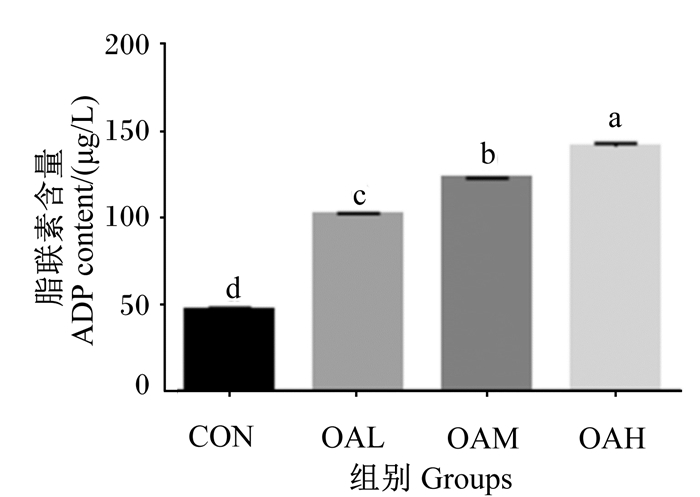
不同浓度OA诱导96 h以后,收集细胞培养液进行ADP含量测定,结果如图 2所示,与CON组相比,各诱导组中均有ADP的产生,而且ADP含量显著增加(P<0.05),并且各诱导组间差异显著(P<0.05)。
|
数据柱标注不同字母表示差异显著(P<0.05)。图 11同。 Data column with different letters mean significant difference (P < 0.05). The same as Fig. 11. 图 2 不同浓度OA对延边牛骨骼肌卫星细胞中ADP含量的影响 Fig. 2 Effects of different concentrations of OA on ADP content in Yanbian bovine skeletal muscle satellite cells |
测序产生的原始数据(raw data),通过Fastp软件过滤掉不合格的序列后得到有效数据(clean data),分别进行统计后发现符合过滤条件的reads(PF)大于92%以上,过滤后reads大于Q30的比例在84%以上,4组的序列数据中GC含量分别为0.55、0.56、0.55、0.55,共得到13 951条单基因,表明数据质量符合进一步生物信息分析的需求(表 2)。
|
|
表 2 测序数据质量评估 Table 2 Assessment of sequencing data quality |
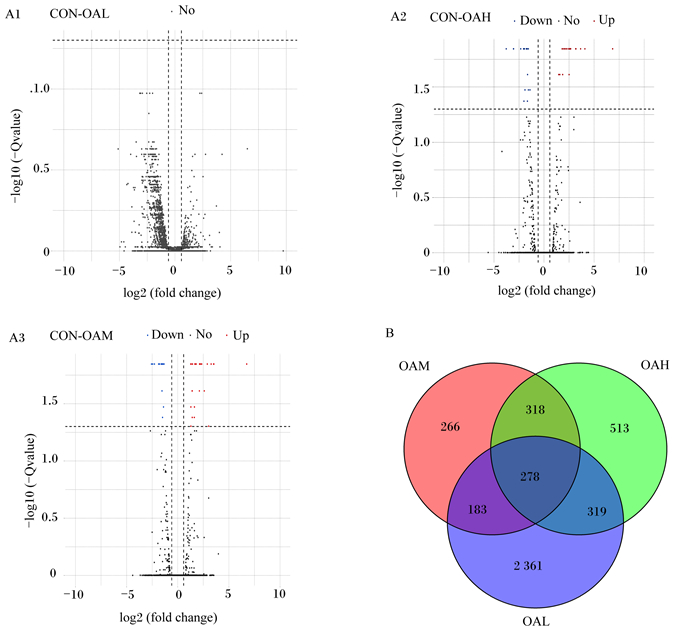
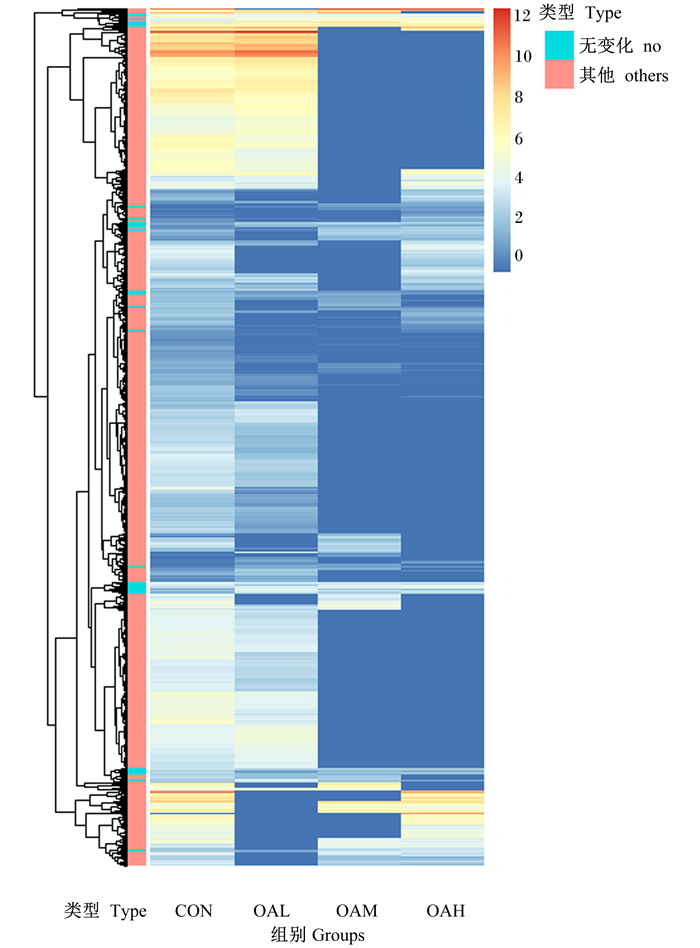
经OA诱导延边牛骨骼肌卫星细胞96 h后,差异基因分析结果显示(图 3-A),与CON组相比,OAL组有3 412个差异表达基因,其中1 168个基因相对上调和1 973个基因相对下调;OAM组有1 045个差异表达基因,其中463个基因相对上调和582个基因相对下调;OAH组有1 428个差异表达基因,其中704个基因相对上调和724个基因相对下调;如韦恩图所示,将这些差异基因结果综合分析后发现,延边牛骨骼肌卫星细胞用不同浓度OA分化处理后,有278个差异表达基因(图 3-B),对其进行聚类分析如图 4所示,其中横坐标为样本,纵坐标为基因,不同的颜色表示不同的基因表达水平,颜色由蓝色经由黄白色至红色表示表达量标准化后的表达了从低到高,颜色相近的基因表达模式相似,也说明它们可能有相似的功能,或者参与相似的调控通路,红色表示高表达基因,深蓝色表示低表达基因。
|
CON: CON组CON group;OAM:OAM组OAM group;OAH:OAH组OAH group;OAL:OAL组OAL group。Down:下调;No:无变化;Up: 上调;fold change:差值倍数 图A-1、2和3为差异表达基因分析的火山图,红色点代表上调基因,蓝色点代表下调基因,灰色点代表变化不显著基因;图B为差异表达基因韦恩图。 Figure A-1, 2 and 3 were a volcano map of differentially expressed genes analysis. Red dots represented up-regulated genes, blue dots represented down-regulated genes, and gray dots represented genes that had not changed significantly; Figure B was a Venn diagram of differentially expressed genes. 图 3 不同浓度OA诱导的差异表达基因 Fig. 3 Differentially expressed genes induced by different concentrations of OA |
|
图 4 不同浓度OA的DEGs的聚类热图分析 Fig. 4 Clustering heat map analysis of DEGs with different concentrations of OA |
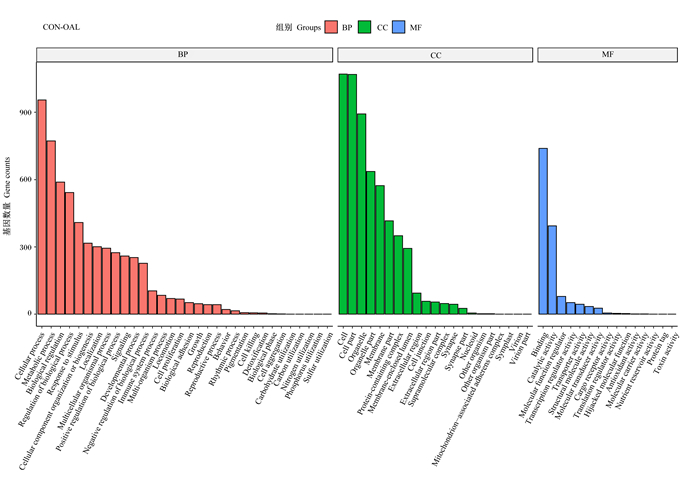
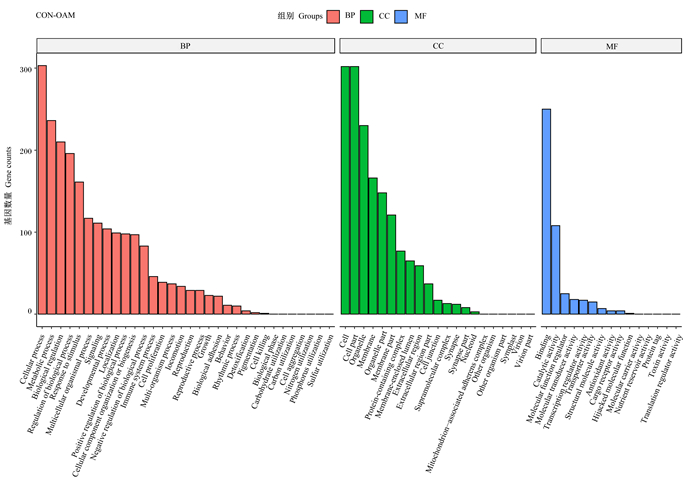
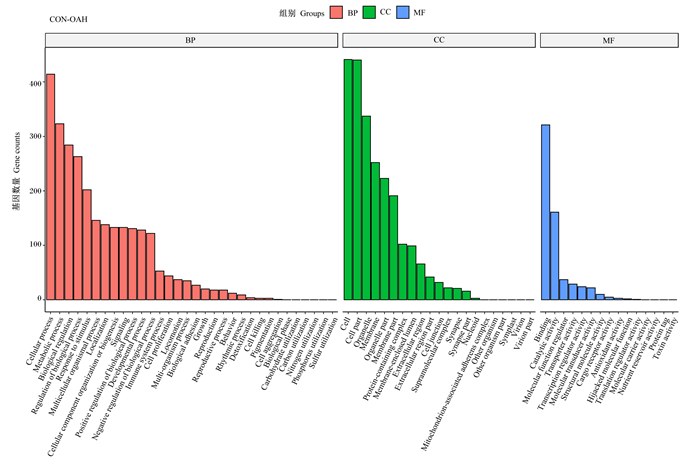
为探究这些DEGs的生物学功能,对不同浓度差异表达基因的GO富集结果进行分析,按照分子功能(MF)、生物过程(BP)和细胞组分(CC)进行GO分类,挑选每个GO分类中P值最小即富集最显著的前10个GO条目进行展示(图 5、图 6、图 7)。与CON组相比,试验组的差异表达基因参与了多种生物过程,包括细胞过程、代谢过程、生物调节过程等;在分子功能类别上,大多数的基因功能与结合活性、催化活性、分子功能调节活性等相关;在细胞组分范畴内,大部分的基因被富集到细胞、细胞部分、细胞器等。
|
Cellular process:细胞过程;Metabolic process:代谢过程;Biological regulation:生物调节;Regulation of biological process:生物过程调节;Response to stimulus:刺激反应;Cellular component organization or biogenesis:细胞组成、组织或生物形成;Localization:定位;Multicellular organismal process:多细胞生物过程;Positive regulation of biological process:生物过程正调控;Signaling:信号;Developmental process:发展过程;Negative regulation of biological process:生物过程负调控;Immune system process:免疫系统过程;Multi-organism process:多生物过程;Locomotion:移动;Cell proliferation:细胞增殖;Biological adhesion:生物黏附;Growth:生长;Reproduction:复制;Reproductive process:复制过程;Behavior:行为;Rhythmic process:节律过程;Pigmentation:色素沉着;Cell killing:细胞杀伤;Detoxification:解毒;Biological phase:生物相;Cell aggregation:细胞聚集;Carbohydrate utilization:碳水化合物利用;Carbon utilization:碳利用;Nitrogen utilization:氮利用;Phosphorus utilization:磷利用;Sulfur utilization:硫利用;Cell:细胞;Cell part:细胞部分;Organelle:细胞器;Organelle part:细胞器部分;Membrane:膜;Membrane part:膜部分;Protein-containing complex:蛋白质复合物;Membrane-enclosed lumen:膜封闭腔;Extracellular region:细胞外区域;Cell junction:细胞连接;Extracellular region part:细胞外区域部分;Supramolecular complex:超分子复合物;Synapse:突触;Synapse part:突触部分;Nucleoid:核质体;Other organism:其他生物;Other organism part:其他生物部分;Mitochondrion-associated adherens complex:线粒体相关黏附复合物;Symplast:共质体;Virion:病毒体;Virion part:病毒体部分。Binding:结合;Catalytic activity:催化活性;Molecular function regulator:分子功能调节活性;Transcription regulator activity:转录调节活性;Transporter activity:转运活性;Structural molecule activity:结构分子活性;Molecular transducer activity:分子传感器活性;Cargo receptor activity:运货受体活性;Translation regulator activity:翻译调节活性;Hijacked molecular function:劫持分子功能;Antioxidant activity:抗氧化活性;Molecular carrier activity:分子载体活性;Nutrient reservoir activity:营养储层活性;Protein tag:蛋白标签;Toxin activity毒素活性。图 6、图 7同 the same as Fig. 6 and Fig. 7。 图 5 OAL组差异表达基因的GO功能注释分类 Fig. 5 GO functional annotation classification of differentially expressed genes of OAL group |
|
图 6 OAM组差异表达基因的GO功能注释分类 Fig. 6 GO functional annotation classification of differentially expressed genes of OAM group |
|
图 7 OAH组差异表达基因的GO功能注释分类 Fig. 7 GO functional annotation classification of differentially expressed genes of OAH group |
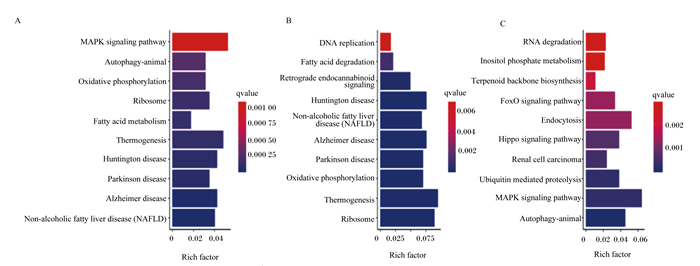
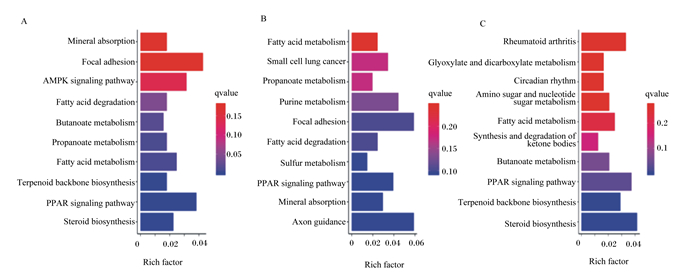
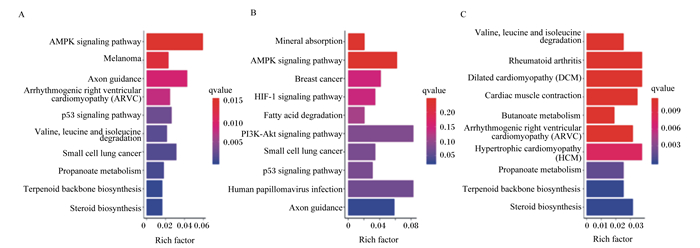
通过DEGs参与的主要生化代谢和信号转导途径进行KEGG富集分析探究,筛选出富集前10的通路。与CON组相比,OAL组差异基因有1 367个得到注释,这些基因共涉及86个通路,富集最主要的为丝裂原活化蛋白激酶(MAPK)信号通路、产热效应通路、脂肪酸代谢通路等,其中529个上调基因主要为产热效应通路、核糖体通路、脂肪酸降解通路等,838个下调基因为MAPK信号通路、胞吞作用通路、泛素介导的蛋白水解通路等;OAM组有444个得到注释,涉及35个通路,富集最主要的为PPAR信号通路、腺苷酸活化蛋白激酶(AMPK)信号通路、脂肪酸代谢通路等,203个上调基因主要为PPAR信号通路、脂肪酸降解通路、脂肪酸代谢通路等,241个下调基因主要为类固醇生物合成通路、PPAR信号通路、脂肪酸代谢通路等;OAH组有605个得到注释,涉及57个通路,富集最主要的为类固醇生物合成通路、MAPK信号通路、p53信号通路等,289个上调基因主要为p53信号通路、脂肪酸降解通路、MAPK信号通路等,316个下调基因主要为类固醇生物合成通路、萜类骨架的生物合成、丙酸酯代谢通路等(图 8、图 9、图 10)。
|
横轴表示富集系数,纵轴表示通路名称,图中显示的是不同浓度OA诱导的所有差异表达基因(A)、上调基因(B)、下调基因(C)富集前10的信号通路。图 9、图 10同。 Rich factor: 富集因子;MAPK signaling pathway:MAPK信号通路;Autophagy-animal:自噬-动物;Oxidative phosphorylation:氧化磷酸化;Ribosome:核糖体;Fatty acid metabolism:脂肪酸代谢;Thermogenesis:生热;Huntington disease:亨廷顿病;Parkinson disease:帕金森综合症;Alzheimer disease:阿尔茨海默病;Non-alcoholic fatty liver disease (NAFLD):非酒精性脂肪肝病。UP:DNA replication:DNA复制;Fatty acid degradation:脂肪酸降解;Retrograde endocannabinoid signaling:逆行内源性大麻素信号传导。DOWN:RNA degradation:RNA降解;Inositol phosphate metabolism:磷酸肌醇代谢;Terpenoid backbone biosynthesis:萜类骨架的生物合成;FoxO signaling pathway:FoxO信号通路;Endocytosis:胞吞作用;Hippo signaling pathway:Hippo信号通路;Renal cell carcinoma:肾细胞癌;Ubiquitin mediated proteolysis:泛素介导的蛋白水解。图 9、图 10同。The same as Fig. 9 and Fig. 10. The horizontal axis represented the enrichment coefficient, and the vertical axis represented the name of the pathway. The figure showed all the differentially expressed genes (A), the up-regulated genes (B), and the top 10 signal pathways of the down-regulated genes (C) induced by different concentrations of oleic acid. The same as Fig. 9 and Fig. 10. 图 8 OAL组差异表达基因KEGG富集分析 Fig. 8 Enrichment analysis of differentially expressed gene KEGG of OAL group |
|
Mineral absorption:矿物质吸收;Focal adhesion:黏附斑激酶;AMPK signaling pathway:AMPK信号通路;Butanoate metabolism:丁酸酯代谢;Propanoate metabolism:丙酸酯代谢;PPAR signaling pathway:PPAR信号通路;Steroid biosynthesis:类固醇生物合成。UP:Small cell lung cancer:小细胞肺癌;Purine metabolism:嘌呤代谢;Sulfur metabolism:硫代谢;Axon guidance轴突导向。DOWN:Glyoxylate and dicarboxylate metabolism:乙醛酸和二羧酸的代谢;Circadian rhythm:昼夜节律;Amino sugar and nucleotide sugar metabolism:氨基糖和核苷酸糖代谢;Synthesis and degradation of ketone bodies:酮体的合成与降解。 图 9 OAM组差异表达基因KEGG富集分析 Fig. 9 Enrichment analysis of differentially expressed gene KEGG of OAM group |
|
Melanoma:黑色素瘤;Arrhythmogenic right ventricular cardiomyopathy (ARVC):心律失常性右室心肌病;p53 signaling pathway:p53信号通路;Valine, leucine and isoleucine degradation:缬氨酸、亮氨酸和异亮氨酸降解。UP:Breast cancer:乳腺癌;HIF-1 signaling pathway:HIF-1信号通路;PI3K-Akt signaling pathway:PI3K-Akt信号通路;Human papillomavirus infection:人乳头瘤病毒感染;Axon guidance:轴突导向。DOWN:Rheumatoid arthritis:类风湿关节炎;Dilated cardiomyopathy (DCM):扩张型心肌病;Cardiac muscle contraction:心肌收缩;Hypertrophic cardiomyopathy (HCM):肥厚型心肌病。 图 10 OAH组差异表达基因KEGG富集分析 Fig. 10 Enrichment analysis of differentially expressed gene KEGG of OAH group |
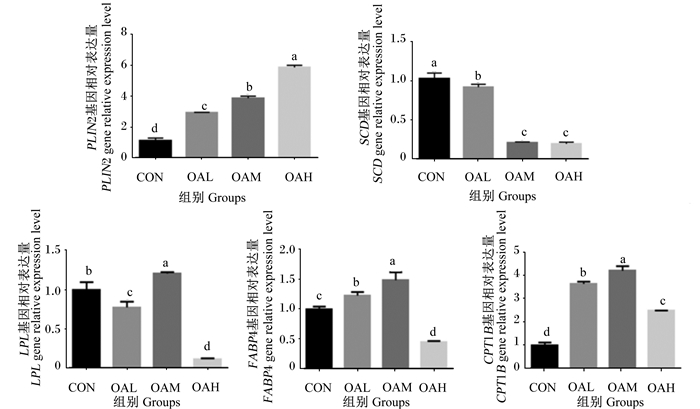
经OA处理后,不同浓度的差异表达基因富集的通路发生了变化,对差异基因的富集分析结果显示,差异基因主要富集在MAPK信号通路、PPAR信号通路、AMPK信号通路、脂肪酸代谢通路等,而PPAR信号通路与脂代谢关系密切,在脂肪生成、脂质代谢中起着关键作用,是调节机体能量代谢和脂肪酸氧化的关键因子,而OA是PPAR系统的天然配体,结合富集分析结果和脂肪细胞分化相关的主要代谢通路,为了检验转录组测序数据的准确性,从PPAR代谢通路中筛选出5个脂肪细胞分化相关候选基因脂肪分化相关蛋白2(PLIN2)、硬脂酰辅酶A去饱和酶(SCD)、脂蛋白脂酶(LPL)、脂肪细胞型脂肪酸结合蛋白4(FABP4)、肉碱棕榈酰转移酶1B(CPT1B)(表 3),利用实时荧光定量PCR对转录组数据进行验证,结果如图 11所示,实时荧光定量PCR与转录组测序结果在0.05水平下相关性显著,基因的表达趋势基本一致,说明转录组所得FPKM(每千个碱基的转录每百万映射读取的碎片)值相对准确。
|
|
表 3 PPAR代谢通路中部分显著差异表达基因 Table 3 Some significantly differentially expressed genes in PPAR metabolic pathway |
|
PLIN2:脂肪分化相关蛋白2 adipose differentiation-related protein 2;SCD:硬脂酰辅酶A去饱和酶stearoyl-CoA desaturase;LPL:脂蛋白脂酶lipoprteinlipase;FABP4:脂肪细胞型脂肪酸结合蛋白4 adipocyte fatty acid binding protein 4;CPT1B:肉碱脂酰转移酶1B carnitine palmitoyl transferase 1B。 图 11 不同浓度OA转录组测序结果的实时荧光定量PCR验证 Fig. 11 qRT-PCR verification of transcriptome sequencing results of different concentrations of OA |
随着人们对牛肉的需求不断增加,对牛肉的品质和口味的要求也越来越高,尤其是大理石花纹样牛肉直接影响着口感和品质。肌肉的发育主要依赖于肌卫星细胞的增殖和分化,而肌卫星细胞在某些条件下可诱导分化为脂肪细胞,这为大理石花纹样牛肉的生产提供了理论依据,而近年来脂肪酸对细胞分化的影响作用一直为大家研究的热点,因此本试验基于以上原因进行研究,以期为OA引起延边牛骨骼肌卫星细胞成脂分化途径的分子调控机制提供理论依据。本试验最初设计OA处理骨骼肌卫星细胞诱导培养144 h,到144 h时观察到大多数骨骼肌卫星细胞在OA诱导后都充满了脂滴,培养到96 h后骨骼肌卫星细胞中的大多数脂滴都漂浮到培养孔的表面或者细胞变得非常脆弱脂滴轻易的破膜而出,导致无法收集包含脂滴的细胞进行油红O染色,因此,我们在96 h收获了细胞,进行油红O染色及后续试验。本试验在油红O染色后,OA诱导组中可明显见到红色脂滴,并伴有剂量依赖关系,CON组中则无脂滴生成,说明OA诱导了延边牛骨骼肌卫星细胞向成脂方向转化。
脂肪组织作为重要的内分泌器官,通过分泌多种激素在调节各种生理功能中起着至关重要的作用[15-18]。这些脂肪来源的激素(也称为脂肪细胞因子)分泌到循环系统中,以作为脂肪组织与其他组织器官之间的重要信使[19]。ADP是一种因其多效性而受到广泛关注的脂肪因子[20-24]。ADP基因表达的调控受到许多转录因子的严格控制[25],当ADP与其受体AdipoR1和R2结合后,会引发一系列依赖于组织的信号转导事件[26-27],包括AMPK和p38丝裂原激活的蛋白激酶(p38 MAPK)的磷酸化,以及增加过氧化物酶体增殖物激活的受体α(PPARα)的配体活性[28-31]。由此可说明ADP的生成与AMPK、MAPK、PPAR等信号通路有着密切的关系,这从DEGs的KEGG富集分析中也可证明这点。
本试验通过对OA诱导延边牛骨骼肌卫星细胞成脂转分化过程中的DEGs进行GO功能注释和KEGG富集分析,结果表明差异表达基因主要注释到生物过程中的细胞过程、代谢过程、多细胞生物过程、生物调节等,细胞组成中的细胞、细胞部分、细胞器、细胞器的部分、膜、膜部分等;KEGG富集分析表明差异表达基因主要富集的通路为AMPK信号通路、PPAR信号通路、脂肪酸代谢、脂肪酸降解等通路。AMPK信号通路在激活后,主要参与调控蛋白质代谢、脂质代谢、糖类代谢以及自噬和线粒体稳态[32],PPAR信号通路主要参与调控脂肪酸代谢、糖代谢、细胞增殖与分化等[33]。通过KEGG-GO功能注释和富集分析,说明添加OA后激发了各类代谢通路以促进骨骼肌卫星细胞向成脂方向分化,这可能与OA调节了磷脂酰乙醇胺(PE)脂质上的膜结构,引起负膜曲率应变(促进六边形HII相)[4],从而引起一系列的生物反应有关。因为细胞膜主要由磷脂和蛋白质构成,磷脂是结构骨架,而PE是质膜中的主要磷脂种类[34]。PE是具有六边形HII相倾向性的脂质[4],六边形HII相倾向性的磷脂具有促进膜双层的融合和裂变[35-36]、膜通透性[37]、蛋白质运输[38]、伴侣蛋白样活性[34]的调控等;同时又参与许多细胞功能,如内吞(膜裂变)和胞外(膜-膜融合)过程的发展和膜蛋白活性的调节[37],因此,PE赋予膜的特殊特征对于膜的结构/功能至关重要,而OA的存在极大地促进了六边形HII相的倾向[4],其通过调节负膜曲率应变来促进HII相的形成。这种对膜结构的调节部分解释了OA对膜和细胞功能的调节:膜流动性、通透性、结构域形成,胞外/内吞作用,细胞分裂,信号转导,膜蛋白活性等,但具体的机制还需进一步研究。
PPAR有3种亚型,包括α、β(δ)、γ,其中PPARγ是脂质吸收与合成的关键调控因子,是目前为止唯一1个对脂肪的发育起到必不可少作用的转录因子[39-40]。目前认为,脂肪细胞的分化由CCAAT/增强子结合蛋白(C/EBP)、脂肪细胞分化决定因子1/固醇调控元件结合蛋白1(ADDl/SREBPl)及PPARγ/RXR异二聚体共同调控[41-42],PPARγ起核心作用[43],具有正向调节脂肪细胞分化的作用,并促进葡萄糖内环境稳定[44]。在有配体存在下,PPARγ通过与下游靶基因SCD、LPL、FABP、PLIN等启动子区的PPREs结合来调控一系列脂肪代谢特异性基因的表达,从而参与脂肪合成、转运和沉积等脂肪代谢的全过程[45-47],这和对转录组数据验证中脂肪细胞分化相关基因所相符。
4 结论添加OA后对延边牛骨骼肌卫星细胞的转录组测序分析发现,共得到13 951条单基因。对4个组差异表达基因进行比较发现,与CON组相比,OAL组、OAM组和OAH组分别有3 412、1 045和1 428个差异表达基因,共同差异表达基因有278个。GO富集分析显示,差异基因主要参与了代谢过程、细胞过程、生物调节过程,其基因功能与结合活性、转录调节活性、催化活性等相关,大部分的基因被富集到细胞、细胞器、膜等。同时,KEGG富集分析表明差异表达基因主要富集通路为AMPK信号通路、PPAR信号通路、脂肪酸代谢和降解通路等。不同浓度OA差异基因荧光定量PCR结果显示,所选的5个差异基因与转录组测序结果基本一致,表明了测序结果的可靠性。
| [1] |
LEE H, PARK W J. Unsaturated fatty acids, desaturases, and human health[J]. Journal of Medicinal Food, 2014, 17(2): 189-197. DOI:10.1089/jmf.2013.2917 |
| [2] |
HAN S, SCHROEDER E A, SILVA-GARCÍA C G, et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan[J]. Nature, 2017, 544(7649): 185-190. DOI:10.1038/nature21686 |
| [3] |
ROBINSON M D, CISTOLA D P. Nanofluidity of fatty acid hydrocarbon chains as monitored by benchtop time-domain nuclear magnetic resonance[J]. Biochemistry, 2014, 53(48): 7515-7522. DOI:10.1021/bi5011859 |
| [4] |
FUNARI S S, BARCELÓ F, ESCRIBÁ P V. Effects of oleic acid and its congeners, elaidic and stearic acids, on the structural properties of phosphatidylethanolamine membranes[J]. Journal of Lipid Research, 2003, 44(3): 567-575. DOI:10.1194/jlr.M200356-JLR200 |
| [5] |
RIOS-ESTEVES J, RESH M D. Stearoyl CoA desaturase is required to produce active, lipid-modified Wnt proteins[J]. Cell Reports, 2013, 4(6): 1072-1081. DOI:10.1016/j.celrep.2013.08.027 |
| [6] |
LU Y F, WU H L. Effect of monounsaturated fatty acids under fixed P/S and n-6/n-3 ratios on lipid metabolism in rats[J]. Journal of Nutritional Science and Vitaminology, 1994, 40(2): 189-200. DOI:10.3177/jnsv.40.189 |
| [7] |
GIRÓN M D, MATAIX F J, FAUS M J, et al. Effect of long-term feeding olive and sunflower oils on fatty acid composition and desaturation activities of liver microsomes[J]. Biochemistry International, 1989, 19(3): 645-656. |
| [8] |
杨建梅, 高妍, 李长红, 等. 游离脂肪酸、胰岛素对脂肪前体细胞分化的影响[J]. 北京医科大学学报, 1998, 30(3): 276-278. YANG J M, GAO Y, LI C H, et al. The effects of the free fatty acid and insulin on the preadipocyte different[J]. Journal of Beijing Medical University, 1998, 30(3): 276-278 (in Chinese). |
| [9] |
宋沙, 冯丽萍, 苏华维, 等. 油酸对肉牛肾周前脂肪细胞增殖与分化的影响[J]. 中国畜牧杂志, 2012, 48(5): 43-45. SONG S, FENG LP, SU H W, et al. Effects of oleic acid on proliferation and differentiation of prerenal adipocytes in beef cattle[J]. Chinese Journal of Animal Husbandry, 2012, 48(5): 43-45 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.05.011 |
| [10] |
李进, 洪光祥, 康皓, 等. 成年大鼠骨骼肌肌源性干细胞向神经细胞的分化[J]. 华中科技大学学报(医学版), 2008, 37(4): 443-444, 448. LI J, HONG G X, KANG H, et al. A pilot study on the differentiation of skeleton muscle-derived stem cells into neural cells[J]. Journal of Huazhong University of Science and Technology (Medical Edition), 2008, 37(4): 443-444, 448 (in Chinese). DOI:10.3870/j.issn.1672-0741.2008.04.006 |
| [11] |
王凡, 石钊. SD大鼠骨骼肌卫星细胞的成脂、成骨、成心肌样细胞的诱导[J]. 局解手术学杂志, 2009, 18(6): 442-443. WANG F, SHI Z. Induction of adipogenesis, osteogenesis and cardiomyocyte-like cells of skeletal muscle satellite cells in SD rats[J]. Journal of Regional Anatomy and Surgery, 2009, 18(6): 442-443 (in Chinese). |
| [12] |
LI X Z, YAN Y, ZHANG J F, et al. Oleic acid in the absence of a PPARγ agonist increases adipogenic gene expression in bovine muscle satellite cells[J]. Journal of Animal Science, 2019, 97(10): 4114-4123. DOI:10.1093/jas/skz269 |
| [13] |
闫研, 张军芳, 孙斌, 等. 添加环格列酮对延边黄牛骨骼肌卫星细胞成脂转分化的影响[J]. 中国畜牧兽医, 2020, 47(3): 714-721. YAN Y, ZHANG J F, SUN B, et al. Effect of ciglitazone on adipogenic transdifferentiation of skeletal muscle satellite cells in Yanbian yellow cattle[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(3): 714-721 (in Chinese). |
| [14] |
张军芳, 闫研, 崔岩, 等. 不同种类脂肪酸对延边黄牛骨骼肌卫星细胞成脂转分化的影响[J]. 中国畜牧兽医, 2020, 47(4): 992-999. ZHANG J F, YAN Y, CUI Y, et al. Effects of different Fatty acids on adipogenic and transdifferentiation of skeletal muscle satellite cells in Yanbian yellow cattle[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(4): 992-999 (in Chinese). |
| [15] |
FRÜHBECK G, GÓMEZ-AMBROSI J, MURUZÁBAL F J, et al. The adipocyte: a model for integration of endocrine and metabolic signaling in energy metabolism regulation[J]. American Journal of Physiology-Endocrinology and Metabolism, 2001, 280(6): E827-E847. DOI:10.1152/ajpendo.2001.280.6.E827 |
| [16] |
HAVEL P J. Update on adipocyte hormones: regulation of energy balance and carbohydrate/lipid metabolism[J]. Diabetes, 2004, 53(Suppl.1): S143-S151. |
| [17] |
RAJALA M W, SCHERER P E. Minireview: the adipocyte-at the crossroads of energy homeostasis, inflammation, and atherosclerosis[J]. Endocrinology, 2003, 144(9): 3765-3773. DOI:10.1210/en.2003-0580 |
| [18] |
TRAYHURN P. Endocrine and signalling role of adipose tissue: new perspectives on fat[J]. Acta Physiologica Scandinavica, 2005, 184(4): 285-293. DOI:10.1111/j.1365-201X.2005.01468.x |
| [19] |
WANG Z V, SCHERER P E. Adiponectin, the past two decades[J]. Journal of Molecular Cell Biology, 2016, 8(2): 93-100. DOI:10.1093/jmcb/mjw011 |
| [20] |
BERG A H, SCHERER P E. Adipose tissue, inflammation, and cardiovascular disease[J]. Circulation Research, 2005, 96(9): 939-949. DOI:10.1161/01.RES.0000163635.62927.34 |
| [21] |
KUBOTA N, TERAUCHI Y, YAMAUCHI T, et al. Disruption of adiponectin causes insulin resistance and neointimal formation[J]. Journal of Biological Chemistry, 2002, 277(29): 25863-25866. DOI:10.1074/jbc.C200251200 |
| [22] |
OKAMOTO Y, KIHARA S, OUCHI N, et al. Adiponectin reduces atherosclerosis in apolipoprotein E-deficient mice[J]. Circulation, 2002, 106(22): 2767-2770. DOI:10.1161/01.CIR.0000042707.50032.19 |
| [23] |
SHIMADA K, MIYAZAKI T, DAIDA H. Adiponectin and atherosclerotic disease[J]. Clinica Chimica Acta, 2004, 344(1/2): 1-12. |
| [24] |
WANG B H, JENKINS J R, TRAYHURN P. Expression and secretion of inflammation-related adipokines by human adipocytes differentiated in culture: integrated response to TNF-α[J]. American Journal of Physiology-Endocrinology and Metabolism, 2005, 288(4): E731-E740. DOI:10.1152/ajpendo.00475.2004 |
| [25] |
SHEHZAD A, IQBAL W, SHEHZAD O, et al. Adiponectin: regulation of its production and its role in human diseases[J]. Hormones (Athens), 2012, 11(1): 8-20. DOI:10.1007/BF03401534 |
| [26] |
YAMAUCHI T, NIO Y, MAKI T, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J]. Nature Medicine, 2007, 13(3): 332-339. DOI:10.1038/nm1557 |
| [27] |
FANG H, JUDD R L. Adiponectin regulation and function[J]. Comprehensive Physiology, 2018, 8(3): 1031-1063. |
| [28] |
GUSTAFSON B, JACK M M, CUSHMAN S W, et al. Adiponectin gene activation by thiazolidinediones requires PPARγ2, but not C/EBPα-evidence for differential regulation of the aP2 and adiponectin genes[J]. Biochemical and Biophysical Research Communications, 2003, 308(4): 933-939. DOI:10.1016/S0006-291X(03)01518-3 |
| [29] |
HE W M, BARAK Y, HEVENER A, et al. Adipose-specific peroxisome proliferator-activated receptor γ knockout causes insulin resistance in fat and liver but not in muscle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(26): 15712-15717. DOI:10.1073/pnas.2536828100 |
| [30] |
YAMAUCHI T, KAMON J, ITO Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature, 2003, 423(6941): 762-769. DOI:10.1038/nature01705 |
| [31] |
LUO C T, LV N, CHANG Z, et al. Adipose angiotensin Ⅱ type 1 receptor-associated protein ameliorates metabolic disorders via promoting adipose tissue adipogenesis and browning[J]. European Journal of Cell Biology, 2017, 96(6): 567-578. DOI:10.1016/j.ejcb.2017.05.003 |
| [32] |
HERZIG S, SHAW R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nature Reviews Molecular Cell Biology, 2018, 19(2): 121-135. DOI:10.1038/nrm.2017.95 |
| [33] |
CHINETTI G, FRUCHART J C, STAELS B. Peroxisome proliferator-activated receptors (PPARs): nuclear receptors at the crossroads between lipid metabolism and inflammation[J]. Inflammation Research, 2000, 49(10): 497-505. DOI:10.1007/s000110050622 |
| [34] |
BOGDANOV M, SUN J Z, KABACK H R, et al. A phospholipid acts as a chaperone in assembly of a membrane transport protein[J]. Journal of Biological Chemistry, 1996, 271(20): 11615-11618. DOI:10.1074/jbc.271.20.11615 |
| [35] |
SIEGEL D P, BANSCHBACH J, ALFORD D, et al. Physiological levels of diacylglycerols in phospholipid membranes induce membrane fusion and stabilize inverted phases[J]. Biochemistry, 1989, 28(9): 3703-3709. DOI:10.1021/bi00435a012 |
| [36] |
EMOTO K, KOBAYASHI T, YAMAJI A, et al. Redistribution of phosphatidylethanolamine at the cleavage furrow of dividing cells during cytokinesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(23): 12867-12872. DOI:10.1073/pnas.93.23.12867 |
| [37] |
GUDI S, NOLAN J P, FRANGOS J A. Modulation of GTPase activity of G proteins by fluid shear stress and phospholipid composition[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(5): 2515-2519. DOI:10.1073/pnas.95.5.2515 |
| [38] |
RIETVELD A G, KOORENGEVEL M C, DE KRUIJFF B. Non-bilayer lipids are required for efficient protein transport across the plasma membrane of Escherichia Coli[J]. The EMBO Journal, 1995, 14(22): 5506-5513. DOI:10.1002/j.1460-2075.1995.tb00237.x |
| [39] |
MATSUSUE K, AIBARA D, HAYAFUCHI R, et al. Hepatic PPARγ and LXRα independently regulate lipid accumulation in the livers of genetically obese mice[J]. FEBS Letters, 2014, 588(14): 2277-2281. DOI:10.1016/j.febslet.2014.05.012 |
| [40] |
TANG Q Q, LANE M D. Activation and centromeric localization of CCAAT/enhancer-binding proteins during the mitotic clonal expansion of adipocyte differentiation[J]. Genes & Development, 1999, 13(17): 2231-2241. |
| [41] |
LORD E, MURPHY B D, DESMARAIS J A, et al. Modulation of peroxisome proliferator-activated receptor δ and γ transcripts in swine endometrial tissue during early gestation[J]. Reproduction, 2006, 131(5): 929-942. DOI:10.1530/rep.1.00657 |
| [42] |
GROSS D N, FARMER S R, PILCH P F. Glut4 storage vesicles without Glut4:transcriptional regulation of insulin-dependent vesicular traffic[J]. Molecular and Cellular Biology, 2004, 24(16): 7151-7162. DOI:10.1128/MCB.24.16.7151-7162.2004 |
| [43] |
PERERA R J, MARCUSSON E G, KOO S, et al. Identification of novel PPARγ target genes in primary human adipocytes[J]. Gene, 2006, 369: 90-99. DOI:10.1016/j.gene.2005.10.021 |
| [44] |
NAKAJIMA A, YONEDA M, TAKAHASHI H, et al. The roles of PPARs in digestive diseases[J]. Nihon Rinsho.Japanese Journal of Clinical Medicine, 2005, 63(4): 665-671. |
| [45] |
YANG H, SUH D H, KIM E D, et al. Metabolomic and lipidomic analysis of the effect of pioglitazone on hepatic steatosis in a rat model of obese type 2 diabetes[J]. British Journal of Pharmacology, 2018, 175(17): 3610-3625. DOI:10.1111/bph.14434 |
| [46] |
TONTONOZ P, HU E, DEVUNE J, et al. PPAR gamma 2 regulates adipose expression of the phosphoenolpyruvate carboxykinase gene[J]. Molecular and Cellular Biology, 1995, 15(1): 351-357. DOI:10.1128/MCB.15.1.351 |
| [47] |
GLORIAN M, DUPLUS E, BEALE E G, et al. A single element in the phosphoenolpyruvate carboxykinase gene mediates thiazolidinedione action specifically in adipocytes[J]. Biochimie, 2001, 83(10): 933-943. DOI:10.1016/S0300-9084(01)01343-8 |




