2. 福建省生猪疫病防控工程技术研究中心, 龙岩 364000;
3. 福建省家畜传染病防治与生物技术重点实验室, 龙岩 364000;
4. 福建农林大学动物科学学院(蜂学学院), 福州 350000
2. Fujian Provincial Engineering & Technology Research Center for the Prevention and Control of Swine Diseases, Longyan 364000, China;
3. Fujian Provincial Key Laboratory for the Prevention and Control of Animal Infectious Diseases and Biotechnology, Longyan 364000, China;
4. College of Animal Sciences(College of Bee Science), Fujian Agriculture and Forestry University, Fuzhou 350000, China
在规模化养猪生产中,各种病原菌及其毒素侵袭,甚至是病原菌的感染、创伤都会使仔猪处于应激状态,严重时会产生高烧、腹泻、采食量下降等症状,造成仔猪生长受阻,生长性能下降[1]。目前对仔猪应激的防治措施很多,遵循中药配伍的相须、相使原则,不断开发新的复方中药免疫增强剂进行调控是一条行之有效的解决途径。例如,陈燕凌等[2]研制的复方中药制剂可在一定程度上改善断乳仔猪的生长性能,预防腹泻;陈张华等[3]报道,在断奶仔猪饲粮中添加1.0%“猪康散”能增强仔猪细胞免疫功能和提高仔猪生长性能;程佳等[4]研究证实,中药制剂柴术抗激散对LPS导致的早期断奶仔猪免疫应激具有明显的缓减作用。以上研究表明,复方中草药制剂将成为理想的免疫调节剂应用于养猪生产。本课题组前期研究发现,饲粮中添加0.2%复方银杏叶制剂有助于提高爱拔益加(AA)肉仔鸡的生长性能和免疫功能[5];饲粮中添加1.00%的复方银杏叶制剂可维持和养护断奶肉兔的小肠黏膜组织[6];复方银杏叶制剂还可维持和修复由免疫应激引起的断奶仔猪肠道损伤,并能增强肠道黏膜的免疫功能[7]。为进一步探究复方银杏叶的作用机理,本试验采用超高效液相色谱和四极杆飞行时间质谱(UHPLC-QTOF-MS)技术,研究LPS免疫应激仔猪的血清代谢组学特征及复方银杏叶的干预效果,寻找其干预免疫应激仔猪的靶点及代谢通路,为复方银杏叶免疫增强剂在仔猪上的应用提供依据。
1 材料与方法 1.1 复方银杏叶制剂组成及制备复方银杏叶由银杏叶、黄芪、党参、白术、茯苓、砂仁和陈皮按照10 : 15 : 15 : 12 : 15 : 6 : 9比例组成,药物制备方法参照本课题组前期研究[7],每毫升药液含1 g生药(按照生药量计算),-20 ℃保存备用。混合后的复方银杏叶制剂送至青岛科标检测研究院进行主要活性成分含量检测。经检测,试验所用复方银杏叶制剂中:总多糖含量7.60%,总黄酮含量0.06%,总皂苷含量1.70%,总黄酮醇苷含量1 647.97 mg/kg,萜类内酯含量650 mg/kg,黄芪甲苷含量95 mg/kg,毛蕊异黄酮葡萄糖苷含量174.49 mg/kg,橙皮苷含量2 121.42 mg/kg。
1.2 试验设计及样品采集试验选取平均体重为(9.52±0.80) kg、(35±1)日龄的“杜×长×大”杂交仔猪36头,按体重、胎次等一致原则随机分为3组,每组4个重复,每个重复3头。3组仔猪饲喂同一基础饲粮,基础饲粮参照NRC(1998)仔猪营养需要配制,其组成及营养水平见表 1。其中对照组每头每天灌服110 mL生理盐水,LPS应激组每头每天灌服110 mL生理盐水,LPS+复方银杏叶组每头每天灌服110 mL复方银杏叶制剂。免疫应激模型的建立和样品采集参照文献[8]的方法进行,即在正式试验第23天LPS应激组和LPS+复方银杏叶组仔猪腹膜注射LPS(大肠杆菌血清型O55 : B5,Sigma公司),注射剂量为100 μg/kg,对照组仔猪腹膜注射等量的生理盐水;注射LPS后3 h,所有猪只空腹前腔静脉采血,3 000 r/min、4 ℃离心10 min制备血清,-80 ℃保存。试验于龙岩学院动物房进行,采用半开放猪舍,自然通风,保持干燥,自由采食和饮水,消毒、免疫和管理按猪场常规程序进行。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验期每天记录每个重复猪的采食量,并分别在试验第1、7、21、23和27天对所有试验猪进行称重(空腹12 h),计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.3.2 血清生化指标测定采用迈瑞BS-420全自动生化仪测定血清葡萄糖(GLU)、尿素氮(UN)、肌酐(CREA)、胰高血糖素样肽-2(GLP-2)含量以及谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转移酶(γ-GGT)和碱性磷酸酶(ALP)活性,以上指标均采用试剂盒(购自中生北控生物科技股份有限公司)测定,按照试剂盒说明书操作。
1.3.3 数据统计分析采用SPSS 22.0统计软件进行单因素方差分析和LSD法多重比较,统计结果用平均值和标准误(SE)表示,以P < 0.05表示差异显著。
1.4 血清代谢组学特征分析 1.4.1 代谢组学色谱和质谱条件采用1290 UHPLC超高效液相色谱仪进行物质分离,在AB 6600 Triple TOF质谱仪下基于IDA采集模式进行一级、二级质谱数据的采集。采集条件如下:轰击能量为30 ev,每50 ms采集15张二级谱图。电喷雾离子源(ESI)参数设置如下:雾化气压(GS1)、辅助气压及气帘气压分别为60、60和35 Psi;温度为650 ℃,喷雾电压为5 000 V(正离子模式)或-4 000 V(负离子模式)。
1.4.2 代谢组学血清样品处理将存放于-80 ℃的血清样品复融后吸取100 μL至EP管中,加入300 μL甲醇,再加入20 μL内标,涡旋混匀30 s,超声10 min(冰水浴),-20 ℃静置1 h,4 ℃、12 000 r/min离心15 min,吸取上清液备用。
1.4.3 代谢组学数据处理与生物标志物鉴定首先使用ProteoWizard软件将原始质谱转成mzXML格式,再使用XCMS做保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,并使用二级质谱数据库对峰进行物质鉴定。
1.4.4 代谢组学统计分析及通路分析将上述得到的化合物信息导入SIMCA 14.1软件进行主成分分析(PCA)和偏最小二乘法-判别分析(OPLS-DA),将筛选出的差异化合物导入KEGG Pathway数据库,注释到差异代谢物相关的代谢通路,最后通过MetaboAnalyst网站进行通路富集。
2 结果与分析 2.1 复方银杏叶对免疫应激仔猪生长性能的影响由表 2可知,在第23天之前,3个试验组间的ADFI、ADG和F/G差异均不显著(P>0.05)。在试验第24~27天,LPS应激组的ADFI较对照组和LPS+复方银杏叶组分别降低了21.52%和15.07%(P < 0.05),LPS应激组的ADG较对照组降低了51.22%(P < 0.05),LPS+复方银杏叶组的ADG虽然较对照组降低了21.95%(P>0.05),但较LPS应激组提高了60%(P>0.05);在试验第24~27天,LPS+复方银杏叶组的F/G较LPS应激组降低了35.77%(P < 0.05),与对照组相比差异不显著(P>0.05)。以上结果表明复方银杏叶制剂可促进免疫应激仔猪的生长,提高饲料利用率。
|
|
表 2 复方银杏叶对免疫应激仔猪生长性能的影响 Table 2 Effects of Ginkgo biloba compound on growth performance of immune stressed piglets |
由表 3可知,注射LPS后,与对照组相比,LPS应激组血清γ-GGT、ALT和ALP活性以及UN、CREA含量均显著升高(P < 0.05),GLP-2含量则显著降低(P < 0.05);与LPS应激组相比,复方银杏叶显著缓解了LPS刺激引起的血清UN、CREA含量和γ-GGT活性的升高(P < 0.05),以及LPS刺激引起的血清GLP-2含量降低(P < 0.05)。
|
|
表 3 复方银杏叶对免疫应激仔猪血清生化指标的影响 Table 3 Effects of Ginkgo biloba compound on serum biochemical parameters of immune stressed piglets |
3组血清样品及QC样本PCA见图 1。在正、负2种离子模式下,对照组与LPS+复方银杏叶组和LPS应激组分离明显,而LPS+复方银杏叶组与对照组和LPS应激组之间存在交叉。在正离子模式下,74.1%样本符合模型判别(R2X=0.741),模型的预测能力66.9%(Q2=0.669);在负离子模式下,R2X=0.668、Q2=0.534,表明在2种离子模式下模型拟合均良好。为了筛选得到由组间差异而形成的潜在标志物,减少干扰因素对相似性聚类分析的影响,在LPS应激模型基础上,使用有监督的模式识别方法正交偏最小二乘判别分析(OPLS-DAS)进一步区分LPS+复方银杏叶组与LPS应激组的血清代谢模式的变化,如图 2所示。在负离子模式下,R2X=0.284,R2Y=0.851,Q2=-0.430;在正离子模式下R2X=0.268,R2Y=0.828,Q2=-0.272。
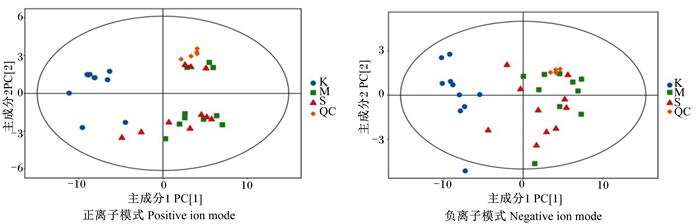
|
K: 对照组control group;M:LPS应激组LPS-stressed group;S:LPS+复方银杏叶组LPS+GBC group;QC:质控样本quality control sample。图 2同the same as Fig. 2. 图 1 3组血清样品PCA得分图 Fig. 1 PCA score plot of serum samples from 3 groups |
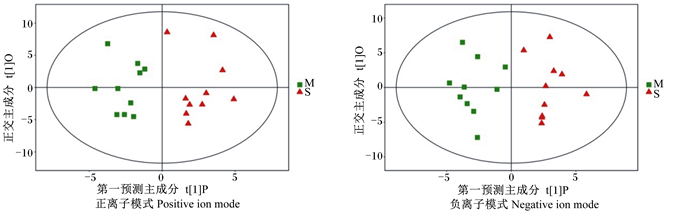
|
图 2 OPLS-DA模型得分散点图(LPS+复方银杏叶组vs.LPS应激组) Fig. 2 Score scatter plot of OPLS-DA mode (LPS+GBC group vs. LPS-stressed group) |
根据UHPLC-QTOF-MS所得数据,利用SIMCA14.1软件在建立OPLS-DA模型基础上,通过S-plot分析指标筛选LPS+复方银杏叶组与LPS应激组之间的差异变量作为潜在的生物标志物(P < 0.05且VIP>1)。如图 3中红色标记,这些差异变量可能是LPS+复方银杏叶组与LPS应激组的关键代谢物。在正、负2种离子模式下,分别检测到831(正离子模式)、834(负离子模式)种物质,通过比对数据库,鉴定出得分值高于0.6分的化合物作为内源性生物标志物,正离子模式下定性到141个,负离子模式下定性到118个。使用SIMCA14.1软件进行多元变量分析,在正离子模式下,共筛选出2个内源性生物标志物;在负离子模式下,共筛选出5个内源性生物标志物。将正、负离子的所有标志物结合在一起,通过KEGG通路分析,进一步筛选得到有KEGG号的7个生物标志物,见表 4。
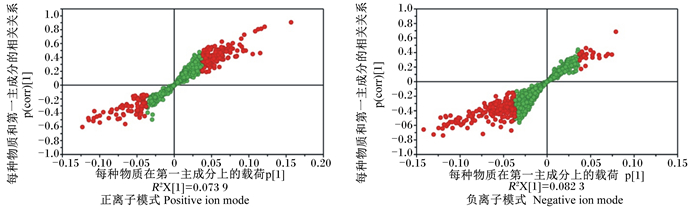
|
图 3 S-plot(LPS+复方银杏叶组vs.LPS应激组) Fig. 3 S-plot (LPS+GBC group vs. LPS-stressed group) |
|
|
表 4 主要差异代谢物(LPS+复方银杏叶组vs. LPS应激组) Table 4 Major different metabolites (LPS+GBC group vs. LPS-stressed group) |
由表 4可见,在正离子模式下,共筛选出2个内源性生物标志物,分别是L-焦谷氨酸、N6-甲基-L-赖氨酸;在负离子模式下,共筛选出5个内源性生物标志物,分别是羟(基)脯氨酸、L-谷氨酰胺、L-谷氨酸、棕榈酸和甘氨石胆酸。与LPS应激组相比,LPS+复方银杏叶组血清N6-甲基-L-赖氨酸和L-谷氨酸含量显著上升(P < 0.05),血清L-焦谷氨酸、羟(基)脯氨酸、左旋谷氨酰胺、棕榈酸和甘氨石胆酸含量显著下降(P < 0.05)。
2.5 代谢通路分析将上述筛选的有KEGG号的7个内源性生物标志物导入MetaboAnalyst网站进行富集通路分析,筛选得到12个代谢通路,见图 4。将潜在的靶标路径临界值设置为0.25,得到2个代谢通路,分别是D-谷氨酰胺和D-谷氨酸代谢通路以及丙氨酸、天冬氨酸和谷氨酸代谢通路。
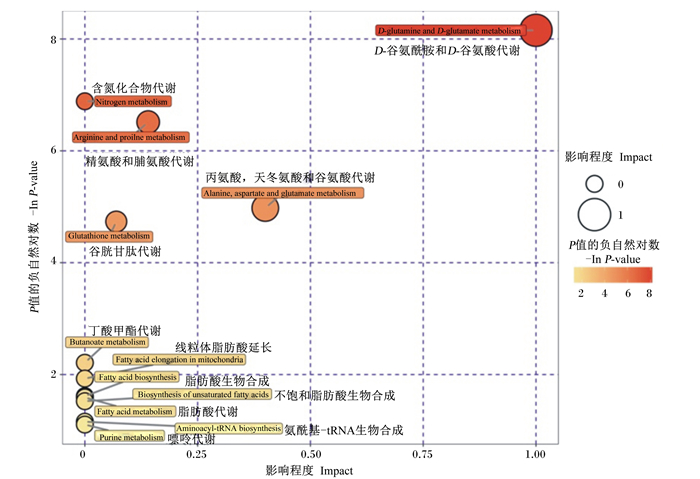
|
图 4 用MetaboAnalyst软件进行富集通路分析结果 Fig. 4 Results of pathway analysis with MetaboAnalyst software |
目前腹腔注射一定剂量的LPS是模拟免疫应激最典型的方式之一。LPS是革兰氏阴性菌的重要组分多糖,能诱导机体发生强烈的应激,导致动物精神不振、发热、采食量下降。本试验临床效果显示,第23天注射LPS后,仔猪出现精神沉郁、呕吐、畏寒成堆躺卧、腹泻、体温升高至40.5 ℃左右。已有报道证实,LPS应激可造成仔猪生长性能显著降低[9-10],本试验结果与上述报道一致,不仅说明本次试验用LPS制作免疫应激模型是成功的,也证实用复方银杏叶制剂干预后可促进免疫应激仔猪生长,提高饲料利用率。
血液ALT、AST和ALP是反映肝脏功能的重要指标,三者活性的升高不仅表示肝脏受到严重损伤,也是机体受到应激反应的标志[11];血清中γ-GGT主要来自肝胆系统,当肝脏内合成亢进或胆汁排出受阻时,血清γ-GGT活性增高[12]。本试验中,LPS应激组血清中的ALT、ALP、γ-GGT活性较对照组均显著升高,说明免疫应激造成仔猪肝功能受损。GLP-2是一种肠道多肽类激素,具有多种肠道效应,包括刺激肠黏膜生长、促进营养物的消化和吸收、提高肠屏障功能、抑制胃能动性和胃酸分泌等[13-14]。本试验发现LPS应激组血清中GLP-2含量较对照组显著降低,说明免疫应激还造成了仔猪肠道屏障功能受损,与车炼强等[15]报道一致。而用复方银杏叶干预免疫应激仔猪后,LPS+复方银杏叶组血清ALT、AST、ALP、γ-GGT活性及ALT/AST较LPS应激组均有所下降,血清GLP-2含量较LPS应激组显著提高,说明复方银杏叶可缓解免疫应激导致的仔猪肝脏和肠道屏障功能的损伤。血液中的UN和CREA是蛋白质代谢的主要产物,蛋白质代谢良好时,血液中这些非蛋白氮的含量会降低[16]。本试验中,LPS+复方银杏叶组血清中UN和CREA含量显著低于LPS应激组,这与ADG的变化趋势相一致,说明复方银杏叶是通过提高GLP-2含量、降低仔猪血清中非蛋白氮含量,在一定程度上改善了免疫应激仔猪对营养物质的消化和吸收。本课题组前期研究发现,复方银杏叶通过调控细胞因子生成,能有效拮抗环磷酰胺对肝脏和脾脏组织造成的损伤[17],还有修复脾虚性断奶仔猪小肠组织的作用[18]。因此,可将复方银杏叶开发成一种理想的免疫调节剂。
3.2 基于血清代谢组学的复方银杏叶干预免疫应激仔猪的作用机制研究本研究基于LPS诱导建立的免疫应激模型,将LPS应激组与LPS+复方银杏叶组进行比较,PCA得分图显示,LPS应激组血清代谢物与对照组分离明显,说明LPS应激后仔猪的生理代谢环境受到明显干扰,病理状态下代谢网络出现紊乱;正、负离子模式下LPS+复方银杏叶组血清代谢物与对照组均有少许重叠,与LPS应激组之间存在交叉,但负离子模式下LPS+复方银杏叶组和LPS应激组之间区分较明显,综合OPLS-DA说明复方银杏叶干预LPS免疫应激仔猪后,虽不能完全逆转病理到正常状态,但显示已经发挥一定的药效作用,提示复方银杏叶制剂在干预LPS免疫应激仔猪的应用方面在使用剂量、剂型或者时间上还有改进空间。
通过差异代谢物分析,与LPS应激组相比,LPS+复方银杏叶组血清N6-甲基-L-赖氨酸和L-谷氨酸含量显著上升,血清L-焦谷氨酸、羟(基)脯氨酸、左旋谷氨酰胺、棕榈酸和甘氨石胆酸含量显著下降。谷氨酸作为一种功能性氨基酸,是肠上皮的主要能源物质[19],不仅参与蛋白质的合成和氧化供能[20],还具有改善肠道上皮完整性、增强肠道屏障功能和抗氧化能力、提高肠道干细胞的活性和促进肠道发育的作用[21-24];赖氨酸作为第一限制性氨基酸,参与猪体内蛋白质、脂肪代谢以及肉毒碱的形成等,还有利于钙的吸收,有助于抗体、激素、酶等的形成,增强机体免疫力[25-26];虽然谷氨酰胺和谷氨酸一样具有为肠上皮细胞提供能量的功能,并且还能增加肠道对亮氨酸和脯氨酸的吸收量[27],但是当谷氨酸和谷氨酰胺同时存在时,肠上皮细胞会优先利用谷氨酸,从而抑制谷氨酰胺氧化供能[28],故推测LPS+复方银杏叶组谷氨酰胺、脯氨酸的代谢产物羟(基)脯氨酸和焦谷氨酸含量较LPS应激组显著下降与其血清中谷氨酸含量显著增加有关,由此也降低了由谷氨酰胺转化为有害的焦谷氨酸的缺陷。肝细胞代谢障碍时会致使血液中胆汁酸含量升高[29]。差异代谢物分析结果显示,LPS+复方银杏叶组血清甘氨石胆酸含量较LPS应激组显著下降,进一步说明复方银杏叶可缓解LPS应激导致的肝脏损伤。代谢通路分析发现,复方银杏叶对预防免疫应激仔猪药效作用的靶标代谢通路主要为D-谷氨酰胺和D-谷氨酸代谢以及丙氨酸、天冬氨酸和谷氨酸代谢通路,涉及到机体内碳水化合物、氨基酸、脂类等物质代谢。本试验尽管已经初步筛选出复方银杏叶缓解仔猪免疫应激相关的生物标志物,但是仍需要进一步通过试验和临床验证。
4 结论① 复方银杏叶可显著缓解LPS应激导致的仔猪血清生化指标的改变,减轻肝脏损伤,改善仔猪对营养物的消化和吸收,提高机体对含氮物质的利用效率以及肠黏膜屏障功能,从而保证仔猪的正常生长发育,提高饲料利用率。
② 复方银杏叶预防仔猪LPS应激、提高生产性能的药效作用的靶标代谢通路主要为D-谷氨酰胺和D-谷氨酸代谢以及丙氨酸、天冬氨酸和谷氨酸代谢通路。
| [1] |
程佳, 孙耀贵, 李宏全, 等. 柴术抗激颗粒对脂多糖免疫应激断奶仔猪血清抗氧化和生化指标的影响[J]. 中国兽医杂志, 2015, 51(5): 24-26. CHENG J, SUN Y G, LI H Q, et al. Effects of CZKJKL on serum antioxidant indices and biochemical parameters in weanling piglets under immune stress[J]. Chinese Journal of Veterinary Medicine, 2015, 51(5): 24-26 (in Chinese). DOI:10.3969/j.issn.0529-6005.2015.05.008 |
| [2] |
陈燕凌, 蔡景义, 左之才, 等. 复方中药制剂对断乳仔猪生长性能及腹泻的影响[J]. 中国兽医杂志, 2008, 44(10): 21-22. CHEN Y L, CAI J Y, ZUO Z C, et al. Effects of Chinese herbal compound preparation on growth performance and diarrhea of weaned piglets[J]. Chinese Journal of Veterinary Medicine, 2008, 44(10): 21-22 (in Chinese). DOI:10.3969/j.issn.0529-6005.2008.10.008 |
| [3] |
陈张华, 邓惠丹, 邓俊良, 等. 复方中草药"猪康散"对仔猪生产性能及细胞免疫功能的影响[J]. 中国兽医学报, 2016, 32(6): 898-901. CHEN Z H, DENG H D, DENG J L, et al. Effect of Zhukangsan on growth performance and cellular immune function of in piglets[J]. Chinese Journal of Veterinary Science, 2016, 32(6): 898-901 (in Chinese). |
| [4] |
程佳, 孙耀贵, 王俊东. 柴术抗激颗粒对早期断奶仔猪生长性能和血清应激相关激素水平的影响[J]. 动物医学进展, 2013, 34(1): 47-51. CHENG J, SUN Y G, WANG J D, et al. Effects of CZKJKL on growth performance and serum hormones of early weanling piglets[J]. Progress in Veterinary Medicine, 2013, 34(1): 47-51 (in Chinese). DOI:10.3969/j.issn.1007-5038.2013.01.011 |
| [5] |
岳稳, 黄梅丹, 李焰, 等. 银杏叶复方制剂对AA肉仔鸡生长性能及免疫功能的影响[J]. 黑龙江畜牧兽医, 2019(23): 106-110. YUE W, HUANG M D, LI Y, et al. Effects of a formulation containing Ginkgo biloba leaves on growth performance and immune function in Arbor Acres broilers[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(23): 106-110 (in Chinese). |
| [6] |
李焰, 王华, 尹会方, 等. 银杏叶复方对肉兔小肠黏膜形态及上皮内淋巴细胞和杯状细胞数量的影响[J]. 安徽农业大学学报, 2013, 40(4): 529-533. LI Y, WANG H, YIN H F, et al. Influence of Ginkgo biloba compound on the morphology of small intestine mucosa and the number of intraepithelial lymphocytes and goblet cells in meat rabbits[J]. Journal of Anhui Agricultural University, 2013, 40(4): 529-533 (in Chinese). |
| [7] |
李焰, 兰天香, 邱龙新, 等. 银杏叶复方对LPS应激断奶仔猪小肠黏膜形态及上皮内淋巴细胞和杯状细胞数量的影响[J]. 中国畜牧杂志, 2018, 54(12): 109-113. LI Y, LAN T X, QIU L X, et al. Influence of oral formulation containing Ginkgo biloba leaves on small intestinal mucosal morphology and numbers of intraepithelial lymphocytes and goblet cells in weaned piglets under LPS-induced stress[J]. Chinese Journal of Animal Science, 2018, 54(12): 109-113 (in Chinese). |
| [8] |
赵亚波, 萨茹丽, 那·巴根那, 等. 动物氧化和免疫应激模型的建立方法[J]. 中国畜牧杂志, 2018, 54(9): 20-25. ZHAO Y B, SA R L, NA·B G N, et al. Methods of animal oxidation and immune stress models[J]. Chinese Journal of Animal Science, 2018, 54(9): 20-25 (in Chinese). |
| [9] |
康保聚, 陈家顺, 金顺顺, 等. 血根碱对脂多糖免疫应激断奶仔猪生长性能、免疫功能及肠道健康的影响[J]. 动物营养学报, 2019, 31(9): 4251-4261. KANG B J, CHEN J S, JIN S S, et al. Effects of sanguinarine on growth performance, immune function and gut heath of immune-stressed weaned piglets challenged with lipopolysaccharide[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4251-4261 (in Chinese). |
| [10] |
董海军, 王康宁, 李霞, 等. pGRF基因质粒对免疫应激断奶仔猪生长抑制的缓解作用[J]. 畜牧兽医学报, 2009, 40(3): 349-355. DONG H J, WANG K N, LI X, et al. Alleviation effect of pGRF gene plasmid on growth depression of weaned piglets after immune challenge[J]. Chinese Journal of Animal and Veterinary Sciences, 2009, 40(3): 349-355 (in Chinese). DOI:10.3321/j.issn:0366-6964.2009.03.012 |
| [11] |
石海峰, 刘玉兰, 李爽, 等. 天冬氨酸对脂多糖刺激断奶仔猪生长性能、血细胞分类计数和血液生化指标的影响[J]. 中国畜牧杂志, 2013, 49(7): 38-43. SHI H F, LIU Y L, LI S, et al. Effect of aspartic acid on growth performance, blood cell differential count, and blood biochemical measurements of weaned piglets after lipopolysaccharide challenge[J]. Chinese Journal of Animal Science, 2013, 49(7): 38-43 (in Chinese). DOI:10.3969/j.issn.0258-7033.2013.07.011 |
| [12] |
张军民, 高振川. 谷氨酰胺对早期断奶仔猪血浆、肝和肠中γ-谷氨酰转肽酶活性的影响[J]. 中国兽医学报, 2010, 30(9): 1269-1272. ZHANG J M, GAO Z C. Effect of glutamine supplementation on activities of γ-glutamyl transeptidase in plasma, liver and intestine of early-weaned piglets[J]. Chinese Journal of Veterinary Science, 2010, 30(9): 1269-1272 (in Chinese). |
| [13] |
余长松, 贾刚, 邓秋红, 等. 胰高血糖素样肽-2对脂多糖应激的IPEC-J2细胞形态和紧密连接相关基因表达的影响[J]. 畜牧兽医学报, 2015, 46(4): 592-599. YU C S, JIA G, DENG Q H, et al. The effects of GLP-2 on cell morphology and the gene expression of tight junction in LPS stressed IPEC-J2 cells[J]. Chinese Journal of Animal and Veterinary Sciences, 2015, 46(4): 592-599 (in Chinese). |
| [14] |
SHI X, WEN S, CHANG B, et al. GLP-2 receptor is required for glucose homeostasis and energy balance[J]. Faseb Journal, 2013, 27: 1160. |
| [15] |
车炼强, 张克英, 丁雪梅, 等. 免疫应激对仔猪肠道发育及胰高血糖素样肽-2分泌的影响[J]. 畜牧兽医学报, 2009, 40(5): 676-682. CHE L Q, ZHANG K Y, DING X M, et al. Effect of immune challenge on gut development and GLP-2 secretion of piglets[J]. Chinese Journal of Animal and Veterinary Sciences, 2009, 40(5): 676-682 (in Chinese). DOI:10.3321/j.issn:0366-6964.2009.05.012 |
| [16] |
汪水平, 王文娟, 左福元, 等. 中药复方对夏季肉牛的影响: Ⅱ.血气指标、血清代谢产物浓度及免疫和抗氧化功能参数[J]. 畜牧兽医学报, 2011, 42(5): 734-741. WANG S P, WANG W J, ZUO F Y, et al. Effect of chinese medicine prescription on beef cattle in summer: Ⅱ.The blood gas analysis, the concentration of metabolites and the parameters of the immune and antioxidant capability in the serum[J]. Chinese Journal of Animal and Veterinary Sciences, 2011, 42(5): 734-741 (in Chinese). |
| [17] |
李焰, 邓心慰, 曾福炎, 等. 银杏叶复方对免疫抑制小鼠细胞因子和肝脾组织形态的影响[J]. 中国畜牧杂志, 2015, 51(19): 71-74. LI Y, DENG X W, ZENG F Y, et al. Effect of Ginkgo biloba compound on cytokines and histomorphology of liver and spleen in immunosuppressive mice[J]. Chinese Journal of Animal Science, 2015, 51(19): 71-74 (in Chinese). DOI:10.3969/j.issn.0258-7033.2015.19.016 |
| [18] |
黄素华, 李焰, 游伟, 等. 银杏叶复方对脾虚性断奶仔猪肠黏膜形态、上皮淋巴细胞和杯状细胞数量的影响[J]. 中国畜牧杂志, 2017, 53(11): 86-89. HUANG S H, LI Y, YOU W, et al. Effects of compound Ginkgo biloba on the morphology of intestinal mucosa and number of intraepithelial lymphocytes and goblet cells in weaned pigs with spleen deficiency[J]. Chinese Journal of Animal Science, 2017, 53(11): 86-89 (in Chinese). |
| [19] |
BROSNAN J T, BROSNAN M E. Glutamate: a truly functional amino acid[J]. Amino Acids, 2013, 45(3): 413-418. DOI:10.1007/s00726-012-1280-4 |
| [20] |
YIN J, LIU M F, REN W K, et al. Effects of dietary supplementation with glutamate and aspartate on diquat-induced oxidative stress in piglets[J]. PLoS One, 2015, 10(4): e0122893. DOI:10.1371/journal.pone.0122893 |
| [21] |
JIAO N, WU Z L, JI Y, et al. L-glutamate enhances barrier and antioxidative functions in intestinal porcine epithelial cells[J]. The Journal of Nutrition, 2015, 145(10): 2258-2264. DOI:10.3945/jn.115.217661 |
| [22] |
DENG H S, GERENCSER A A, JASPER H. Signal integration by Ca2+ regulates intestinal stem-cell activity[J]. Nature, 2015, 528(7581): 212-217. DOI:10.1038/nature16170 |
| [23] |
TURNER J R. Intestinal mucosal barrier function in health and disease[J]. Nature Reviews Immunology, 2009, 9(11): 799-809. DOI:10.1038/nri2653 |
| [24] |
WU X, ZHANG Y, LIU Z, et al. Effects of oral supplementation with glutamate or combination of glutamate and N-carbamylglutamate on intestinal mucosa morphology and epithelium cell proliferation in weanling piglets[J]. Journal of Animal Science, 2012, 90(4): 337-339. |
| [25] |
YANG Y X, JIN Z, YOON S Y, et al. Lysine restriction during grower phase on growth performance, blood metabolites, carcass traits and pork quality in grower finisher pigs[J]. Acta Agriculturae Scandinavica, Section A: Animal Sciences, 2008, 58(1): 14-22. |
| [26] |
KIM Y W, INGALE S L, KIM J S, et al. Effects of dietary lysine and energy levels on growth performance and apparent total tract digestibility of nutrients in weanling pigs[J]. Asian-Australasian Journal of Animal Sciences, 2011, 24(9): 1256-1267. DOI:10.5713/ajas.2011.11134 |
| [27] |
唐倩, 李吕木, 丁维民. 谷氨酰胺对肠道营养与健康的影响[J]. 饲料博览, 2015(2): 11-16. TANG Q, LI L M, DING W M. Effects of glutamine on intestinal nutrition and health[J]. Feed Review, 2015(2): 11-16 (in Chinese). |
| [28] |
BLACHIER F, MARIOTTI F, HUNEAU J F, et al. Effects of amino acid-derived luminal metabolites on the colonic epithelium and physiopathological consequences[J]. Amino Acids, 2007, 33(4): 547-562. DOI:10.1007/s00726-006-0477-9 |
| [29] |
邓阳, 张毕奎, 颜苗, 等. LC-MS/MS测定大鼠血浆中16种胆汁酸及在甘草减毒研究中的应用[J]. 中国药学杂志, 2015, 50(3): 263-268. DENG Y, ZHANG B K, YAN M, et al. LC-MS/MS method for determination of sixteen bile acids in rat plasma and its application in liquorice detoxification research[J]. Chinese Pharmaceutical Journal, 2015, 50(3): 263-268 (in Chinese). |




