反刍动物瘤胃的微生态系统极其复杂[1-2],包括细菌、真菌和原生动物,而细菌是这些微生物中的优势种群[3]。甘露寡糖(MOS)是一种常见的功能性低聚糖[4],被称为“化学益生素”,可以促进动物胃肠道内有益菌群的增殖[5-6],改善动物胃肠道微生态环境,提高免疫力和生产性能[7],在动物饲粮中得到广泛使用[8],并已成为多种单胃动物研究的主题,包括猪[9-10]、蛋鸡[11]、肉鸡[12]、家兔[13],而其在反刍动物瘤胃微生物方面的研究较少[14]。普遍认为是低聚糖会被瘤胃微生物降解而不会对反刍动物饲粮带来益处。然而,有研究发现,添加不同水平的MOS在不影响绵羊对绝大多数营养物质表观消化率、存留率以及瘤胃发酵、免疫力、血清一氧化氮(NO)浓度和一氧化氮合酶活性的情况下提高了纤维物质的表观消化率[15],而关于MOS可提高绵羊纤维物质表观消化率的生理机理还需要全面去揭示。因此,本研究基于16S rDNA高通量测序技术分析荞麦秸秆饲粮条件下添加不同水平MOS对滩羊瘤胃细菌菌群结构与多样性的影响,为进一步研究MOS对纤维物质的影响提供一定的理论基础。
1 材料与方法 1.1 试验动物与饲粮组成本试验于2019年5—9月在宁夏农垦贺兰山牛羊产业(集团)有限公司开展,试验前1个月对羊舍做好清洁、防疫工作。
选取健康、体重在30.5 kg左右的宁夏断奶滩羊羯羊20只,随机分为4组,每组5只,独笼饲养。基础饲粮参照《肉羊饲养标准》(NY/T 816—2004)并结合宁夏滩羊的饲养实践进行配制,其组成及营养水平见表 1。饲粮精粗比为30 : 70,全株玉米青贮与荞麦秸秆以60 : 40混合作为粗饲料,其中荞麦秸秆粉碎后与0.1%纤维素酶、1.0%麸皮混合均匀并密闭发酵30 d。对照组(CK-3组)滩羊饲喂基础饲粮;试验组滩羊饲喂在基础饲粮基础上分别添加1%(Y1-3组)、2%(Y2-3组)和3%(Y3-3组)MOS(纯度>99%)的试验饲粮,MOS与精料混合均匀,以保证全部MOS被羊只采食。试验期为75 d,其中预试期15 d,正试期60 d。每天饲喂2次(07:30和17:30),先喂粗料后喂精料,自由采食和饮水。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
瘤胃液采集:在正试期第60天每组随机选择3只羊用瘤胃导管各采集瘤胃液50 mL,于-80 ℃超低温保存,待测瘤胃发酵参数和菌群结构。
1.3 指标测定 1.3.1 瘤胃发酵参数使用pHS-2型酸度计测定瘤胃液的pH,参照冯宗慈等[16]的方法测定氨态氮(NH3-N)含量;采用气相色谱法测定挥发性脂肪酸含量。
1.3.2 16S rDNA测序从样本中提取基因组DNA后,用带有barcode的特异引物扩增16S rDNA的V3+V4区,所用引物及引物序列为:341F,5′-CCTACGGGNGGCWGCAG-3′;806R,5′-GGACTACHVGGGTATCTAAT-3′。然后PCR扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,以HiSeq 2500的PE250模式上机测序。测序得到raw reads之后,对低质量reads进行过滤,然后进行组装和过滤,以保证利用最有效数据聚类成操作分类单元(OTUs)。
1.4 数据统计与分析用Excel 2010对试验数据进行简单处理,并在SAS 8.2软件上进行分析,数据用“平均值±标准差”表示。
2 结果与分析 2.1 瘤胃发酵参数由表 2可知,在本试验条件下,饲粮中添加不同水平的MOS对试验羊的瘤胃液pH及NH3-N含量无显著影响(P>0.05),以Y2-3组数值最高。饲粮中添加不同水平的MOS显著影响瘤胃液乙酸含量(P < 0.05),表现为Y1-3组、Y2-3组显著高于Y3-3组(P < 0.05),其中以Y2-3组数值最高。各组间瘤胃液丙酸含量无显著差异(P>0.05)。Y2-3组瘤胃液丁酸、异丁酸、戊酸、异戊酸含量以及乙酸/丙酸均高于其他组,但差异未达显著水平(P>0.05)。
|
|
表 2 瘤胃发酵参数 Table 2 Rumen fermentation parameters |
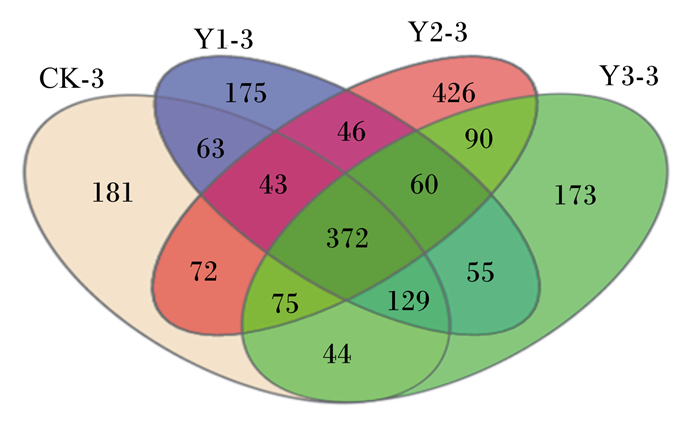
测序共得888 992个有效序列,用Uparse软件对所有样本的全部有效序列聚类,以97%的一致性将序列聚类成为OTUs,结果显示12个样本共产生4 104个OTUs。由图 1可知,CK-3组有979个OTUs,Y1-3组有943个OTUs,Y2-3组有1 184个OTUs,Y3-3组有998个OTUs。4组共享372个OTUs。Y1-3组OTUs相对CK-3组有所减少,而Y2-3组、Y3-3组OTUs相对CK-3组有所增加,说明不同添加水平的MOS对滩羊瘤胃菌群丰度的影响不同。
|
CK-3:CK-3组CK-3 group;Y1-3:Y1-3组Y1-3 group;Y2-3:Y2-3组Y2-3 group;Y3-3:Y3-3组Y3-3 group。下图同the same as below。 图 1 瘤胃菌群OTUs数量 Fig. 1 Number of rumen bacterial OTUs |
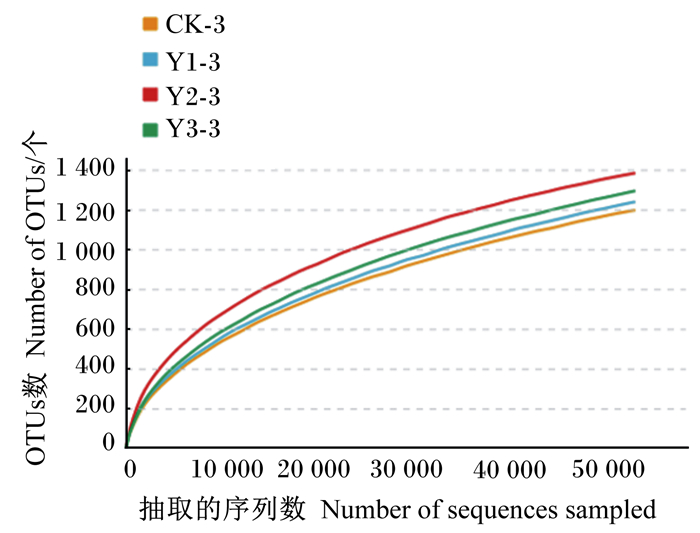
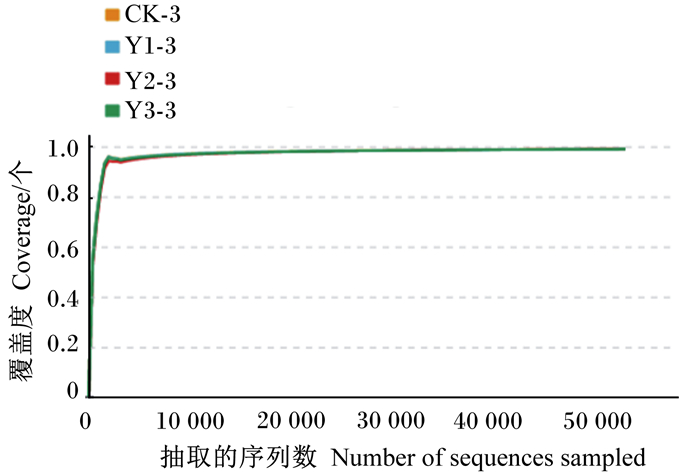
样本稀释曲线如图 2所示,随着试验测序深度的增加,各条曲线趋于平缓,表明测序深度覆盖了样本中的大部分微生物。样本覆盖度曲线如图 3所示,当测序深度达50 000 reads时,覆盖度>0.99,已至饱和状态,表明本试验中测序饱和,测序量及测序深度合理,当前的测序量足够进行菌群多样性分析。
|
图 2 样本稀释曲线 Fig. 2 Sample dilution curve |
|
图 3 样本覆盖度曲线 Fig. 3 Sample coverage curve |
如表 3可知,Y1-3组、Y2-3组、Y3-3组的各Alpha多样性指数与对照组均无显著差异(P>0.05),但是总体分析可知Y1-3组、Y2-3组、Y3-3组的菌群丰度较CK-3组提高,且多样性增加,说明添加MOS可在一定程度上提高滩羊瘤胃菌群的多样性。
|
|
表 3 Alpha多样性指数 Table 3 Alpha diversity indexes |
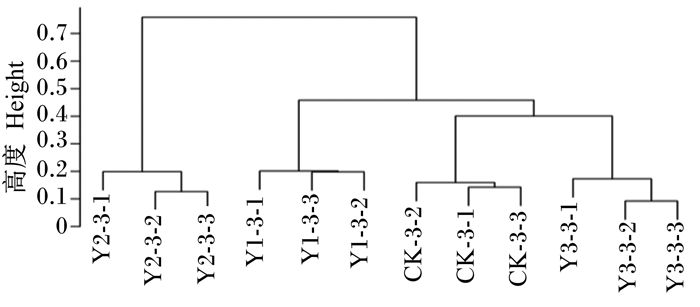
根据各样本丰度差异的统计结果,基于遗传距离矩阵,采用非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)对样本进行聚类分析。样本越靠近,枝长越短,说明2个样本的物种组成越相似。由图 4可知,与CK-3组样本的瘤胃菌群构成相比差异由大到小依次为Y2-3组、Y1-3组、Y3-3组,说明饲粮中添加不同水平的MOS对滩羊瘤胃菌群组成有不同的影响,饲粮中添加2%MOS时滩羊瘤胃菌群组成与饲粮不添加MOS时差异最大。
|
CK-3-1、CK-3-2、CK-3-3为CK-3组的3个样本,Y1-3-1、Y1-3-2、Y1-3-3为Y1-3组的3个样本,Y2-3-1、Y2-3-2、Y2-3-3为Y2-3组的3个样本,Y3-3-1、Y3-3-2、Y3-3-3为Y3-3组的3个样本。Three samples in CK-3 group were CK-3-1, CK-3-2, CK-3-3, in Y1-3 group were Y1-3-1, Y1-3-2, Y1-3-3, in Y2-3 group were Y2-3-1, Y2-3-2, Y2-3-3, and in Y3-3 group were Y3-3-1, Y3-3-2, Y3-3-3. 图 4 样本间物种组成聚类分析 Fig. 4 Cluster analysis of species composition among samples |
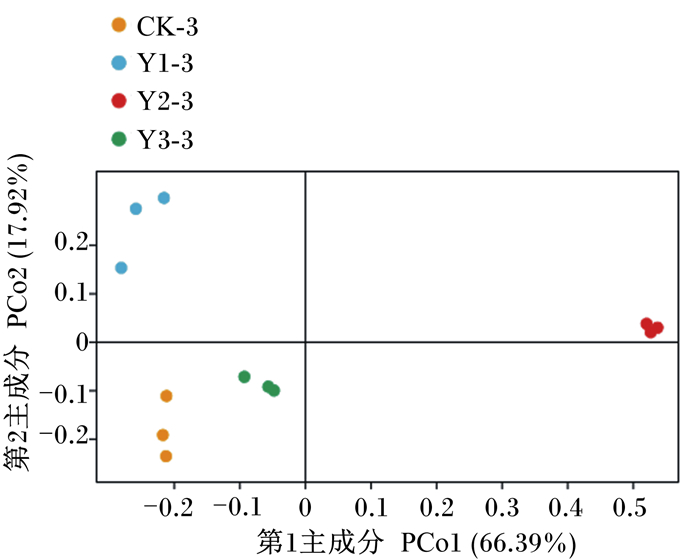
通过PCoA,可以观察到个体或者群体之间的差异。PCo1为第1主成分,表示分离样品66.39%的方差;PCo2为第2主成分,表示分离样品17.92%的方差。从图 5可知,与CK-3组相比,Y2-3组、Y3-3组的个体聚集度较高,而Y1-3组的个体聚集度降低,说明饲粮中添加2%或3%MOS均能使组内菌群组成相似性变得更高。Y2-3组的组内菌群组成相似性最高且与其他组间差异最大,说明饲粮中添加2%MOS对滩羊瘤胃菌群结构影响最大。
|
图 5 PCoA图 Fig. 5 PCoA map |
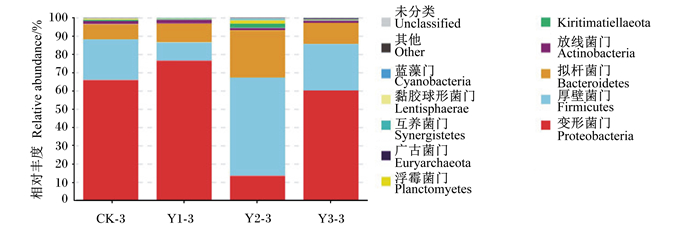
将试验得到的有效序列在不同分类水平上进行物种注释及组间统计分析。如图 6所示,在门水平上共注释得到12个菌门,相对丰度都在0.1%以上。变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为4组滩羊瘤胃菌群中的优势菌门。其中,变形菌门是CK-3组、Y1-3组和Y3-3组这3组中共享的优势菌门,而厚壁菌门、拟杆菌门是Y2-3组中的优势菌门。Y2-3组较其他组极显著提高了厚壁菌门、拟杆菌门的相对丰度(P < 0.01),极显著降低了变形菌门的相对丰度(P < 0.01),且此组中浮霉菌门(Planctomycetes)、Kiritimatiellaeota、黏胶球形菌门(Lentisphaerae)的相对丰度也较其他组高(表 4)。上述结果说明饲粮中添加不同水平MOS对滩羊瘤胃菌群中的优势菌门存在不同的影响,添加2%MOS提高了厚壁菌门、拟杆菌门的相对丰度,而降低了变形菌门的相对丰度。
|
图 6 门水平物种注释 Fig. 6 Phylogeny level species annotation |
|
|
表 4 门水平相对丰度 Table 4 Relative abundance at phylum level |
为了进一步探索不同添加水平的MOS对滩羊瘤胃菌群结构影响的差异,对各组菌群进行了属水平上的差异分析,总共得到56个菌属,但是由于种类太多且相对丰度太小,仅对排名前20的菌属进行分析,图 7为聚类热图,绿色越深代表细菌丰度越小,红色越深代表细菌丰度越大。结合图 7和表 5可知,CK-3组Rummeliibacillus、肠球菌属(Enterococcus)、链球菌属(Streptococcus)的相对丰度极显著大于其他组(P < 0.01),不动杆菌属(Acinetobacter)的相对丰度极显著大于Y1-3组和Y2-3组(P < 0.01)。Y1-3组丛毛单胞菌属(Comamonas)、埃希氏菌属-志贺菌属(Escherichia-Shigella)、寡养单胞菌属(Stenotrophomonas)、鞘氨醇杆菌属(Sphingobacterium)的相对丰度极显著大于其他组(P < 0.01)。Y2-3组赖氨酸芽孢杆菌属(Lysinibacillus)、普雷沃氏菌属1(Prevotella_1)、醋杆菌属(Acetobacter)、理岩菌科RC9肠道群(Rikenellaceae_RC9_gut_group)、克里斯滕森菌科R-7群(Christensenellaceae_R-7_group)、乳球菌属(Lactococcus)、解琥珀酸菌属(Succiniclasticum)、瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)、瘤胃球菌属(Ruminococcus)、小梨形菌属(Pirellula)的相对丰度极显著大于CK-3组(P < 0.01)。Y3-3组狭义梭菌属1(Clostridium_sensu_stricto_1)的相对丰度极显著大于其他组(P < 0.01)。p-1088-a5_gut_group、甲烷短杆菌属(Methanobrevibacter)的相对丰度在4组之间差异不显著(P>0.05)。

|
图 7 属水平物种注释 Fig. 7 Species annotation at genus level |
|
|
表 5 属水平相对丰度 Table 5 Relative abundance at genus level |
有研究表明瘤胃微生物可以利用饲粮中的寡糖,添加到饲粮中的寡糖在瘤胃中会被降解转化为挥发性脂肪酸[17]。在MOS降解的过程中,对瘤胃发酵模式会产生影响而增加丙酸的产量。有研究者比较了基础饲粮、基础饲粮+乳寡糖、基础饲粮+丝兰植物提取液、基础饲粮+乳酸链球菌肽4种饲粮对绵羊的影响,结果表明,各组干物质、有机物、粗蛋白质、中性洗涤纤维和酸性洗涤纤维的消化率相似,寡糖组微生物氮的供给量最高,乙酸含量最低,丙酸含量最高[18],说明瘤胃微生物可有效降解寡糖,但是由于瘤胃内环境的复杂性,目前尚不清楚这一系列变化的产生机理。
3.1 MOS对滩羊瘤胃发酵参数的影响瘤胃液pH可直观反映瘤胃内环境是否正常,其过高或过低均不利于瘤胃微生物的生长、增殖[19]。本试验中,4组滩羊瘤胃液pH变动范围为6.45~6.86,在瘤胃液pH的正常范围(5.5~7.5)内[20]。此外,本试验条件下,不同添加水平的MOS对滩羊瘤胃液pH无显著影响,这与张然等[21]的结果一致,即MOS添加水平在各时间点对体外瘤胃培养液pH没有产生显著影响,其分析原因可能是MOS添加水平(其最高添加水平为2%)太低。瘤胃液NH3-N含量可在一定程度上反映出瘤胃微生物分解含氮物质产生NH3-N及对其利用的情况。NH3-N含量过高,会增加瘤胃氮循环中氮素的损失,而NH3-N含量过低,则会限制纤维素分解菌分解纤维物质的效率[22]。本试验中,4组滩羊瘤胃液NH3-N含量在13.33~14.85 mg/dL,在大多研究者认可范围(10~50 mg/dL)之内[23]。本试验中,不同添加水平的MOS对滩羊瘤胃液NH3-N含量无显著影响,其中Y2-3组NH3-N含量最高。这可能是因为,添加2%MOS对纤维素分解菌分解纤维物质的效率的影响比其他组小,从而能保证纤维菌的正常生长增殖,也可能是2%MOS促进了分解含氮微生物的生长、增殖。瘤胃发酵类型及挥发性脂肪酸产量主要与饲粮的类型密切相关[24],一般而言,粗饲料中纤维素、半纤维素、木质素的含量较高,瘤胃中发酵产生的乙酸比例较高。本试验中,Y2-3组瘤胃液乙酸含量显著高于Y3-3组、CK-3组且高于Y1-3组,在同等饲粮条件下,可能的原因是添加2%MOS促进了纤维分解菌的增殖,从而促进了纤维物质的降解。总体而言,添加不同水平MOS均可保证滩羊瘤胃内环境正常。
3.2 MOS对滩羊瘤胃菌群多样性的影响瘤胃微生物群落结构和多样性长期以来一直是研究的热点话题[25]。近几年,16S rDNA高通量测序技术被用来研究反刍动物瘤胃微生物群落结构,更利于学者对瘤胃细菌遗传多样性的探究[26-27]。本研究基于16S rDNA高通量测序技术,探究添加不同水平MOS对滩羊瘤胃菌群多样性的影响。通过质控测序共得888 992个有效序列用于后续多样性组成分析。各组样本稀释曲线趋于平缓,表明测序深度覆盖了样本中的大部分微生物,且覆盖度>0.99,说明测序量和测序深度合理。Alpha多样性是对样本中物种丰富度和多样性进行分析,主要包括Chao1指数、Ace指数、Shannon指数和、Simpson指数,前2个指数可以反映样品中群落的丰富数值,该值越大说明物种数量越多,即丰富度越高;后2个指数表示群落的多样性,Shannon指数越大,Simpson指数越接近1,表明多样性越高[28]。本试验中4组滩羊瘤胃菌群Alpha多样性指数无显著差异,但是总体来看,添加MOS组的瘤胃菌群多样性较对照组有所增加,其中添加2%MOS组对瘤胃菌群多样性影响最大,由Beta多样性分析可知添加2%MOS组的瘤胃菌群构成与对照组相比差异最大。有研究者在锦江黄牛饲粮中添加功能性寡糖组合,结果表明可提升瘤胃液微生物种类[29],与本试验研究结果一致。有研究报道,MOS添加方式对哺乳期犊牛瘤胃菌群多样性未产生显著影响[30]。有研究表明,低聚糖可通过改变羔羊断奶引起的肠道菌群变化及改变微生物的代谢等来影响动物的生产性能[31]。Newman等[32]在犊牛饲粮每天添加2 g MOS,5周后粪便中大肠杆菌数量明显降低且呼吸道疾病减少,从而提高生产性能。赵晓静等[33]在犊牛饲粮中分别添加0.1%和0.2%(干物质基础)的MOS,结果显示添加0.1%组在降低大肠杆菌和增加乳酸杆菌数量方面均较不添加组和添加0.2%组优势明显。任海军[34]研究发现,饲粮中添加0.1%壳聚糖显著增加了奶牛肠道乳酸杆菌数量且降低了大肠杆菌数量。以上结果均说明,添加一定水平的MOS可在一定程度上提高滩羊瘤胃菌群的多样性。
3.3 MOS对滩羊瘤胃菌群结构的影响有研究发现,拟杆菌门、厚壁菌门是反刍动物纤维物质降解的主要菌群,因此瘤胃中拟杆菌门、厚壁菌门丰度的高低与纤维物质降解紧密相关[35-36]。本试验中, 变形菌门、厚壁菌门和拟杆菌门为4组中的优势菌门,与不添加MOS组菌群结构组成相比差异由大到小的添加水平依次为2%、1%、3%,其中添加2%MOS组厚壁菌门、拟杆菌门的相对丰度最高,说明添加2%MOS组滩羊的瘤胃内环境更利于瘤胃细菌对荞麦秸秆等纤维物质的降解,在奶牛饲粮中添加MOS同样发现能够改善瘤胃中纤维素降解菌的丰度和活性[37-38]。另有研究表明变形菌门丰度的大量增加是胃肠道菌群失调的微生态标志[39]。本试验中添加2%MOS组使变形菌门的相对丰度降低,说明在荞麦秸秆饲粮条件下添加2%MOS可能有利于维持滩羊瘤胃菌群微生态平衡,具体机制还有待研究。浮霉菌门是严格厌氧的革兰氏阴性细菌,有研究者为了研究浮霉菌门沿化学梯度的分布,对整个Sælenvannet湖的水柱进行了采样,并使用16S rDNA扩增子测序和454焦磷酸测序对微生物群落进行了描述,结果表明与浮霉菌门相关的16S rDNA基因序列在湖泊的缺氧和氧化部分都存在,并且在整个水柱中分布不均,在15 m深的盐碱地缺氧层中其相对丰度最高,为10%[40]。另外,有研究者在研究黄粉虫降解肠道塑料废物的能力时发现,其肠道浮霉菌门可以降解燕麦等纤维类饲料,但是在饲喂聚苯乙烯后浮霉菌门的摄食频率增加[41]。黏胶球形菌门与纤维二糖的降解有关,郭威等[42]研究发酵玉米秸秆对绵羊瘤胃菌群结构的影响时发现,黏胶球形菌门和纤维杆菌门均为绵羊瘤胃中的优势菌群。本试验中,添加2%MOS组滩羊瘤胃菌群中浮霉菌门、Kiritimatiellaeota和黏胶球形菌门的相对丰度较其他组高,说明添加2%MOS有利于增加与纤维分解有关的菌,从而促进荞麦秸秆等纤维物质的降解。
在属水平上,本试验中的4组滩羊瘤胃中不同菌群的相对丰度差异明显。相比其他组,添加2%MOS对滩羊瘤胃菌群结构及其相对丰度影响最大,其中赖氨酸芽孢杆菌属、普雷沃氏菌属1、醋杆菌属为优势菌属且其相对丰度极显著大于其他组。普雷沃氏菌属具有多种功能,它不仅能促进最初的蛋白质分解并协同其他分解纤维素菌发挥作用,提高机体对纤维素的分解能力[43],且对植物中非纤维性多糖和蛋白质的降解也有一定的作用[44]。本试验结果说明添加2%MOS可促进滩羊瘤胃中普雷沃氏菌的增殖,从而增强对荞麦秸秆等相关纤维物质的降解能力。另外,添加2%MOS组滩羊瘤胃菌群中理岩菌科RC9肠道群、解琥珀酸菌属、瘤胃球菌属的相对丰度也极显著大于其他组。普雷沃氏菌属1和理岩菌科RC9肠道群都属于拟杆菌门[45],所以可推测理岩菌科RC9肠道群可能是与非纤维植物成分降解有关的细菌。瘤胃球菌属和琥珀酸菌属均有降解纤维物质的能力[46-47]。瘤胃球菌科NK4A214群属于瘤胃球菌科,有研究表明瘤胃球菌科是一类典型的纤维降解菌[48],饲粮中性洗涤纤维的消化率随着瘤胃球菌科丰度的增加而增加[49-50]。也有研究表明瘤胃球菌科可促进宿主对饲粮中氮的消化和利用[51-52]。另外,本试验结果显示,添加2%MOS组滩羊瘤胃菌群中克里斯滕森菌科R-7群、乳球菌属、小梨形菌属的相对丰度也极显著大于其他组,这些微生物可能在滩羊瘤胃体内扮演着重要的生理及生态角色。
4 结论① 本试验条件下,饲粮中添加不同水平MOS均可保证滩羊瘤胃内环境正常。
② 本试验条件下,饲粮中添加MOS可增加滩羊瘤胃菌群的多样性,其中2%MOS对其影响最大。
③ 本试验条件下,饲粮中添加2%MOS对滩羊瘤胃菌群结构影响最大,可提高纤维素降解菌的相对丰度,有利于增强滩羊对饲粮纤维物质的降解能力。
| [1] |
AGARWAL N, KAMRA D N, CHAUDHARY L C. Rumen microbial ecosystem of domesticated ruminants[M]//PUNIYA A, SINGH R, KAMRA D. Rumen microbiology: from evolution to revolution. New Delhi: Springer, 2015: 17-30.
|
| [2] |
KNOELL A L, ANDERSON C L, PESTA A C, et al. Alterations of the rumen bacterial and archaeal communities in growing and finishing beef cattle and its effects on methane emissions[J]. Journal of Animal Science, 2016, 94(Suppl.2): 53-54. |
| [3] |
PITTA D W, INDUGU N, KUMAR S, et al. Metagenomic assessment of the functional potential of the rumen microbiome in Holstein dairy cows[J]. Anaerobe, 2015, 38: 50-60. |
| [4] |
PATEL S, GOYAL A. Functional oligosaccharides: production, properties and applications[J]. World Journal of Microbiology and Biotechnology, 2010, 27(5): 1119-1128. |
| [5] |
刘卫东, 宋素芳, 程璞. 甘露寡糖和益生菌对肉仔鸡生产性能和肠道菌群的影响[J]. 家畜生态学报, 2011, 32(1): 32-35. LIU W D, SONG S F, CHENG P. Effects of mannan oligosaccharides and probiotics on production performance and intestinal flora of broilers[J]. Journal of Domestic Animal Ecology, 2011, 32(l): 32-35 (in Chinese). |
| [6] |
万嘉佳, 蒋敏, 李恒, 等. 低聚合度魔芋甘露寡糖对正常小鼠肠道及微生物菌群的影响[J]. 食品与发酵工业, 2015, 41(9): 13-18. WAN J J, JIANG M, LI H, et al. Effects of low degree of polymerization konjac mannan oligosaccharide on intestinal tract and microflora of normal mice[J]. Food and Fermentation Industry, 2015, 41(9): 13-18 (in Chinese). |
| [7] |
张学峰. 外源寡糖在绵羊消化道内的降解、转化、利用和流通规律及其对瘤胃微生物区系、免疫和营养物质消化影响的研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2007. ZHANG X F. Studies on the degradation, transformation, utilization and circulation of exogenous oligosaccharides in the digestive tract of sheep and their effects on rumen microflora, immunity and nutrient digestion[D]. Ph. D. Thesis. Hohhot: Inner Mongolia Agricultural University, 2007. (in Chinese) |
| [8] |
DUAN X D, CHEN D W, ZHENG P, et al. Effects of dietary mannan oligosaccharide supplementation on performance and immune response of sows and their offspring[J]. Animal Feed Science and Technology, 2016, 218: 17-25. DOI:10.1016/j.anifeedsci.2016.05.002 |
| [9] |
GIANNENAS I, DOUKAS D, KARAMOUTSIOS A, et al. Effects of Enterococcus faecium, mannan oligosaccharide, benzoic acid and their mixture on growth performance, intestinal microbiota, intestinal morphology and blood lymphocyte subpopulations of fattening pigs[J]. Animal Feed Science and Technology, 2016, 220: 159-167. DOI:10.1016/j.anifeedsci.2016.08.003 |
| [10] |
VALPOTIĆ H M, SAMARDŽIJA S, TERZⅡĆ S, et al. Effect of mannan oligosaccharide supplementation on blood and intestinal immune cells, bacteria numbers and performance in weaned pigs[J]. Acta Veterinaria Brno, 2016, 85(3): 267-276. DOI:10.2754/avb201685030267 |
| [11] |
BOZKURT M E, BINTŞ S, KIRKAN H, et al. Comparative evaluation of dietary supplementation with mannan oligosaccharide and oregano essential oil in forced molted and fully fed laying hens between 82 and 106 weeks of age[J]. Poultry Science, 2016, 95(11): 2576-2591. DOI:10.3382/ps/pew140 |
| [12] |
ATTIA Y A, ABDAL-HAMID A E, IBRAHIM M S, et al. Productive performance, biochemical and hematological traits of broiler chickens supplemented with propolis, bee pollen, and mannan oligosaccharides continuously or intermittently[J]. Livestock Science, 2014, 164: 87-95. DOI:10.1016/j.livsci.2014.03.005 |
| [13] |
ABDEL-HAMID T M, FARAHAT M H. Effect of dietary mannan-oligosaccharides on some blood biochemical, haematological parameters and carcass traits in purebred New Zealand White and crossbred rabbits[J]. Animal Production Science, 2016, 56(12): 2133-2139. DOI:10.1071/AN15032 |
| [14] |
顾君华, 王欣. 安全饲料和绿色饲料的最终目标和途径[J]. 饲料工业, 2002, 23(8): 1-4. GU J H, WANG X. The ultimate goal and approach of safe feed and green feed[J]. Feed Industry, 2002, 23(8): 1-4 (in Chinese). |
| [15] |
ZHENG C, LI F D, HAO Z L, et al. Effects of adding mannan oligosaccharides on digestibility and metabolism of nutrients, ruminal fermentation parameters, immunity, and antioxidant capacity of sheep[J]. Journal of Animal Science, 2018, 96(1): 284-292. DOI:10.1093/jas/skx040 |
| [16] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 内蒙古畜牧科学, 1993(4): 40-41. FENG Z C, GAO M. An improved method for determining the content of ammonia nitrogen in rumen fluid by colorimetry[J]. Inner Mongolia Animal Husbandry Science, 1993(4): 40-41 (in Chinese). |
| [17] |
祁茹, 肖宇, 褚永康, 等. 外源寡糖对反刍动物胃肠道微生物区系的影响[J]. 饲料博览, 2011(12): 32-34. QI R, XIAO Y, CHU Y K, et al. effects of exogenous oligosaccharides on gastrointestinal microflora of ruminants[J]. Feed Review, 2011(12): 32-34 (in Chinese). DOI:10.3969/j.issn.1001-0084.2011.12.013 |
| [18] |
SANTOSO B. Influence of galacto-oligosaccharides supplementation on nitrogen utilization, rumen fermenterion, and microbial nitrogen supply in dairy cows fed silage[J]. Animal Science, 2003, 16(8): 1137-1142. |
| [19] |
HOOVER W H, KINCAID C R, VARGA G A, et al. Effects of solids and liquid flows on fermentation in continuous cultures.Ⅳ.pH and dilution rate[J]. Journal of Animal Science, 1984, 58(3): 692-699. DOI:10.2527/jas1984.583692x |
| [20] |
王加启, 冯仰廉. 不同粗饲料日粮发酵规律及合成瘤胃微生物蛋白质效率研究[J]. 黄牛杂志, 1994, 20(增刊2): 82-85. WANG J Q, FENG Y L. Study on fermentation regularity of different roughage diets and efficiency of rumen microbial protein synthesis[J]. Scalper Magazine, 1994, 20(Suppl.2): 82-85 (in Chinese). |
| [21] |
张然, 郑琛, 韩海珠, 等. 应用Rusitec-S系统研究甘露寡糖对绵羊体外瘤胃发酵的影响[J]. 草业科学, 2018, 35(9): 2262-2269. ZHANG R, ZHENG C, HAN H Z, et al. The effect of mannan-oligosaccharide on rumen fermentation of sheep in vitro was studied by Rusitec-S system[J]. Pratacultural Science, 2018, 35(9): 2262-2269 (in Chinese). |
| [22] |
HRISTOV A N, ROPP J K, HUNT C W. Effect of barley and its amylopectin content on ruminal fermentation and bacterial utilization of ammonia-N in vitro[J]. Animal Feed Science and Technology, 2002, 99(1/2/3/4): 25-36. |
| [23] |
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988. HAN Z K, CHEN J. Rumen digestion and metabolism of ruminants[M]. Beijing: Science Press, 1988 (in Chinese). |
| [24] |
汪水平, 王文娟, 王加启, 等. 日粮精粗比对奶牛瘤胃发酵及泌乳性能的影响[J]. 西北农林科技大学学报(自然科学版), 2007, 35(6): 45-50. WANG S P, WANG W J, WANG J Q, et al. Effect of dietary concentrate/roughage ratio on rumen fermentation and lactation performance of dairy cows[J]. Journal of Northwestern University of Agriculture and Forestry (Natural Science Edition), 2007, 35(6): 45-50 (in Chinese). |
| [25] |
AZEVEDO A C, BENTO C B P, RUIZ J C, et al. Distribution and genetic diversity of bacteriocin gene clusters in rumen microbial genomes[J]. Applied and Environmental Microbiology, 2015, 81(20): 7290-7304. DOI:10.1128/AEM.01223-15 |
| [26] |
HENDERSON G, COX F, GANESH S, et al. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range[J]. Scientific Reports, 2015, 5: 14567. DOI:10.1038/srep14567 |
| [27] |
WANG Y Y, CAO P H, WANG L, et al. Bacterial community diversity associated with different levels of dietary nutrition in the rumen of sheep[J]. Applied Microbiology and Biotechnology, 2017, 101(9): 3717-3728. DOI:10.1007/s00253-017-8144-5 |
| [28] |
HUO W J, ZHU W Y, MAO S Y. Impact of subacute ruminal acidosis on the diversity of liquid and solid-associated bacteria in the rumen of goats[J]. World Journal of Microbiology and Biotechnology, 2014, 30(2): 669-680. DOI:10.1007/s11274-013-1489-8 |
| [29] |
闵力. 功能性寡糖组合对锦江黄牛瘤胃微生物区系的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2012. MIN L. Effect of functional oligosaccharide combination on rumen microflora of Jinjiang yellow cattle[D]Master's Thesis. Nanchang: Jiangxi Agricultural University, 2012. (in Chinese) |
| [30] |
冶文兴, 张洁, 陈林, 等. 甘露寡糖添加方式对哺乳期犊牛瘤胃细菌菌群结构的影响[J]. 草业科学, 2020, 37(5): 984-992. YE W X, ZHANG J, CHEN L, et al. Effect of mannose oligosaccharide addition on rumen bacterial flora structure of lactating calves[J]. Pratacultural Science, 2020, 37(5): 984-992 (in Chinese). |
| [31] |
WANG Y, HAN F, HU B, et al. In vivo prebiotic properties of alginate oligosaccharides prepared through enzymatic hydrolysis of alginate[J]. Nutrition Research, 2006, 26(11): 597-603. DOI:10.1016/j.nutres.2006.09.015 |
| [32] |
NEWMAN K, JACQUEA K, BUEDE R. Effect of mannan-oligosaccharide supplementation on performance and fecal bacteria of Holstein calves[J]. Journal of Animal Sciences, .1993, 71(Suppl.1): 271. |
| [33] |
赵晓静, 李建国, 李秋凤, 等. 甘露寡糖对犊牛粪便菌群影响的研究[J]. 中国畜牧杂志, 2007, 43(5): 31-34. ZHAO X J, LI J G, LI Q F, et al. Study on the effect of mannan oligosaccharides on fecal microflora of calves[J]. Chinese Journal of Animal Science, 2007, 43(5): 31-34 (in Chinese). DOI:10.3969/j.issn.0258-7033.2007.05.011 |
| [34] |
任海军. 壳聚糖对奶牛产奶性能和免疫功能影响的研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2008. REN H J. Effects of chitosan on milk production performance and immune function of dairy cattle[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2008. (in Chinese) |
| [35] |
SPENCE C, WELLS W G, SMITH C J. Characterization of the primary starch utilization operon in the obligate anaerobe Bacteroides fragilis: regulation by carbon source and oxygen[J]. Journal of Bacteriology, 2006, 188(13): 4663-4672. DOI:10.1128/JB.00125-06 |
| [36] |
BRULC J M, ANTONOPOULOS D A, MILLER M E B, et al. Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases[J]. Proceeding of the National Academy of Sciences of the United States of America, 2009, 106(6): 1948-1953. DOI:10.1073/pnas.0806191105 |
| [37] |
RAJENDHRAN J, GUNASEKARAN P. Microbial phylogeny and diversity: small subunit ribosomal RNA sequence analysis and beyond[J]. Microbiological Research, 2011, 166(2): 99-110. DOI:10.1016/j.micres.2010.02.003 |
| [38] |
赵广存. 牛瘤胃未培养微生物纤维素酶基因的克隆、鉴定及表达[D]. 硕士学位论文. 南宁: 广西大学, 2005. ZHAO G C. Cloning, Identification and expression of cellulase gene from uncultured bovine rumen[D]. Master's Thesis. Nanning: Guangxi University, 2005. (in Chinese) |
| [39] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [40] |
STORESUND J E, LANZÈN A, NORDMANN E L, et al. Planctomycetes as a vital constituent of the microbial communities inhabiting different layers of the meromictic lake Sælenvannet (Norway)[J]. Microorganisms, 2020, 8(8): 1150. DOI:10.3390/microorganisms8081150 |
| [41] |
PRZEMIENIECKI S W, KOSEWSKA A, CIESIELSKI S, et al. Changes in the gut microbiome and enzymatic profile of Tenebrio molitor larvae biodegrading cellulose, polyethylene and polystyrene waste[J]. Environment Pollution, 2020, 256: 113265. DOI:10.1016/j.envpol.2019.113265 |
| [42] |
郭威, 郭晓军, 周贤, 等. 复合菌剂发酵玉米秸秆对绵羊瘤胃液细菌多样性的影响[J]. 畜牧兽医学报, 2018, 49(4): 736-745. GUO W, GUO X J, ZHOU X, et al. Effect of corn straw fermented with compound bacteria on the multiplicity of microflora in sheep rumen fluid[J]. Journal of Animal Husbandry and Veterinary Medicine, 2018, 49(4): 736-745 (in Chinese). |
| [43] |
杨琦玥, 黄勇, 陈亚冰, 等. 16S rRNA高通量测序技术筛选牦牛瘤胃细菌基因组DNA提取方法及菌群结构[J]. 中国农业科学, 2017, 50(5): 932-941. YANG Q Y, HUANG Y, CHEN Y B, et al. Screening of genomic DNA extraction and flora structure of rumen bacteria of yak by 16S rRNA high-throughput sequencing technique[J]. Chinese Agricultural Sciences, 2017, 50(5): 932-941 (in Chinese). |
| [44] |
GRISWOLD K E, WHITE B A, MACKIE R I. Diversity of extracellular proteolytic activities among Prevotella species from the rumen[J]. Current Microbiology, 1999, 39(4): 187-194. DOI:10.1007/s002849900443 |
| [45] |
CUI X X, WANG Z F, YAN T H, et al. Rumen bacterial diversity of Tibetan sheep (Ovis aries) associated with different forage types on the Qinghai-Tibetan plateau[J]. Canadian Journal of Microbiology, 2019, 65(12): 859-869. DOI:10.1139/cjm-2019-0154 |
| [46] |
GRILLI D J, CERÓN M E, PAEZ S, et al. Isolation of Pseudobutyrivibrio ruminis and Pseudobutyrivibrio xylanivorans from rumen of Creole goats fed native forage diet[J]. Folia Microbiologica, 2012, 58(5): 367-373. |
| [47] |
KOIKE S, KOBAYASHI Y. Fibrolytic rumen bacteria: their ecology and functions[J]. Asian-Australasian Journal of Animal Sciences, 2009, 22(1): 131-138. DOI:10.5713/ajas.2009.r.01 |
| [48] |
EZAKI T. Ruminococcus[M]New York: John Wiley & Sons, Ltd., 2015.
|
| [49] |
PATRA A K, YU Z T. Essential oils affect populations of some rumen bacteria in vitro as revealed by microarray (RumenBactArray) analysis[J]. Frontiers in Microbiology, 2015, 6: 297. |
| [50] |
ZHAO X H, CHEN Z D, ZHOU S, et al. Effects of daidzein on performance, serum metabolites, nutrient digestibility, and fecal bacterial community in bull calves[J]. Animal Feed Science and Technology, 2017, 225: 87-96. DOI:10.1016/j.anifeedsci.2017.01.014 |
| [51] |
KANG J H, ZENG B, TANG S X, et al. Effects of Momordica charantia polysaccharide on in vitro ruminal fermentation and cellulolytic bacteria[J]. Italian Journal of Animal Science, 2017, 16(2): 226-233. DOI:10.1080/1828051X.2017.1289825 |
| [52] |
WANG L Z, LIU K Z, WANG Z S, et al. Bacterial community diversity associated with different utilization efficiencies of nitrogen in the gastrointestinal tract of goats[J]. Frontiers in Microbiology, 2019, 10: 239. DOI:10.3389/fmicb.2019.00239 |




