2. 兰州大学草地农业科技学院, 草地农业生态系统国家重点实验室, 农业农村部草牧业创新重点实验室, 兰州 730020
2. Key Laboratory of Grassland Livestock Industry Innovation, Ministry of Agriculture and Rural Affairs, State Key Laboratory of Grassland Agro-Ecosystem, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China
随着畜禽养殖规模化、集约化的不断发展,养殖环境污染等问题越来越严重,由此影响畜禽健康,导致动物免疫力低下、易受病原菌侵袭等。在畜禽饲粮中添加抗生素可以增强动物自身免疫力,但却导致抗生素残留和细菌耐药性等问题,严重危害畜禽养殖环境和畜产品质量安全。因此,开发安全高效、无残留的新型饲料添加剂成为科研工作者的研究重点。绿原酸作为一种广泛存在于天然植物中的多酚类物质,具有抗氧化[1]、抗炎[2]、抑菌[3]、抗病毒[4]及抗癌[5]等生物学功能。其中,金银花、山银花、杜仲叶以及咖啡豆等是绿原酸的主要来源[6]。研究发现,添加绿原酸能够缓解动物肠道氧化应激和炎症,维持肠道稳态和免疫机能,保障动物肠道健康[7-8]。因此,绿原酸可作为一种潜在的增强动物自身免疫力的饲料添加剂。本文就国内外研究现状,简要介绍绿原酸的来源,系统总结绿原酸的生理功能及其可能的作用机理,并探讨其作为饲料添加剂在畜禽生产中的应用。
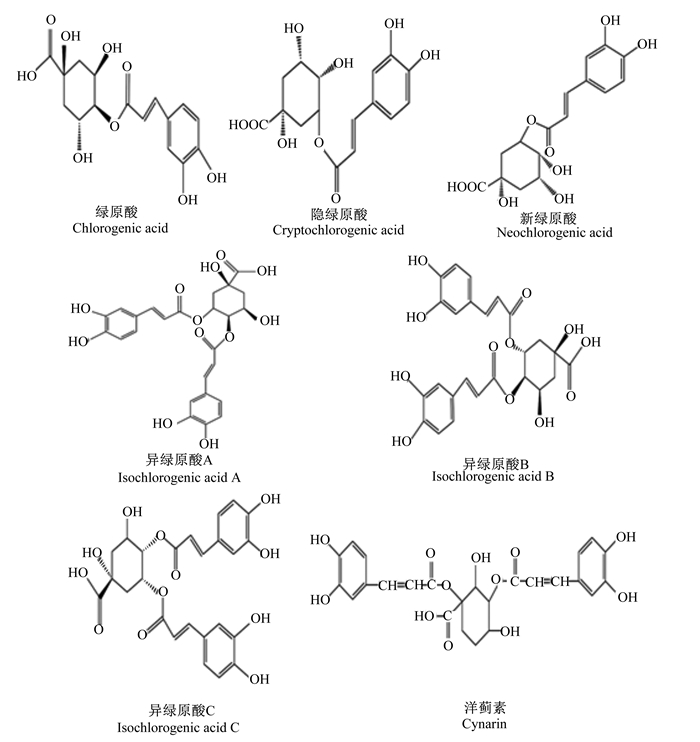
1 绿原酸绿原酸在植物中广泛存在,属于苯丙烯酸(羟基肉桂酸)家族,具有6个异构体,分别为隐绿原酸(4-咖啡酰奎宁酸)、新绿原酸(5-咖啡酰奎宁酸)、异绿原酸A(3, 5-二咖啡酰奎宁酸)、异绿原酸B(3, 4-二咖啡酰奎宁酸)、异绿原酸C(4, 5-二咖啡酰奎宁酸)和洋蓟素(1, 3-二咖啡酰奎宁酸)[9](图 1)。Payen[10]于1864年首次报道发现绿原酸,其从咖啡中提取出一种物质,约占咖啡总量的5%,发现该种物质在碱性氧化物的作用下变为绿色,并将其命名为“绿原酸”。后续有报道指出,奎宁酸和咖啡酸能合成一种白色晶体物质,即为绿原酸,具体为奎宁酸与咖啡酸结合形成半绿原酸,2分子半绿原酸缩合,失去1分子水生成绿原酸[11]。21世纪初,随着质谱和高效液相色谱技术的发展,绿原酸的分子结构和化学性质逐渐被清晰认识[12],并且研究发现,绿原酸具有抗氧化[1, 13]、抗炎[2]、抑菌[3, 6]、抗病毒[4]及抗癌[5]等多种生理功能,目前已被应用于保健食品、医药等领域。
|
图 1 绿原酸及其异构体的分子结构 Fig. 1 Molecular structure of chlorogenic acid and its isomers |
绿原酸主要提取自金银花、山银花、杜仲叶和元宝枫叶等中草药的茎叶。我国中草药资源丰富,这为绿原酸的开发和利用提供了有力保障。据国家林业局颁布的《全国杜仲产业发展规划(2016—2030年)》[14],预计2030年,我国杜仲种植面积将达到233.33万hm2。杜仲植株的叶子是绿原酸的主要提取部位,不同的季节绿原酸的含量不同,以6月含量最高[15]。元宝枫是槭树科槭树属的一种落叶乔木,其枫叶中含有绿原酸和黄酮等多种活性成分,与杜仲类似,6月份绿原酸含量最高,可达4%左右[16]。此外,忍冬科植物山银花(又名山花)广泛分布于我国南方各地,尤其在四川、广东和广西等地,也是绿原酸的重要来源之一。
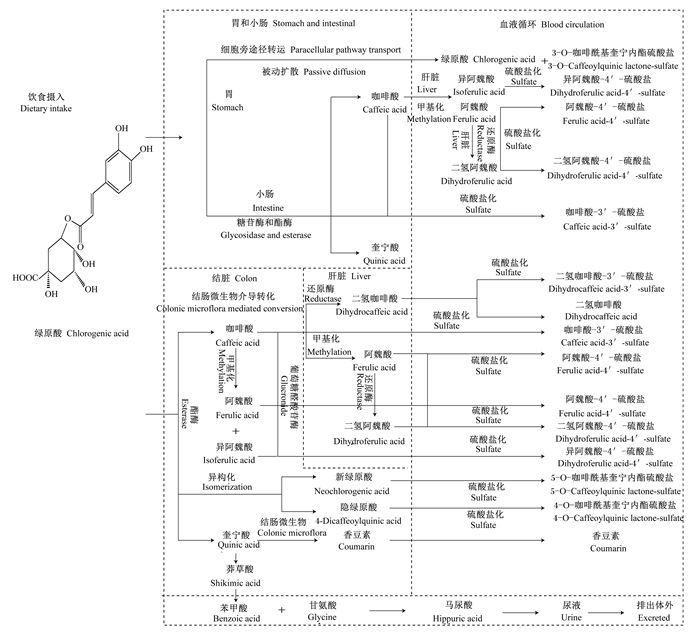
2 绿原酸在动物体内的代谢途径绿原酸在动物胃和小肠中,主要代谢生成咖啡酸和奎宁酸[6]。研究表明,只有约1/3绿原酸在胃和小肠被吸收,其主要原因在于绿原酸的亲水性使其较难通过亲脂性的膜屏障[17]。细胞培养试验发现,绿原酸及其异构体在胃上皮细胞的吸收机制,发现均以细胞旁途径转运、被动扩散方式吸收,其中异绿原酸(异绿原酸A、异绿原酸B和异绿原酸C)、绿原酸、新绿原酸以及隐绿原酸的表观渗透系数约为0.2 cm/s,时间和浓度梯度呈线性关系[18]。另外,大鼠胃结扎后灌服绿原酸,在胃的静脉和主动脉均检测到绿原酸[19],这也证实了绿原酸在胃内以原型被吸收。Stalmach等[20]研究发现,给健康人饮用咖啡(含有412 μmol的绿原酸)后1 h,在血浆中检测到绿原酸的代谢产物咖啡酸-3′-硫酸盐、阿魏酸-4′-硫酸盐以及3-O-咖啡酰基奎宁内酯硫酸盐,说明绿原酸在小肠中发生分解。而小鼠小肠灌注绿原酸,发现部分绿原酸在小肠中被糖苷酶和酯酶分解,酯键断裂生成奎宁酸和咖啡酸[21];其中部分咖啡酸被肠道吸收,通过肝肠循环进入肝脏,咖啡酸的羟基儿茶酚邻位在甲基转移酶的作用下发生甲基化,形成邻位羟基-甲氧基,转化为阿魏酸和异阿魏酸[21]。部分阿魏酸在还原酶的作用下生成二氢阿魏酸,阿魏酸、异阿魏酸以及二氢阿魏酸由肝静脉进入血液循环[21-22],部分发生硫酸盐化,分别生成阿魏酸-4′-硫酸盐、异阿魏酸-4′-硫酸盐以及二氢阿魏酸-4′-硫酸盐[21]。另外,小鼠小肠灌注绿原酸,在血浆中并未检测到奎宁酸及其代谢产物,可能是奎宁酸并未在小肠中被吸收,而是在结肠被肠道菌群代谢[23]。再者,小肠中部分绿原酸被肠道直接吸收,进入血液循环系统,发生硫酸盐化反应生成硫酸盐代谢产物[6, 24]。
未被胃和小肠吸收的绿原酸直接进入大肠,约占总量的2/3,结肠对其代谢和吸收发挥关键作用[23]。大部分绿原酸在结肠被大肠杆菌、双歧杆菌和加氏乳杆菌等菌群产生的酯酶水解生成咖啡酸和奎宁酸[23]。还有部分绿原酸发生酯基位置异构形成新绿原酸和隐绿原酸,进入血液循环系统,发生硫酸盐化反应分别生成5-O-咖啡酰基奎宁内酯硫酸盐和4-O-咖啡酰基奎宁内酯硫酸盐[21]。绿原酸分解生成的咖啡酸有2种代谢途径:1)通过细胞旁途径转运和被动扩散方式吸收[22],进入肝脏进行后续代谢[25],在肝脏中还原酶作用下发生氢化作用生成二氢咖啡酸,二氢咖啡酸通过肝静脉进入血液循环,部分二氢咖啡酸发生硫酸盐化,生成二氢咖啡酸-3′-硫酸盐[23],或者与小肠中咖啡酸进入肝脏代谢途径相同[23];2)未被肠道吸收的一部分咖啡酸由肠道菌群作用发生甲基化反应生成阿魏酸和异阿魏酸,而后被肠道直接吸收,进入血液循环,发生硫酸盐化反应,分别生成阿魏酸-4′-硫酸盐和异阿魏酸-4′-硫酸盐[22]。还有一种途径是阿魏酸、异阿魏酸以及肠道中未降解的咖啡酸在肠道中发生葡糖苷酸化代谢,以葡糖苷酸化形式吸收[26]。绿原酸分解生成的奎宁酸在结肠微生物的作用下,代谢产生马尿酸和香豆素[27]。其中马尿酸的生成途径为:奎宁酸在肠道菌群的作用下首先脱去1分子水形成莽草酸,而后莽草酸脱甲基形成苯甲酸,苯甲酸与甘氨酸结合形成马尿酸随尿液排出体外[27]。奎宁酸分解生成的香豆素被肠道直接吸收进入血液循环。研究证实,口服绿原酸,在动物的血浆和尿液中均检测到绿原酸的代谢产物阿魏酸、马尿酸以及香豆素[19]。另外,酯化后生成的新绿原酸在儿茶酚-O-甲基转移酶作用下发生甲基化反应生成5-阿魏酰奎宁酸,进而被肠道微生物产生的酯酶水解形成阿魏酸和奎宁酸。后续代谢途径与上述相同[22]。综上所述,绿原酸在体内的主要代谢途径如图 2所示。
3 绿原酸的生理功能及其作用机理 3.1 抗氧化酚类物质因含有酚羟基而具有抗氧化作用,羟基的位置和数量决定酚类物质抗氧化能力的强弱。绿原酸分子结构包含5个酚羟基和1个羧基,其中酚羟基易与自由基发生反应,形成具有抗氧化作用的氢自由基,因此,绿原酸具有较强的清除自由基和抗氧化的生物学功能[28]。细胞色素P450 2E1(cytochrome P450 2E1,CYP2E1)和细胞色素P450 4A(cytochrome P450 4A,CYP4A)均属于细胞色素P450[29]。当机体发生氧化应激时,活性氧(reactive oxygen species,ROS)增加,CYP2E1能够辅助脂质发生过氧化,改变呼吸链,进一步诱导产生更严重的氧化应激[29]。而CYP4A是一种氧化应激的引发剂,能够促进肝脏脂质过氧化,其在肝脏中的表达上调也伴随ROS的产生[30]。体外HepG2细胞试验发现,高浓度的绿原酸(2 mmol/L)通过抑制CYP2E1和CYP4A的表达来改善油酸诱导的细胞氧化损伤[31]。绿原酸还能调控相关信号通路发挥抗氧化作用。在乙酰氨基酚诱导的小鼠肝脏急性衰竭模型中,提前口服绿原酸能够缓解肝脏损伤,主要作用机制是通过增加血红素加氧酶-1(heme oxygenase-1,HO-1)和NADPH醌脱氢酶1基因的表达量,激活细胞核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)信号通路,发挥自身的抗氧化作用[32]。类似的,在四氯化碳诱导小鼠肝纤维化的损伤模型研究中,给小鼠腹腔注射金银花提取物(主要成分为绿原酸),同样发现能激活Nrf2信号通路,降低氧化应激,缓解肝损伤[33]。此外,还有报道指出,绿原酸能够降低氧化应激诱导的白细胞介素-8的分泌及其转录表达[34]。另外,肉鸡饲粮中添加1 000 mg/kg绿原酸可提高肉鸡的抗热应激能力和鸡胸肉的氧化稳定性[35];断奶仔猪饲粮中添加1 000 mg/kg绿原酸,可显著提高仔猪血清中超氧化物歧化酶、谷胱甘肽过氧化物酶以及过氧化氢酶的活性,并且降低腹泻率,表明绿原酸具有提高动物机体的抗氧化能力的作用[36]。总之,绿原酸通过降低ROS水平和激活Nrf2信号通路降低或阻止氧化应激的发生,达到抗氧化的效果,其作为饲料添加剂可提高动物机体的抗氧化能力。
3.2 抗炎炎症反应是机体保护自身的一种免疫反应,但炎症因子的过度激活会导致组织损伤、器官衰竭,如不能及时治疗甚至会造成死亡[37]。绿原酸具有抗炎作用,可下调促炎因子的表达量,提高机体的抵抗力。总结绿原酸发挥抗炎作用的研究显示:1)绿原酸通过介导核转录因子-κB(nuclear factor-κB,NF-κB)通路发挥抗炎功能[38]。Zamani-Garmsiri等[39]研究发现,非酒精性脂肪肝小鼠饲喂含有绿原酸(0.2 g/kg)的饲粮,12周后,绿原酸抑制了多囊性肾病NF-κB信号通路中p65蛋白的移位和核转录因子-κB抑制蛋白激酶(nuclear factor-kappa B inhibitor protein kinase, IκB)的磷酸化,显著降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)以及白细胞介素-6(interleukin-6,IL-6)等促炎因子的表达量,从而实现抗炎症效果。类似报道证明,绿原酸可以降低脂多糖(LPS)诱导的乳腺上皮细胞中IL-1β和IL-6的转录表达,并抑制NF-κB p65蛋白的表达[40]。2)细胞试验结果表明,绿原酸能够缓解LPS诱导的RAW 264.7小鼠巨噬细胞炎症,通过抑制环氧合酶-2和NOD样受体家族蛋白3(NOD-like receptor family protein 3,NLRP3)炎症小体的蛋白表达,发挥抗炎作用[38]。3)在缓解糖尿病和肾病的研究中发现,绿原酸能增加Nrf2的核易位和HO-1的表达,通过调节Nrf2/HO-1信号通路发挥抗炎作用[41];Zhao等[42]利用隐绿原酸对LPS处理的RAW 264.7巨噬细胞炎症反应进行干预,发现隐绿原酸使HO-1基因的表达量上升,能够激活Nrf2信号通路发挥抗炎作用。4)绿原酸可介导丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路发挥抗炎功能[43]。绿原酸能够缓解葡聚糖硫酸钠诱导的小鼠结肠炎性损伤,降低细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)1/2、磷酸化细胞外调节蛋白激酶、p38激酶、磷酸化p38激酶、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)以及磷酸化c-Jun氨基末端激酶蛋白的表达,通过抑制MAPK/ERK/JNK信号通路,缓解小鼠肠道炎症[43]。Tan等[44]研究发现,绿原酸能够缓解鼠伤寒沙门氏菌诱导的小鼠肠道炎症,主要机制为绿原酸促使肠道中生长阻滞特异性转录因子5(growth arrest specific 5,GAS5)的表达,而后长链非编码RNA GAS5竞争性结合微小RNA 23a(microRNA 23a,miR-23a),进而上调第10号染色体缺失的磷酸酶与张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)的表达量,降低p38 MAPK通路相关基因p38和磷酸化p38蛋白的表达水平,通过长链非编码RNA GAS5/miR-23a/PTEN轴抑制p38 MAPK信号通路,从而抑制肠道炎症。
3.3 抑菌绿原酸是金银花、山银花和杜仲等中草药的主要抑菌成分[6]。绿原酸对包括大肠杆菌、沙门氏菌、痢疾杆菌、假单胞菌属及幽门螺杆菌属等革兰氏阴性菌和包括金黄色葡萄球菌、芽孢杆菌、链球菌及葡萄球菌属等革兰氏阳性菌均有明显的抑制作用[6]。Chai等[45]认为绿原酸抑菌作用是由于绿原酸协同抑制了细菌细胞壁和细胞膜的合成,并抑制了细菌蛋白和DNA的合成。动物试验表明,绿原酸不仅抑制肠道有害细菌,还可促进肠道有益菌的增殖。Gong等[46]研究发现,金黄色葡萄球菌诱导奶牛乳腺炎,添加绿原酸可提高牛奶中κ-酪蛋白的水平,增强中性粒细胞对病原菌的吞噬能力。另外,绿原酸可以增加断奶仔猪回肠和盲肠挥发性脂肪酸含量,提高乙酸盐和丙酸盐的含量,还可增加盲肠菌群多样性,提高盲肠中乳酸菌属、普氏杆菌属和厌氧弧菌属等有益菌属的丰度,维持仔猪肠道菌群稳态,保护肠道健康[47-48]。
绿原酸的抗菌机制可能与以下有关:1)绿原酸可作用于病原菌的细胞外膜,促使其凹陷和脱落,并降低细胞外膜LPS的含量,使细胞外膜通透性增加,引起细胞内蛋白质和ATP的释放,导致细胞外膜破坏、代谢中断,最终导致细胞死亡[49]。Sun等[8]在冷藏鸡肉中评估绿原酸对沙门氏菌病原体的抗菌活性,发现绿原酸能够改变沙门氏菌细胞外膜的通透性,促进胞内蛋白质和ATP的释放,并且抑制苹果酸脱氢酶和琥珀酸脱氢酶的活性,破坏细胞膜和细胞代谢,引发细胞死亡。2)在发光二极管(LED)光照射下,绿原酸进入病菌细胞膜发生光氧化,生成过氧化氢(H2O2),H2O2在光的作用下分解生成羟基自由基(·OH),·OH使细胞内DNA发生氧化损伤,导致DNA断裂、细胞凋亡[50]。3)绿原酸可作用于细菌中的酶,发挥抗菌作用。肺炎链球菌神经氨酸酶具有去除宿主细胞表面聚糖末端的唾液酸残基,促进病菌黏附和定殖的作用。最新研究发现,绿原酸通过氢键、盐桥与肺炎链球菌神经氨酸酶建立较强的结合,涉及的氨基酸残基包括Arg347、Ile348、Lys440、Asp372、Asp417以及Glu768,其中与Arg347的侧链可形成帽状结构,将绿原酸锁定在神经氨酸酶的活性位点,并与其发生结合,因此绿原酸是一种潜在的肺炎链球菌神经氨酸酶抑制剂[51]。4)绿原酸可以诱导细胞内ROS耗竭,最终影响细菌凋亡。ROS是细胞内信号传导的重要分子,细胞内ROS耗竭是细菌凋亡的核心调节因子。研究表明,先在大肠杆菌中添加绿原酸,而后用H2O2进行处理,绿原酸能诱导大肠杆菌中ROS耗竭,进而影响大肠杆菌细胞内的信号通路传导,从而导致细菌凋亡[13]。
3.4 抗病毒绿原酸具有抗病毒作用,对流感病毒[52]、呼吸道合胞病毒[53]、疱疹病毒[54]、肠道病毒[55]、H5N1病毒[52]、腺病毒[53]和乙型肝炎病毒[56]均有明显抑制作用。关于绿原酸抗病毒的机理还不是很清楚,根据文献报道,推测绿原酸的抗病毒机制可能与以下几点有关:1)绿原酸可以抑制病毒表面酶的活性。Karar等[52]研究指出,神经氨酸酶是流感病毒被膜上的一种糖蛋白,具有抗原性,能催化糖苷水解,协助成熟的病毒颗粒脱离宿主细胞并感染新的细胞,造成流感病毒在体内继续扩散。绿原酸、酚酸和衍生物对产气荚膜杆菌、H5N1和重组H5N1 N端组氨酸标签的神经氨基酶有抑制活性的作用。绿原酸通过与神经氨酸酶结合,达到抑制病毒在动物体内扩散的目的。2)绿原酸的抗病毒活性与其自身含有的邻苯二酚基团有关,Ikeda等[57]研究发现,可能是由于绿原酸水解出的具有邻苯二酚基团的咖啡酸,而咖啡酸能抑制疱疹病毒的活性,干扰疱疹病毒DNA的复制,从而发挥抗病毒的作用。
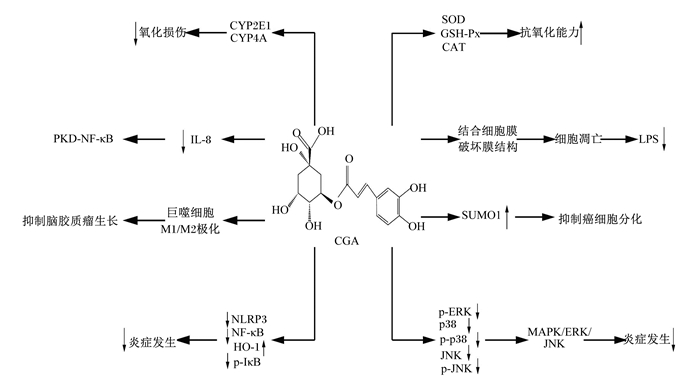
3.5 抗肿瘤上世纪80年代,绿原酸被发现具有抗肿瘤的作用,引起了科研工作者的广泛兴趣。Xue等[58]首次报道,绿原酸能够促进M1型巨噬细胞和抑制M2型巨噬细胞,抑制脑胶质瘤的生长,提出作用途径是介导巨噬细胞的M1/M2极化。也有报道指出,绿原酸能降低癌细胞的增殖速率、线粒体ATP的产生以及侵袭能力,作用方式是绿原酸提高癌细胞分化基因小泛素相关修饰物1(small ubiquitin-related modifier 1,SUMO1)的表达,同时不改变正常细胞中该基因的表达量。因此,绿原酸有望成为一种安全有效的癌细胞分化诱导剂[59]。此外,有研究认为,绿原酸缓解结肠癌的作用是通过降低ROS发挥抑制作用,还可通过降低细胞凋亡相关基因的表达抑制肺癌细胞生长[60-61]。因此,绿原酸具有抗癌作用,但作用方式不尽相同,其潜在靶点和作用机制还有待进一步研究。综上所述,绿原酸具有抗氧化、抗炎、抑菌、抗病毒及抗癌等多种生物学功能,其可能的作用机理如图 3所示。
|
↑:提高increased;↓:降低decreased;CGA:绿原酸chlorogenic acid;CYP2E1:细胞色素P450 2E1 cytochrome P450 2E1;CYP4A:细胞色素P450 4A cytochrome P450 4A;SOD:超氧化物歧化酶superoxide dismutase;GSH-Px:谷胱甘肽过氧化物酶glutathione peroxidase;CAT:过氧化氢酶catalase;PKD-NF-κB:多囊性肾病核转录因子-κB nuclear factor kappa B in polycystic kidney disease;IL-8:白细胞介素-8 interleukin-8;LPS:脂多糖lipopolysaccharide;SUMO1:小泛素相关修饰物1 small ubiquitin-related modifier 1;NLRP3:NOD样受体家族蛋白3 NOD-like receptor family protein 3;NF-κB:核转录因子-κB nuclear factor kappa B;HO-1:血红素加氧酶-1 heme oxygenase-1;p-IκB:磷酸化核转录因子-κB抑制蛋白激酶phosphorylated nuclear factor-kappa B inhibitor protein kinase;ERK:细胞外信号调节蛋白激酶extracellular signal-regulated protein kinase;p-ERK:磷酸化细胞外信号调节蛋白激酶phosphorylated extracellular signal-regulated protein kinase;p38:p38激酶p38 kinase;p-p38:磷酸化p38激酶phosphorylated p38 kinase;JNK:c-Jun氨基末端激酶c-Jun N-terminal kinase;p-JNK:磷酸化c-Jun氨基末端激酶phosphorylated c-Jun N-terminal kinase;MAPK:丝裂原活化蛋白激酶mitogen-activated protein kinase。 图 3 绿原酸的潜在作用机理 Fig. 3 Potential function mechanisms of chlorogenic acid[31, 34, 36, 38, 40, 43, 50, 58-59] |
规模化养猪生产中,由于早期断奶、病原菌侵袭等,仔猪发生断奶应激和肠道稳态失衡,造成肠炎和腹泻[62]。王宇等[63]研究发现,与对照组相比,饲粮添加1 000 mg/kg的绿原酸显著降低断奶仔猪的料重比,认为其可能的机制是绿原酸提高了仔猪十二指肠黏膜中蔗糖酶活性和回肠黏膜中钠-葡萄糖共转运载体1(sodium-glucose co-transporter 1,SGLT1)mRNA的表达量,而SGLT1是位于小肠黏膜上皮细胞和肾单位近曲小管的一种跨膜葡萄糖转运载体蛋白,可以促进葡萄糖的吸收和转运。Zhang等[64]在断奶仔猪的饲粮中添加1 000 mg/kg绿原酸,发现试验组仔猪十二指肠的绒毛高度和绒隐比显著提高,结肠食糜乳酸菌的丰度提高,大肠杆菌的丰度显著降低,说明绿原酸可以保护猪的肠道健康。另外,绿原酸还可降低断奶仔猪十二指肠和空肠中丙二醛的含量,缓解肠道氧化损伤,改善肠道屏障功能[62]。因此绿原酸具有调节仔猪肠道菌群,促进营养物质的消化吸收,维持肠道稳态的作用。
研究发现,绿原酸能够改善母猪卵母细胞成熟、发育及受精能力。与对照组相比,体外补充绿原酸可以显著促进卵母细胞成熟,保护卵母细胞免受氧化应激诱导的DNA损伤,同时提高胚泡形成的速率,改善猪胚胎体外发育能力[65]。另有报道指出,添加50 μmol/L绿原酸与卵母细胞共培养44 h后再进行体外受精,通过电穿孔技术检测受精卵的发育和质量,发现绿原酸显著提高胚泡的生长速率,降低细胞凋亡指数,改善胚胎发育[66]。绿原酸还可提高冷冻公猪精子的质量,补充100 μmol/L绿原酸,公猪精子存活率提高了8%~10%,质膜完整性提高了4%~6%[67],可替代维生素E作为猪精液的保护剂[68]。以上研究说明,绿原酸对母猪卵母细胞和公猪精子发育均有积极影响,可作为卵母细胞发育成熟和精子的保护剂,但绿原酸是否作用于抗氧化相关信号通路,实现促进母猪卵母细胞成熟和缓解公猪精液的氧化应激,目前仍不清楚,具体的作用机制仍需要进一步研究。
绿原酸在反刍动物上的研究,主要关注其抗氧化性能和对营养物质消化代谢的影响。Bongartz等[69]探究了碱处理对葵花粕中绿原酸和蛋白质的影响,发现碱处理增加了过瘤胃蛋白的含量,与对照组相比,碱处理组奶牛肠道蛋白质消化率提高了10%,原因在于经碱处理生成的绿原酸醌和葵花粕中的蛋白质发生反应,降低了瘤胃微生物对蛋白质的降解,增加了过瘤胃蛋白的含量。除了直接应用于反刍动物饲粮,因其抗氧化性能,绿原酸还在牛奶乳制品中表现出积极的影响。研究发现,在乳杆菌发酵乳中加入绿原酸,牛奶的抗氧化活性增加,这是由于绿原酸被乳杆菌发酵代谢生成3,4-二羟基肉桂酸,同时乳杆菌的蛋白水解活性增加了生物活性肽的释放量,以达到抗氧化的作用[70]。另外,Liu等[7]在育肥羊饲粮中添加绿原酸,发现显著提高了羊血清中超氧化物歧化酶活性和总抗氧化能力,显著降低了血清中皮质醇含量。尽管绿原酸的抗氧化功能被一再证实,但由于反刍动物特有的消化器官,还需要着重研究绿原酸对反刍动物胃肠道健康、胃肠道菌群的调控机理以及作为乳制品添加剂的应用价值。
4.2 家禽绿原酸对家禽影响的研究,主要关注改善生长性能、减缓热应激以及缓解炎症等。Zhao等[35]在白羽肉鸡饲粮中添加1 000 mg/kg的绿原酸,肉鸡的平均日增重和饲料转化率显著优于对照组,且添加绿原酸显著提高了鸡肉中多不饱和脂肪酸和饱和脂肪酸的比值;不仅如此,在热应激条件下,饲粮添加绿原酸还显著提高了鸡胸肉的氧化稳定性和脂肪酸含量。绿原酸缓解热应激的研究,可能的机制是绿原酸通过增加低氧诱导因子-1的活性,促进热休克转录因子-1基因表达,增强自噬,提升机体抗热应激的能力[71],而提高鸡胸肉的氧化稳定性可能主要源于绿原酸的抗氧化性。此外,绿原酸还能够缓解雏鸡受损的软骨,促使其恢复和再生。Cheng等[72]使用静脉注射甲苯噻嗪(5 mg/kg)的方法建立雏鸡的关节软骨损伤模型,发现饲喂绿原酸可上调Y染色体性别决定区-盒转录因子9(sex-determining region Y-box transcription factor 9,SOX9)和Ⅱ型胶原α1链(collagen type Ⅱ alpha 1 chain,COL2A1)这2个基因的表达。而SOX9是软骨生成所需的转录激活因子,COL2A1是SOX9的1个下游基因,二者上调可以促进软骨生长[72]。另外,绿原酸抑制损伤部位血管异常生成和纤维化,下调炎症细胞因子IL-1β和TNF-α、磷酸化p65以及金属蛋白酶基因的表达,可能的作用机制是绿原酸通过作用于Nrf2信号通路缓解氧化应激,恢复受损的关节软骨[72]。在水禽的研究中,给1日龄北京鸭接种鸭乙型肝炎病毒(duck hepatitis B virus,DHBV)阳性血清,建立鸭乙肝病毒感染模型,7~17日龄每天口服100 mg/kg的绿原酸,发现口服绿原酸降低了鸭血清中DHBV的水平,抑制了病毒DNA的复制[73],说明绿原酸具有抗DHBV的作用,但具体机制还有待进一步研究。另外,关于绿原酸改善家禽生产性能的作用机制,是否通过作用于肠道微生物区系提高肠道优势菌群丰度以促进营养物质的消化吸收,还有待研究。
5 小结近年来,因其具有抗氧化、抗炎、抑菌、抗癌、提高繁殖性能以及保护畜禽肠道健康等特性,绿原酸的研究呈上升趋势,成为天然植物提取物研究领域的热点之一。我国绿原酸的植物来源广泛、产量高,作为饲料添加剂,在畜禽生产中具有极大的前景。未来对绿原酸的研究应集中在以下方面展开:1)绿原酸的作用机制有待研究。目前绿原酸的作用机理尚不完全清楚,后续的研究需关注绿原酸的作用靶点,探索绿原酸作用的分子机制及其酯水解产物,甚至不同代谢产物对肠道健康的影响及其机制。2)绿原酸的利用方式有待研究。由于绿原酸口服效果不佳,如何提高畜禽对绿原酸的利用效率,也是后续研究的重点之一。3)作为饲料添加剂,绿原酸在畜禽生产中的适宜剂量还有待确定。综上可知,系统研究绿原酸的代谢过程和生物学功能,揭示其作用的分子机制及其高效利用方式,对未来绿原酸成为畜牧业生产中的新型饲料添加剂至关重要。
| [1] |
RUI L Y, XIE M H, HU B, et al. Enhanced solubility and antioxidant activity of chlorogenic acid-chitosan conjugates due to the conjugation of chitosan with chlorogenic acid[J]. Carbohydrate Polymers, 2017, 170: 206-216. DOI:10.1016/j.carbpol.2017.04.076 |
| [2] |
LOU L X, LIU Y J, ZHOU J W, et al. Chlorogenic acid and luteolin synergistically inhibit the proliferation of interleukin-1β-induced fibroblast-like synoviocytes through regulating the activation of NF-κB and JAK/STAT-signaling pathways[J]. Immunopharmacology and Immunotoxicology, 2015, 37(6): 499-507. DOI:10.3109/08923973.2015.1095763 |
| [3] |
ZHANG Z, WU X Y, CAO S Y, et al. Chlorogenic acid ameliorates experimental colitis by promoting growth of Akkermansia in mice[J]. Nutrients, 2017, 9(7): 677. DOI:10.3390/nu9070677 |
| [4] |
PLEŠKO S, VOLK H, LUKŠIČ M, et al. In silico study of plant polyphenols' interactions with VP24-Ebola virus membrane-associated protein[J]. Acta Chimica Slovenica, 2015, 62(3): 555-564. |
| [5] |
GOUTHAMCHANDRA K, SUDEEP H V, VENKATESH B J, et al. Chlorogenic acid complex (CGA7), standardized extract from green coffee beans exerts anticancer effects against cultured human colon cancer HCT-116 cells[J]. Food Science and Human Wellness, 2017, 6(3): 147-153. DOI:10.1016/j.fshw.2017.06.001 |
| [6] |
NAVEED M, HEJAZI V, ABBAS M, et al. Chlorogenic acid (CGA): a pharmacological review and call for further research[J]. Biomedicine and Pharmacotherapy, 2018, 97: 67-74. DOI:10.1016/j.biopha.2017.10.064 |
| [7] |
LIU H W, ZHAO J S, LI K, et al. Effects of chlorogenic acids-enriched extract from Eucommia ulmoides leaves on growth performance, stress response, antioxidant status and meat quality of lambs subjected or not to transport stress[J]. Animal Feed Science and Technology, 2018, 238: 47-56. DOI:10.1016/j.anifeedsci.2018.02.003 |
| [8] |
SUN Z L, ZHANG X X, WU H H, et al. Antibacterial activity and action mode of chlorogenic acid against Salmonella Enteritidis, a foodborne pathogen in chilled fresh chicken[J]. World Journal of Microbiology and Biotechnology, 2020, 36: 24. DOI:10.1007/s11274-020-2799-2 |
| [9] |
MEINHART A D, DAMIN F M, CALDEIRÃO L, et al. Study of new sources of six chlorogenic acids and caffeic acid[J]. Journal of Food Composition and Analysis, 2019, 82: 103244. DOI:10.1016/j.jfca.2019.103244 |
| [10] |
PAYEN S. Memoire sur le café (3° part)[J]. Comptes Rendus, 1846(23): 244-251. |
| [11] |
GORTER K. Coffee[J]. Justus Liebig's Annalen der Chemie, 1908(358): 327-348. |
| [12] |
CLIFFORD M N, JOHNSTON K L, KNIGHT S, et al. Hierarchical scheme for LC-MSn identification of chlorogenic acids[J]. Journal of Agriculture and Food Chemistry, 2003, 51(10): 2900-2911. DOI:10.1021/jf026187q |
| [13] |
LEE B, LEE D G. Depletion of reactive oxygen species induced by chlorogenic acid triggers apoptosis-like death in Escherichia coli[J]. Free Radical Research, 2018, 52(5): 605-615. DOI:10.1080/10715762.2018.1456658 |
| [14] |
国家林业局. 全国杜仲产业发展规划(2016—2030年)[R]. 北京: 国家林业局, 2016. SFA. National development plan of Eucommia ulmoides (2016—2030)[R]. Beijing: The State Forestry Administration of China, 2016. (in Chinese) |
| [15] |
王娟娟, 秦雪梅, 高晓霞, 等. 杜仲化学成分、药理活性和质量控制现状研究进展[J]. 中草药, 2017, 48(15): 3228-3237. WANG J J, QIN X M, GAO X X, et al. Research progress on chemical compounds, pharmacological action, and quality status of Eucommia ulmoides[J]. Chinese Herbal Medicines, 2017, 48(15): 3228-3237 (in Chinese). |
| [16] |
胡青平, 徐建国, 李琪, 等. 酶法提取元宝枫叶绿原酸的新工艺研究[J]. 食品科学, 2006, 27(7): 159-162. HU Q P, XU J G, LI Q, et al. Study on new extraction technology of chlorgenic acid in Acer truncatum Bunge leaf with enzyme treatment[J]. Food Science, 2006, 27(7): 159-162 (in Chinese). DOI:10.3321/j.issn:1002-6630.2006.07.034 |
| [17] |
MCCLEMENTS D J. Encapsulation, protection, and release of hydrophilic active components: potential and limitations of colloidal delivery systems[J]. Advances in Colloid and Interface Science, 2015, 219: 27-53. DOI:10.1016/j.cis.2015.02.002 |
| [18] |
FARRELL T L, DEW T P, POQUET L, et al. Absorption and metabolism of chlorogenic acids in cultured gastric epithelial monolayers[J]. Drug Metabolism and Disposition, 2011, 39(12): 2338-2346. DOI:10.1124/dmd.111.040147 |
| [19] |
LI L, SU C P, CHEN X Y, et al. Chlorogenic acids in cardiovascular disease: a review of dietary consumption, pharmacology, and pharmacokinetics[J]. Journal of Agricultural and Food Chemistry, 2020, 68(24): 6464-6484. DOI:10.1021/acs.jafc.0c01554 |
| [20] |
STALMACH A, MULLEN W, BARRON D, et al. Metabolite profiling of hydroxycinnamate derivatives in plasma and urine after the ingestion of coffee by humans: identification of biomarkers of coffee consumption[J]. Drug Metabolism and Disposition, 2009, 37(8): 1749-1758. DOI:10.1124/dmd.109.028019 |
| [21] |
CLIFFORD M N, KERIMI A, WILLIAMSON G. Bioavailability and metabolism of chlorogenic acids (acyl-quinic acids) in humans[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(3): 1299-1352. |
| [22] |
SOVA M, SASO L. Natural sources, pharmacokinetics, biological activities and health benefits of hydroxycinnamic acids and their metabolites[J]. Nutrients, 2020, 12(8): 2190. DOI:10.3390/nu12082190 |
| [23] |
CLIFFORD M N, JAGANATH I B, LUDWIG I A, et al. Chlorogenic acids and the acyl-quinic acids: discovery, biosynthesis, bioavailability and bioactivity[J]. Natural Product Reports, 2017, 34(12): 1391-1421. DOI:10.1039/C7NP00030H |
| [24] |
TAJIK N, TAJIK M, MACK I, et al. The potential effects of chlorogenic acid, the main phenolic components in coffee, on health: a comprehensive review of the literature[J]. European Journal of Nutrition, 2017, 56(7): 2215-2244. DOI:10.1007/s00394-017-1379-1 |
| [25] |
DE OLIVEIRA D M, SAMPAIO G R, PINTO C B, et al. Bioavailability of chlorogenic acids in rats after acute ingestion of mate tea (Ilex paraguariensis) or 5-caffeoylquinic acid[J]. European Journal of Nutrition, 2017, 56(8): 2541-2556. DOI:10.1007/s00394-016-1290-1 |
| [26] |
MONTEIRO M, FARAH A, PERRONE D, et al. Chlorogenic acid compounds from coffee are differentially absorbed and metabolized in humans[J]. The Journal of Nutrition, 2007, 137(10): 2196-2201. DOI:10.1093/jn/137.10.2196 |
| [27] |
DEL RIO D, STALMACH A, CALANI L, et al. Bioavailability of coffee chlorogenic acids and green tea flavan-3-ols[J]. Nutrients, 2010, 2(8): 820-833. DOI:10.3390/nu2080820 |
| [28] |
MIAO M S, XIANG L L. Pharmacological action and potential targets of chlorogenic acid[J]. Advances in Pharmacology, 2020, 87: 71-88. |
| [29] |
GUENGERICH F P. Cytochrome P450 2E1 and its roles in disease[J]. Chemico-Biological Interactions, 2020, 322: 109056. DOI:10.1016/j.cbi.2020.109056 |
| [30] |
EID A A, GORIN Y, FAGG B M, et al. Mechanisms of podocyte injury in diabetes role of cytochrome P450 and NADPH oxidases[J]. Diabetes, 2009, 58(5): 1201-1211. DOI:10.2337/db08-1536 |
| [31] |
LIU Y Y, ZHAI T, YU Q Q, et al. Effect of high exposure of chlorogenic acid on lipid accumulation and oxidative stress in oleic acid-treated HepG2 cells[J]. Chinese Herbal Medicines, 2018, 10(2): 199-205. DOI:10.1016/j.chmed.2018.03.005 |
| [32] |
WEI M J, ZHENG Z Y, SHI L, et al. Natural polyphenol chlorogenic acid protects against acetaminophen-induced hepatotoxicity by activating ERK/Nrf2 antioxidative pathway[J]. Toxicological Sciences, 2018, 162(1): 99-112. DOI:10.1093/toxsci/kfx230 |
| [33] |
MIAO H, ZHANG Y, HUANG Z L, et al. Lonicera japonica attenuates carbon tetrachloride-induced liver fibrosis in mice: molecular mechanisms of action[J]. The American Journal of Chinese Medicine, 2019, 47(2): 351-367. DOI:10.1142/S0192415X19500174 |
| [34] |
SHIN H S, SATSU H, BAE M J, et al. Catechol groups enable reactive oxygen species scavenging-mediated suppression of PKD-NF kappa B-IL-8 signaling pathway by chlorogenic and caffeic acids in human intestinal cells[J]. Nutrients, 2017, 9(2): 165. DOI:10.3390/nu9020165 |
| [35] |
ZHAO J S, DENG W, LIU H W. Effects of chlorogenic acid-enriched extract from Eucommia ulmoides leaf on performance, meat quality, oxidative stability, and fatty acid profile of meat in heat-stressed broilers[J]. Poultry Science, 2019, 98(7): 3040-3049. DOI:10.3382/ps/pez081 |
| [36] |
CHEN J L, LI Y, YU B, et al. Dietary chlorogenic acid improves growth performance of weaned pigs through maintaining antioxidant capacity and intestinal digestion and absorption function[J]. Journal of Animal Science, 2018, 96(3): 1108-1118. DOI:10.1093/jas/skx078 |
| [37] |
TANAKA T, NARAZAKI M, KISHIMOTO T J I. Immunotherapeutic implications of IL-6 blockade for cytokine storm[J]. Immuontherapy, 2016, 8(8): 959-970. DOI:10.2217/imt-2016-0020 |
| [38] |
ZHANG L, FAN Y, SU H W, et al. Chlorogenic acid methyl ester exerts strong anti-inflammatory effects via inhibiting the COX-2/NLRP3/NF-κB pathway[J]. Food & Function, 2018, 9(12): 6155-6164. |
| [39] |
ZAMANI-GARMSIRI F, GHASEMPOUR G, ALIABADI M, et al. Combination of metformin and chlorogenic acid attenuates hepatic steatosis and inflammation in high-fat diet fed mice[J]. International Union of Biochemistry and Molecular Biology Life, 2020. DOI:10.1002/iub.2424 |
| [40] |
GAO R F, YANG H D, JING S F, et al. Protective effect of chlorogenic acid on lipopolysaccharide-induced inflammatory response in dairy mammary epithelial cells[J]. Microbial Pathogenesis, 2018, 124: 178-182. DOI:10.1016/j.micpath.2018.07.030 |
| [41] |
BAO L P, LI J S, ZHA D Q, et al. Chlorogenic acid prevents diabetic nephropathy by inhibiting oxidative stress and inflammation through modulation of the Nrf2/HO-1 and NF-κB pathways[J]. International Immunopharmacology, 2018, 54: 245-253. DOI:10.1016/j.intimp.2017.11.021 |
| [42] |
ZHAO X L, YU L, ZHANG S D, et al. Cryptochlorogenic acid attenuates LPS-induced inflammatory response and oxidative stress via upregulation of the Nrf2/HO-1 signaling pathway in RAW 264.7 macrophages[J]. International Immunopharmacology, 2020, 83: 106436. DOI:10.1016/j.intimp.2020.106436 |
| [43] |
GAO W Y, WANG C H, YU L, et al. Chlorogenic acid attenuates dextran sodium sulfate-induced ulcerative colitis in mice through MAPK/ERK/JNK pathway[J]. Biomed Research International, 2019, 2019: 6769789. |
| [44] |
TAN S R, YAN F, LI Q R, et al. Chlorogenic acid promotes autophagy and alleviates Salmonella typhimurium infection through the lncRNAGAS5/miR-23a/PTEN axis and the p38 MAPK pathway[J]. Frontiers in Cell and Develpomental Biology, 2020, 8: 552020. DOI:10.3389/fcell.2020.552020 |
| [45] |
CHAI B B, JIANG W J, HU M, et al. In vitro synergistic interactions of protocatechuic acid and chlorogenic acid in combination with antibiotics against animal pathogens[J]. Synergy, 2019, 9: 100055. DOI:10.1016/j.synres.2019.100055 |
| [46] |
GONG X X, SU X S, ZHAN K, et al. The protective effect of chlorogenic acid on bovine mammary epithelial cells and neutrophil function[J]. Journal of Dairy Science, 2018, 101(11): 10089-10097. DOI:10.3168/jds.2017-14328 |
| [47] |
CHEN J L, YU B, CHEN D W, et al. Changes of porcine gut microbiota in response to dietary chlorogenic acid supplementation[J]. Applied Microbiology and Biotechnology, 2019, 103(19): 8157-8168. DOI:10.1007/s00253-019-10025-8 |
| [48] |
PENG M J, WANG Z H, PENG S, et al. Dietary supplementation with the extract from Eucommia ulmoides leaves changed epithelial restitution and gut microbial community and composition of weanling piglets[J]. PLoS One, 2019, 14(9): e0223002. DOI:10.1371/journal.pone.0223002 |
| [49] |
SU M M, LIU F, LUO Z, et al. The antibacterial activity and mechanism of chlorogenic acid against foodborne pathogen pseudomonas aeruginosa[J]. Foodborne Pathogens and Disease, 2019, 16(12): 823-830. DOI:10.1089/fpd.2019.2678 |
| [50] |
NAKAMURA K, ISHIYAMA, SHENG H, et al. Bactericidal activity and mechanism of photoirradiated polyphenols against gram-positive and-negative bacteria[J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7707-7713. DOI:10.1021/jf5058588 |
| [51] |
GUAN S S, ZHU K T, DONG Y J, et al. Exploration of binding mechanism of a potential Streptococcus pneumoniae neuraminidase inhibitor from herbaceous plants by molecular simulation[J]. International Journal of Molecualr Science, 2020, 21(3): 1003. DOI:10.3390/ijms21031003 |
| [52] |
KARAR M G E, MATEI M F, JAISWAL R, et al. Neuraminidase inhibition of dietary chlorogenic acids and derivatives-potential antivirals from dietary sources[J]. Food & Function, 2016, 7(4): 2052-2059. |
| [53] |
SINISI V, STEVAERT A, BERTI F, et al. Chlorogenic compounds from coffee beans exert activity against respiratory viruses[J]. Planta Medica, 2017, 83(7): 615-623. |
| [54] |
PRINSLOO G, VERVOORT J. Identifying anti-HSV compounds from unrelated plants using NMR and LC-MS metabolomic analysis[J]. Metabolomics, 2018, 14(10): 134. DOI:10.1007/s11306-018-1432-y |
| [55] |
SILVA-BELTRAN N P, CHAIDEZ-QUIROZ C, LOPEZ-CUEVAS O, et al. Phenolic compounds of potato peel extracts: their antioxidant activity and protection against human enteric viruses[J]. Journal of Microbiology and Biotechnology, 2017, 27(2): 234-241. DOI:10.4014/jmb.1606.06007 |
| [56] |
INOUE M, TSUGANE S. Coffee drinking and reduced risk of liver cancer: update on epidemiological findings and potential mechanisms[J]. Current Nutrition Reports, 2019, 8(3): 182-186. DOI:10.1007/s13668-019-0274-1 |
| [57] |
IKEDA K, TSUJIMOTO K, UOZAKI M, et al. Inhibition of multiplication of herpes simplex virus by caffeic acid[J]. International Journal of Molecular Medicine, 2011, 28(4): 595-598. |
| [58] |
XUE N N, ZHOU Q, JI M, et al. Chlorogenic acid inhibits glioblastoma growth through repolarizating macrophage from M2 to M1 phenotype[J]. Scientific Reports, 2017, 7: 39011. DOI:10.1038/srep39011 |
| [59] |
HUANG S, WANG L L, XUE N N, et al. Chlorogenic acid effectively treats cancers through induction of cancer cell differentiation[J]. Theranostics, 2019, 9(23): 6745-6763. DOI:10.7150/thno.34674 |
| [60] |
HOU N, LIU N, HAN J, et al. Chlorogenic acid induces reactive oxygen species generation and inhibits the viability of human colon cancer cells[J]. Anti-Cancer Drugs, 2017, 28(1): 59-65. DOI:10.1097/CAD.0000000000000430 |
| [61] |
YAMAGATA K, IZAWA Y, ONODERA D, et al. Chlorogenic acid regulates apoptosis and stem cell marker-related gene expression in A549 human lung cancer cells[J]. Molecular and Cellular Biochemistry, 2018, 441(1/2): 9-19. |
| [62] |
CHEN J L, YU B, CHEN D W, et al. Chlorogenic acid improves intestinal barrier functions by suppressing mucosa inflammation and improving antioxidant capacity in weaned pigs[J]. The Journal of Nutritional Biochemistry, 2018, 59: 84-92. DOI:10.1016/j.jnutbio.2018.06.005 |
| [63] |
王宇, 周选武, 陈代文, 等. 绿原酸对仔猪生长性能、血清免疫球蛋白及肠道黏膜形态与消化吸收能力的影响[J]. 动物营养学报, 2018, 30(3): 1136-1145. WANG Y, ZHOU X W, CHEN D W, et al. Effects of chlorogenic acid on growth performance, serum immunolobulins, intestinal mucosa morphology, digestive and absorptive capacity of piglets[J]. Chinese Journal of Animal Nutrition, 2018, 30(3): 1136-1145 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.03.039 |
| [64] |
ZHANG Y, WANG Y, CHEN D W, et al. Dietary chlorogenic acid supplementation affects gut morphology, antioxidant capacity and intestinal selected bacterial populations in weaned piglets[J]. Food & Function, 2018, 9(9): 4968-4978. |
| [65] |
NGUYEN T V, TANIHARA F, DO L T K, et al. Chlorogenic acid supplementation during in vitro maturation improves maturation, fertilization and developmental competence of porcine oocytes[J]. Reproduction in Domestic Animals, 2017, 52(6): 969-975. DOI:10.1111/rda.13005 |
| [66] |
NGUYEN T V, WITTAYARAT M, DO L T K, et al. Effects of chlorogenic acid (CGA) supplementation during in vitro maturation culture on the development and quality of porcine embryos with electroporation treatment after in vitro fertilization[J]. Animal Science Journal, 2018, 89(8): 1207-1213. DOI:10.1111/asj.13049 |
| [67] |
NAMULA Z, HIRATA M, WITTAYARAT M, et al. Effects of chlorogenic acid and caffeic acid on the quality of frozen-thawed boar sperm[J]. Reproduction in Domestic Animals, 2018, 53(6): 1600-1604. DOI:10.1111/rda.13288 |
| [68] |
PEREIRA B A, CHAVES B R, TELES M C, et al. Chlorogenic acid improves the quality of boar semen subjected to cooled storage at 15 ℃[J]. Andrologia, 2018, 50(5): e12978. |
| [69] |
BONGARTZ V, BÖTTGER C, WILHELMY N, et al. Protection of protein from ruminal degradation by alkali-induced oxidation of chlorogenic acid in sunflower meal[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(1): e209-e215. DOI:10.1111/jpn.12729 |
| [70] |
OH N S, LEE J Y, OH S, et al. Improved functionality of fermented milk is mediated by the synbiotic interaction between Cudrania tricuspidata leaf extract and Lactobacillus gasseri strains[J]. Applied Microbiology and Biotechnology, 2016, 100(13): 5919-5932. DOI:10.1007/s00253-016-7414-y |
| [71] |
CARRANZA A D V, SARAGUSTI A, CHIABRANDO G A, et al. Effects of chlorogenic acid on thermal stress tolerance in C. elegans via HIF-1, HSF-1 and autophagy[J]. Phytomedicine, 2020, 66: 153132. DOI:10.1016/j.phymed.2019.153132 |
| [72] |
CHENG X, LI K, XU S S, et al. Applying chlorogenic acid in an alginate scaffold of chondrocytes can improve the repair of damaged articular cartilage[J]. PLoS One, 2018, 13(4): e0195326. DOI:10.1371/journal.pone.0195326 |
| [73] |
WANG G F, SHI L P, REN Y D, et al. Anti-hepatitis B virus activity of chlorogenic acid, quinic acid and caffeic acid in vivo and in vitro[J]. Antiviral Research, 2009, 83(2): 186-190. DOI:10.1016/j.antiviral.2009.05.002 |