白术是菊科苍术属多年生草本植物白术的干燥根茎,主要产自于我国南方(以浙江为主)和韩国等地。白术性温、归脾、胃经,最常用作补益中药,在治疗水潴留、关节炎和消化系统疾病等方面具有重要作用[1-2]。白术多糖(PAMK)是白术中的主要活性成分,也是白术发挥药效的重要物质基础,前人的报道主要集中于探究PAMK作为抗癌和抗肿瘤药物在预防和治疗癌症中的应用效果及前景[3]。随着对PAMK开发应用的持续深入,研究人员发现其具有改善动物肠道健康、促进免疫功能的作用,应用于畜禽生产中能够促进畜禽生长,提高抗病能力[4]。因此,本文主要综述PAMK对动物肠道健康和免疫功能的调控及其机制和在畜禽生产中的应用效果,以期在无抗养殖的大背景下为PAMK在畜禽生产中的合理应用与推广提供参考依据。
1 PAMK的结构组成和提取工艺 1.1 PAMK的结构组成PAMK的结构组成是影响其生物活性功能的重要因素之一。研究发现,PAMK的免疫活性与其结构中的鼠李糖醛酸Ⅰ型(RG-Ⅰ)有关。RG-Ⅰ含量较高的PAMK对巨噬细胞释放一氧化氮(NO)有明显的促进作用,而RG-Ⅰ含量较低的PAMK则无促进作用[5]。此外,研究表明分子质量大的多糖一般活性较低[6]。综合国内外关于PAMK化学结构组成的研究报道发现,由于其提取工艺、来源和结构测定方法等因素的不同,导致从白术中所提取的PAMK的结构组成也存在差异。研究表明,PAMK主要由葡萄糖、甘露糖和半乳糖组成,伴有少量的鼠李糖、木糖和阿拉伯糖,不同来源和提取工艺的PAMK中单糖的摩尔比和分子质量具有较大差异[7-9]。PAMK的主链主要由β-D-1→3和β-D-1→3, 6吡喃葡萄糖构成,β-D-半乳糖构成支链[10]。不同来源产地和提取方法所提取的PAMK中单糖比例概况如表 1所示。
1.2 PAMK的提取工艺PAMK的提取主要采用酶提取法、超声提取法、热水浸提法和微波辅助提取法,其中酶提取法的提取率较高[11]。传统的提取工艺一般通过热水浸提或中性盐溶液提取,成本低并可保留较多的有效成分,但这种方法容易破坏PAMK的立体结构并导致活性降低,而且存在提取时间较长、提取率较低等缺点[12]。袁海梅等[13]采用水提醇法对PAMK的提取工艺进行优化,得出最佳提取工艺为:煎煮次数为2次,煎煮时间为1.5 h,加水量为10倍,PAMK的平均提取率为35.81%。超声波辅助提取法可显著缩短PAMK的提取时间,但提取率较低,在萃取时间10 min,超声波功率400 W,萃取温度55 ℃,提取固液比1:30(g/mL)的最佳条件下,PAMK的提取率为15.13%[14]。而新一代的酶提取法相较于超声提取法和水提醇法,其提取率更高,但酶的价格较高,对酶解时间和酶解pH把控要求十分严格。候轩等[15]采用复合酶(纤维素酶和果胶酶)提取法提取PAMK,结果表明,最佳提取条件为酶解温度为50 ℃,酶解pH为5.0,酶解时间为50 min,复合酶量为0.7%,PAMK的提取率为43.00%。最新的研究发现,超声波协同酶解法可得到较高的提取率,孟永海等[16]采用超声波协同酶解法提取PAMK,提取率可达到43.87%,其提取条件为:复合酶(纤维素酶: 果胶酶=2:1)添加量为15 mg/g,水浴酶解时间为50 min,超声提取1.25 h。综上所述,各提取方法均有其优势与不足,在实际生产中,应根据具体情况进行合理的选择。
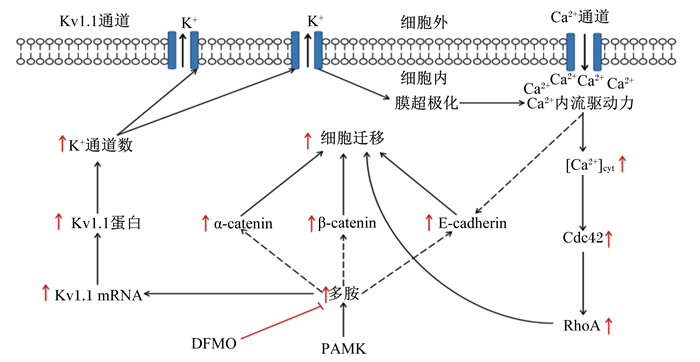
2 PAMK对机体肠道健康的调控 2.1 维持肠道黏膜屏障完整性肠道健康很大程度上取决于肠道黏膜屏障是否完整,而肠道黏膜屏障的完整性主要取决于肠上皮细胞间的紧密连接(TJ)状况。TJ蛋白如封闭蛋白(Claudins)、闭合蛋白(Occludin)和闭合小环蛋白-1(ZO-1)是组成肠道上皮机械屏障功能的重要结构[17]。谢红兵[18]用脂多糖(LPS)处理猪小肠上皮细胞(IPEC-J2细胞)后,添加PAMK可显著提高Claudin-1、Occludin和ZO-1 mRNA的表达水平,缓解LPS造成的肠黏膜机械屏障损伤。细胞迁移是肠黏膜损伤修复过程中的第1阶段,后一阶段主要是细胞的增殖和分化。研究表明,多胺及其信号通路可介导细胞迁移,从而促进胃肠道黏膜损伤的修复[19]。Song等[4]报道,在大鼠小肠上皮细胞(IEC-6细胞)迁移模型中,PAMK可显著提高细胞内多胺含量、Ca2+浓度和钾通道蛋白(Kv1.1)mRNA的表达,促进IEC-6细胞迁移。伍婷婷[20]研究发现,多胺在受多胺抑制剂二氟甲基鸟氨酸(DFMO)抑制的条件下,其含量显著下降,IEC-6细胞迁移受到抑制,添加PAMK可逆转DFMO的抑制效果,这提示PAMK促进IEC-6细胞迁移与其提高胞内多胺含量有关;同时,研究还发现PAMK可提高黏附连接蛋白E-钙黏蛋白(E-cadherin)、α-连环蛋白(α-catenin)和β-连环蛋白(β-catenin)的表达,促进细胞聚集,维持肠上皮的完整性。另有研究显示,PAMK可通过提高细胞内游离钙离子浓度([Ca2+]cyt),激活并提高下游靶点细胞分裂周期,调控蛋白42(Cdc42)和Ras同源蛋白A(RhoA)的表达和活性,逆转DFMO导致的RhoA表达抑制,这也表明多胺可能对Ca2+下游信号通路具有调控作用[21]。综上所述,PAMK促进细胞迁移进而修复肠黏膜屏障的过程与多胺和Ca2+及其信号通路是密不可分的,其介导细胞迁移的机制主要有以下几个方面:1)提高胞内多胺含量,促进Kv1.1 mRNA的表达,可引起膜电位(Em)超极化,促进K+外流,进而提高Ca2+内流驱动力,[Ca2+]cyt浓度增加;2)[Ca2+]cyt浓度增加,可激活并提高下游靶点Cdc42和RhoA蛋白的表达和活性;3)提高黏附连接蛋白E-cadherin、β-catenin和α-catenin的表达。PAMK影响多胺介导细胞迁移修复肠黏膜损伤的信号通路如图 1所示。
|
PAMK:白术多糖polysaccharide of Atractylodes macrocephala Koidz;DFMO:二氟甲基鸟氨酸difluoromethylornithine;E-cadherin:E-钙黏蛋白; α-catenin:α-连环蛋白;β-catenin:β-连环蛋白;Kv1.1蛋白:钾通道蛋白potassium channel protein;Cdc42:细胞分裂周期调控蛋白cell division control protein 42;RhoA:Ras同源蛋白A Ras homologous protein A;[Ca2+]cyt:细胞内游离钙离子浓度cytosolic free Ca2+ concentration。 图 1 PAMK影响多胺介导细胞迁移的信号通路 Fig. 1 PAMK affects signal pathway of polyamine-mediated cell migration[20] |
肠道相关淋巴组织及其分泌的分泌型免疫球蛋白A(sIgA)、细胞因子等免疫物质共同构成肠黏膜免疫屏障。sIgA由免疫球蛋白A(IgA)与黏膜上皮细胞分泌片段结合形成,分布于黏膜表面,可抑制病原体、有害的可溶性物质以及共生菌的入侵[22-23]。Xie等[24]给小鼠灌喂PAMK发现,血清免疫球蛋白G(IgG)含量显著增加,sIgA的mRNA表达升高。但也有研究表明,PAMK显著降低了小鼠肠道sIgA的含量,这可能与其刺激巨噬细胞功能和试验剂量有关,其机制还需要进一步研究[25]。此外,一些肠道黏膜修复相关细胞因子可通过上皮间质和上皮免疫细胞相互作用影响细胞增殖、分化,在修复肠黏膜免疫屏障损伤过程中起关键作用。Shiou等[26]在建立大鼠坏死性小肠结肠炎模型中,用转化生长因子-β1(TGF-β1)预处理后发现,TGF-β1通过Smad信号通路抑制核因子κB抑制蛋白(IκBα)的磷酸化,维持IκBα的表达,并抑制NF-κB的活化,从而降低白细胞介素-6(IL-6)和干扰素-γ(INF-γ)等促炎因子的产生,保护肠道黏膜屏障免受损伤。表皮生长因子受体(EGFR)一般分布于上皮细胞上,当其与EGF结合时会诱发构象变化,活化胞内催化活性,促使酪氨酸残基磷酸化,从而介导下游信号通路加速细胞迁移、分化、增殖[27]。尚秋辰[28]研究表明,添加PAMK显著增加大肠杆菌腹泻模型小鼠TGF-β1和EGFR基因的表达,促进肠道黏膜损伤的修复,有效缓解腹泻。即PAMK修复肠黏膜免疫屏障损伤的机制可能是:一方面通过增加TGF-β1的表达,激活TGF-β1/Smad信号通路,抑制NF-κB的活化,减少促炎因子的产生,从而缓解肠道炎症反应;另一方面通过增加EGFR的表达,诱导酪氨酸残基磷酸化,促进肠上皮细胞的增殖、分化和迁移。Han等[29]报道,PAMK能够明显地缓解葡聚糖硫酸钠造成的小鼠结肠炎,其作用机理是通过抑制环氧化酶-2、诱导型一氧化氮合酶、IL-1β、NF-κB和肿瘤坏死因子-α(TNF-α)等炎性因子的mRNA表达,同时也抑制氧化应激诱导因子血红素加氧酶-1的mRNA表达,从而缓解炎性因子和氧化应激对肠道黏膜屏障的损伤。
肠道菌群是一个复杂的微生态系统,在促进营养物质的消化吸收、物质代谢和免疫调控等方面具有重要作用。在正常生理状态下,肠道菌群处于平衡状态,以厌氧菌为主的生理性细菌与肠黏膜紧密黏附而产生定植抵抗力,形成肠黏膜生物屏障。当受外界条件刺激,肠道菌群的种类和数量发生大规模变化时,肠道菌群失衡,引起肠道功能失调和机体紊乱[30]。研究表明,PAMK能够大幅度地减少盲肠中大肠杆菌,同时增殖乳酸杆菌、双歧杆菌[31]。而双歧杆菌和乳酸杆菌可通过将多糖发酵转化为短链脂肪酸(SCFAs),为肠上皮细胞提供能量,同时也为有益菌的增殖提供酸性环境;另外SCFAs可与SCFAs受体(GPR41/GPR43)结合激活丝裂原活化蛋白激酶(MAPK)信号通路,刺激细胞因子的产生,抑制肠黏膜炎症,维持正常肠道通透性和内环境的稳定[32]。Wang等[33]对PAMK成分分析发现其单糖组成中木糖含量较高,而食用木糖可提高人体肠道中的双歧杆菌的数量、改善肠道微生物[34]。由此可见,PAMK改善肠道微生态的原因可能与其结构中的高木糖含量有关。
2.2 改善肠道形态动物的肠道形态指标反映其对营养物质的消化吸收能力。小肠绒毛高度增加,隐窝深度减小可增加小肠与营养物质的接触面积,增强对营养物质的消化与吸收能力[35]。王琳[36]在海兰褐育成鸡饲粮中添加PAMK可显著提高十二指肠绒毛高度和绒毛高度与隐窝深度的比值(V/C)。柴艳等[37]在断奶仔猪饲粮中添加0.1% PAMK同样显著提高了十二指肠和空肠的V/C,但对回肠的V/C无显著影响,说明PAMK在改善小肠前段对营养物质的消化吸收功能的效果比小肠后段好。赵燕飞等[38]在断奶仔猪的研究中也发现,0.2% PAMK可提高断奶仔猪十二指肠和空肠的绒毛高度,降低十二指肠和空肠的隐窝深度,从而提高V/C。
3 PAMK对机体免疫调节作用及其机制 3.1 提高机体体液免疫和细胞免疫CD4+T细胞在免疫系统中发挥重要作用,可促进B淋巴细胞产生抗体,其活化后主要分化为几种不同的亚型,即辅助性T细胞Th1亚型、Th2亚型和调节性T细胞(Treg)亚型[39]。白细胞介素-2(IL-2)和白细胞介素-12(IL-12)等由Th1细胞分泌,介导细胞免疫;白细胞介素-4(IL-4)、白细胞介素-10(IL-10)等由Th2细胞分泌,介导体液免疫[40]。研究表明,PAMK可提高鸡血清中IL-2、IL-4、IL-6、TNF-α和INF-γ的含量,也可提高小鼠血清中TNF-α、INF-γ和IL-6的含量,促进自然杀伤(NK)细胞、T淋巴细胞和B淋巴细胞的活化和增殖,从而增强体液和细胞免疫应答[41-42]。其机理是PAMK能够促进T淋巴细胞的增殖,诱导其进入S期和G2/M期,从而提高CD4+/CD8+。脾脏是机体重要的免疫器官之一,脾脏指数在一定程度上反映机体免疫功能的强弱;血清溶血素和免疫球蛋白含量及B淋巴细胞增殖率主要反映体液免疫功能;T淋巴细胞增殖率和细胞因子水平主要反映细胞免疫功能[43-44]。Li等[45]报道,PAMK能显著提高鹅环磷酰胺(CTX)免疫抑制模型的脾脏指数、血清溶血素、IL-4、IL-10和IgA含量、T和B淋巴细胞增殖率,表明PAMK可有效缓解CTX对机体造成的免疫抑制,维持体液和细胞免疫平衡。此外,研究表明,PAMK是一种提高免疫功能的免疫增强剂,本身可作为一种抗原,也可作为疫苗的免疫佐剂促进抗体的形成[46]。Zhao等[47]研究发现,PAMK能有效提高接种新城疫(ND)疫苗雏鸡血清中的CD4+/CD8+和ND HI抗体滴度。PAMK还可作为免疫口服佐剂,显著提高血清IgG、INF-γ和白细胞介素-5(IL-5)含量,促进脾淋巴细胞的增殖[48]。综上所述,PAMK能够维持体液和细胞免疫平衡的实质是:一方面,通过提高CD4+T细胞的百分率使Th1和Th2细胞分泌更多的细胞因子,从而维持机体免疫的动态平衡;另一方面,在提高T淋巴细胞增殖率的同时也刺激了B淋巴细胞的增殖,可诱导抗原特异性体液免疫应答。
3.2 PAMK介导的免疫信号通路Toll样受体4(TLR4)是免疫细胞表面重要的非特异性免疫受体之一,其信号级联是一种经典的多糖调控途径,在非特异性免疫应答中起重要作用[49]。汲广全[50]团队前期研究发现,PAMK能够促进小鼠巨噬细胞(RAW264.76)分泌TNF-α、INF-γ,增强巨噬细胞活性并促进TLR4、p38和NF-κB的活化。首先,采用TLR4抗体阻断TLR4,结果显著抑制了PAMK对巨噬细胞p38的活化,TNF-α和INF-γ分泌量减少,表明TLR4参与了PAMK活化巨噬细胞的信号通路并介导了p38的活化;然后采用p38激酶特异性抑制剂(SB203580)阻断p38,结果发现显著抑制了PAMK诱导p38MAPK对下游蛋白的活化,TNF-α和INF-γ分泌量减少,表明p38也参与了PAMK诱导巨噬细胞分泌下游细胞因子;最后采用NF-κB特异性抑制剂吡咯烷二硫代氨基甲酸酯(PDTC),显著抑制PAMK诱导NF-κB的活化,表明NF-κB同样参与了PAMK诱导巨噬细胞的活化[51]。这些结果提示PAMK对机体免疫调节是通过介导TLR4/p38MAPK/NF-κB信号通路实现的。研究进一步证实,小鼠巨噬细胞表面的TLR4可识别并与PAMK结合,形成受体-配体复合物,通过触发髓样分化因子88(MyD88)依赖性和非依赖性信号级联反应来激活核因子-κB抑制蛋白激酶(IKK),诱导IκB降解,导致NF-κB从细胞质NF-κB-IκB复合物中释放出来进入细胞核,刺激巨噬细胞分泌TNF-α和NO并调控其转录[52]。Li等[53]研究团队同样用小鼠作为研究对象,饲喂PAMK后显著提高了TLR4、MyD88、肿瘤坏死因子受体关联因子3(TRAF3)、TRAF6和NF-κB的mRNA的表达;此外,PAMK对非MyD88依赖性信号通路中的β干扰素TIR结构域衔接蛋白(TRIF)的mRNA的表达并无显著影响,这也证实了PAMK是通过启动MyD88依赖性(TLR4-MyD88/NF-κB)信号通路来调控免疫功能,而不是非MyD88依赖性(TLR4-TRIF/NF-κB)信号通路。李婉雁等[54]研究也证实,PAMK通过TLR4/NF-κB信号通路调控雏鸡脾脏淋巴细胞免疫功能。此外,Li等[55]通过建立鹅的CTX免疫抑制模型发现,PAMK可显著提高与T细胞活化和成熟相关的CD28、CD96和IL-2的mRNA表达,并上调miRNA的表达,以T细胞受体(TCR)信号通路中的CTLA4为靶点,抑制其与CD28竞争结合CD80和CD86的能力,从而使CD28能与更多的配体结合,提高活化T细胞转录因子(NFAT)的表达,促进T细胞的活化。这说明PAMK可通过提高或抑制TCR-NFAT信号通路中关键基因的表达,激活T细胞,减轻CTX的免疫抑制作用。
综上所述,PAMK对机体免疫功能调控的途径可以概括为以下几个方面: 1)促进T、B淋巴细胞的增殖分化,提高机体细胞和体液免疫应答;2)作为疫苗的免疫佐剂,提高抗体和免疫球蛋白水平;3)通过激活由TLR4介导的TLR4-MyD88/NF-κB以及TCR-NFAT信号通路,调控NF-κB和NFAT的表达,促进细胞因子产生,从而促进巨噬细胞活化。然而,目前对PAMK介导的免疫功能调节机制和相关信号通路的报道依然较少,主要集中于TLR4/NF-κB信号通路的研究,因此,对PAMK影响机体免疫功能和相关信号通路调控机理的研究还有待进一步深入。
4 PAMK在畜禽生产中的应用 4.1 在断奶仔猪生产中的应用断奶仔猪是生猪养殖中最关键的阶段,易受饲养环境、营养和疾病等因素的影响。Li等[56]发现,添加0.3% PAMK显著改善仔猪生长性能,提高血清中IgG和IgM的含量以及IL-6、TNF-α、INF-γ和NFAT mRNA的相对表达量。赵燕飞等[38]研究表明,与对照组相比,饲粮添加0.2% PAMK显著提高断奶仔猪日增重,并使腹泻率显著降低30.94%。柴艳等[37]也得出了类似的结果,饲粮添加0.05%、0.10%、0.15% PAMK时断奶仔猪平均日增重(ADG)均显著提高,同时料重比(F/G)下降,其中添加0.1% PAMK时,可以较好地抑制仔猪腹泻率,显著增强空肠与十二指肠的V/C,提高断奶仔猪生长性能。李丽立等[57]研究指出,添加0.3% PAMK能够显著促进早期断奶仔猪淋巴细胞增殖,同时显著提高血清中TNF-α和IL-2的含量。许丹宁等[58]研究显示,添加0.5% PAMK能够使断奶仔猪的饲料转化率(FCR)与ADG大幅度提高,F/G降低,且其促生长效果与抗生素组(15%金霉素100 mg/kg+4%黄霉素50 mg/kg)相当。另外,PAMK还可与其他多糖配合使用,陈丽玲等[59]将PAMK与茯苓多糖复配成白术茯苓多糖,在断奶仔猪饲粮中添加4个水平(0.02%、0.04%、0.06%、0.08%)的白术茯苓多糖均可显著提高ADG,降低F/G和腹泻率,其中0.06%白术茯苓多糖促生长效果最佳并且其缓解腹泻的效果与抗生素组(20 mg/kg硫酸黏杆菌素+40 mg/kg杆菌肽锌+100 mg/kg喹乙醇)相当。以上结果表明,PAMK可通过提高免疫力、改善肠道健康和降低腹泻率来促进断奶仔猪生长。
4.2 在家禽生产中的应用目前PAMK应用家禽生产的报道较少,现有的研究多是以蛋鸡为对象。文贵辉[60]试验表明,5% PAMK(纯度≥68%)可使林下养殖的绿壳蛋鸡平均蛋重显著提高6.26%,产蛋率显著提高7.33%,料蛋比显著降低12.64%,还可提高蛋壳厚度、哈氏单位。荆佳林等[61]在以海兰灰育成鸡为对象的试验中发现,饲粮中加入0.2%、0.4%、0.6% PAMK(纯度60%)均可提高海兰灰育成鸡血清中IgG、IgM和IgA的含量,0.4%和0.6% PAMK可显著提高末体重,降低F/G,其中添加0.4% PAMK效果最佳。Xu等[62]研究表明,200 mg/kg PAMK可通过降低急性热应激条件下热休克蛋白27(HSP27)和HSP70 mRNA的表达,下调INF-γ、TNF-α、IL-2、IL-4在免疫器官中的表达水平,从而缓解热应激造成的鸡脾脏、法氏囊、胸腺的氧化受损。李婉雁[63]的试验表明,在常温条件下,添加100~200 mg/kg PAMK对岭南黄鸡脾脏、胸腺和法氏囊的发育有促进作用,并且可促进淋巴细胞的增殖和TNF-α、INF-γ、IL-2等细胞因子的分泌。以上研究报道提示,在热应激和正常温度条件下添加PAMK都能在一定程度上促进家禽免疫器官的发育,提高免疫功能。此外,PAMK与枯草芽孢杆菌联用可显著提高海兰褐育成期蛋鸡ADG,降低F/G,提高血清中IgG、IgM和IgA的含量,其中0.4% PAMK和250 mg/kg枯草芽孢杆菌联用效果较佳,但二者联用提高免疫功能的调控机制尚不清楚,需要进一步的研究和验证[36]。
综上所述,PAMK可通过提高家禽免疫功能和抗应激能力来提高生产性能。但各研究报道中PAMK添加量都不尽相同,这可能是由于家禽不同品种、生长阶段、饲养环境和评价指标以及PAMK纯度、来源、提取工艺等因素所导致的结果。
4.3 在反刍动物生产中的应用PAMK在反刍动物中的报道很少,仅限于促进牛淋巴细胞增殖和提高牛、羊卵母细胞成熟率及受精卵发育。Xu等[64]前期研究发现,在泌乳奶牛乳房淋巴结区(SMLN)皮下注射油乳化PAMK可降低乳汁体细胞数和N-乙酰β-D-氨基葡萄糖苷酶的活性,对治疗奶牛隐性乳腺炎具有一定的价值。进一步体外试验发现,PAMK促进S期和G2/M期SMLN淋巴细胞增殖以及提高INF-γ的mRNA表达与Ca2+浓度升高有关,提示PAMK治疗奶牛乳腺炎的机制可能与其在SMLN淋巴细胞中的免疫刺激作用有关[65]。体外试验发现,低剂量10、50 μg/mL PAMK可显著提高牛、羊卵母细胞成熟率,对热应激条件下的牛、羊卵母细胞具有保护作用,10~100 μg/mL PAMK可显著提高羊受精卵的24 h卵裂率[66]。
5 小结白术是我国年销售量最大的中药材品种之一,国内年总产量在1万t以上,因此PAMK的来源是非常广泛的。在全面禁用饲用抗生素的大背景下,将PAMK开发成为有效的饲料添加剂产品,对植物饲料资源的合理开发利用和可持续发展具有重要意义。但现阶段PAMK的应用还存在一些问题需要解决:1)PAMK的结构组成因白术的品种、来源和提取工艺方法的不同而复杂多样,需要进一步优化提取工艺,建立统一高效的制备流程,降低生产成本,提高提取率;2)PAMK在机体代谢机制和免疫调控的信号通路有待进一步研究,使免疫促进效果更加安全有效;3)虽然现已有研究报道PAMK在畜禽生产中的应用效果,但研究还相对较少,且缺少安全性评价数据,有待针对不同动物的不同生长阶段进行进一步的试验,明确适宜添加量。在探究PAMK生物学功能及其在动物生产应用效果的同时,将其与不同多糖(如白术茯苓多糖)配比组合或与益生菌联合使用,开发更为高效的饲料添加剂产品是PAMK未来的重点研究方向之一。
| [1] |
CHEN C, ZHOU S, MENG Q G. A molecular docking study of Rhizoma atractylodis and Rhizoma atractylodis macrocephalae herbal pair with respect to type 2 diabetes mellitus[J]. Journal of Traditional Chinese Medical Sciences, 2018, 5(2): 185-198. DOI:10.1016/j.jtcms.2018.05.004 |
| [2] |
FENG Y Y, JI H Y, DONG X D, et al. Polysaccharide extracted from Atractylodes macrocephala Koidz (PAMK) induce apoptosis in transplanted H22 cells in mice[J]. International Journal of Biological Macromolecules, 2019, 137: 604-611. DOI:10.1016/j.ijbiomac.2019.06.059 |
| [3] |
KIM C K, KIM M, OH S D, et al. Effects of Atractylodes macrocephala Koidzumi rhizome on 3T3-L1 adipogenesis and an animal model of obesity[J]. Journal of Ethnopharmacology, 2011, 137(1): 396-402. DOI:10.1016/j.jep.2011.05.036 |
| [4] |
SONG H P, LI R L, CHEN X, et al. Atractylodes macrocephala Koidz promotes intestinal epithelial restitution via the polyamine-voltage-gated K+ channel pathway[J]. Journal of Ethnopharmacology, 2014, 152(1): 163-172. DOI:10.1016/j.jep.2013.12.049 |
| [5] |
CUI Y S, LI Y X, JIANG S L, et al. Isolation, purification, and structural characterization of polysaccharides from Atractylodis macrocephalae Rhizoma and their immunostimulatory activity in RAW264.7 cells[J]. International Journal of Biological Macromolecules, 2020, 163: 270-278. DOI:10.1016/j.ijbiomac.2020.06.269 |
| [6] |
YAMADA H, KIYOHARA H. Immunomodulating activity of plant polysaccharide structures[M]//KAMERLING H. Comprehensive glycoscience: from chemistry to systems biology. Oxford: Elsevier, 2007, 4: 663-694.
|
| [7] |
HAN B, GAO Y, WANG Y L, et al. Protective effect of a polysaccharide from rhizoma Atractylodis macrocephalae on acute liver injury in mice[J]. International Journal of Biological Macromolecules, 2016, 87: 85-91. DOI:10.1016/j.ijbiomac.2016.01.086 |
| [8] |
王少杰, 巴娟, 张勇军, 等. 白术多糖的分子量及其单糖组成分析[J]. 中国兽药杂志, 2019, 53(5): 26-32. WANG S J, BA J, ZHANG Y J, et al. Analysis of molecular weight and monosaccharide composition of polysaccharides from Atractylodes macrocephala[J]. Chinese Journal of Veterinary Medicine, 2019, 53(5): 26-32 (in Chinese). |
| [9] |
池玉梅, 李伟, 文红梅, 等. 白术多糖的分离纯化和化学结构研究[J]. 中药材, 2001, 24(9): 647-648. CHI Y M, LI W, WEN H, et al. Studies on separation, purification and chemical structure of polysaccharide from Atractylodes macrocephala[J]. Journal of Chinese Medicinal Materials, 2001, 24(9): 647-648 (in Chinese). DOI:10.3321/j.issn:1001-4454.2001.09.013 |
| [10] |
伍乐芹, 张静, 孙润广, 等. 白术多糖的分离纯化与结构表征[J]. 高等学校化学学报, 2011, 32(12): 2812-2816. WU L Q, ZHANG J, SUN R G, et al. Separation, purification and structural characterization of polysaccharides from Atractylodes macrocephala[J]. Chemical Journal of Chinese Universities, 2011, 32(12): 2812-2816 (in Chinese). |
| [11] |
王龙, 白云. 近10年白术多糖的研究进展[J]. 按摩与康复医学, 2018, 9(17): 88-89. WANG L, BAI Y. Research progress of Atractylodes macrocephala polysaccharides in the past 10 years[J]. Massage and Rehabilitation Medicine, 2018, 9(17): 88-89 (in Chinese). DOI:10.3969/j.issn.1008-1879.2018.17.045 |
| [12] |
ZHU B, ZHANG Q L, HUA J W, et al. The traditional uses, phytochemistry, and pharmacology of Atractylodes macrocephala Koidz.: a review[J]. Journal of Ethnopharmacology, 2018, 226: 143-167. DOI:10.1016/j.jep.2018.08.023 |
| [13] |
袁海梅, 李鸿翔, 彭腾. 正交试验法优选白术多糖的提取工艺[J]. 成都大学学报(自然科学版), 2015, 34(3): 217-219. YUAN H M, LI H X, PENG T. Optimization of the extraction process of Atractylodes macrocephala polysaccharide by orthogonal experiment[J]. Journal of Chengdu University (Natural Science Edition), 2015, 34(3): 217-219 (in Chinese). DOI:10.3969/j.issn.1004-5422.2015.03.003 |
| [14] |
BI Y G, YANG D L, HUANG X J, et al. Study on ultrasonic-assisted extraction of polysaccharide of Atractylis macroceohala Koidz of experiment[J]. Energy Procedia, 2012, 17: 1778-1785. DOI:10.1016/j.egypro.2012.02.311 |
| [15] |
侯轩, 周家容, 田允波. 复合酶法提取白术多糖的工艺研究[J]. 广东化工, 2008, 35(12): 91-94. HOU X, ZHOU J R, TIAN Y B. Study on the technology of extracting polysaccharides from Atractylodes macrocephala with compound enzyme[J]. Guangdong Chemical Industry, 2008, 35(12): 91-94 (in Chinese). DOI:10.3969/j.issn.1007-1865.2008.12.029 |
| [16] |
孟永海, 孟祥瑛, 付敬菊, 等. 超声波协同酶解法提取白术总多糖工艺优化[J]. 化学工程师, 2020, 34(3): 18-21. MENG Y H, MENG X Y, FU J J, et al. Optimization of extraction process for total polysaccharides of Atractylodes macrocephala by ultrasonic and enzymatic hydrolysis[J]. Chemical Engineer, 2020, 34(3): 18-21 (in Chinese). |
| [17] |
TURNER J R. Intestinal mucosal barrier function in health and disease[J]. Nature Reviews Immunology, 2009, 9(11): 799-809. DOI:10.1038/nri2653 |
| [18] |
谢红兵. 植物多糖对断奶仔猪肠道生理特征和免疫机能的影响及机理研究[D]. 博士学位论文. 长沙: 湖南农业大学, 2018. XIE H B. The effect and mechanism of plant polysaccharides on intestinal physiological characteristics and immune function of weaned piglets[D]. Ph. D. Thesis. Changsha: Hunan Agricultural University, 2018. (in Chinese) |
| [19] |
SONG H P, HOU X Q, LI R Y, et al. Atractylenolide I stimulates intestinal epithelial repair through polyamine-mediated Ca2+ signaling pathway[J]. Phytomedicine, 2017, 28: 27-35. DOI:10.1016/j.phymed.2017.03.001 |
| [20] |
伍婷婷. 白术多糖通过多胺和Ca2+调节IEC-6细胞迁移及粘附连接蛋白的研究[D]. 硕士学位论文. 广州: 广州中医药大学, 2017. WU T T. Atractylodes macrocephala polysaccharide regulates IEC-6 cell migration and adhesion junction protein through polyamine and Ca2+[D]. Master's Thesis. Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2017. (in Chinese) |
| [21] |
ZENG D, HU C, LI R L, et al. Polysaccharide extracts of Astragalus membranaceus and Atractylodes macrocephala promote intestinal epithelial cell migration by activating the polyamine-mediated K+ channel[J]. Chinese Journal of Natural Medicines, 2018, 16(9): 674-682. DOI:10.1016/S1875-5364(18)30107-9 |
| [22] |
DANYVID OLIVARES-VILLAGÓMEZ, KAER L V. Intestinal intraepithelial lymphocytes: sentinels of the mucosal barrier[J]. Trends in Immunology, 2017, 39(4): 264-275. |
| [23] |
SHI N, LI N, DUAN X W. Interaction between the gut microbiome and mucosal immune system[J]. Military Medical Research, 2017, 4: 14. DOI:10.1186/s40779-017-0122-9 |
| [24] |
XIE F, SAKWIWATKUL K, ZHANG C R, et al. Atractylodis macrocephalae Koidz.polysaccharides enhance both serum IgG response and gut mucosal immunity[J]. Carbohydrate Polymers, 2013, 91(1): 68-73. DOI:10.1016/j.carbpol.2012.07.083 |
| [25] |
蒋焱平, 陈刚, 郭彦, 等. 玉屏风多糖对小鼠肠黏膜免疫功能影响的复方效应[J]. 中国兽医学报, 2018, 38(9): 1794-1797. JIANG Y P, CHEN G, GUO Y, et al. Compound effect of Yupingfeng polysaccharide on intestinal mucosal immune function[J]. Chinese Journal of Veterinary Medicine, 2018, 38(9): 1794-1797 (in Chinese). |
| [26] |
SHIOU S R, YU Y Y, GUO Y E, et al. Oral administration of transforming growth factor-β1 (TGF-β1) protects the immature gut from injury via Smad protein-dependent suppression of epithelial nuclear factor-κB (NF-κB) signaling and proinflammatory cytokine production[J]. Journal of Biological Chemistry, 2013, 288(48): 34757-34766. DOI:10.1074/jbc.M113.503946 |
| [27] |
PELLAT A, VAQUERO J, FOUASSIER L. Role of ErbB/HER family of receptor tyrosine kinases in cholangiocyte biology[J]. Hepatology, 2018, 67(2): 762-773. DOI:10.1002/hep.29350 |
| [28] |
尚秋辰. 白术多糖对大肠杆菌腹泻模型小鼠肠道黏膜修复机理研究[D]. 硕士学位论文. 扬州: 扬州大学, 2017. SHANG Q C. Research on mechanism of Atractylodes macrocephala polysaccharide on intestinal mucosal repair in mice with E. coli diarrhea[D]. Master's Thesis. Yangzhou: Yangzhou University, 2017. (in Chinese) |
| [29] |
HAN K H, PARK J M, JEONG M, et al. Heme oxygenase-1 induction and anti-inflammatory actions of Atractylodes macrocephala and Taraxacum herba extracts prevented colitis and was more effective than sulfasalazine in preventing relapse[J]. Gut Liver, 2017, 11(5): 655-666. DOI:10.5009/gnl16496 |
| [30] |
BESEDNOVA N N, ZAPOROZHETS T S, KUZNETSOVA T A, et al. Extracts and marine algae polysaccharides in therapy and prevention of inflammatory diseases of the intestine[J]. Marine Drugs, 2020, 18(6): 289. DOI:10.3390/md18060289 |
| [31] |
谢红兵, 邹云, 刘丽莉, 等. 植物多糖对断奶仔猪小肠黏膜形态及肠黏膜屏障功能的影响[J]. 中国兽医学报, 2019, 39(1): 150-157, 187. XIE H B, ZOU Y, LIU L L, et al. Effects of plant polysaccharides on the intestinal mucosal morphology and intestinal mucosal barrier function of weaned piglets[J]. Chinese Journal of Veterinary Medicine, 2019, 39(1): 150-157, 187 (in Chinese). |
| [32] |
OHATA A, USAMI M, MIYOSHI M. Short-chain fatty acids alter tight junction permeability in intestinal monolayer cells via lipoxygenase activation[J]. Nutrition, 2005, 21(7/8): 838-847. |
| [33] |
WANG R J, ZHOU G S, WANG M Y, et al. The metabolism of polysaccharide from Atractylodes macrocephala Koidz and its effect on intestinal microflora[J]. Evidence-Based Complementary and Alternative Medicine, 2014, 2014: 926381. |
| [34] |
BROEKAERT W F, COURTIN C M, VERBEKE K, et al. Prebiotic and other health-related effects of cereal-derived arabinoxylans, arabinoxylan-oligosaccharides, and xylooligosaccharides[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(2): 178-194. DOI:10.1080/10408390903044768 |
| [35] |
THEERAWATANASIRIKU S, KOOMKRONG N, KAYAN A, et al. Intestinal barrier and mucosal immunity in broilers, Thai Betong, and native Thai Praduhangdum chickens[J]. Turkish Journal of Veterinary and Animal Sciences, 2017, 41(3): 357-364. |
| [36] |
王琳. 白术多糖、枯草芽孢杆菌对育成鸡生长性能和肠道生理的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2018. WANG L. Effects of Atractylodes macrocephala polysaccharide and Bacillus subtilis on growth performance and intestinal physiology of growing chickens[D]. Master's Thesis. Baoding: Hebei Agricultural University, 2018. (in Chinese) |
| [37] |
柴艳, 李琦华, 贾俊静, 等. 白术多糖对断奶仔猪生产性能及肠道组织形态的影响[J]. 中国饲料, 2020(15): 49-54. CHAI Y, LI Q H, JIA J J, et al. Effects of Atractylodes macrocephala polysaccharides on production performance and intestinal tissue morphology of weaned piglets[J]. China Feed, 2020(15): 49-54 (in Chinese). |
| [38] |
赵燕飞, 汪以真. 白术、微米白术和白术多糖对断奶仔猪生长性能和肠道形态及微生态区系的影响[J]. 中国畜牧杂志, 2015, 51(1): 65-69. ZHAO Y F, WANG Y Z. The effects of Atractylodes macrocephala, micro-Atractylodes macrocephala and polysaccharides of Atractylodes macrocephala on the growth performance, intestinal morphology and micro-ecological flora of weaned piglets[J]. Chinese Journal of Animal Husbandry, 2015, 51(1): 65-69 (in Chinese). DOI:10.3969/j.issn.0258-7033.2015.01.014 |
| [39] |
PATANKAR Y R, SUTIWISESAK R, BOYCE S, et al. Limited recognition of Mycobacterium tuberculosis-infected macrophages by polyclonal CD4 and CD8 T cells from the lungs of infected mice[J]. Mucosal Immunology, 2020, 13(1): 140-148. DOI:10.1038/s41385-019-0217-6 |
| [40] |
ZHANG Z J, MENG Y M, GUO Y X, et al. Rehmannia glutinosa polysaccharide induces maturation of murine bone marrow derived Dendritic cells (BMDCs)[J]. International Journal of Biological Macromolecules, 2013, 54: 136-143. DOI:10.1016/j.ijbiomac.2012.12.005 |
| [41] |
LIU J, CHEN X, YUE C J, et al. Effect of selenylation modification on immune-enhancing activity of Atractylodes macrocephala polysaccharide[J]. International Journal of Biological Macromolecules, 2015, 72: 1435-1440. DOI:10.1016/j.ijbiomac.2014.10.022 |
| [42] |
SON Y O, KOOK S H, LEE J C. Glycoproteins and polysaccharides are the main class of active constituents required for lymphocyte stimulation and antigen-specific immune response induction by traditional medicinal herbal plants[J]. Journal of Medicinal Food, 2017, 20(10): 1011-1021. DOI:10.1089/jmf.2017.3943 |
| [43] |
LAFRENTZ B R, SHOEMAKER C A, BOOTH N J, et al. Spleen index and mannose-binding lectin levels in four channel catfish families exhibiting different susceptibilities to Flavobacterium columnare and Edwardsiella ictaluri[J]. Journal of Aquatic Animal Health, 2012, 24(3): 141-147. DOI:10.1080/08997659.2012.675936 |
| [44] |
SHETTY S K, VENKATESHA D T, RAO S P, et al. Hemolysin and serum resistance among ESBL producing extraintestinal pathogenic Escherichia coli isolated from a tertiary care hospital[J]. International Journal of Current Microbiology and Applied Sciences, 2016, 5(1): 71-77. DOI:10.20546/ijcmas.2016.501.006 |
| [45] |
LI W Y, GUO S X, XU D N, et al. Polysaccharide of Atractylodes macrocephala Koidz (PAMK) relieves immunosuppression in cyclophosphamide-treated geese by maintaining a humoral and cellular immune balance[J]. Molecules, 2018, 23(4): 932. DOI:10.3390/molecules23040932 |
| [46] |
LIU Z G, SUN Y Q, ZHANG J, et al. Immunopotentiation of polysaccharides of Atractylodes macrocephala Koidz-loaded nanostructured lipid carriers as an adjuvant[J]. International Journal of Biological Macromolecules, 2018, 120: 768-774. DOI:10.1016/j.ijbiomac.2018.08.108 |
| [47] |
ZHAO X N, SUN W J, ZHANG S J, et al. The immune adjuvant response of polysaccharides from Atractylodis macrocephalae Koidz in chickens vaccinated against Newcastle disease (ND)[J]. Carbohydrate Polymers, 2016, 141: 190-196. DOI:10.1016/j.carbpol.2016.01.013 |
| [48] |
XIE F, LI Y T, SU F, et al. Adjuvant effect of Atractylodis macrocephalae Koidz.polysaccharides on the immune response to foot-and-mouth disease vaccine[J]. Carbohydrate Polymers, 2012, 87(2): 1713-1719. DOI:10.1016/j.carbpol.2011.09.080 |
| [49] |
WANG Z X, DONG B, FENG Z F, et al. A study on immunomodulatory mechanism of polysaccharopeptide mediated by TLR4 signaling pathway[J]. BMC Immunology, 2015, 16: 34. DOI:10.1186/s12865-015-0100-5 |
| [50] |
汲广全. 白术有效成分对巨噬细胞和树突状细胞免疫活性的研究[D]. 博士学位论文. 广州: 华南理工大学, 2014. JI G Q. Study on the immune activity of the active ingredients of Baizhu on macrophages and dendritic cells[D]. Ph. D. Thesis. Guangzhou: South China University of Technology, 2014. (in Chinese) |
| [51] |
汲广全, 陈仁琼, 郑建仙. 白术多糖对树突状细胞表型及功能成熟的影响[J]. 食品科学, 2015, 36(3): 207-211. JI G Q, CHEN R Q, ZHENG J X. The effect of Atractylodes macrocephala polysaccharides on the phenotype and functional maturation of dendritic cells[J]. Food Science, 2015, 36(3): 207-211 (in Chinese). |
| [52] |
JI G Q, CHEN R Q, ZHENG J X. Macrophage activation by polysaccharides from Atractylodes macrocephala Koidz through the nuclear factor-κB pathway[J]. Pharmaceutical Biology, 2014, 53(4): 512-517. |
| [53] |
LI B X, LI W Y, TIAN Y B, et al. Polysaccharide of Atractylodes macrocephala Koidz enhances cytokine secretion by stimulating the TLR4-MyD88-NF-κB signaling pathway in the mouse spleen[J]. Journal of Medicinal Food, 2019, 22(9): 937-943. DOI:10.1089/jmf.2018.4393 |
| [54] |
李婉雁, 曹楠, 田允波, 等. 白术多糖通过Toll样受体4/核因子-κB信号通路调控雏鸡脾脏淋巴细胞免疫功能[J]. 动物营养学报, 2019, 31(11): 5192-5201. LI W Y, CAO N, TIAN Y B, et al. Atractylodes macrocephala polysaccharide regulates the immune function of chicken spleen lymphocytes through Toll-like receptor 4/nuclear factor-κB signaling pathway[J]. Chinese Journal of Animal Nutrition, 2019, 31(11): 5192-5201 (in Chinese). |
| [55] |
LI W Y, XU D N, LI B X, et al. The polysaccharide of Atractylodes macrocephala Koidz (PAMK) alleviates cyclophosphamide-mediated immunosuppression in geese, possibly through novel_mir2 targeting of CTLA4 to upregulate the TCR-NFAT pathway[J]. RSC Advances, 2018, 8(47): 26837-26848. DOI:10.1039/C8RA00368H |
| [56] |
LI L L, YIN F G, ZHANG B, et al. Dietary supplementation with Atractylodes macrophala Koidz polysaccharides ameliorate metabolic status and improve immune function in early-weaned pigs[J]. Livestock Science, 2011, 142(1/2/3): 33-41. |
| [57] |
李丽立, 张彬, 朱南山, 等. 多糖对早期断奶仔猪淋巴细胞增殖与细胞因子的影响[J]. 农业现代化研究, 2009, 30(4): 495-497. LI L L, ZHANG B, ZHU N S, et al. Effects of polysaccharides on lymphocyte proliferation and cytokines in early weaned piglets[J]. Research of Agricultural Modernization, 2009, 30(4): 495-497 (in Chinese). DOI:10.3969/j.issn.1000-0275.2009.04.027 |
| [58] |
许丹宁, 田允波, 周家容, 等. 白术多糖促仔猪生长的内分泌机制[J]. 中国畜牧兽医, 2010, 37(3): 18-21. XU D N, TIAN Y B, ZHOU J R, et al. The endocrine mechanism of Atractylodes macrocephala polysaccharide in promoting growth of piglets[J]. China Animal Husbandry and Veterinary Medicine, 2010, 37(3): 18-21 (in Chinese). |
| [59] |
陈丽玲, 贺琴, 郭晓波, 等. 白术茯苓多糖复方对断奶仔猪生长性能和免疫功能的影响[J]. 动物营养学报, 2020, 32(7): 3394-3402. CHEN L L, HE Q, GUO X B, et al. Effects of Atractylodes macrocephala polysaccharide compound on growth performance and immune function of weaned piglets[J]. Chinses of Journal of Animal Nutrition, 2020, 32(7): 3394-3402 (in Chinese). |
| [60] |
文贵辉. 饲料中添加白术多糖对林下养殖绿壳蛋鸡生产性能与蛋品质的影响[J]. 中国饲料, 2019(5): 54-57. WEN G H. The effect of adding Atractylodes macrocephala polysaccharide in feed on the production performance and egg quality of green-shell laying hens raised under forest[J]. China Feed, 2019(5): 54-57 (in Chinese). |
| [61] |
荆佳林, 赵国先, 龚建刚, 等. 白术多糖对育成期蛋鸡生长性能和血清免疫指标的影响[J]. 饲料研究, 2019, 42(2): 35-37. JING J L, ZHAO G X, GONG J G, et al. Effects of Atractylodes macrocephala polysaccharides on growth performance and serum immune indexes of laying hens during the growing period[J]. Feed Research, 2019, 42(2): 35-37 (in Chinese). |
| [62] |
XU D N, TIAN Y B. Selenium and polysaccharides of Atractylodes macrocephala Koidz play different roles in improving the immune response induced by heat stress in chickens[J]. Biological Trace Element Research, 2015, 168(1): 235-241. DOI:10.1007/s12011-015-0351-2 |
| [63] |
李婉雁. 白术多糖对岭南黄鸡免疫功能影响的研究[D]. 硕士学位论文. 广州: 仲恺农业工程学院, 2014. LI W Y. The effect of Atractylodes macrocephala polysaccharide on the immune function of Lingnan yellow chicken[D]. Master's Thesis. Guangzhou: Zhongkai University of Agricultural and Engineering, 2014. (in Chinese) |
| [64] |
XU W, GUAN R, LU Y S, et al. Therapeutic effect of polysaccharide fraction of Atractylodis macrocephalae Koidz.in bovine subclinical mastitis[J]. BMC Veterinary Research, 2015, 11: 165. DOI:10.1186/s12917-015-0494-6 |
| [65] |
XU W, GUAN R, SHI F S, et al. Structural analysis and immunomodulatory effect of polysaccharide from Atractylodis macrocephalae Koidz.on bovine lymphocytes[J]. Carbohydrate Polymers, 2015, 174: 1213-1223. |
| [66] |
樊敏欢. 白术多糖对牛羊卵母细胞体外成熟及体外受精的影响[D]. 硕士学位论文. 广州: 仲恺农业工程学院, 2014. FAN M H. The influent of polysaccharide of Atractylis macroceohala Koidz (PAM) in cattle and sheep oocytes in vitro maturation and fertilization[D]. Master's Thesis. Guangzhou: Zhongkai University of Agricultural and Engineering, 2014. (in Chinese) |




