2. 浙江农业科学院省部共建农产品质量安全危害因子与风险防控国家重点实验室, 杭州 310021;
3. 浙江农业科学院农产品质量安全与营养研究所, 杭州 310021
2. State Key Laboratory for Managing Biotic and Chemical Threats to the Quality and Safety of Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;
3. Institute of Agro-Product Safety and Nutrition, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
产丁酸菌是一类能够发酵碳水化合物、主要代谢产物为丁酸的细菌统称[1]。常见产丁酸菌主要包括:丁酸弧菌属(Anaerostipes)、布劳特氏菌属(Blautia)、丁酸球菌属(Butyricicoccus)、丁酸单胞菌属(Butyricimonas)、粪杆菌属(Faecalibacterium)、梭杆菌属(Fusobacterium)、颤螺旋菌属(Oscillospira)、罗斯伯里氏菌属(Roseburia)、真杆菌属([Eubacterium] hallii group)等[1-4],其主要通过丁酸激酶途径和丁酰-CoA:乙酰-CoA转移酶途径生成丁酸。肠道产丁酸菌作为益生菌对人和动物的生理机能均具有重要意义,其分解未被消化的膳食纤维产生丁酸是结肠细胞能量的主要来源,并对肠黏膜修复及结肠炎和结肠癌的预防起重要作用[2],有些产丁酸菌可通过本身的结构和免疫特性发挥抗炎症作用[5],其数量和多样性的变化还能预测机体的健康状况[6]。在经济动物方面,丁酸能够提高动物的免疫功能、促进动物生长,并且可通过调节脂肪沉积从而影响肉品质,因此,肠道产丁酸菌与其代谢产物丁酸是调控动物经济性状的重要研究靶点[7]。
金华猪是我国优良地方猪种,具有肉质好、繁殖率高、脂肪沉积能力强等优良特性;长白猪原产于丹麦,具有生长速度快、饲料利用率高、瘦肉率高等特点,这2个品种猪是研究肉品质与肠道微生物之间关系的重要模型[8-9]。通过采集粪便分析发现,金华猪肠道优势菌属主要包括:乳酸杆菌属、链球菌属、梭菌属、SMB53、双歧杆菌属、颤螺旋菌属、粪球菌属等[10],而长白猪肠道优势菌属主要包括:梭菌属、SMB53、链球菌属、普氏菌属、乳酸杆菌属、Turicibacter、瘤胃球菌属等[11]。本课题组前期将金华猪和长白猪饲养于相同环境中,并饲喂相同饲粮,对其肠道菌群结构进行分析发现,金华猪和长白猪肠道中菌群结构存在较大的差异,特别是在小肠段中[12]。将金华猪和长白猪肠道微生物移植于抗生素处理小鼠,小鼠可以在一定程度上重现猪的体脂体征,且小鼠肠道内容物中短链脂肪酸含量变化也与供体猪相一致,说明了猪肠道微生物可通过产短链脂肪酸干预猪的体脂代谢[9]。丁酸作为具有多种生物学功能的短链脂肪酸之一,其调节脂肪代谢功能在人[13-14]、小鼠[15]和鸡[7]试验中均已得到证实,但在与猪体脂代谢方面的研究较少,特别是对于猪不同品种和不同肠段中产丁酸菌、产丁酸关键功能基因相对表达量和丁酸含量相关性研究。因此,本研究旨在将肥胖型金华猪和瘦肉型长白猪作为研究对象,分析不同脂肪沉积能力猪各肠段主要产丁酸菌、丁酸关键功能基因相对表达量以及丁酸含量的差异,揭示猪肠道丁酸代谢与体脂沉积的相关性,为猪肠道微生物丁酸代谢研究和脂肪沉积调控提供科学依据。
1 材料与方法 1.1 试验设计分别选择金华猪和长白猪仔猪各18头,公母各占1/2,饲养于相同环境中,饲喂相同的饲粮,饲粮组成及营养水平见表 1,自由饮水和采食。在240日龄阶段,从每个品种中选择体重相近的公、母猪各5头屠宰取样,其中金华猪体重(70.6±9.4) kg,背膘厚(2.71±0.45) cm,长白猪体重(124.5±5.1) kg,背膘厚(1.72±0.16) cm[12],分别收集十二指肠、空肠、回肠、盲肠和结肠内容物于液氮中速冻后-80 ℃保存。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of diets (DM basis) |
采用QIAamp DNA Stool Mini试剂盒(QIAGEN)提取各肠段内容物微生物基因组DNA。参照Xu等[16]的引物序列对金华猪和长白猪各肠段丁酰-CoA:乙酰-CoA转移酶(上游引物5′-AAGGATCTCGGIRTICAYWSIGARATG-3′;下游引物5′-GAGGTCGTCICKRAAITYIGGRTGNGC-3′)和丁酸激酶(上游引物5′-TGCTGTWGTTGGWAGAGGYGGA-3′;下游引物5′-GCAACIGCYTTTTGATTTAATGCATGG-3′)基因相对表达量进行实时荧光定量PCR分析。实时荧光定量PCR在ABI 7500型定量PCR仪中进行。体系为10 μL,其中包含了5.0 μL SYBRTM Green qPCR mix,上、下游引物各0.5 μL,ddH2O 4.0 μL。程序为:95 ℃,2 min预变性;95 ℃,15 s;58 ℃,45 s;72 ℃,1 min;共35个循环。每个样品做3个重复,最终依据测得的Ct值与标准曲线比较计算样品中DNA拷贝数(基因相对表达量)。
1.3 高通量测序和生物信息分析对细菌16S-rRNA基因的V4高变区进行扩增,引物序列如下:515F (5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),在Illumina HiSeq 2500上测序。通过QIIME平台在97%相似性水平上对操作分类单元(OTUs)进行分类。使用Sliva数据库对所有OTUs的代表性序列进行物种匹配,根据最终的有效数据(effective Tags)统计各个样本中各分类水平相对丰度。
1.4 丁酸含量测定参照Xiao等[11]的方法,准备1.5 mL离心管,将0.1 g左右各肠段内容物样品,置于管中并加入9倍体积(mL)的超纯水,充分振荡混匀后,12 000 r/min离心10 min,离心后取上清液0.5 mL置于1.5 mL离心管中,随后加入0.1 mL的25%(w/v)偏磷酸与巴豆酸(内标)混合溶液,在-20 ℃环境下保存过夜。上样前使用0.22 μm滤膜进行过滤,采用12 000 r/min离心10 min的方式对滤液进行处理,离心处理后取500 μL上清液于气相色谱仪上进行测定,色谱柱采用毛细管色谱柱(InertCap FFAP)。色谱条件设置为:柱温110 ℃,汽化室温度180 ℃;采用FID检测器,检测温度180 ℃;载气为氮气,压力为0.06 MPa,氧气压力0.05 MPa,氢气压力0.05 MPa,灵敏度为10-1,衰减3.0。
1.5 数据分析采用SPSS 20.0中的非配对t检验进行差异显著性分析,采用Graphpad 8软件作图,数据结果以平均值±标准差(means±SD)表示,以P < 0.05作为差异显著性判断标准。采用R软件进行斯皮尔曼相关性分析。
2 结果 2.1 金华猪和长白猪不同肠段主要产丁酸菌的相对丰度比较选取9种重要的常见产丁酸菌属进行分析发现(图 1),金华猪和长白猪肠道产丁酸菌差异主要体现在小肠段,金华猪空肠、回肠中布劳特氏菌属、丁酸球菌属、丁酸单胞菌属、粪杆菌属、真杆菌属相对丰度显著低于长白猪(P < 0.05);而颤螺旋菌属和罗斯伯里氏菌属显著高于长白猪(P < 0.05)。
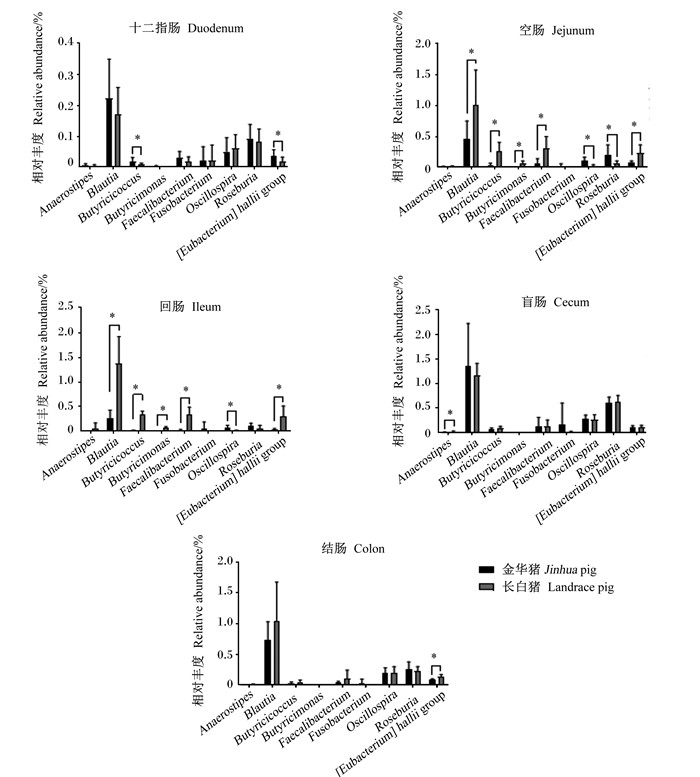
|
Anaerostipes:丁酸弧菌属;Blautia:布劳特氏菌属;Butyricicoccus:丁酸球菌属;Butyricimonas:丁酸单胞菌属;Faecalibacterium:粪杆菌属;Fusobacterium:梭杆菌属;Oscillospira:颤螺旋菌属;Roseburia:罗斯伯里氏菌属;[Eubacterium] hallii group:真杆菌属。“*”:P < 0.05。下图同The same as below。 图 1 金华猪和长白猪肠道9种主要产丁酸菌相对丰度比较 Fig. 1 Comparison of relative abundance of 9 genera of butyrate-producing bacteria in intestines of Jinhua and Landrace pigs (n=10) |
分别对金华猪和长白猪的9种常见产丁酸菌相对丰度进行相关性分析发现(图 2),在金华猪中,丁酸弧菌属、颤螺旋菌属、粪杆菌属、布劳特氏菌属、丁酸球菌属、罗斯伯里氏菌属和真杆菌属相对丰度间呈极显著正相关(r=0.20~0.84,P < 0.01);在长白猪中,布劳特氏菌属、丁酸球菌属、丁酸单胞菌属、粪杆菌属和真杆菌属相对丰度间呈极显著正相关(r=0.41~0.88,P < 0.01)。
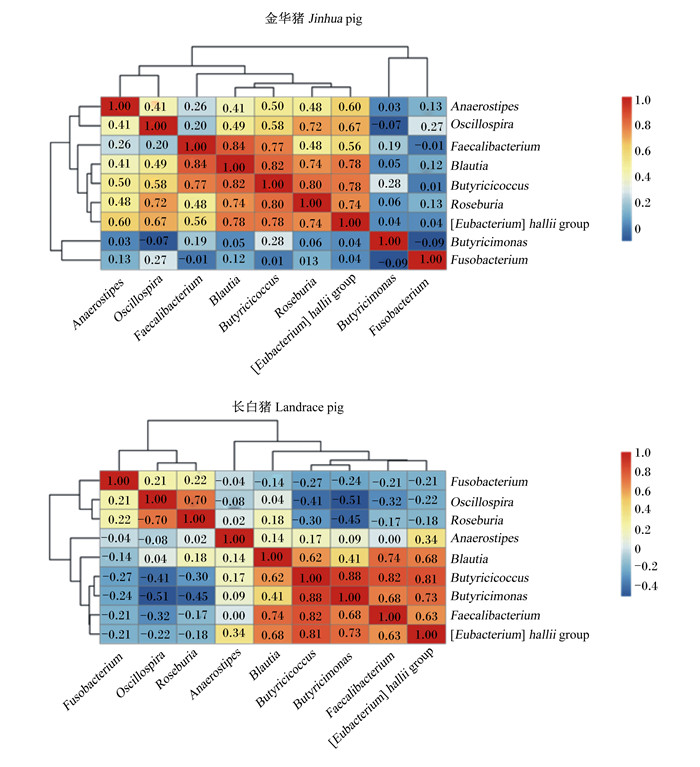
|
图 2 金华猪和长白猪肠道9种主要产丁酸菌属相对丰度的相关性分析 Fig. 2 Correlation analysis of relative abundance of 9 genera of butyrate-producing bacteria in intestines of Jinhua and Landrace pigs |
通过实时荧光定量PCR分析发现(图 3),丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因主要在大肠段富集。金华猪回肠段丁酰-CoA:乙酰-CoA转移酶基因相对表达量显著低于长白猪(P < 0.05),且金华猪结肠段丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因相对表达量显著低于长白猪(P < 0.05)。
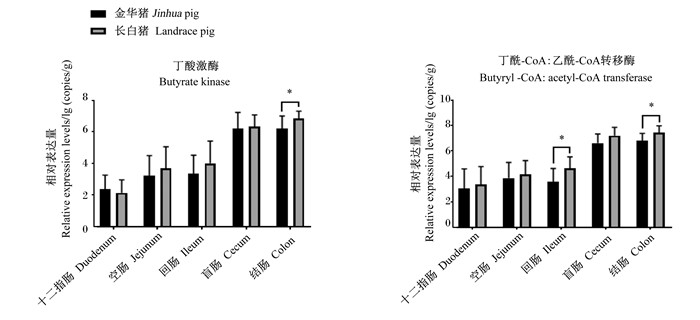
|
图 3 丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因相对表达量比较 Fig. 3 Comparison of relative expression levels of butyrate kinase and butyryl-CoA: acetyl-CoA transferase (n=10) |
通过对金华猪和长白猪各肠段内容物中丁酸含量进行分析发现(图 4),盲肠和结肠是丁酸的主要产生部位,在空肠、回肠、结肠中,金华猪丁酸含量均显著低于长白猪(P < 0.05)。
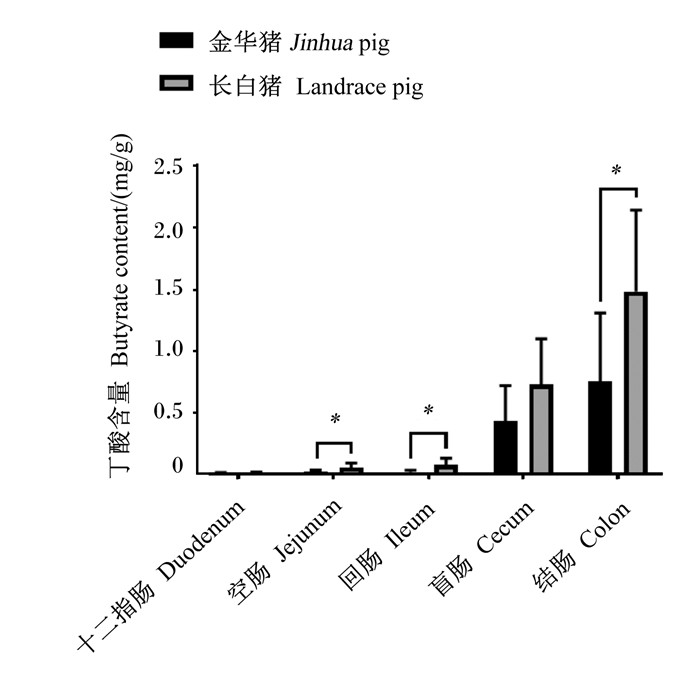
|
图 4 不同肠段丁酸含量比较 Fig. 4 Comparison of butyrate content in different intestinal segments (n=10) |
通过对金华猪和长白猪各肠段主要产丁酸菌相对丰度与丁酸含量和产丁酸关键基因相对表达量进行相关性分析发现(表 2),金华猪和长白猪肠道丁酸含量均与丁酸弧菌属、布劳特氏菌属、颤螺旋菌属、罗斯伯里氏菌属相对丰度呈显著或极显著正相关(r=0.318 0~0.700 6,P < 0.05或P < 0.01);金华猪和长白猪肠道丁酸激酶基因相对表达量均与丁酸弧菌属、颤螺旋菌属、罗斯伯里氏菌属相对丰度呈显著或极显著正相关(r=0.318 4~0.659 9,P < 0.05或P < 0.01);金华猪和长白猪肠道丁酰-CoA:乙酰-CoA转移酶基因相对表达量均与颤螺旋菌属、罗斯伯里氏菌属相对丰度呈极显著正相关(r=0.581 3~0.649 0,P < 0.01)。
|
|
表 2 肠道产丁酸菌相对丰度与丁酸含量和产丁酸关键功能基因相对表达量的相关性分分析 Table 2 Correlation analysis of relative abundance of intestinal butyrate-producing bacteria with butyrate content and relative expression levels of key functional genes for butyrate production |
通过对肠道丁酸含量与丁酸激酶、丁酰- CoA:乙酰-CoA转移酶基因相对表达量相关性分析发现(图 5),丁酸激酶、丁酰-CoA:乙酰-CoA转移酶基因相对表达量与丁酸含量呈极显著正相关(r=0.570 4~0.722 1,P < 0.01),2个品种对比发现长白猪相关系数均高于金华猪。
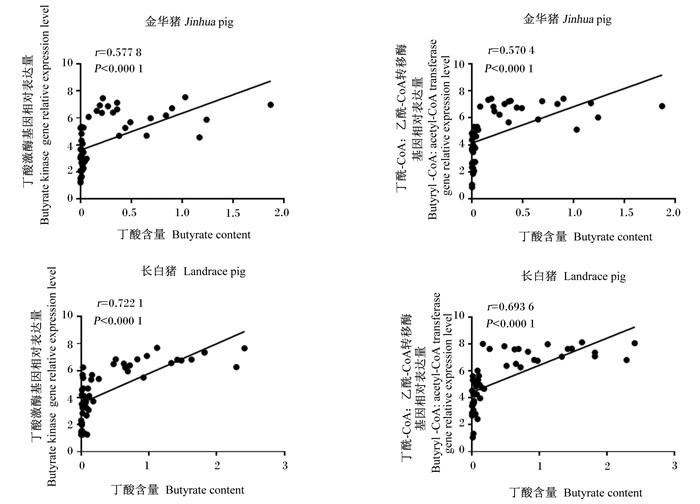
|
图 5 丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因相对表达量与丁酸含量相关性分析 Fig. 5 Correlation analysis of relative expression levels of butyrate kinase and butyryl-CoA: acetyl-CoA transferase genes and butyrate content |
肠道中丁酸是由产丁酸菌在对膳食纤维和未分解的食用碳水化合物、内源蛋白质进行发酵的过程中代谢产生的[17]。本研究发现,金华猪和长白猪肠道产丁酸菌差异主要在小肠段,长白猪空肠、回肠内容物中布劳特氏菌属、丁酸球菌属、丁酸单胞菌属、粪杆菌属、真杆菌属相对丰度显著高于金华猪,长白猪空肠、回肠内容物中颤螺旋菌属和罗斯伯里氏菌属相对丰度显著低于金华猪。通过斯皮尔曼相关性分析发现,颤螺旋菌属、罗斯伯里氏菌属相对丰度与其他几种主要产丁酸菌相对丰度呈显著负相关。
产丁酸菌生成丁酸主要有2条途径,即丁酰-CoA:乙酰-CoA转移酶和丁酸激酶代谢途径[18]。已有研究表明,单胃动物肠道微生物的产丁酸主要途径是丁酰-CoA:乙酰-CoA转移酶途径,而土壤微生物的主要产丁酸途径是丁酸激酶途径[19]。Louis等[20]研究结果认为可以通过丁酰-CoA:乙酰-CoA转移酶基因和丁酸激酶基因的基因拷贝数来计算产丁酸菌的拷贝数。因此,本试验通过实时荧光定量PCR分析发现,金华猪结肠段丁酸激酶、丁酰-CoA:乙酰-CoA转移酶基因相对表达量和丁酸含量均显著低于长白猪。相关性分析发现,产丁酸菌相对丰度和丁酸含量及产丁酸关键基因相对表达量均呈不同程度的正相关关系,丁酸含量和丁酸激酶、丁酰-CoA:乙酰-CoA转移酶基因相对表达量呈显著正相关,且长白猪相关系数均高于金华猪。
丁酸作为肠道微生物重要的代谢产物能够影响宿主基因的表达和参与机体代谢[21]。首先,丁酸可以促进肠道细胞血管生成素样蛋白4(ANGPTL4)的合成,ANGPTL4抑制脂蛋白脂肪酶(LPL)活性,使LPL催化血液中乳糜微粒(CM)和极低密度脂蛋白(VLDL)所携带的甘油三酯(TG)水解成甘油和脂肪酸受阻,从而阻碍TG沉积到脂肪细胞[22-24]。其次,进入血液通过激活G蛋白耦联受体(GPCRs)和抑制组蛋白去乙酰化酶(HDAC)调控基因的表达调控多种代谢信号通路,激活GPR41和GPR109A使能量消耗增加、耗氧量增加、瘦素表达增加、TG含量降低[25]。Gao等[26]研究发现,饮食补充丁酸可预防和治疗饮食诱导的小鼠胰岛素抵抗,其作用机制与促进能量消耗和诱导线粒体功能有关。因此,在本研究中,金华猪体重显著低于长白猪,背膘后却显著高于长白猪[12],高脂金华猪和低脂长白猪可能与肠道中的丁酸代谢差异有关。
4 结论① 金华猪和长白猪主要在小肠段存在肠道产丁酸菌相对丰度差异,金华猪空肠和回肠中产丁酸菌相对丰度显著低于长白猪,且金华猪结肠段产丁酸关键功能基因丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因相对表达量显著低于长白猪,与之相对应的是金华猪空肠、回肠和结肠中丁酸含量显著低于长白猪。
② 金华猪和长白猪肠道中产丁酸菌与产丁酸关键功能基因相对表达量和丁酸含量呈显著正相关;丁酸激酶和丁酰-CoA:乙酰-CoA转移酶基因相对表达量也与丁酸含量呈显著正相关,且长白猪相关系数均高于金华猪,这也在一定程度上解释了长白猪肠道丁酸含量高于金华猪的原因。
| [1] |
高文文, 孟祥晨. 人肠道产丁酸细菌及其所产丁酸的促健康作用研究进展[J]. 食品科学, 2019, 40(21): 273-279. GAO W W, MENG X C. A review of recent literature on butyrate-producing bacteria in the human intestine and health-promoting functions of their metabolite butyrate[J]. Food Science, 2019, 40(21): 273-279 (in Chinese). DOI:10.7506/spkx1002-6630-20181010-086 |
| [2] |
于卓腾, 杭苏琴, 姚文, 等. 肠道产丁酸细菌及其丁酸产生机制的研究进展[J]. 世界华人消化杂志, 2006, 14(25): 2531-2534. YU Z T, HANG S Q, YAO W, et al. Advances in intestinal butyric acid producing bacteria and its mechanism[J]. World Chinese Journal of Digestology, 2006, 14(25): 2531-2534 (in Chinese). DOI:10.3969/j.issn.1009-3079.2006.25.012 |
| [3] |
李杰. 双歧杆菌与产丁酸菌的相关性分析——基于随机对照干预研究及大人群横断面数据[D]. 硕士学位论文. 广州: 南方医科大学, 2019. LI J. Correlation analysis of Bifidobacterium and butyrate-producing bacteria[D]. Master's Thesis. Guangzhou: Southern Medical University, 2019. (in Chinese) |
| [4] |
李劲亭, 刘力, 戴欣. 人和动物胃肠道微生物丁酸合成途径相关酶基因的研究进展[J]. 微生物学报, 2012, 52(10): 1181-1186. LI J T, LIU L, DAI X. Genes and gene clusters involved in microbial butyrate-producing pathway of human and animal gastrointestinal tract[J]. Acta Microbiologica Sinica, 2012, 52(10): 1181-1186 (in Chinese). |
| [5] |
陈映宇, 毛联智, 刘华缓, 等. 肠道产丁酸菌防治炎症性肠病的机制研究进展[J]. 世界华人消化杂志, 2019, 27(14): 907-912. CHEN J Y, MAO L Z, LIU H, et al. Mechanism of gut butyric acid producing bacteria for prevention and treatment of inflammatory bowel disease[J]. World Chinese Journal of Digestology, 2019, 27(14): 907-912 (in Chinese). |
| [6] |
金多晨. 产丁酸菌通过重塑肠道菌群抑制Wnt通路防治高脂饮食诱导的肠腺瘤恶变[D]. 硕士学位论文. 天津: 天津医科大学, 2018. JIN D C. Butyrate-producing bacteria inhibits high-fat diet-induced intestinal carcinogenesis by remodeling gut microbiota and inhibiting Wnt signaling pathway[D]. Master's Thesis. Tianjin: Tianjin Medical University, 2018. (in Chinese) |
| [7] |
王远霞, 邹晓庭, 郑有秀, 等. 丁酸梭菌对断奶仔猪空肠菌群结构的影响[J]. 动物营养学报, 2020, 32(11): 5128-5136. WANG Y X, ZOU X T, ZHENG Y X, et al. Effects of Clostridium butyricum on microbial community structure in jejunum of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5128-5136 (in Chinese). |
| [8] |
WU T, ZHANG Z H, YUAN Z Q, et al. Distinctive genes determine different intramuscular fat and muscle fiber ratios of the longissimus dorsi muscles in Jinhua and Landrace pigs[J]. PLoS One, 2013, 8(1): e53181. DOI:10.1371/journal.pone.0053181 |
| [9] |
YANG H, XIANG Y, ROBINSON K, et al. Gut microbiota is a major contributor to adiposity in pigs[J]. Frontiers in Microbiology, 2018, 9: 3045. DOI:10.3389/fmicb.2018.03045 |
| [10] |
YANG H, XIAO Y P, WANG J J, et al. Core gut microbiota in Jinhua pigs and its correlation with strain, farm and weaning age[J]. Journal of Microbiology, 2018, 56(5): 346-355. DOI:10.1007/s12275-018-7486-8 |
| [11] |
XIAO Y P, LI K F, XIANG Y, et al. The fecal microbiota composition of boar Duroc, Yorkshire, Landrace and Hampshire pigs[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(10): 1456-1463. DOI:10.5713/ajas.16.0746 |
| [12] |
XIAO Y P, KONG F L, XIANG Y, et al. Comparative biogeography of the gut microbiome between Jinhua and Landrace pigs[J]. Scientific Reports, 2018, 8: 5985. DOI:10.1038/s41598-018-24289-z |
| [13] |
葛晓龙, 丁超. 粪菌移植改善肥胖和糖尿病病人的研究进展[J]. 肠外与肠内营养, 2015, 22(6): 370-373, 377. GE X L, DING C, LI N, et al. Research progress on fecal microbiota transplantation for the improvement of obesity and type 2 diabetes mellitus[J]. Parenteral & Enteral Nutrition, 2015, 22(6): 370-373, 377. (in Chinese) |
| [14] |
CANFORA E E, VAN DER BEEK C M, JOCKEN J W E, et al. Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial[J]. Scientific Reports, 2017, 7(1): 2360. DOI:10.1038/s41598-017-02546-x |
| [15] |
FANG W J, XUE H L, CHEN X, et al. Supplementation with sodium butyrate modulates the composition of the gut microbiota and ameliorates high-fat diet-induced obesity in mice[J]. The Journal of Nutrition, 2019, 149(5): 747-754. DOI:10.1093/jn/nxy324 |
| [16] |
XU J, VERBRUGGHE A, LOURENÇO M, et al. The response of canine faecal microbiota to increased dietary protein is influenced by body condition[J]. BMC Veterinary Research, 2017, 13: 374. DOI:10.1186/s12917-017-1276-0 |
| [17] |
MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016, 7(3): 189-200. DOI:10.1080/19490976.2015.1134082 |
| [18] |
VITAL M, PENTON C R, WANG Q, et al. A gene-targeted approach to investigate the intestinal butyrate-producing bacterial community[J]. Microbiome, 2013, 1(1): 8. DOI:10.1186/2049-2618-1-8 |
| [19] |
LOUIS P, DUNCAN S H, MCCRAE S I, et al. Restricted distribution of the butyrate kinase pathway among butyrate-producing bacteria from the human colon[J]. Journal of Bacteriology, 2004, 186(7): 2099-2106. DOI:10.1128/JB.186.7.2099-2106.2004 |
| [20] |
LOUIS P, FLINT H J. Development of a semiquantitative degenerate real-time pcr-based assay for estimation of numbers of butyryl-coenzyme A (CoA) CoA transferase genes in complex bacterial samples[J]. Applied and Environmental Microbiology, 2007, 73(6): 2009-2012. DOI:10.1128/AEM.02561-06 |
| [21] |
赵旭. 丁酸梭菌对肉鸡脂肪代谢的影响及其机理研究[D]. 博士学位论文. 北京: 中国农业大学, 2014. ZHAO X. Effects of Clostridium butyricum on lipid metabolism of broiler chickens and its underlying mechanism[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2014. (in Chinese) |
| [22] |
DIJK W, KERSTEN S. Regulation of lipid metabolism by angiopoietin-like proteins[J]. Current Opinion in Lipidology, 2016, 27(3): 249-256. DOI:10.1097/MOL.0000000000000290 |
| [23] |
ZHANG R. The ANGPTL3-4-8 model, a molecular mechanism for triglyceride trafficking[J]. Open Biology, 2016, 6(4): 150272. DOI:10.1098/rsob.150272 |
| [24] |
ALEX S, LICHTENSTEIN L, DIJK W, et al. ANGPTL4 is produced by entero-endocrine cells in the human intestinal tract[J]. Histochemistry and Cell Biology, 2014, 141(4): 383-391. DOI:10.1007/s00418-013-1157-y |
| [25] |
FURUSAWA Y, OBATA Y, FUKUDA S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504(7480): 446-450. DOI:10.1038/nature12721 |
| [26] |
GAO Z G, YIN J, ZHANG J, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice[J]. Diabetes, 2009, 58(7): 1509-1517. DOI:10.2337/db08-1637 |




