2. 宜春学院生命科学与资源环境学院, 宜春 336000
2. College of Life Science and Resources and Environmental, Yichun University, Yichun 336000, China
近年来,抗生素在动物养殖中滥用,致使细菌耐药性、食品安全和药物残留问题日益突出。自2020年7月1日起,我国全面禁止在动物饲料中添加促生长类药物饲料添加剂(中药类除外)。饲料禁抗后对动物肠道健康和生产性能会带来一定负面影响[1]。因此,寻找安全、有效的饲用抗生素替代品已成为畜牧业健康发展的重要课题。当动物肠道被大量病原菌侵袭时,过度繁殖的病原菌会造成肠道菌群失衡,破坏肠黏膜屏障功能,降低机体免疫能力,进而降低动物生产性能,甚至增加死亡率[2]。百里香酚和香芹酚是芳香植物精油的主要成分,对细菌、真菌和病毒均有一定抑制作用,在食品、化妆品和动物养殖等方面有着较广泛的应用[3-4]。但由于植物精油难溶于水、挥发性强、分子结构对环境敏感、耐热性差等原因,需要改善植物精油的稳定性以提高其应用效果[5]。凹凸棒石是一种链层状结构黏土,因其吸附能力强、比表面积大、具有催化性等特性,常被作为载体应用于工业和动物营养领域[6-7]。杨勇等[8]报道,将银(Ag)、溴化银(AgBr)和二氧化钛(TiO2)等无机物负载于凹凸棒石,结合后产物的抑菌效果较凹凸棒石显著增强。Lei等[9]研究指出,改性凹凸棒石与姜精油复合物比单纯的姜精油表现出更好的抗菌性能,且有靶向抑菌能力;此外,该复合物具有很好的热稳定性和耐酸碱性。本研究以凹凸棒石为载体,负载植物精油,将多种活性成分通过工艺制备,组装成凹凸棒石负载植物精油复合物(essential oil/palygorskite composite,EO-PGS),推测其能够有效抑制肠道有害菌,优化肠道菌群结构,改善肠道健康,进而提高蛋鸡生产性能。因此,本试验旨在探讨饲粮添加不同水平EO-PGS对蛋鸡生产性能和肠道微生物的影响,以期为其在蛋鸡生产中的应用提供依据。
1 材料与方法 1.1 试验材料试验用EO-PGS由江苏某生物科技股份有限公司提供,其主要成分含量为:凹凸棒石>70%,植物精油(百里香酚精油和香芹酚精油等)>15%,其他矿物元素 < 15%。利用凹凸棒石的纳米特性,通过凹凸棒石表面改性、电荷调控、抗菌因子组装、表面交联等工艺制备EO-PGS。
1.2 试验设计与饲养管理选取480只65周龄、体重相近、健康的罗曼粉壳蛋鸡,随机分成4组,每组6个重复,每个重复20只鸡。预试期各组统一饲喂基础饲粮。正试期对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加0.50、0.75和1.00 g/kg EO-PGS的试验饲粮。基础饲粮参考《鸡饲养标准》(NY/T 33—2004)并结合生产实际配制,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-day basis) |
试验鸡采用双层阶梯式笼养,饲养于上、下2层,每笼4只,每5笼为1个重复;饲养管理按照鸡场常规管理程序进行。试验鸡自由采食和饮水,预试期7 d,正试期56 d。
1.3 生产性能的测定正试期内,每日以重复为单位记录各组产蛋数、蛋重、软破壳蛋数及死淘鸡数,每周统计1次采食量,计算统计期内的产蛋率、平均蛋重、死淘率、料蛋比、日产蛋重和平均日采食量。
1.4 肠道内容物样品采集试验第56天,每个重复随机选取1只接近平均体重的鸡,放血死亡后,剖开腹腔,取十二指肠和盲肠内容物样品置于2 mL冻存管中,于-80 ℃保存。
1.5 肠道内容物微生物相对丰度的测定选取十二指肠和盲肠内容物样品180~220 mg,采用粪便基因组DNA提取试剂盒(DP328,天根生化科技有限公司)提取肠道内容物DNA,严格按照试剂盒说明进行操作。用超微量分光光度计(NanoDrop ND-2000 UV,Thermo Fisher Scientific公司,美国)检测DNA浓度,1%琼脂糖凝胶电泳检测纯度。
每个DNA样品的浓度检测3次,计算平均值,将24个DNA样品的浓度统一稀释至100 ng/μL。使用荧光定量PCR试剂盒[宝生物工程(大连)有限公司]并参照其说明书进行荧光定量PCR扩增,反应体系为10 μL:SYBR 5.0 μL,上游引物0.4 μL,下游引物0.4 μL,DNA 1.0 μL,双蒸水3.2 μL。反应程序为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 40 s,39个循环;在65~95 ℃绘制熔解曲线。引物采用Primers软件设计,由上海生工生物有限公司合成,引物序列见表 2,所有引物经特异性检测合格后再使用。以总菌为内参基因,采用2-ΔΔCt法计算目的细菌的相对丰度[10]。
|
|
表 2 引物序列 Table 2 Premier sequences |
盲肠内容物DNA提取和检测方法同上,将合格的DNA样品送美吉生物科技服务有限公司测序分析。利用Illumina MiSeq平台进行测序,对样品16S rRNA的V4区建立文库并上机测序,具体操作如下:以带有515F/806R的序列为引物,选择16S rDNA的V4区作为目的扩增区域进行PCR扩增。根据PCR产物浓度进行等量混样,PCR产物充分混匀后使用2%的琼脂糖凝胶电泳检测,产物纯化使用AxyPreP DNA Gel Extraction Kit。将PCR产物用QuantusTM Flurometer进行检测定量,按照每个样品的测序量要求,进行相应比例的混合。使用NEXTFLEX® Repid DNA-Seq PE300平台进行测序(上海美吉生物医药科技有限公司)。
数据优化:使用Trimmomatic软件原始测序序列进行质控,使用Flash v1.2.11软件进行拼接:对经过双端(pair-end)测序的数据进行质量控制,截断或舍弃低质量序列(50个连续碱基平均质量>Q30,接头污染、含有N碱基的reads)。利用软件Uparse 7.0.1090,根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类,使用UCHIME软件剔除嵌合体。选取每个类最长的序列为代表序列,通过RDP-Classifier v2.11软件将OTU代表序列与数据库有比对进行物种注释,得到每个OTU的分类学信息。通过软件Mothur 1.30.2和Qiime 1.9.1对生成的OTU信息进行细菌群落多样性和丰富度分析。
1.7 数据统计与分析微生物测序数据采用SAS 9.2统计软件进行Kruskal-Wallis秩和检验,生产性能和微生物相对丰度数据进行单因素方差分析,差异显著者采用Duncan氏法进行多重比较。试验结果以平均值±标准差表示,P < 0.05表示差异显著,0.05≤P < 0.10表示有提高或降低的趋势。
2 结果与分析 2.1 EO-PGS对蛋鸡生产性能的影响由表 3可知,试验组蛋鸡的产蛋率较对照组均有所提高,其中0.75和1.00 g/kg EO-PGS组的产蛋率显著高于对照组(P < 0.05)。各组间平均日采食量、平均蛋重、日产蛋重、料蛋比和死淘率均差异不显著(P>0.05)。
|
|
表 3 EO-PGS对蛋鸡生产性能的影响 Table 3 Effects of EO-PGS on performance of laying hens |
由表 4可知,各组样品测序覆盖率均在99.5%以上,说明测序深度已经基本覆盖到样品中的所有物种。各组样品测序获得的有效序列和盲肠菌群Shannon指数、Simpson指数、Ace指数、Chao指数均无显著差异(P>0.05)。
|
|
表 4 EO-PGS对蛋鸡盲肠菌群α多样性的影响 Table 4 Effects of EO-PGS on cecal microflora α diversity of laying hens |
β多样性分析可以比较不同样品间在物种多样性方面存在的差异大小。如图 1所示,经主坐标分析(PCoA),结果显示对照组和0.50 g/kg EO-PGS组菌群结构分布相对紧凑,相似度较高,而0.75和1.00 g/kg EO-PGS组菌群结构分布相对零散,相似度低,群落构成差异较大。
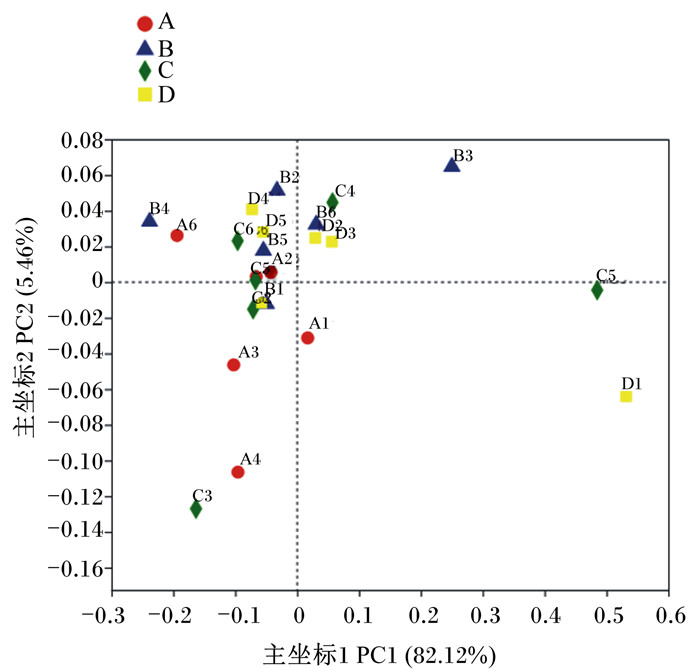
|
A:对照组control group;B:0.50 g/kg EO-PGS组0.50 g/kg EO-PGS group;C:0.75 g/kg EO-PGS组0.75 g/kg EO-PGS group;D:1.00 g/kg EO-PGS组1.00 g/kg EO-PGS group。 图 1 EO-PGS对蛋鸡盲肠菌群β多样性的影响 Fig. 1 Effects of EO-PGS on cecal microflora β diversity of laying hens |
由表 5可知,在门水平上,各组中拟杆菌门、厚壁菌门和变形菌门均为优势菌门,其中拟杆菌门和厚壁菌门相对丰度分别为45.43%~53.27%和38.39%~46.14%。对照组盲肠中相对丰度排第4的菌门为螺旋体门,而0.50、0.75和1.00 g/kg EO-PGS组为放线菌门。统计结果表明,各组间优势菌门相对丰度均无显著差异(P>0.05)。与对照组相比,试验组软壁菌门相对丰度有提高的趋势(P=0.071),0.50和0.75 g/kg EO-PGS组迷踪菌门相对丰度显著提高(P < 0.05)。
|
|
表 5 相对丰度大于0.15%(序列占测序总量比例)的菌门 Table 5 Bacterial phyla with relative abundance above 0.15% (sequence percentage of total sequence amount) |
由表 6可知,在相对丰度大于0.7%的菌属中,各组中拟杆菌属和考拉杆菌属均为优势菌属。统计结果表明:各组间优势菌属没有显著差异(P>0.05);与对照组相比,0.50和0.75 g/kg EO-PGS组Elusimicrobium相对丰度显著提高(P < 0.05),0.50 g/kg EO-PGS组优杆菌属相对丰度显著提高(P < 0.05)。此外,与对照组相比,试验组双歧杆菌属和乳杆菌属相对丰度均有不同程度的提高(P>0.05),志贺氏菌属相对丰度有不同程度的降低(P>0.05)。
|
|
表 6 相对丰度大于0.7%(序列占测序总量比例)或差异显著的菌属 Table 6 Bacterial genus with relative abundance above 0.7% (sequence percentage of total sequence amount) or significant difference |
由表 7可知,与对照组相比,试验组十二指肠双歧杆菌相对丰度有提高的趋势(P=0.065),0.50 g/kg EO-PGS组乳酸杆菌相对丰度显著提高(P < 0.05)。与对照组相比,试验组盲肠双歧杆菌相对丰度显著提高(P < 0.05),沙门氏菌相对丰度显著降低(P < 0.05),0.50 g/kg EO-PGS组乳酸杆菌相对丰度显著提高(P < 0.05),0.50和1.00 g/kg EO-PGS组大肠杆菌相对丰度显著降低(P < 0.05)。
3 讨论 3.1 EO-PGS对蛋鸡生产性能的影响研究表明,植物精油具有抑菌、抗炎、增强免疫等多种生物学功能,饲粮添加植物精油对蛋鸡生产性能有积极作用[11-12]。Wang等[13]研究表明,饲粮添加植物精油混合物可以提高蛋鸡产蛋率,一定程度上降低料蛋比。Akbari等[14]研究发现,薄菏精油和百里香精油能有效缓解蛋鸡因寒冷引起的生产性能下降,提高产蛋率。此外,Qiao等[15]研究表明,饲粮添加天然凹凸棒石和热改性凹凸棒石均可改善蛋鸡的消化功能,一定程度上提高产蛋率和蛋品质。本研究发现,饲粮添加0.50、0.75和1.00 g/kg EO-PGS提高了蛋鸡产蛋率,一定程度上降低了死淘率和料蛋比。目前,已有较多学者开展了植物精油和凹凸棒石单独应用于蛋鸡生产中的研究,尽管试验结果存在差异,但总体上表明它们能在不同程度上提高蛋鸡的生产性能[13-15],本试验结果与前人的报道基本相符。
|
|
表 7 EO-PGS对蛋鸡肠道微生物相对丰度的影响 Table 7 Effects of EO-PGS on intestinal microorganisms relative abundance of laying hens |
研究表明,宿主与肠道微生物之间互利共生,宿主自身的生长状况影响肠道微生物的生长定植,同时肠道微生物可以参与宿主营养物质的消化吸收,微生物多样性的增加有利于提高机体免疫功能[16]。本试验中,试验组蛋鸡盲肠菌群有效序列和对照组之间无显著差异,但试验组样品中反映α多样性的Shannon指数均高于对照组,Simpson指数均低于对照组,说明试验组样品中微生物菌群更丰富;根据PCoA中β多样性发现,0.75和1.00 g/kg EO-PGS组菌群结构分布相对零散,相似度低,群落构成差异较大,说明微生物的多样性有一定提高。张超[17]基于16S rDNA高通量测序分析肠炎小鼠肠道微生物多样性,结果发现,与正常小鼠相比,炎症性肠病小鼠肠道微生物菌群结构紊乱,肠道菌群多样性降低;经植物精油治疗后,肠炎小鼠肠道微生物多样性提高。辛洪亮[18]采用PCR-变性梯度凝胶电泳(DGGE)及DNA测序技术研究植物精油混合物对肉鸡肠道微生物多样性的影响,发现前期、后期和全期添加精油对肠道微生物多样性均无显著影响,这与本试验结果基本一致。
3.3 EO-PGS对蛋鸡盲肠菌群结构和物种相对丰度的影响家禽肠道微生物数量多,组成结构复杂,前人研究发现,家禽的肠道菌群主要由拟杆菌门和厚壁菌门组成[19]。本试验结果表明,蛋鸡盲肠菌群以拟杆菌门和厚壁菌门占绝对优势,二者相对丰度在90%以上,且添加EO-PGS后2个优势菌门的相对丰度没有显著变化,可能与健康的成年蛋鸡肠道中已经形成较稳定的微生物区系有关,虽然EO-PGS可能在肠道内抑制部分有害菌如大肠杆菌、沙门氏菌的增殖,但很难引起肠道主要微生物发生很大变化。研究指出,糖代谢异常和非酒精性脂肪肝小鼠肠道中软壁菌门的相对丰度降低,机体血脂异常和炎症程度都有所加剧[20-21]。麦云珮等[22]报道,香芹酚可有效降低1型糖尿病小鼠血液中葡萄糖含量,改善机体糖脂代谢。本试验发现,试验组软壁菌门相对丰度有提高的趋势且呈剂量效应,且香芹酚是EO-PGS的主要组成成分,提示EO-PGS可能具有调节肠道菌群结构,改善糖代谢的作用。黄飞[23]研究了高脂饲粮诱导的SD大鼠模型肠道菌群结构的变化,发现模型组血液大鼠高密度脂蛋白-胆固醇(HDL-C)含量显著降低,血液低密度脂蛋白-胆固醇(LDL-C)含量显著升高,糖代谢出现异常,肠道菌群样本相对丰度和多样性显著降低,厚壁菌门和迷踪菌门相对丰度显著降低,肠屏障修复能力下降;经复方中药治疗后,肠道菌群多样性显著提高,肠道屏障修复能力得到恢复。本研究结果显示,0.50和0.75 g/kg EO-PGS组迷踪菌门的相对丰度显著提高,进一步说明EO-PGS可能具有调节肠道菌群结构和改善糖代谢的作用。
在属水平上,饲粮添加EO-PGS对盲肠优势菌属相对丰度没有显著差异。与对照组相比,试验组Elusimicrobium相对丰度显著升高。研究发现,Elusimicrobium可产生醋酸盐和丙氨酸,这可能对肝损伤和葡萄糖-丙氨酸循环有益[24]。Shi等[25]报道,饲粮添加乳杆菌和片球菌后,肝硬化小鼠症状得到改善,肝脏和肠道中炎症因子含量减少,Eluximicrobium和普雷沃菌属等潜在有益菌的相对丰度提高,且与白细胞介素-6和白细胞介素-17含量呈高度负相关。本研究表明,0.75和1.00 g/kg EO-PGS组盲肠菌群中乳杆菌属和普雷沃菌相对丰度均高于对照组。这提示EO-PGS可能与有益菌一样,具有降低机体炎症反应、调节肠道菌群结构的作用。此外,试验组肠道中优杆菌属相对丰度较对照组均有不同程度提高,其中0.50 g/kg EO-PGS组优杆菌属相对丰度显著提高。研究表明,优杆菌属包含众多产丁酸盐菌群,是一种有益于宿主健康的菌属[26-27]。朱林文思[28]研究发现,结肠癌患者中肠道优杆菌属相对丰度较低的患者,术后再发的风险较大。这提示EO-PGS可能具有增强肠道免疫的作用。同时,本研究也发现添加EO-PGS后,试验组其他菌属的物种相对丰度有所改变,但在统计学上无显著差异,不能作为评判EO-PGS是否影响肠道菌群结构和物种相对丰度的标志。
3.4 EO-PGS对蛋鸡肠道内容物微生物相对丰度的影响肠道病原菌的过度繁殖容易引起肠道屏障受损和肠道炎症,影响肠道健康[29-30]。研究表明,植物精油能够通过破坏细胞膜和细胞壁,影响蛋白质和DNA合成等多种途径来发挥抑菌作用[31-32]。Tiihonen等[33]研究发现,饲粮添加15 g/t的百里香酚和5 g/t肉桂醛植物精油,肉鸡盲肠内大肠杆菌数量显著降低,乳酸杆菌数量显著增加。韩旭[34]研究发现,牛至油能够显著提高蛋鸡双歧杆菌和乳酸杆菌数量,同时降低大肠杆菌和沙门氏菌数量,一定程度上改善肠道功能,促进肠道健康。此外,有研究指出,凹凸棒石内部存在强大的库仑场和极性,具有很强的吸附性,能够吸附大肠杆菌和假单胞菌等致病菌[35]。本研究结果显示,试验组蛋鸡盲肠内容物中沙门氏菌和大肠杆菌相对丰度均低于对照组;0.50 g/kg EO-PGS组盲肠和十二指肠乳酸杆菌相对丰度显著提高,试验组盲肠和十二指肠双歧杆菌相对丰度均有所提高,这与前人研究结果基本一致,提示饲粮中添加EO-PGS能够优化蛋鸡肠道菌群结构,改善肠道健康。
研究表明,肠道有害菌数量的减少和有益菌数量的增多对动物生产性能有积极作用,可能是因为削弱了有害菌与宿主之间对营养物质的竞争、减少了因致病菌过度繁殖引起的肠道疾病以及促进有益菌代谢物的产生改善肠道屏障功能[36-37]。综上所述,有害菌(大肠杆菌和沙门氏菌)数量的降低和有益菌(乳酸杆菌和双歧杆菌)数量的增加以及肠道微生物多样性的一定程度的提高可能是本试验中蛋鸡产蛋性能改善的一个重要原因。
4 结论饲粮添加0.75和1.00 g/kg EO-PGS可以显著提高蛋鸡产蛋率;饲粮添加EO-PGS能够在一定程度上提高蛋鸡肠道微生物多样性,调节肠道菌群结构。
| [1] |
UPADHYAYA I, UPADHYAY A, KOLLANOOR-JOHNY A, et al. In-feed supplementation of trans-cinnamaldehyde reduces layer-chicken egg-borne transmission of Salmonella enterica serovar enteritidis[J]. Applied and Environmental Microbiology, 2015, 81(9): 2985-2994. DOI:10.1128/AEM.03809-14 |
| [2] |
HAI D, YIN X, LU Z, et al. Occurrence, drug resistance, and virulence genes of Salmonella isolated from chicken and eggs[J]. Food Control, 2020, 113: 107109. DOI:10.1016/j.foodcont.2020.107109 |
| [3] |
LIAKOS I L, MENAGER C, GUIGO N, et al. Suberin trans-cinnamaldehyde oil nanoparticles with antimicrobial activity and anticancer properties when loaded with paclitaxel[J]. ACS Applied Materials & Interfaces, 2019(2): 3484-3497. |
| [4] |
FRIEDMAN M, HENIKA P R, MANDRELL R E. Bactericidal activities of plant essential oils and some of their isolated constituents against Campylobacter jejuni, Escherichia coli, Listeria monocytogenes, and Salmonella enterica[J]. Journal of Food Protection, 2002, 65(10): 1545-1560. DOI:10.4315/0362-028X-65.10.1545 |
| [5] |
BHATTARAI S, DUKE C C. The stability of gingerol and shogaol in aqueous solutions[J]. Journal of Pharmaceutical Sciences, 2001, 90(10): 1658-1664. DOI:10.1002/jps.1116 |
| [6] |
CHENG Y F, CHEN Y P, WEN C, et al. Evaluation of dietary palygorskite supplementation on growth performance, mineral accumulations, antioxidant capacities, and meat quality of broilers fed lead-contaminated diet[J]. Biological Trace Element Research, 2018, 181(2): 314-322. DOI:10.1007/s12011-017-1047-6 |
| [7] |
SU Y, CHEN Y, CHEN L, et al. Effects of different levels of modified palygorskite supplementation on the growth performance, immunity, oxidative status and intestinal integrity and barrier function of broilers[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(6): 1574-1584. DOI:10.1111/jpn.12974 |
| [8] |
杨勇, 固旭, 钱运华, 等. Ag/AgBr/TiO2/凹土基抗菌剂的制备及其抗菌性能[J]. 非金属矿, 2011, 34(6): 53-55. YANG Y, GU X, QIAN Y H, et al. Preparation and antibacterial property study of Ag/AgBr/TiO2/palygorskite antibacterial agent[J]. Non-Metallic Mines, 2011, 34(6): 53-55 (in Chinese). DOI:10.3969/j.issn.1000-8098.2011.06.017 |
| [9] |
LEI H, WEI Q, WANG Q, et al. Characterization of ginger essential oil/palygorskite composite (GEO-PGS) and Its anti-bacteria activity[J]. Materials Science and Engineering: C, 2017, 73: 381-387. DOI:10.1016/j.msec.2016.12.093 |
| [10] |
陈继发, 匡佑华, 康克浪, 等. 蒙脱石、枯草芽孢杆菌及其互作对蛋鸡血浆激素含量、卵巢繁殖相关基因表达和肠道微生物的影响[J]. 动物营养学报, 2019, 31(1): 294-303. CHEN J F, KUANG Y H, KANG K L, et al. Effects of montomorillonite, Bacillus subtilis and their interaction on hormone contents in plasma, reproduction related genes expression in ovarian and intestinal microflora of laying hens[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 294-303 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.036 |
| [11] |
DING X, YU Y, SU Z, et al. Effects of essential oils on performance, egg quality, nutrient digestibility and yolk fatty acid profile in laying hens[J]. Animal Nutrition, 2017, 3(2): 127-131. DOI:10.1016/j.aninu.2017.03.005 |
| [12] |
TORKI M, MOHEBBIFAR A, MOHAMMADI H. Effects of supplementing hen diet with lavandula angustifolia and/or mentha spicata essential oils on production performance, egg quality and blood variables of laying hens[J]. Veterinary Medicine and Science, 2020(1): 1-10. |
| [13] |
WANG H, LIANG S, LI X, et al. Effects of encapsulated essential oils and organic acids on laying performance, egg quality, intestinal morphology, barrier function, and microflora count of hens during the early laying period[J]. Poultry Science, 2019, 98(12): 6751-6760. DOI:10.3382/ps/pez391 |
| [14] |
AKBARI M, TORKI M, KAVIANI K. Single and combined effects of peppermint and thyme essential oils on productive performance, egg quality traits, and blood parameters of laying hens reared under cold stress condition (6.8±3.0℃)[J]. International Journal of Biometeorology, 2016, 60(3): 447-454. DOI:10.1007/s00484-015-1042-6 |
| [15] |
QIAO L, CHEN Y, WEN C, et al. Effects of natural and heat modified palygorskite supplementation on the laying performance, egg quality, intestinal morphology, digestive enzyme activity and pancreatic enzyme mRNA expression of laying hens[J]. Applied Clay Science, 2015, 104: 303-308. DOI:10.1016/j.clay.2014.12.010 |
| [16] |
BUTEL M J. Probiotics, gut microbiota and health[J]. Médecine et Maladies Infectieuses, 2014, 44(1): 1-8. DOI:10.1016/j.medmal.2013.10.002 |
| [17] |
张超. 基于高通量测序研究肉桂精油对肠炎小鼠肠道菌群的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2017: 24-29. ZHANG C. Effect of cinnamon essential oil on intestinal microflora in enteritis mice based on high-throughput sequencing[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2017: 24-29. (in Chinese) |
| [18] |
辛洪亮. 精油和有机酸复合包被物对肉鸡生长性能及肠道微生物区系的影响[D]. 硕士学位论文. 西安: 西北农林科技大学, 2015: 25-45. XIN H L. Effects of coated essential oil and organic acids on the growth performance and the intestinal microbiota of broilers[D]. Master's Thesis. Xi'an: Northwest Agriculture & Forestry University, 2015: 25-45. (in Chinese) |
| [19] |
LEE S, LA T M, LEE H J, et al. Characterization of microbial communities in the chicken oviduct and the origin of chicken embryo gut microbiota[J]. Scientific Reports, 2019, 9(1): 1-11. |
| [20] |
郑佳, 肖新华, 张茜, 等. 母鼠和断乳后高脂饮食诱导子代雄鼠出现糖脂代谢异常及肠道菌群失调的实验观察[J]. 中国糖尿病杂志, 2015, 23(11): 1018-1022. ZHENG J, XIAO X H, ZHANG X, et al. Experimental observation on the abnormality of glucose and lipid metabolism and intestinal microbiota induced by maternal and post-weaning high fat diet in male offspring mice[J]. Chinese Journal of Diabetes, 2015, 23(11): 1018-1022 (in Chinese). DOI:10.3969/j.issn.1006-6187.2015.11.015 |
| [21] |
朱华, 郭亚茜, 杜晓鹏, 等. 链脲佐菌素诱导糖尿病大鼠模型肠道菌群变化[J]. 中国实验动物学报, 2018, 26(3): 349-356. ZHU H, GUO Y X, DU X P, et al. Analysis of gut microbiota in SD rat model of diabetes mellitus induced by streptozotocin[J]. Acta Laboratorium Animalis Scientia Sinica, 2018, 26(3): 349-356 (in Chinese). DOI:10.3969/j.issn.1005-4847.2018.03.013 |
| [22] |
麦云珮, 张淑允, 窦纪梁, 等. 香芹酚对STZ诱导的1型糖尿病小鼠糖脂代谢的影响[J]. 中国药理学通报, 2016, 32(9): 1306-1310. MAI Y P, ZHANG S Y, DOU J L, et al. Effect of CAR on STZ-induced type 1 diabetic mice[J]. Chinese Pharmacology Bulletin, 2016, 32(9): 1306-1310 (in Chinese). DOI:10.3969/j.issn.1001-1978.2016.09.023 |
| [23] |
黄飞. 高脂饲料诱导的SD大鼠肠道菌群分布特征及糖肾胶囊干预后的影响[D]. 博士学位论文. 北京. 北京中医药大学, 2018: 38-85. HUANG F. The gut microflora distribution characters of SD rats fed with high-fat diet and the effects on gut microbiota intervened by Tangshen capsule[D]. Ph. D. Thesis. Beijing: Beijing University of Chinese Medicine, 2018: 38-85. (in Chinese) |
| [24] |
GEISSINGER O, HERLEMANN D P R, MORSCHEL E, et al. The ultramicrobacterium "Elusimicrobium minutum" gen.nov., sp.nov., the first cultivated representative of the termite group 1 phylum[J]. Applied and Environmental Microbiology, 2009, 75(9): 2831-2840. DOI:10.1128/AEM.02697-08 |
| [25] |
SHI D, LV L, FANG D, et al. Administration of Lactobacillus salivarius LI01 or Pediococcus pentosaceus LI05 prevents CCl4-induced liver cirrhosis by protecting the intestinal barrier in rats[J]. Scientific Reports, 2017, 7(1): 1-13. DOI:10.1038/s41598-016-0028-x |
| [26] |
UEMATSU H, SATO N, HOSSAIN M Z, et al. Degradation of arginine and other amino acids by butyrate-producing asaccharolytic anaerobic Gram-positive rods in periodontal pockets[J]. Archives of Oral Biology, 2003, 48(6): 423-429. DOI:10.1016/S0003-9969(03)00031-1 |
| [27] |
DRONAMRAJU S S, COXHEAD J M, KELLY S B, et al. Differential antineoplastic effects of butyrate in cells with and without a functioning DNA mismatch repair[J]. Nutrition & Cancer, 2009, 62(1): 105-115. |
| [28] |
朱林文思. 结直肠腺瘤再发与肠道菌群构成的关系[D]. 博士学位论文. 上海. 上海交通大学, 2017: 25-33 ZHU L W S. The relationship between the recurrence of colorectal adenoma and the composition of intestinal flora[D]. Ph. D. Thesis. Shanghai: Shanghai Jiaotong University, 2017: 25-33. (in Chinese) |
| [29] |
GROSCHWITZ K R, HOGAN S P. Intestinal barrier function: molecular regulation and disease pathogenesis[J]. Journal of Allergy and Clinical Immunology, 2009, 124(1): 3-20. DOI:10.1016/j.jaci.2009.05.038 |
| [30] |
ZAREIE M, RIFF J, DONATO K, et al. Novel effects of the prototype translocating Escherichia coli, strain C25 on intestinal epithelial structure and barrier function[J]. Cellular Microbiology, 2005, 7(12): 1782-1797. DOI:10.1111/j.1462-5822.2005.00595.x |
| [31] |
DOMADIA P, SWARUP S, BHUNIA A, et al. Inhibition of bacterial cell division protein FtsZ by cinnamaldehyde[J]. Biochemical Pharmacology, 2007, 74(6): 831-840. DOI:10.1016/j.bcp.2007.06.029 |
| [32] |
MARYANNEROSHNI A, VENKIATNARAYANAN K. Effect of trans-cinnamaldehyde on inhibition and inactivation of Cronobacter sakazakii biofilm on abiotic surfaces[J]. Journal of Food Protection, 2011, 74(2): 200-208. DOI:10.4315/0362-028X.JFP-10-296 |
| [33] |
TⅡHONEN K, KETTUNEN H, BENTO M H L, et al. The effect of feeding essential oils on broiler performance and gut microbiota[J]. British Poultry Science, 2010, 51(3): 381-392. DOI:10.1080/00071668.2010.496446 |
| [34] |
韩旭. 牛至油对蛋鸡肠道消化吸收功能影响的研究[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2013: 23-31. HAN X. The effects of oregano oil on intestinal digestion and absoiptibe function in laying hens[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural Reclamation University, 2013: 23-31. (in Chinese) |
| [35] |
HASSEN A, JAMOUSSI F, SAIDI N, et al. Microbial and copper adsorption by smectitic clay-an experimental study[J]. Environmental Technology, 2003, 24(9): 1117-1127. DOI:10.1080/09593330309385652 |
| [36] |
KAMADA N, SEO S U, CHEN G Y, et al. Role of the gut microbiota in immunity and inflammatory disease[J]. Nature Reviews Immunology, 2013, 13(5): 321-335. DOI:10.1038/nri3430 |
| [37] |
KOGUT M H. The effect of microbiome modulation on the intestinal health of poultry[J]. Animal Feed Science and Technology, 2019, 250: 32-40. DOI:10.1016/j.anifeedsci.2018.10.008 |




