2. 山西祥和岭上农牧开发有限公司, 右玉 037200;
3. 山西安弘检测技术有限公司, 太原 030000;
4. 山西省右玉县畜牧兽医中心, 右玉 037200
2. Xianghe Lingshang Agriculture and Animal Husbandry Development Co., Ltd. of Shanxi, Youyu 037200, China;
3. Anhong Testing Technology Co., Ltd. of Shanxi, Taiyuan 030000, China;
4. Animal Husbandry Bureau of Youyu County, Youyu 037200, China
近年来,由于限抗、禁抗等政策,在动物生产中应用植物提取物替代抗生素受到研究者的广泛关注。植物提取物是植物的次生性代谢产物,对细菌、真菌、原虫、病毒等微生物有选择性抗菌活性。因此,许多植物提取物能够调控反刍动物瘤胃微生物发酵[1]。肉桂为樟科常绿乔木植物,主要分布在广东、广西、云南、福建等地区,其中广东、广西的肉桂产量约占世界产量的80%。肉桂醛(cinnamaldehyde,CA)又称桂醛、桂皮醛、三苯基丙烯醛,属醛类有机化合物,具有抑菌、杀菌、抗病毒、抗氧化等生物学功能。Yang等[2]在肉牛高精料饲粮中添加CA,结果表明,CA能够调节反刍动物瘤胃发酵,影响肉牛对饲粮氮利用。Khorrami等[3]利用CA替代莫能菌素应用于肉牛生产,其结果表明,CA可以降低肉牛瘤胃原虫数量和乙酸/丙酸。研究发现,CA能影响犊牛瘤胃微生物发酵,在犊牛开食料中添加CA能够降低瘤胃乙酸和总挥发性脂肪酸(TVFA)浓度,提高丙酸浓度[4]。金恩望等[5]在体外研究中发现,添加肉桂精油能够显著提高发酵72 h时微生物蛋白(MCP)的产量。据统计,反刍动物瘤胃发酵产生的甲烷(CH4)占总排放量的26%,同时占饲料能量的5%~12%,不但加剧温室效应,而且降低动物对饲料能量的利用率[6]。石宁等[7]体外研究表明,肉桂精油可以改善瘤胃发酵,降低CH4产量。目前,CA在单胃动物生产中的应用较广泛,而有关CA在反刍动物上的应用和研究主要集中于肉牛和奶牛,在肉羊上的应用较少,且影响效果及适宜添加量不确定。因此,本试验采用尼龙袋法和体外产气法研究不同添加水平的CA对肉羊饲粮营养物质瘤胃降解特性及体外发酵参数的影响,为CA在肉羊生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料试验所用CA购自西安某科技有限公司,纯度为20%,红色粉末状,其余为无功能肉桂残渣。
1.2 试验设计与饲养管理本试验采用单因子试验设计,选用12只体况良好、年龄相近、体重(50±2) kg、装有永久性瘤胃瘘管的杜×寒杂交羯羊作为试验动物。参考NRC(2007)绵羊营养需要配制基础饲粮,其组成及营养水平见表 1,精粗比为70∶30。将12只试验羊随机分为4组,每组3只,单栏饲喂,并且每千克基础饲粮中分别添加0(对照组)、200(200CA组)、300(300CA组)、400 mg(400CA组)的CA。预饲15 d,每天08:00、18:00各饲喂1次,自由饮水。预饲结束后投放尼龙袋,测定营养物质瘤胃降解率。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选用10 cm×8 cm(孔径为50 μm)尼龙袋,编号并清洗干净,放65 ℃烘箱中烘48 h,回潮24 h后称重记录。将各组饲粮粉碎,过40目筛,准确称取5 g(精确至0.000 1 g)饲粮样品并无损转入尼龙袋中,每组3个重复,每个重复2个平行。尼龙袋按照“依次放入,同时取出”原则放入瘤胃。发酵时间点设置为0、6、12、24、36、48、72 h。发酵72 h后尼龙袋全部取出,利用冷的自来水冲洗(包括0 h),直至水澄清,放入65 ℃的烘箱中烘48 h,再回潮24 h,称重后将尼龙袋中的残渣分装,用于营养物质含量测定。
被测样品中某营养物质瘤胃降解率的计算公式:

|
利用Ørskov等[8]提出的指数模型计算瘤胃降解参数:
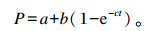
|
式中:P为在t时间点样品中某营养物质的瘤胃降解率(%);a为快速降解部分(%);b为慢速降解部分(%);c为慢速降解部分的降解速率(h-1);t为样品中该营养物质降解所用的时间(h)。
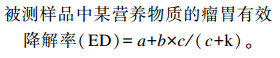
|
式中:k为样品中该营养物质的外流速率常数(h-1),本试验中k值为0.031。
1.4 体外产气法测定体外瘤胃发酵参数本试验参考Menke等[9]方法,采用DHP-9162型恒温培养箱、玻璃注射器(德国Harberle公司)、分液装置(德国Poulten and Graf GmbH)以及培养液分装槽(北京方正兴达科技发展公司)等装置进行体外发酵试验。
1.4.1 发酵底物准备将基础饲粮粉碎,过40目筛后分别在每千克基础饲粮中添加0(对照组)、200(200CA组)、300(300CA组)、400 mg(400CA组)的CA,充分混合均匀,作为发酵底物。准确称量0.2 g(精确至0.000 1 g)饲粮样品,无损转入体外消化-移动尼龙小袋(35 mm×75 mm,孔径为40 μm,北京一牛肉牛研究中心),封口,放入100 mL玻璃注射器内,39 ℃预热,备用。每个饲粮样品设6个平行。
1.4.2 瘤胃液采集晨饲前采集3只仅饲喂基础饲粮的瘘管羊的瘤胃液,4层纱布过滤,置于39 ℃预热且无氧的暖瓶中备用。
1.4.3 体外培养将瘤胃液与人工唾液按照1∶2混合作为体外发酵的培养液,通入CO2并使用磁力搅拌器搅拌均匀。每个玻璃注射器中装30 mL培养液,排尽空气,记录其初始刻度,同时设置3个空白管(只添加培养液,不放饲粮样品)。快速将玻璃注射器依次放入39 ℃的恒温摇床培养箱中,培养48 h。
1.4.4 样品采集分别于培养0、3、6、9、12、18、24、36和48 h时读取并记录注射器刻度值,当读数超过80 mL时,采用集气袋收气并保存,用于测定CH4浓度。48 h后终止发酵,收集培养液并立即测定pH,随后将培养液置于-20 ℃冷冻保存,用于测定挥发性脂肪酸(VFA)、氨态氮(NH3-N)和MCP浓度。
1.4.5 指标测定利用气相色谱仪(Agilent 7890B,美国)测定CH4浓度;参考Wang等[10]的方法,利用气相色谱仪测定VFA浓度,计算TVFA浓度以及TVFA中乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸的比例及乙酸/丙酸;利用考马斯亮蓝G-250作为指示剂, 使用比色法[11]测定MCP浓度;采用亚硝基铁氰化钠-次氯酸钠比色法测定NH3-N浓度。
1.5 数据处理与分析采用Excel 2010对试验数据进行初步整理,然后使用SPSS 23.0软件进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较,并进行线性和二次回归分析。P < 0.05为差异显著,0.05≤P≤0.10为有趋势。
2 结果与分析 2.1 添加不同水平的CA对DM瘤胃降解特性的影响由表 2可知,200CA、300CA组DM的瘤胃降解率在各时间点均显著高于对照组(P < 0.05)。200CA、300CA、400CA组DM的快速降解部分及瘤胃有效降解率均显著高于对照组(P < 0.05)。
|
|
表 2 添加不同水平的CA对DM瘤胃降解特性的影响 Table 2 Effects of different supplemental levels of CA on DM rumen degradation characteristics of diets |
由表 3可知,在6~72 h,200CA、300CA组CP的瘤胃降解率显著高于对照组(P < 0.05);在24~72 h,400CA组CP的降解率显著低于对照组(P < 0.05)。400CA组的CP的快速降解部分、慢速降解部分及慢速降解部分的降解速率均显著低于其余各组(P < 0.05)。200CA和300CA组的CP瘤胃有效降解率显著高于对照组(P < 0.05),而400CA组CP瘤胃有效降解率则显著低于对照组(P < 0.05)。
|
|
表 3 添加不同水平的CA对CP瘤胃降解特性的影响 Table 3 Effects of different supplemental levels of CA on CP rumen degradation characteristics of diets |
由表 4可知,在6~72 h,200CA、300CA、400CA组NDF的瘤胃降解率显著高于对照组(P < 0.05),同时NDF的快速降解部分及瘤胃有效降解率也均显著高于对照组(P < 0.05),且以400CA组最高,但与200CA、300CA组差异不显著(P>0.05)。
|
|
表 4 添加不同水平的CA对NDF瘤胃降解特性的影响 Table 4 Effects of different supplemental levels of CA on NDF rumen degradation characteristics of diets |
由表 5可知,在6~72 h,200CA、300CA、400CA组ADF的瘤胃降解率均显著高于对照组(P < 0.05),同时ADF的快速降解部分与瘤胃有效降解率也均显著高于对照组(P < 0.05)。
|
|
表 5 添加不同水平的CA对ADF瘤胃降解特性的影响 Table 5 Effects of different supplemental levels of CA on ADF rumen degradation characteristics of diets |
由表 6可知,在体外发酵试验中,产气量随发酵时间的延长而增加,各组的不同时间点的产气量均无显著差异(P>0.05),但在16~48 h,产气量随CA添加水平的增加呈线性降低(P < 0.05)或降低趋势(0.05≤P≤0.10)。
|
|
表 6 添加不同水平的CA对体外发酵产气量的影响 Table 6 Effects of different supplemental levels of CA on in vitro fermentation gas production |
由表 7可知,添加不同水平的CA对发酵液pH无显著影响(P>0.05);发酵液中NH3-N浓度随CA添加水平的增加呈线性和二次曲线降低(P < 0.05),且各CA添加组均显著低于对照组(P < 0.05)。发酵液中MCP浓度各组之间无显著差异(P>0.05);CH4浓度随CA添加水平的增加呈线性或二次曲线降低(P < 0.05),且300CA、400CA组显著低于对照组(P < 0.05)。
|
|
表 7 添加不同水平的CA对体外瘤胃发酵参数的影响 Table 7 Effects of different supplemental levels of CA on in vitro rumen fermentation parameters |
由表 8可知,在体外发酵试验中,各组发酵液中TVFA浓度无显著差异(P>0.05),且添加不同水平的CA对异丁酸、异戊酸及戊酸的比例无显著影响(P>0.05)。发酵液VFA中,300CA组乙酸的比例较对照组显著降低(P < 0.05);丙酸的比例随CA添加水平的增加呈线性和二次曲线增加(P < 0.05),300CA、400CA组显著高于对照组(P < 0.05);300CA、400CA组丁酸的比例较对照组有增加的趋势(0.05≤P≤0.10),且丁酸的比例随着CA添加水平的增加呈线性和二次曲线增加(P < 0.05);乙酸/丙酸随CA添加水平的增加呈线性或二次曲线降低(P < 0.05),且200CA、300CA、400CA组显著低于对照组(P < 0.05)。
|
|
表 8 添加不同水平的CA对体外瘤胃发酵液VFA组成的影响 Table 8 Effects of different supplemental levels of CA on in vitro rumen fermentation fluid VFA composition |
CA是一种新型绿色饲料添加剂,饲粮中添加适量的CA能够改善瘤胃内环境[12]。Macheboeuf等[13]研究表明,CA的抑菌作用是醛类有机物中最强的,低浓度的CA即可调控瘤胃发酵。林波等[14]体外发酵试验结果表明,植物挥发油在适当的浓度下可有效调控瘤胃发酵,而添加高浓度的肉桂醛时TVFA浓度急剧下降,瘤胃发酵受到抑制。饲粮中的营养物质在瘤胃中的降解率反映了饲料原料被消化利用的难易程度,是饲粮营养物质被动物机体利用程度的重要指标[15]。Tekippe等[16]在奶牛饲粮中添加CA后提高了饲粮中NDF的消化率。An等[17]研究表明,饲粮中添加CA可提高营养物质在瘤胃中的降解率。Yang等[2]给带有瘤胃及十二指肠瘘管的肉牛饲粮中添加不同水平的CA,结果表明,给肉牛补饲低剂量的CA对其干物质采食量的影响较小,但可以提高其对饲粮中营养物质的消化利用。林波等[18]在湖羊饲粮中添加肉桂油、丁香油、牛至油等不同植物精油后发现,湖羊瘤胃中NH3-N的浓度及饲粮CP瘤胃降解率显著降低。本试验中,各CA添加组饲粮DM、NDF及ADF的瘤胃有效降解率显著高于对照组,200CA、300CA组CP的瘤胃有效降解率显著高于对照组,而400CA组CP的瘤胃有效降解率显著低于对照组,这证明了适量的CA可以提高饲粮中营养物质在瘤胃中的降解率,也可以提高饲粮蛋白质在瘤胃中的存留率,这种效果与CA的添加水平高度相关。营养物质降解率的提高可能与添加适量的CA后选择性的提高了瘤胃细菌、真菌的活性,改善了瘤胃功能有关。同时,有研究表明,CA能够抑制部分瘤胃原虫的活性[19],而原虫具有蛋白质水解活性和脱氨基活性[20]。因此,在肉羊饲粮中添加一定水平的CA时,CP的瘤胃有效降解率降低,使进入小肠的蛋白质的量增加。
3.2 添加不同水平的CA对体外瘤胃发酵参数的影响产气量是反映饲粮可发酵程度及瘤胃微生物活性的重要指标[21]。目前,关于CA及肉桂油对瘤胃发酵产气量的大多数研究表明,随着CA或肉桂油添加水平的增加,总产气量无显著变化或显著降低。本试验中,各组之间的总产气量(72 h产气量)无显著差异,但与对照组相比,试验组产气量随CA添加水平的增加呈线性降低趋势,这与前人的研究基本一致。反刍动物瘤胃合成CH4的主要途径是氢气(H2)还原二氧化碳(CO2)生成CH4,其次是利用乙酸、丙酸、丁酸等挥发性脂肪酸生成CH4[22]。林波等[14]体外研究发现,添加50 mg/L CA和肉桂醛油时,CH4产量较对照组分别降低16.5%和21.4%,总产气量分别降低8.5%和10.4%,但与对照组相比差异不显著,但其添加水平高于500 mg/L时能显著降低CH4产量及总产气量,总产气量分别降低57.2%和51.2%,瘤胃发酵受到抑制。Blanch等[23]研究发现,体外条件下添加适宜浓度的CA和大蒜油,能够显著降低CH4的产量。王东升等[24]体外发酵试验表明,添加100 mg/L的肉桂油能够显著降低CH4产量及总产气量。在本试验中,发酵液中CH4浓度随CA添加水平的增加线性降低,与上述前人的研究基本一致。这可能是由于CA抑制了产甲烷菌的活性[25],导致CH4产量降低,但H2和CO2产量增加,同时,瘤胃发酵产生的H2被用来合成丙酸,使得合成CH4的底物减少,进而降低CH4产量,总产气量无显著变化,这也与本试验发酵液中丙酸比例升高的结果相一致。
瘤胃液pH可以反映瘤胃内环境的状态,受饲粮类型、动物唾液分泌量以及有机酸浓度的共同影响[7],pH过高或过低均会抑制瘤胃微生物生长,对瘤胃发酵产生负面影响。本次体外发酵试验结果表明添加CA后对发酵液pH无显著影响,且pH均在6.2~6.8,在适宜瘤胃微生物生长的pH范围内,这可能是由于体外瘤胃发酵试验中缓冲液对维持pH的稳定起了重要作用。饲粮中的蛋白质在瘤胃菌群的作用下降解为NH3-H,一部分被瘤胃微生物利用合成MCP,进而被机体吸收利用。因此,瘤胃中NH3-N及MCP的浓度是反映瘤胃氮代谢的重要指标。目前,关于CA或肉桂精油对NH3-N浓度影响的研究已经有很多报道,但结果存在差异。Fraser等[26]研究表明,500 mg/L的肉桂油能够显著降低NH3-N的浓度。CA是肉桂精油的主要活性成分,Busquet等[4]研究表明,CA比肉桂精油对瘤胃发酵的影响大,CA可以通过降低脱氨基作用降低发酵液中NH3-N的浓度,从而影响瘤胃氮代谢。金恩望等[5]利用体外产气法研究了不同植物精油对瘤胃发酵的影响,结果表明,不同添加水平的植物精油均会不同程度的降低NH3-N的浓度,但对MCP的浓度无显著影响。Jahani-Azizabadi等[27]利用批次培养法研究植物精油对瘤胃发酵特性的影响,结果表明,发酵液中添加20 μL/L的肉桂油能显著降低NH3-N浓度及CH4产量。本试验结果也表明,添加不同水平的CA均能降低发酵液中NH3-N浓度,但对MCP浓度无显著影响。瘤胃中的NH3-N大部分(总量的50%以上)是由瘤胃中的超级产氨细菌(HAP)产生的,HAP仅占瘤胃细菌总数的1%左右,却有非常高的脱氨基活性[28]。研究表明,植物精油能够选择性的抑制HAP,从而降低瘤胃中NH3-N的浓度[29]。除此之外,肉桂醛能够降低普雷沃菌属的数量,从而降低瘤胃液中NH3-N的浓度[30]。然而,王东升等[24]研究显示,添加CA(100 mg/L)后对发酵液中NH3-N及MCP浓度均无显著影响。金恩望等[31]利用批次培养法研究植物精油对瘤胃发酵的影响,结果表明,在发酵的72 h内,添加100、500 mg/L的肉桂精油时NH3-N的浓度逐渐升高,而添加100、500、1 500 mg/L的肉桂油在发酵72 h时MCP浓度显著升高。这些试验结果的差异可能是由于试验方法、发酵体系、CA的添加形式和添加水平以及发酵底物不同而引起的。另外,瘤胃中的细菌可以利用NH3-N合成MCP,降低瘤胃中NH3-N的浓度,然而,本试验结果表明,添加不同水平的CA对发酵液中MCP浓度无显著影响。因此推测,CA降低NH3-N的浓度是由于选择性地抑制了瘤胃中产氨菌的脱氨基活性。其作用机制可能是CA的羰基与微生物酶结合使其失去作用[12]。
VFA是饲粮中碳水化合物进入瘤胃后被降解的主要产物,是反刍动物能量供应的主要来源。其中乙酸、丙酸及丁酸总量占TVFA的95%以上。关于CA对瘤胃发酵时TVFA及各种VFA的浓度及比例影响的研究结果也不统一。Chaves等[33]研究报道,在体外发酵试验中,添加250 mg/L的肉桂精油对TVFA、乙酸浓度无显著影响,而丁酸浓度显著升高;同时,Chaves等[34]在羔羊饲粮中添加CA(0.2 g/kg DM),研究其对羔羊瘤胃发酵的影响,结果表明CA增加了瘤胃液中TVFA的浓度。Busquet等[35]的体外产气试验结果表明,添加3、30、300 mg/L的肉桂油对TVFA、乙酸及丙酸浓度均无显著影响,添加3 000 mg/L的CA能显著降低TVFA浓度。然而,Busquet等[4]利用双外流持续发酵系统研究CA对瘤胃发酵的影响时发现,添加31.2或312.0 g/L的CA使得发酵液中乙酸比例下降,丙酸及丁酸比例上升。Cardozo等[36]研究表明,添加300 mg/L的肉桂油显著降低TVFA及支链脂肪酸的浓度,而添加30 mg/L的肉桂油对TVFA浓度无显著影响。由此可见,肉桂精油及CA对TVFA浓度的影响存在明显的剂量效应,添加低浓度的CA对TVFA浓度无显著影响,添加高浓度CA能够显著降低TVFA浓度,瘤胃发酵受到抑制;另外,由于试验方法不同,可能会对各VFA浓度及比例产生不同的影响。本试验结果表明,添加不同水平的CA对发酵液中TVFA浓度以及异丁酸、异戊酸、戊酸比例无显著影响,可能是由于本试验所采用的CA纯度较低(20%左右),不会对瘤胃发酵产生抑制作用;而添加CA使得发酵液中丙酸比例显著增加,乙酸/丙酸显著降低,可能是由于CA抑制了甲烷菌的活性,瘤胃内多余的H2被转移到了丙酸合成的过程中,从而使丙酸比例增加,乙酸/丙酸降低。目前,关于CA对反刍动物瘤胃发酵的影响存在很多争议,体外试验和体内试验结果也存在一些差异,确定CA在肉羊生产中的最适添加量需进一步增加体内试验。
4 结论综上所述,饲粮中添加200和300 mg/kg CA能够提高肉羊饲粮中DM、CP、NDF、ADF的瘤胃有效降解率,降低发酵液中CH4和NH3-N浓度,提高发酵液中丙酸比例,并降低乙酸比例及乙酸/丙酸。在本试验条件下,每千克饲粮中添加300 mg CA时效果最好。
| [1] |
MATEOS I, RANILLA M J, TEJIDO M L, et al. The influence of diet type (dairy versus intensive fattening) on the effectiveness of garlic oil and cinnamaldehyde to manipulate in vitro ruminal fermentation and methane production[J]. Animal Production Science, 2013, 53(4): 299-307. DOI:10.1071/AN12167 |
| [2] |
YANG W Z, AMETAJ B N, BENCHAAR C, et al. Dose response to cinnamaldehyde supplementation in growing beef heifers: ruminal and intestinal digestion[J]. Journal of Animal Science, 2010, 88(2): 680-688. DOI:10.2527/jas.2008-1652 |
| [3] |
KHORRAMI B, VAKILI A R, MESGARAN M D, et al. Thyme and cinnamon essential oils: potential alternatives for monensin as a rumen modifier in beef production systems[J]. Animal Feed Science and Technology, 2015, 200: 8-16. DOI:10.1016/j.anifeedsci.2014.11.009 |
| [4] |
BUSQUET M, CALSAMIGLIA S, FERRET A, et al. Effects of cinnamaldehyde and garlic oil on rumen microbial fermentation in a dual flow continuous culture[J]. Journal of Dairy Science, 2005, 88(7): 2510-2516. |
| [5] |
金恩望, 王加启, 卜登攀, 等. 利用体外产气法研究植物精油对瘤胃体外发酵和甲烷生成的影响[J]. 中国农业大学学报, 2013, 18(3): 120-127. JIN E W, WANG J Q, BU D P, et al. Effect of essential oil on rumen fermentation and methanogenesis in vitro gas production[J]. Journal of China Agricultural University, 2013, 18(3): 120-127 (in Chinese). |
| [6] |
JOHNSON K A, JOHNSON D E. Methane emissions from cattle[J]. Journal of Animal Science, 1995, 73(8): 2483-2492. DOI:10.2527/1995.7382483x |
| [7] |
石宁, 贾淼, 李艳玲. 体外产气法研究植物精油对肉羊体外瘤胃发酵参数及甲烷产量的影响[J]. 动物营养学报, 2019, 31(1): 274-284. SHI N, JIA M, LI Y L. Effects of plant essential oil on rumen fermentation parameters and methane production of mutton sheep in vitro[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 274-284 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.034 |
| [8] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [9] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [10] |
WANG C, LIU Q, GUO G, et al. Effects of rumen-protected folic acid on ruminal fermentation, microbial enzyme activity, cellulolytic bacteria and urinary excretion of purine derivatives in growing beef steers[J]. Animal Feed Science and Technology, 2016, 221: 185-194. DOI:10.1016/j.anifeedsci.2016.09.006 |
| [11] |
BRADFORD M M. A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [12] |
CARDOZO P W, CALSAMIGLIA S, FERRET A, et al. Effects of alfalfa extract, anise, capsicum, and a mixture of cinnamaldehyde and eugenol on ruminal fermentation and protein degradation in beef heifers fed a high-concentrate diet[J]. Journal of Animal Science, 2006, 84(10): 2801-2808. DOI:10.2527/jas.2005-593 |
| [13] |
MACHEBOEUF D, MORGAVI D P, PAPON Y, et al. Dose-response effects of essential oils on in vitro fermentation activity of the rumen microbial population[J]. Animal Feed Science and Technology, 2008, 145(1/2/3/4): 335-350. |
| [14] |
林波, 纪苗苗, 梁权, 等. 肉桂油和牛至油及其主要成分对体外瘤胃发酵和甲烷产生的影响[J]. 中国兽医学报, 2011, 31(2): 279-282, 287. LIN B, JI M M, LIANG Q, et al. Effect of cinnamon oil and oregano oil and their major components on rumen fermentation in vitro[J]. Chinese Journal of Veterinary Science, 2011, 31(2): 279-287 (in Chinese). |
| [15] |
GAO W, CHEN A D, ZHANG B W, et al. Rumen degradability and post-ruminal digestion of dry matter, nitrogen and amino acids of three protein supplements[J]. Asian-Australasian Journal of Animal Science, 2015, 28(4): 485-493. DOI:10.5713/ajas.14.0572 |
| [16] |
TEKIPPE J A, TACOMA R, HRISTOV A N, et al. Effect of essential oils on ruminal fermentation and lactation performance of dairy cows[J]. Journal of Dairy Science, 2013, 96(12): 7892-7903. DOI:10.3168/jds.2013-7128 |
| [17] |
AN X P, WANG Y, WANG R F, et al. Effects of a blend of cinnamaldehyde, eugenol and capsicum oleoresin (CEC) on growth performance, nutrient digestibility, immune response and antioxidant status of growing ewes[J]. Livestock Science, 2020, 234: 103982. DOI:10.1016/j.livsci.2020.103982 |
| [18] |
林波. 挥发油及其活性成分组合与富马酸钠共同添加对体外瘤胃发酵和湖羊养分消化的影响[D]. 博士学位论文. 杭州: 浙江大学, 2011. LIN B. Effects of volatile oil and combination of active components and sodium fumarate on rumen fermentation and nutrient digestion in vitro[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2011. (in Chinese) |
| [19] |
丁大伟, 徐小强, 高许雷, 等. 牛至油和肉桂醛添加组合对奶牛瘤胃微生物蛋白产量与养分消化率的影响[J]. 中国畜牧杂志, 2019, 55(9): 76-80. DING D W, XU X Q, GAO X L, et al. Effects of oregano oil and cinnamic aldehyde on rumen microbial protein production and nutrient digestibility of dairy cows[J]. Chinese Journal of Animal Science, 2019, 55(9): 76-80 (in Chinese). |
| [20] |
HART K J, YÁÑEZ-RUIZ D R, DUVAL S M, et al. Plant extracts to manipulate rumen fermentation[J]. Animal Feed Science and Technology, 2008, 147(1/2/3): 8-35. |
| [21] |
MCINTOSH F M, WILLIAMS P, LOSA R, et al. Effects of essential oils on ruminal microorganisms and their protein metabolism[J]. Applied and Environmental Microbiology, 2003, 69(8): 5011-5014. DOI:10.1128/AEM.69.8.5011-5014.2003 |
| [22] |
郝正里, 刘世民, 孟宪政. 反刍动物营养学[M]. 兰州: 甘肃民族出版社, 2000: 3-4. HAO Z L, LIU S M, MENG X Z. Ruminant nutrition[M]. Lanzhou: Gansu Ethnic Press, 2000: 3-4 (in Chinese). |
| [23] |
BLANCH M, CARRO M D, RANILLA M J, et al. Influence of a mixture of cinnamaldehyde and garlic oil on rumen fermentation, feeding behavior and performance of lactating dairy cows[J]. Animal Feed Science and Technology, 2016, 219: 313-323. DOI:10.1016/j.anifeedsci.2016.07.002 |
| [24] |
王东升, 黄江丽, 于一尊, 等. 3种挥发油对肉牛体外瘤胃发酵、甲烷生成和微生物种群的影响[J]. 江西农业大学学报, 2016, 38(4): 711-716. WANG D S, HUANG J L, YU Y Z, et al. Effects of three kinds of essential oil on rumen fermentation, methanogenesis and microbiota in vitro[J]. Acta Agriculture Universitatis Jiangxiensis, 2016, 38(4): 711-716 (in Chinese). |
| [25] |
杨云燕. 肉桂醛对犊牛生长性能、健康及瘤胃发酵相关指标的影响[D]. 硕士学位论文. 南宁: 广西大学, 2019. YANG Y Y. Effects of cinnamaldehyde on growth performance, health and rumen fermentation of calves[D]. Master's Theise. Nanning: Guangxi University, 2019. (in Chinese) |
| [26] |
FRASER G R, CHAVES A V, WANG Y, et al. Assessment of the effects of cinnamon leaf oil on rumen microbial fermentation using two continuous culture systems[J]. Journal of Dairy Science, 2007, 90(5): 2315-2328. DOI:10.3168/jds.2006-688 |
| [27] |
JAHANI-AZIZABADI H, MESGARAN M D, VAKILI A R, et al. Effect of various medicinal plant essential oils obtained from semi-arid climate on rumen fermentation characteristics of a high forage diet using in vitro batch culture[J]. African Journal of Microbiology Research, 2011, 5(27): 4812-4819. |
| [28] |
NEWBOLD C J, MCINTOSH F M, WILLIAMS P, et al. Effects of a specific blend of essential oil compounds on rumen fermentation[J]. Animal Feed Science and Technology, 2004, 114(1/2/3/4): 105-112. |
| [29] |
PATRA A K. Enteric methane mitigation technologies for ruminant livestock: a synthesis of current research and future directions[J]. Environmental Monitoring and Assessment, 2012, 184(4): 1929-1952. DOI:10.1007/s10661-011-2090-y |
| [30] |
FERME D, CALSAMIGLIA S, BUSQUET M, et al. Structure changes in bacterial populations from the phylum Bacteroidetes upon the inclusion of monensin, cinnamaldehyde or garlic extract in a dual flow continuous culture system[C]. Proceedings of the royal society of London A. London: [s. n. ], 2004: 5.
|
| [31] |
金恩望, 卜登攀, 王加启, 等. 利用批次培养法研究植物精油对瘤胃体外发酵的影响[J]. 甘肃农业大学学报, 2014, 49(2): 5-12, 20. JIN E W, BU D P, WANG J Q, et al. Effect of essential oil on rumen fermentation in vitro batch fermentation trial[J]. Journal of Gansu Agricultural university, 2014, 49(2): 5-12, 20 (in Chinese). DOI:10.3969/j.issn.1003-4315.2014.02.002 |
| [32] |
BURT S. Essential oils: their antibacterial properties and potential applications in foods—a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253. |
| [33] |
CHAVES A V, STANFORD K, GIBSON L L, et al. Effects of carvacrol and cinnamaldehyde on intake, rumen fermentation, growth performance, and carcass characteristics of growing lambs[J]. Animal Feed Science and Technology, 2007, 145(1/2/3/4): 396-408. |
| [34] |
CHAVES A V, STANFORD D K, DUGAN M E R, et al. Effects of cinnamaldehyde, garlic and juniper berry essential oils on rumen fermentation, blood metabolites, growth performance, and carcass characteristics of growing lambs[J]. Livestock Science, 2008, 117(2/3): 215-224. |
| [35] |
BUSQUET M, CALSAMIGLIA S, FERRET A, et al. Plant extracts affect in vitro rumen microbial fermentation[J]. Journal of Dairy Science, 2006, 89(2): 761-771. DOI:10.3168/jds.S0022-0302(06)72137-3 |




