2. 汉中市烟草公司南郑分公司, 汉中 723102;
3. 沈阳禾丰反刍动物饲料有限公司, 沈阳 110164
2. Hanzhong Tobacco Company Nanzheng Branch, Hanzhong 723102, China;
3. Shenyang Hefeng Ruminant Feed Co., Ltd., Shenyang 110164, China
籽用南瓜是以种子作为主要食用器官或加工对象的南瓜类总称,属于葫芦科南瓜属[1]。我国籽用南瓜的年产量30万~40万t,位居世界第一,产生大量的籽用南瓜副产物,如南瓜籽饼、南瓜籽皮、南瓜果肉等[2]。然而,籽用南瓜副产物的利用程度较低,人们通常将其就地堆放或者直接焚烧,造成了资源的浪费,且污染环境。因此,深入了解籽用南瓜副产物的营养特性并加以充分利用,对我国非常规饲料资源的开发和利用具有一定的意义。
有数据显示,南瓜籽饼中粗蛋白质含量不低于50%[3],且适口性好[4],可作为反刍动物饲粮的优质营养来源。Klir等[5]研究表明,在不改变饲粮能量和粗蛋白质水平的基础上,奶山羊饲粮中用南瓜籽饼完全替代豆粕对其产奶量无显著影响。南瓜籽皮是南瓜籽经浸泡、脱皮、晾晒之后得到的种子外皮,属于短纤维粗饲料。南瓜果肉中碳水化合物含量丰富,其中淀粉含量为5%~10%,果胶含量为0.6%~2.0%[1],且粗蛋白质水平可达到15%[6],同样也可作为优质的反刍动物饲料原料。
傅里叶变换红外光谱(FTIR)技术是一种简单、便捷和快速的分析手段,已经广泛应用于谷物[7-8]、油籽[9]、粗饲料[10-11]和农业副产物[12]分子结构特性的研究中。然而,关于籽用南瓜副产物的FTIR分子结构的分析,未见报道。基于此,本试验旨在比较南瓜籽饼、南瓜籽皮及南瓜果肉的营养价值和生物学降解特性,并利用FTIR技术分析上述南瓜籽副产物中与碳水化合物官能团有关区域内的分子结构特征,分析营养价值与分子结构是否存在相关关系,为籽用南瓜副产品在反刍动物生产中的合理高效利用提供数据基础。
1 材料与方法 1.1 试验样品采集与处理本试验选用的籽用南瓜来自于双鸭山市黑龙江和兴农产品有限公司(2018年10月),包括3个品种,分别为银辉1号、银辉2号和金辉1号(品种作为重复),每个品种包含50个籽用南瓜。采用人工分离的方法将每个籽用南瓜分为3部分,即南瓜籽、南瓜籽皮和南瓜果肉。利用物理冷榨方法,使用螺旋式榨油机(KYL-380榨油机)对南瓜籽进行加工,控制温度为70 ℃,水分含量为7.5%,转速为36 r/min,出油率约为47%,将南瓜籽榨油后得到南瓜籽饼。所有样品均在55 ℃的烘箱中干燥48 h,一部分粉碎至1.0 mm,用于常规化学成分分析以及瘤胃降解参数的测定,另一部分粉碎至0.25 mm,用于光谱扫描。
1.2 测定指标及方法 1.2.1 常规化学成分分析干物质(DM)和粗灰分(Ash)含量采用AOAC(2002)[13]的方法进行测定。根据Van Soest等[14]的方法,使用Ankom 220纤维分析仪(Ankom公司,美国)分析中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和酸性洗涤木质素(ADL)的含量。淀粉(starch)含量采用Megazyme总淀粉试剂盒(产品编号:K-TSTA;Megazyme国际爱尔兰有限公司,爱尔兰)测定。根据NRC(2001)[15]公式计算总碳水化合物(CHO)、非纤维性碳水化合物(NFC)、半纤维素(hemicellulose)和纤维素(cellulose)的含量。根据康奈尔净碳水化合物—蛋白质体系(CNCPS)[16]计算碳水化合物中快速降解碳水化合物(CA)、中速降解碳水化合物(CB1)、慢速降解碳水化合物(CB2)、不可利用纤维(CC)的含量。
1.2.2 瘤胃降解参数测定采用Nuez-Ortin等[17]方法,准确称取7 g样品放入已称重的尼龙袋(40 μm,10 cm×20 cm)中,在距离上端1.5 cm左右的位置,用橡皮筋扎紧袋口。选用3头装有永久性瘤胃瘘管的健康荷斯坦干奶牛[体重为(625±21) kg]为供体动物,将尼龙袋放入规格为40 cm×50 cm网兜中,于晨饲前放入瘤胃中,分别培养0、2、4、8、12、16、24、36、48 h,每头牛每个时间点每个样本为3个重复,培养结束后,迅速从瘤胃中取出,放入冷水中停止发酵,并用冷水冲洗,直至流水澄清。清洗后的尼龙袋置于65 ℃烘干48 h,记录尼龙袋总重。随后,将尼龙袋内的残渣粉碎过1 mm孔筛,测定其DM和NDF含量,用于测定此2种营养成分的瘤胃降解率。试验牛基础饲粮参照奶牛营养需要NRC(2001)标准进行配制(DM基础),包括羊草(42.7%)、全株玉米青贮(15.8%)、玉米(13.3%)、麦麸(3.8%)、糖蜜(1.0%)、豆粕(3.2%)、干酒糟(5.4%)、棉籽粕(2.1%)、玉米纤维饲料(7.5%)、玉米胚芽粕(5.0%)和预混料(0.5%),每日饲喂2次(08:00和16:00),自由饮水。
瘤胃降解参数利用Ørskov等[18]提出的非线性模型进行估算:
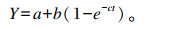
|
式中:Y为尼龙袋在瘤胃中滞留时间t后营养成分的瘤胃消失率(%);a为快速降解部含量(%);b为慢速降解部分含量(%);c为慢速降解部分的降解速率(%/h)。通过假设通过率(k)为4.6%/h来计算饲料样本的瘤胃有效降解率(ED):
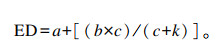
|
式中:a、b和c是上述常数。
1.2.3 光谱数据的采集及分析籽用南瓜副产物(即南瓜籽饼、南瓜籽皮和南瓜果肉)碳水化合物光谱数据的采集在东北农业大学理学院化学分子结构分析实验室进行;利用德国Bruker Alpha-T红外光谱仪收集其碳水化合物分子结构光谱图,每个样本扫描5次,扫描波段在4 000~400 cm-1,分辨率为4 cm-1,扫描次数128次。
用OMNIC 8.2软件(Thermo Nicolet公司,美国)对3种籽用南瓜副产物的红外光谱图进行分析。根据文献确定籽用南瓜副产物中的碳水化合物官能团(包括峰高和峰面积)以及基线位置[19-20]。本试验所采用的参数为:结构性碳水化合物区域(STCHO,基线1 488~1 183 cm-1);纤维复合物区域(CELC,基线1 287~1 183 cm-1);总碳水化合物区域(CHO,基线1 183~870 cm-1)。利用软件中的傅立叶自反卷积(FSD)[19]确定STCHO、CELC和CHO区域的3个峰高位置,然后对红外光谱相关参数进行统计分析。图 1显示了不同籽用南瓜副产物在碳水化合物相关光谱区域(基线1 488~870 cm-1)内的FTIR光谱图。
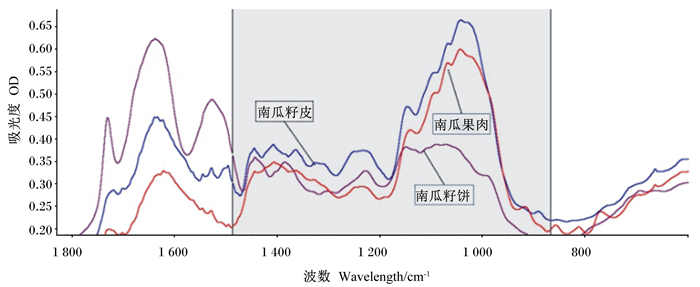
|
图 1 不同籽用南瓜副产物在碳水化合物相关光谱区域(基线1 488~870 cm-1)内的FTIR光谱图 Fig. 1 FTIR spectrum of different by-products of seed pumpkin within carbohydrate related spectral region (ca. 1 488 to 870 cm-1) |
采用SAS 9.4软件中的GLM模块对籽用南瓜副产物(南瓜籽饼、南瓜籽皮和籽用南瓜果肉)的瘤胃降解参数和光谱参数进行数据分析。数据模型为:
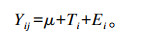
|
式中:Yi为自变量;μ为平均值;Ti为处理效应;Ei为残差值。
多重比较采用Duncan氏法,P < 0.10代表有趋势,P < 0.05代表差异显著,P < 0.01代表差异极显著。根据Pearson相关分析法,利用SAS 9.4的PROC CORR程序,进行籽用南瓜副产物碳水化合物营养成分、瘤胃降解参数和碳水化合物光谱结构参数的相关分析。
2 结果 2.1 籽用南瓜副产物碳水化合物组分含量由表 1可知,DM基础下南瓜籽皮的NDF、ADF、ADL和纤维素的含量最高;而南瓜果肉的starch、NFC和CHO的含量最高。南瓜籽饼的半纤维素含量最高。从CNCPS碳水化合物组分来看,南瓜籽皮CA的含量最低,CC的含量最高;南瓜果肉CA和CB1的含量均最高,CC的含量最低。
|
|
表 1 不同籽用南瓜副产物碳水化合物组分 Table 1 Carbohydrate profiles of different kinds of seed pumpkin by-products |
由表 2可知,南瓜籽饼、南瓜籽皮和南瓜果肉的DM和NDF的瘤胃降解参数均存在显著的差异(P < 0.05)。其中,南瓜果肉的DM快速降解部分、潜在可降解部分、中性洗涤纤维潜在可降解部分均显著高于南瓜籽饼和南瓜籽皮(P < 0.05)。南瓜籽饼的NDF快速降解部分和有效降解率显著高于南瓜籽皮和南瓜果肉(P < 0.05)。南瓜籽饼和南瓜果肉的DM有效降解率无显著差异(P>0.05)。南瓜籽皮的DM和NDF的瘤胃降解参数均显著低于南瓜籽饼和南瓜果肉(P < 0.05)。
|
|
表 2 不同籽用南瓜副产物的瘤胃降解参数 Table 2 Rumen degradation parameters of different kinds of seed pumpkin by-products |
由表 3可知,南瓜籽饼、南瓜籽皮、南瓜果肉3种籽用南瓜副产物的碳水化合物分子结构光谱参数差异显著(P < 0.05)。其中,南瓜果肉在光谱区域(基线1 488~1 183 cm-1)的结构性碳水化合物峰面积(A_STCHO)及出峰区域内的多个亚峰的峰高值都显著高于南瓜籽饼和南瓜籽皮(P < 0.05)。南瓜籽饼和南瓜果肉的纤维复合物相关光谱波段(基线1 287~1 183 cm-1)的峰面积(A_CELC)以及在出峰区域(基线1 226~1 234 cm-1)最高峰峰高都显著低于南瓜籽皮(P < 0.05)。南瓜果肉的总碳水化合物相关波段(基线1 183~870 cm-1)的峰面积(A_CHO)及3个峰的峰高值均显著高于南瓜籽饼和南瓜籽皮(P < 0.05)。在碳水化合物光谱结构比例特点方面,南瓜籽饼分子结构中结构碳水化合物与总碳水化合物峰面积比(A_STCHO/A_CHO)显著低于南瓜籽皮和南瓜果肉,总碳水化合物3个特征峰高间比显著高于南瓜籽皮和南瓜果肉(P < 0.05)。南瓜果肉分子结构中纤维复合物与总碳水化合物峰面积比(A_CELC/A_CHO)、纤维复合物与结构性碳水化合物峰面积比(A_CELC/A_STCHO)都显著低于南瓜籽饼和南瓜籽皮(P < 0.05)。
|
|
表 3 不同籽用南瓜副产物碳水化合物光谱分子结构特点 Table 3 Molecular structural characteristics of carbohydrates of different kinds of seed pumpkin by-products |
由表 4可知,在碳水化合物组分中,NDF、ADF、ADL、纤维素含量与A_CELC呈显著正相关(r=0.96~0.99,P < 0.01)。Starch、NFC含量与A_STCHO、A_CHO呈极显著正相关(r=0.91~0.98,P≤0.01),与A_CELC/A_CHO、A_CELC/A_STCHO呈极显著负相关(r=-0.99~-0.93,P < 0.01)。半纤维素含量与A_STCHO、A_CHO及A_STCHO/A_CHO呈极显著负相关(r=-0.98~-0.93,P≤0.01),与A_CELC/A_STCHO呈极显著正相关(r=0.89,P < 0.01)。CHO含量与A_STCHO、A_CHO及A_STCHO/A_CHO呈极显著正相关(r=0.88~0.98,P≤0.01)。
|
|
表 4 不同籽用南瓜副产物碳水化合物分子结构光谱参数与CNCPS碳水化合物组分、碳水化合物组分及瘤胃降解特性的相关性分析 Table 4 Correlation analysis between carbohydrates molecular structural spectral parameters and CHO fractions partitioned by CNCPS carbohydrate componet, carbohydrate component and rumen degradation characteristics of different kinds of seed pumpkin by-products |
在CNCPS碳水化合物组分中,CA含量与A_CELC、A_CELC/A_CHO呈极显著负相关(r=-0.90~-0.88,P < 0.01)。CB1含量与A_STCHO、A_CHO呈极显著正相关(r=0.97~0.98,P < 0.01),与A_CELC/A_CHO、A_CELC/A_STCHO呈极显著负相关(r=-0.99~-0.93,P≤0.01)。CB2含量与A_CELC、A_CELC/A_CHO及A_CELC/A_STCHO呈极显著正相关(r=0.81~0.94,P≤0.01)。CC含量与A_CHO呈极显著负相关(r=-0.80,P≤0.01),与A_CELC/A_CHO、A_CELC/A_STCHO呈极显著正相关(r=0.91~0.99,P < 0.01)。
2.5 籽用南瓜副产物的碳水化合物分子结构与其DM和NDF瘤胃降解特性之间的相关关系由表 4可知,DMa、DMb、DM(a+b)含量、DMED与A_CELC呈极显著负相关(r=-0.98~-0.83,P < 0.01),DMc与A_STCHO/A_CHO呈极显著负相关(r=-0.91,P < 0.01)。NDFa含量、NDFc与A_STCHO/A_CHO呈极显著负相关(r=-0.90~-0.86,P < 0.01),NDFb、NDF(a+b)含量与A_CELC呈极显著负相关(r=-0.99~-0.97,P < 0.01),NDFED与A_CELC存在极显著负相关(r=-0.89,P < 0.01)。
3 讨论 3.1 籽用南瓜副产物的常规化学成分、CNCPS碳水化合物组分和瘤胃降解参数NDF由纤维素、半纤维素和木质素组成,纤维素、半纤维素在瘤胃中降解较慢,而木质素在瘤胃中不可降解,所以其含量越高,饲粮中有机物、CP和NDF的消化率越低[21-22]。本试验数据表明,南瓜籽皮的NDF、ADF、ADL和纤维素的含量均最高,可为反刍动物饲粮提供一定的粗纤维。据文献报道,非结构性碳水化合物(如单糖、淀粉和果聚糖)能够在瘤胃中迅速降解[22],而NFC的含量越多说明饲粮的能量越高[21]。淀粉和糖是南瓜果肉中的主要营养成分[1],说明南瓜果肉的易发酵碳水化合物含量较高,可以为反刍动物提供较多的能量。南瓜籽饼ADF和ADL的含量与南瓜果肉的含量近似,而NFC和CHO的含量在3种副产品中处于最低水平,说明南瓜籽饼为反刍动物提供的能量有限。但是,南瓜籽饼的粗蛋白质含量较高,有研究发现其所含的限制性氨基酸含量也较丰富[23],是一种优质的蛋白质饲料[1, 5]。
CNCPS碳水化合物组分可以反映饲料中碳水化合物在瘤胃中的降解能力。CNCPS将饲料的碳水化合物划分为4个部分:CA为糖类、CB1为淀粉和果胶、CB2为可利用纤维、CC为不可利用纤维。据报道,CA、CB1和CB2含量较高,CC的含量较低时,说明该饲料在瘤胃中易降解,营养丰富[24-25]。本研究得出,南瓜籽肉CA和CB1的含量均最高,CC的含量最低,说明籽用南瓜果肉在碳水化合物营养方面的价值较高。但有关南瓜果肉在反刍动物营养中应用的报道不多,针对其营养特点和理化特性,需要做更进一步的研究。
饲料中瘤胃快速降解部分含量的减少、不可降解部分含量的增加会降低饲料的瘤胃有效降解率,且DM和NDF的降解程度之间存在相关性[17, 26]。本试验结果显示,南瓜籽皮的DM和NDF快速降解部分的含量最少、不可降解部分的含量最多,因此其瘤胃有效降解率最低。南瓜籽饼和南瓜果肉的DM有效降解率相似,说明南瓜籽饼和南瓜果肉的慢速降解部分相似。NDF的降解特性与纤维素、半纤维素和木质素等饲料中的纤维分布密切相关[9]。因此,这些纤维成分的变化(表 1),特别是木质素含量的变化,导致了籽用南瓜副产物之间NDF有效降解率的差异。由此可见,籽用南瓜副产物碳水化合物成分和CNCPS组分的差异导致了DM和NDF的瘤胃降解参数的不同。
3.2 籽用南瓜副产物的碳水化合物分子结构光谱参数研究饲料中的碳水化合物分子结构特征时,主要研究结构性碳水化合物(STCHO)、纤维复合物(CELC)和总碳水化合物(CHO),揭示光谱分子结构官能团的比值并且与饲料的质量和营养价值密切相关[27]。在STCHO区域内,1 443~1 445 cm-1、1 382~1 410 cm-1和1 304~1 365 cm-1处为STCHO的3个特征峰高,主要与半纤维素和纤维素化合物有关[28]。本试验研究表明,南瓜果肉的STCHO的峰面积以及STCHO中3个峰高值均最高,但是其纤维素和半纤维素的含量较低(表 1),目前,本研究首次用FTIR技术对籽用南瓜副产物分子结构的光谱参数进行测定,所以,并没有其他文献可以作为参考进行数据比较。在STCHO区域内(基线1 488~1 183 cm-1),在1 226~1 234 cm-1处出现1个吸收带,该吸收带为CELC(基线1 287~1 183 cm-1),CELC区域的光谱参数与纤维素化合物的含量有关。纤维复合物的结构差异与反刍动物的消化率密切相关,纤维素化合物的复杂结构会影响饲料在瘤胃中的降解和利用[9]。纤维素复合物的含量越高说明饲料中的纤维含量越高[8]。此外,本研究发现,南瓜籽皮的CELC峰面积显著高于南瓜籽饼和南瓜果肉,这说明南瓜籽皮的纤维含量要显著高于南瓜籽饼和南瓜果肉,与表 1所列数据吻合。在CHO区域内(基线1 183~870 cm-1),CHO的峰面积越大,其碳水化合物、淀粉的含量越高。已有研究表明,碳水化合物分子结构的变化可以影响饲料的营养价值、消化特性和利用率[8]。因此,籽用南瓜副产物碳水化合物分子结构的不同与其生物学的降解特性密切相关,也是造成其不同营养特性和降解规律的主要原因。
3.3 籽用南瓜副产物的碳水化合物分子结构与其营养价值和瘤胃降解特性之间的相关关系一般来说,饲料碳水化合物分子结构与其营养价值之间具有一定的相关关系[28-29]。Xin等[30]的研究发现,CELC和CHO峰强度的变化不仅与常规营养成分高度相关,还与NDF瘤胃降解特性之间存在显著相关关系。Zhang等[28]将不同比例的大麦与小麦DDGS进行混合其碳水化合物分子结构与其营养价值存在相关性。其中,CELC的峰面积与NDF、ADF、ADL、纤维素、CB2和CC含量存在显著正相关,CHO峰面积与半纤维素含量存在显著负相关。Xin等[31]在研究玉米秸秆不同部位的碳水化合物分子结构与其营养价值、瘤胃降解特性之间的相关关系中得出,A_STCHO与半纤维素含量存在极显著负相关,与本试验结果一致。A_CELC峰面积与CB2含量存在极显著负相关,与DM的瘤胃降解参数没有相关性,与本试验结果不同,原因可能是由于饲料的种类不同导致饲料中碳水化合物分子结构的不同,使它们之间的相关性存在差异,也可能与本研究样本量较少有关。本研究发现A_CELC与NDF有效降解率存在极显著负相关,这与Xin等[31]的研究结果一致。由此可见,籽用南瓜副产物的分子结构与其营养价值及瘤胃降解特性之间存在相关关系,分子结构光谱参数有可能作为预测因子对籽用南瓜副产物的营养特性进行预测,从而作为饲料营养价值评定新方法建立的基础。
4 结论① 籽用南瓜副产物(南瓜籽饼、南瓜籽皮、南瓜果肉)的碳水化合物组分均存在差异;其中,南瓜果肉starch、NFC和CHO的含量均为最高,南瓜籽饼半纤维素含量最高,而NDF、ADF、ADL和纤维素含量均低于南瓜籽皮,因此南瓜果肉和南瓜籽饼的营养价值较高。
② 籽用南瓜副产物的碳水化合物分子结构存在差异,且与其营养特性之间存在相关关系。初步证明,可以利用FTIR技术对籽用南瓜副产物的营养价值进行评定。
| [1] |
李洋, 么恩悦, 张广宁, 等. 籽用南瓜副产物用作反刍动物饲料的可行性分析[J]. 动物营养学报, 2019, 31(3): 994-1000. LI Y, YAO E Y, ZHANG G N, et al. Feasibility analysis of by-products of seed pumpkin as a feedstuff source for ruminants[J]. Chinese Journal of Animal Nutrition, 2019, 31(3): 994-1000 (in Chinese). |
| [2] |
李红宇, 许丽. 籽用南瓜果肉用作反刍动物饲料的探讨[J]. 饲料研究, 2017(13): 49-52. LI H Y, XU L. Discussion on using seed pumpkin flesh as feed for ruminants[J]. Feed Research, 2017(13): 49-52 (in Chinese). |
| [3] |
ZDUNCZYK Z, MINAKOWSKI D, FREJNAGEL S, et al. Comparative study of the chemical composition and nutritional value of pumpkin seed cake, soybean meal and casein[J]. Die Nahrung, 1999, 43(6): 392-395. DOI:10.1002/(SICI)1521-3803(19991201)43:6<392::AID-FOOD392>3.0.CO;2-2 |
| [4] |
ANTUNOVIĆ Z, KLIRŽ, ŠPERANDA M, et al. Partial replacement of soybean meal with pumpkin seed cake in lamb diets: effects on carcass traits, haemato-chemical parameters and fatty acids in meat[J]. South African Journal of Animal Science, 2018, 48(4): 695-704. |
| [5] |
KLIR Z, CASTRO-MONTOYA J M, NOVOSELEC J, et al. Influence of pumpkin seed cake and extruded linseed on milk production and milk fatty acid profile in Alpine goats[J]. Animal, 2017, 11(10): 1772-1778. DOI:10.1017/S175173111700060X |
| [6] |
BAKSHI M P S, WADHWA M, MAKKAR H P S. Waste to worth: vegetable wastes as animal feed[J]. CAB Reviews Perspectives in Agriculture Veterinary Science Nutrition and Natural Resources, 2016, 11(12): 1-26. |
| [7] |
ZHANG X W, YU P Q. Differentiation of mixtures of co-product blend with barley grain based on Fourier transform infrared attenuated total reflection molecular spectroscopy: carbohydrate molecular spectral profiles and nutritive characteristics in dairy cattle[J]. Journal of Dairy Science, 2012, 95(11): 6624-6634. DOI:10.3168/jds.2012-5450 |
| [8] |
GHOLIZADEH H, ALI NASERIAN A, XIN H S, et al. Detecting carbohydrate molecular structural makeup in different types of cereal grains and different cultivars within each type of grain grown in semi-arid area using FTIR spectroscopy with uni- and multi-variate molecular spectral analyses[J]. Animal Feed Science and Technology, 2014, 194: 136-144. DOI:10.1016/j.anifeedsci.2014.05.007 |
| [9] |
XIN H S, FALK K C, YU P Q. Studies on Brassica carinata seed.2.Carbohydrate molecular structure in relation to carbohydrate chemical profile, energy values, and biodegradation characteristics[J]. Journal of Agricultural and Food Chemistry, 2013, 61(42): 10127-10134. DOI:10.1021/jf402077g |
| [10] |
ABEYSEKARA S, CHRISTENSEN D A, YU P Q. Characterizations of structural, biochemical, and nutritive profiles in silage among cool-season corn cultivars in relation to heat units (aCHU, dCHU) with curvilinear response and multivariate analyses[J]. Journal of Agricultural and Food Chemistry, 2013, 61(50): 12315-12326. DOI:10.1021/jf403245c |
| [11] |
JONKER A, GRUBER M Y, WANG Y, et al. Foam stability of leaves from anthocyanidin-accumulating Lc-alfalfa and relation to molecular structures detected by fourier-transformed infrared-vibration spectroscopy[J]. Grass and Forage Science, 2012, 67(3): 369-381. DOI:10.1111/j.1365-2494.2012.00853.x |
| [12] |
XIN H S, QU Y L, WU H N, et al. Univariate and multi-variate comparisons of protein and carbohydrate molecular structural conformations and their associations with nutritive factors in typical by-products[J]. Journal of the Science of Food and Agriculture, 2016, 96(14): 4736-4748. DOI:10.1002/jsfa.7791 |
| [13] |
AOAC. Official methods of analysis[S]. 17th ed. Gaithersburg, MD: Association of Official Analytical Chemist, 2000.
|
| [14] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [15] |
NRC. Nutrient requirements of dairy cattle[S]. 7th ed. Washington D.C. : The National Academies Press, 2001.
|
| [16] |
SNIFFEN C J, O'CONNOR J D, VAN SOEST P J, et al. A net carbohydrate and protein system for evaluating cattle diets: Ⅱ.Carbohydrate and protein availability[J]. Journal of Animal Science, 1992, 70(11): 3562-3577. DOI:10.2527/1992.70113562x |
| [17] |
NUEZ-ORTÍN W G, YU P Q. Estimation of ruminal and intestinal digestion profiles, hourly effective degradation ratio and potential N to energy synchronization of co-products from bioethanol processing[J]. Journal of the Science of Food and Agriculture, 2010, 90(12): 2058-2067. DOI:10.1002/jsfa.4052 |
| [18] |
ORSKOV E R, HOVELL F D, MOULD F. The use of the nylon bag technique for the evaluation of feedstuffs[J]. Tropical Animal Production, 1980, 5(3): 195-213. |
| [19] |
XIN H S, ZHANG Y G, WANG M J, et al. Characterization of protein and carbohydrate mid-IR spectral features in crop residues[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 129: 565-571. DOI:10.1016/j.saa.2014.03.009 |
| [20] |
LIU N, YU P Q. Characterization of the microchemical structure of seed endosperm within a cellular dimension among six barley varieties with distinct degradation kinetics, using ultraspatially resolved synchrotron-based infrared microspectroscopy[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7801-7810. DOI:10.1021/jf101233n |
| [21] |
PRATES L L, REFAT B, LEI Y G, et al. Relationship of carbohydrates and lignin molecular structure spectral profiles to nutrient profile in newly developed oats cultivars and barley grain[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 188: 495-506. DOI:10.1016/j.saa.2017.07.042 |
| [22] |
BELANCHE A, WEISBJERG M R, ALLISON G G, et al. Measurement of rumen dry matter and neutral detergent fiber degradability of feeds by Fourier-trans form infrared spectroscopy[J]. Journal of Dairy Science, 2014, 97(4): 2361-2375. DOI:10.3168/jds.2013-7491 |
| [23] |
周爽, 么恩悦, 苏阔轩, 等. 应用康奈尔净碳水化合物-蛋白质体系法和尼龙袋法评价麦芽根和南瓜籽饼的营养价值[J]. 动物营养学报, 2019, 31(10): 4885-4892. ZHOU S, YAO E Y, SU K X, et al. Nutritional value of malt root and pumpkin seed cake evaluated by Cornell net carbohydrate and protein system and nylon bag technique[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4885-4892 (in Chinese). |
| [24] |
李岩, 孟庆翔, 陈万宝, 等. 应用CNCPS方法和体外产气法研究豆腐渣饲料的营养价值[J]. 中国畜牧兽医, 2017, 44(5): 1355-1362. LI Y, MENG Q X, CHEN W B, et al. Evaluation of the nutritional value of soybean curb residues by Cornell net carbohydrate and protein system and gas production technique[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(5): 1355-1362 (in Chinese). |
| [25] |
张学燕, 崔占鸿, 孙璐, 等. 利用体外产气法及CNCPS体系评定豆渣、菜籽粕的营养价值[J]. 青海畜牧兽医杂志, 2017, 47(3): 18-22. HANG X Y, CUI Z H, SUN L, et al. Evaluation on nutritional value of soybean residue and rapeseed meal by using in vitro gas production and the CNCPS system[J]. Qinghai Journal of Animal Husbandry and Veterinary medicine, 2017, 47(3): 18-22 (in Chinese). DOI:10.3969/j.issn.1003-7950.2017.03.007 |
| [26] |
VARGA G A, HOOVER W H. Rate and extent of neutral detergent fiber degradation of feedstuffs in situ[J]. Journal of Dairy Science, 1983, 66(10): 2109-2115. DOI:10.3168/jds.S0022-0302(83)82057-8 |
| [27] |
YU P Q, MCKINNON J J, CHRISTENSEN C R, et al. Chemical imaging of microstructures of plant tissues within cellular dimension using synchrotron infrared microspectroscopy[J]. Journal of Agricultural and Food Chemistry, 2003, 51(20): 6062-6067. DOI:10.1021/jf034654d |
| [28] |
ZHANG X W, YU P Q. Relationship of carbohydrate molecular spectroscopic features in combined feeds to carbohydrate utilization and availability in ruminants[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2012, 92: 225-233. DOI:10.1016/j.saa.2012.01.070 |
| [29] |
JI C Y, ZHANG X W, YAN X G, et al. Bio-functions and molecular carbohydrate structure association study in forage with different source origins revealed using non-destructive vibrational molecular spectroscopy techniques[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2017, 183: 260-266. DOI:10.1016/j.saa.2017.04.065 |
| [30] |
XIN H S, ZHANG X W, YU P Q. Using synchrotron radiation-based infrared microspectroscopy to reveal microchemical structure characterization: frost damaged wheat vs.normal wheat[J]. International Journal of Molecular Sciences, 2013, 14(8): 16706-16718. DOI:10.3390/ijms140816706 |
| [31] |
XIN H S, DING X, ZHANG L Y, et al. Investigation of the spectroscopic information on functional groups related to carbohydrates in different morphological fractions of corn stover and their relationship to nutrient supply and biodegradation characteristics[J]. Journal of Agricultural and Food Chemistry, 2017, 65(20): 4035-4043. DOI:10.1021/acs.jafc.7b00231 |




