乳脂肪是牛奶重要营养组成,是膳食脂肪来源。乳脂肪中含有400种以上脂肪酸,其中不乏功能性脂肪酸,如多不饱和脂肪酸、短链脂肪酸等,同时含有具有潜在健康危害的中长链饱和脂肪酸[1]。因此,调控乳脂肪组成与产量对改善乳及乳制品营养品质,并以此平衡饲养效率具有重要意义。乳脂肪是乳成分中最易变化的组分,科学家在此特性上获得了充分的试验证据,主要包括提高乳脂率和乳脂产量或与其相反降低乳脂率(乳脂降低综合征),以及针对性提高功能性脂肪酸含量或降低有潜在危害脂肪酸的比例等方面[2]。
甘油三酯是天然脂肪的主要存在形式,占乳脂肪95%以上,乳脂肪内甘油三酯的结构特点对其膳食营养价值和产品加工工艺有重要意义[2]。近年在人脂肪营养的研究中发现,除脂肪酸组成外,脂肪酸在甘油三酯中的酯化位置对于脂肪和脂肪酸在体内的消化、吸收和代谢途径及代谢效率同样具有决定性作用[3]。因此,从人膳食健康角度考虑,了解牛奶脂肪中甘油三酯结构特点及其合成代谢的影响因素是必要的。乳腺合成乳脂肪过程中甘油三酯酯化反应是必经途径,脂肪酸在此过程中被分配于甘油骨架上。该反应的发生、发生的程度和产物的结构决定乳脂肪的组成、产量及其理化特性。以往的研究虽然认为哺乳动物乳腺内合成甘油三酯时酯化位置具有一定的特异性和保守性,但就奶牛而言,该“特异性和保守性”的范围随乳脂肪组成和产量的变化而发生的变化更为复杂。因此,本文综述了甘油三酯脂肪酸酯化位置结构检测方法与营养意义、牛奶甘油三酯脂肪酸酯化位置结构特点、乳腺合成代谢甘油三酯及其对牛奶甘油三酯结构特点的影响方面的研究进展,并讨论了未来研究趋势,以期为相关领域的研究提供参考。
1 甘油三酯脂肪酸酯化位置结构检测方法与营养意义 1.1 检测方法甘油三酯是天然油脂的主要存在形式,是1分子甘油的3个羟基位分别与3分子脂肪酸羧基位逐一发生酯化反应的产物。酯化的空间结构位置排序(stereo-specifically numbered,sn)分别以sn-1、sn-2和sn-3表示(图 1)。
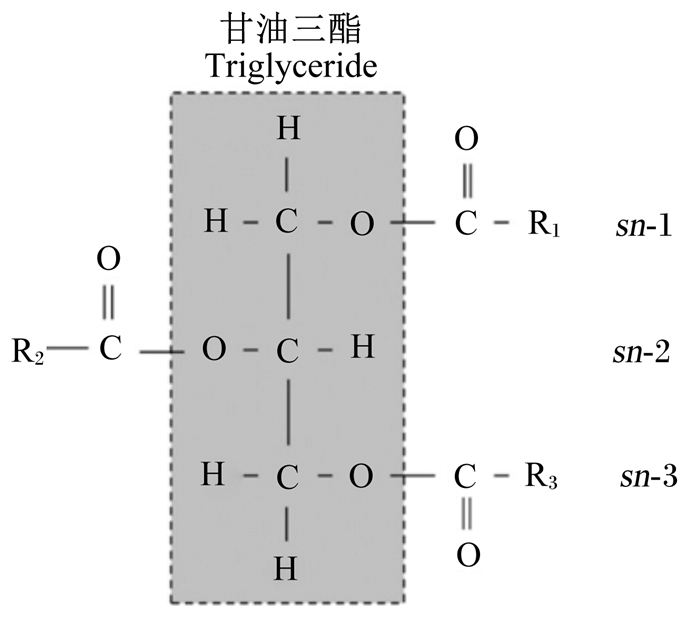
|
R表示脂肪酸,R1、R2、和R3表示脂肪酸分别在sn-1、sn-2和sn-3位酯化。 R represented fatty acids, and R1, R2 and R3 showed that the fatty acids were esterified on the sites of sn-1, sn-2 and sn-3, respectively. 图 1 甘油三酯结构图 Fig. 1 Triglyceride structure chart |
由于检测繁琐以及定量不准确等因素,天然油脂(包括乳脂肪)甘油三酯脂肪酸酯化位置结构特点一直没有得到广泛的分析研究。随分析化学检测技术及合成甘油三酯异构体工业技术的发展,甘油三酯脂肪酸酯化位置分布的检测技术也不断得以改进,操作方法趋于简便。目前检测天然油脂中甘油三酯脂肪酸酯化位置分布的方法主要有脂肪酶法、磷脂酶A2法、衍生化试剂法、高效液相色谱(HPLC)法、核磁共振定量检测法等。其中反向高效液相色谱(RP-HPLC)法、专一性脂肪酶法以及二者结合的方法可有效地定性和定量检测脂肪酸酯化位置分布[4-5]。近年的研究报道,超高效液相色谱联用三倍四级质谱仪(UPLC-QQQ)或超临界流体色谱联用飞行时间质谱(SFC-MC)可提高甘油三酯脂肪酸酯化位置结构的检测时效[6-7]。另外,磷核磁共振可定量检测部分酯化甘油酯,而碳核磁共振可检测甘油酯脂肪酸酯化位置结构[8]。
1.2 营养意义甘油三酯的结构会影响油脂的理化特性及营养生理功能。近年围绕甘油三酯脂肪酸不同酯化位置影响婴儿对脂肪消化吸收的研究较为深入。Innis等[3, 9-10]指出,人母乳甘油三酯内C16 ∶ 0特异结合于sn-2,这样的结构不仅能够防止婴儿C16 ∶ 0吸收缺乏,同时在肠道和其他组织中当C18 ∶ 1cis-9增加时可节约C16 ∶ 0的释放,从而维持脂肪的有效吸收利用,保证高效的能量正平衡,以维持婴儿组织的净生长。此外,研究指出sn-2位的脂肪酸与婴儿肠道微生物区系的形成密切相关,其中sn-2位的C16 ∶ 0和C22 ∶ 6n-3(DHA)与多数肠道微生物相关[11-12]。
在成人脂肪营养相关研究中发现,甘油三酯脂肪酸酯化位置结构也会显著影响脂肪酸的消化、吸收与代谢。长链脂肪酸在甘油三酯外侧(sn-1或sn-3)时,会降低该脂肪酸乃至甘油三酯上的其他脂肪酸的消化、吸收与代谢[13]。研究发现,甘油三酯上脂肪酸酯化位置影响试验小鼠体内脂肪酸的降解速率,sn-2位的棕榈酸、油酸和亚麻酸相较于sn-1和sn-3位较慢被降解,而sn-2位的C20 ∶ 5n-3(EPA)较快被降解,DHA的降解速度不受酯化位置的影响[14]。体外胰脂肪酶水解试验发现游离脂肪酸的释放速率受不同油脂及脂肪酸甘油三酯酯化位置结构的影响[15]。在大鼠上的试验得知sn-2位的DHA相较于sn-1和sn-3位消化率高[16],sn-3位的EPA可降低小鼠肝脏中甘油三酯含量,降低动脉壁炎症的发生率[17]。
脂肪酸在甘油三酯上的不同酯化位置也会影响脂肪的加工及其他特性,从而间接影响营养品质。研究发现,甘油三酯脂肪酸酯化位置结构影响奶酪和奶油的物理特性和风味[18]及皮下脂肪的滑动性(slip point)和硬度[19],此外sn-3位的乙酸甘油酯(acTAG)可降低脂肪的黏稠度和热值[20]。植物油脂肪酸的氧化稳定性与甘油三酯脂肪酸酯化位置结构相关,如sn-2位亚油酸的氧化稳定性高于sn-1和sn-3位[21];另有研究表明牛乳脂肪中的共轭亚油酸在甘油三酯的sn-2位酯化相对sn-1(或sn-3)位拥有更高的氧化稳定性[22]。此外,也有研究报道甘油三酯脂肪酸酯化位置结构与抗微生物特性相关,如sn-1和sn-2位的肉豆蔻酸甘油单酯均具有抗菌和抗真菌作用,且sn-1位强于sn-2位[23]。
2 牛奶甘油三酯脂肪酸酯化位置结构特点通过对乳脂肪甘油三酯脂肪酸酯化位置的检测发现,人母乳脂肪酸在甘油三酯内的结合位置存在较高的保守性,即饱和脂肪酸,尤其是C16 ∶ 0,特异结合在中心位置sn-2位上,而不饱和脂肪酸结合在外侧位置sn-1和sn-3位上[6],然而,Jensen等[24]报道,牛奶甘油三酯上脂肪酸的结合位置却并未呈现此规律(表 1)。早期研究针对不同牛群来源乳脂肪以及采集季节对牛奶甘油三酯内脂肪酸的结合位置进行了分析,虽然得出的结论是牛奶中脂肪酸在甘油三酯上的酯化位置并非随机,而是存在一定的特异性,并有学者推论,乳腺内合成甘油三酯时对脂肪酸具有特异的选择性,并不受饲粮养分的影响,即脂肪的变化局限于甘油三酯数量的改变而不是其结构的变化[25]。但是,其他研究却发现牛奶甘油三酯结构变异较为宽泛[26]。Fox等[27]总结了目前已知的牛奶甘油三酯的结构特性,并推论C12~C16首要酯化于sn-2位,而C4和C6首要酯化在sn-3位;C4和C18的含量可能从底物角度具有限速酯化作用,以保持乳脂肪在正常牛体温条件下呈现液态的需求。然而对于一些微量具生物活性功能的脂肪酸,如多不饱和脂肪酸的报道较少,其他物种油脂,如植物籽实油脂中的C18 ∶ 4n-3和γ-亚麻酸主要酯化在甘油三酯的sn-2位[28]。同位素标记法研究表明,海洋原生生物合成的极长链多不饱和脂肪酸(VLCPUFA)首先酯化于磷脂,其次酯化于甘油三酯的sn-2位[29]。
|
|
表 1 人奶和牛奶中长链脂肪酸在甘油三酯中的酯化位置 Table 1 Esterification positions of long-chain fatty acids in triglyceride in human milk and bovine milk[9, 24] |
了解乳成分前体物脂肪酸在牛乳腺酯化为甘油三酯的特点与规律可提升该营养途径调控的准确性。近年在奶牛乳脂肪调控方面的研究证实,乳脂肪是乳成分中最易变化的组分。通过饲粮调控,乳脂率可产生上下3%的变化,Meta分析结果表明随奶牛十二指肠十八碳脂肪酸流量增加,乳中相应脂肪酸产量均呈现线性或二次曲线升高[30]。另外,通过过瘤胃处理或直接瘤胃后灌注脂肪(或脂肪酸)的研究表明,除乳脂肪含量变化明显外,脂肪酸组成也变化显著,如亚油酸在乳脂肪中的比例由原来的19%升高至57%,亚麻酸的比例由0.6%升高至25.0%[31-32]。大量研究表明,乳腺对长链脂肪酸的摄取量升高时内源从头合成脂肪酸的总量就会随之降低[30-32],所以如果不降低总甘油三酯产量,而要提高某种脂肪酸的含量,那么在乳腺合成甘油三酯时,该脂肪酸就必须抢占更多酯化位置,但此规律与调控因素的研究暂无报道。
3.2 乳腺甘油三酯合成关键酶与调控乳腺合成乳脂肪过程是营养底物与乳腺泌乳生理调控之间的平衡过程。平衡的水平表现于乳脂肪产量、含量与组成。乳腺内泌乳代谢效率与其调节作用决定了乳脂肪甘油三酯的结构和甘油三酯中总的酰基碳数(CN)(通常在26~54)[27]。反之,通过乳脂肪甘油三酯结构和甘油三酯内CN可反馈泌乳代谢效率与调节作用的表现。因此,了解二者的相关互作规律至关重要。
血浆中富含甘油三酯的乳糜微粒(CM)和极低密度脂蛋白(VLDL)是乳腺摄取长链脂肪酸的主要来源,而中短链脂肪酸主要源于乳腺内从头合成[33-34]。哺乳动物乳腺合成甘油三酯主要通过三磷酸甘油途径,暂无证据表明可由单酰甘油途径酯化脂肪酸合成乳脂肪[27, 35]。催化三磷酸甘油途径合成甘油三酯的相关酶关联于内质网和线粒体膜内外,研究发现在内质网上形成的初级脂滴内仍有较高的相关酶活性[33, 36]。三磷酸甘油途径主要由脂酰辅酶A: sn-3-磷酸甘油酰基转移酶(glycerol-3-phosphate acyltransferases,GPATs)、1-乙酰甘油-3-磷酸酰基转移酶(1-acylglycerol-3-phosphate acyltransferases,AGPATs)、磷脂酸磷酸酶(lipin phosphatidic acid phosphatase,PAP)和二甘油酯酰基转移酶(diacylglycerol acyltransferases,DGATs)等序列式催化酶系组成[27, 33]。目前在各组织细胞,包括乳腺细胞内质网上,三磷酸甘油途径合成甘油三酯的酶催化过程和调控机制已了解地较为明晰,但在初级脂小滴内的催化过程和调控机制鲜有报道[33]。
三磷酸甘油的酰基反应是乳腺合成甘油三酯的第1个关键步骤,三磷酸甘油源于糖酵解途径或者血液中的游离甘油代谢途径[27]。该反应的关键酶是GPATs,它是甘油三酯合成过程中活性最低的酰基转移酶,同时具有甘油三酯合成的限速调控作用[33]。虽然多数组织中微粒体GPATs是总GPATs活性的主要组成,并由磷酸化和去磷酸化作用激活或抑制,但甘油三酯合成中的该调节机制还尚不明确[34]。GPATs和AGPTAs使脂肪酸酯化于sn-1和sn-2位,即合成1,2甘油二酯-sn-3-磷酸,该磷脂酸占据生物合成脂类的中心,可进一步转化为胞嘧啶二磷酸-甘油二酯,作为酸性磷脂类的前体物,亦或去磷酸化生成甘油三酯的主要前体物甘油二酯、磷脂酰丝氨酸、磷酸卵磷脂和磷脂酰乙醇胺[34]。GPATs的活性受营养底物和激素的调控,如脂肪细胞分化可增强其翻译水平,同时受饥饿和采食以及磷酸化和去磷酸化的反馈调节[34]。在甘油三酯的合成中,磷脂酸的去磷酸化反应需要磷脂酸磷酸酯酶-1(PAP-1),该酶由胞浆运行至有脂肪酸和脂酰辅酶A的内质网,肝脏中该酶的活性受胰高血糖素、糖皮质激素、环腺苷酸(cAMP)和生长激素的刺激活化,而受胰岛素抑制[33-34]。体外山羊乳腺细胞培养研究发现,短链脂肪酸中丙酸和丁酸可上调AGPAT6的表达,从而提高甘油三酯合成量[37]。另有多项研究报道,在多个物种中,油酸被GATPs催化后主要酯化于sn-1位,而棕榈酸被首要酯化于sn-2位,但在奶牛乳腺中发现棕榈酸在sn-1和sn-2位的酯化数量相当[5, 24, 38]。在较早的研究报道中指出泌乳奶牛乳腺中AGPATs可将C8~C18转移至sn-2位,而不转移C4~C6[39]。
DGATs酯化长链和短链脂肪酸于sn-3位[27]。研究指出,缺乏DGAT-1基因的小鼠不具备泌乳功能[40];同样,在植物合成甘油三酯过程中发现DGAT-1是重要的限速酶[41]。对DGATs活性的调控在动物肝脏和脂肪组织中已有报道,但关于乳腺组织中的相关信息仍不明确。脂肪酸含量升高会提高该酶的表达,由此推测,在乳腺组织中该酶可能具有较高活性[27]。近年的研究表明在反刍动物乳腺组织或乳中体细胞内均可检测到DGATs基因表达,并随着底物脂肪酸的不同,该酶表达发生变化,初步证实了上述推测[37, 42]。在山羊乳腺细胞培养体系中添加短链脂肪酸时DGAT-1表达上调,并且伴随甘油三酯合成量增加,其中丙酸和丁酸的该作用更显著[37]。另有研究表明,通过在泌乳奶牛饲粮中添加富含长链不饱和脂肪酸的油脂(大豆油或鱼油),可提高血液多不饱和脂肪酸含量,并可下调乳腺来源体细胞内DGAT-1基因的表达[42]。
4 小结甘油三酯脂肪酸酯化位置结构与脂肪酸组成共同影响乳脂肪的营养特性。在甘油三酯合成代谢过程中,牛乳腺根据底物脂肪酸种类、数量、比例等不同条件,可相对灵活的调节其代谢程度和方向,从而合成不同结构的甘油三酯产物,进而影响乳脂肪的营养与加工等特性。但目前有关牛乳腺合成不同结构甘油三酯的规律及其与底物的互作尚不清晰。此外,乳腺细胞内甘油三酯合成关键酶的研究在逐步明朗,这为进一步研究奶牛乳腺细胞甘油三酯合成代谢提供了线索以及观测目标。但在不同营养底物条件下,特别是血液来源脂肪酸前体物供给发生变化时,这些关键酶的活性及调节途径的变化规律有待进一步研究总结。
| [1] |
JENKINS T C, MCGUIRE M A. Major advances in nutrition: impact on milk composition[J]. Journal of Dairy Science, 2006, 89(4): 1302-1310. DOI:10.3168/jds.S0022-0302(06)72198-1 |
| [2] |
BAUMAN D E, MATHER I H, WALL R J, et al. Major advances associated with the biosynthesis of milk[J]. Journal of Dairy Science, 2006, 89(4): 1235-1243. DOI:10.3168/jds.S0022-0302(06)72192-0 |
| [3] |
INNIS S M, NELSON C M. Dietary triacyglycerols rich in sn-2 palmitate alter post-prandial lipoprotein and unesterified fatty acids in term infants[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2013, 89(4): 145-151. DOI:10.1016/j.plefa.2013.03.003 |
| [4] |
王贞瑜. 牛乳脂肪中甘油三酯Sn-2位棕榈酸检测方法的研究[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2012. WANG Z Y. Study on the determination of Sn-2 palmitic acid in the milk triglyceride[D]. Master's Thesis. Harbin: Northeast Agricutral University, 2012. (in Chinese) |
| [5] |
CHRISTIE W W, HAN X L. Chapter12-positional distributions of fatty acids in glycerolipids[M]//CHRISTIE W M, HAN X L. Lipid analysis. 4th ed. New York: Woodhead Publishing, 2012: 261-273.
|
| [6] |
GIUFFRIDA F, MARMET C, TAVAZZI I, et al. Quantification of 1, 3-olein-2-palmitin (OPO) and palmitic acid in sn-2 position of triacylglycerols in human milk by liquid chromatography coupled with mass spectrometry[J]. Molecules, 2018, 24(1): 22. DOI:10.3390/molecules24010022 |
| [7] |
TU A Q, DU Z X, QU S P. Rapid profiling of triacylglycerols for identifying authenticity of edible oils using supercritical fluid chromatography-quadruple time-of-flight mass spectrometry combined with chemometric tools[J]. Analytical Methods, 2016, 8(21): 4226-4238. DOI:10.1039/C6AY00970K |
| [8] |
VAFAEI N, ESKIN M N A, REMPEL C B, et al. Interesterification of soybean oil with propylene glycol in supercritical carbon dioxide and analysis by NMR spectroscopy[J]. Applied Biochemistry and Biotechnology, 2020, 191(3): 905-920. DOI:10.1007/s12010-019-03200-0 |
| [9] |
INNIS S M. Dietary triacylglycerol structure and its role in infant nutrition[J]. Advances in Nutrition, 2011, 2(3): 275-283. DOI:10.3945/an.111.000448 |
| [10] |
INNIS S M. Palmitic acid in early human development[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(12): 1952-1959. DOI:10.1080/10408398.2015.1018045 |
| [11] |
WANG X S, ZOU S, MIU Z C, et al. Enzymatic preparation of structured triacylglycerols with arachidonic and palmitic acids at the sn-2 position for infant formula use[J]. Food Chemistry, 2019, 283: 331-337. DOI:10.1016/j.foodchem.2019.01.057 |
| [12] |
JIANG T M, LIU B, LI J F, et al. Association between sn-2 fatty acid profiles of breast milk and development of the infant intestinal microbiome[J]. Food & Function, 2018, 9(2): 1028-1037. |
| [13] |
ALFIERI A, IMPERLINI E, NIGRO E, et al. Effects of plant oil interesterified triacylglycerols on lipemia and human health[J]. International Journal of Molecular Sciences, 2017, 19(1): 104. DOI:10.3390/ijms19010104 |
| [14] |
YOSHINAGA K, BEPPU F, YAMATANI Y, et al. Examination of the catabolic rates of 13C-labeled fatty acids bound to the alpha and beta positions of triacylglycerol using 13CO2 expired from mice[J]. Journal of Oleo Science, 2019, 68(6): 591-598. DOI:10.5650/jos.ess19012 |
| [15] |
YE Z, LI R Z, CAO C, et al. Fatty acid profiles of typical dietary lipids after gastrointestinal digestion and absorbtion: a combination study between in-vitro and in-vivo[J]. Food Chemistry, 2019, 280: 34-44. DOI:10.1016/j.foodchem.2018.12.032 |
| [16] |
LINDERBORG K M, KULKARNI A, ZHAO A, et al. Bioavailability of docosahexaenoic acid 22:6(n-3) from enantiopure triacylglycerols and their regioisomeric counterpart in rats[J]. Food Chemistry, 2019, 283: 381-389. DOI:10.1016/j.foodchem.2018.12.130 |
| [17] |
ZHANG L Y, DING L, SHI H H, et al. Eicosapentaenoic acid in the form of phospholipids exerts superior anti-atherosclerosis effects to its triglyceride form in ApoE-/- mice[J]. Food & Function, 2019, 10(7): 4177-4188. |
| [18] |
JENSEN R G. The composition of bovine milk lipids: January 1995 to December 2000[J]. Journal of Dairy Science, 2002, 85(2): 295-350. DOI:10.3168/jds.S0022-0302(02)74079-4 |
| [19] |
SEGURA J, ESCUDERO R, DE ÁVILA M D R, et al. Effect of fatty acid composition and positional distribution within the triglyceride on selected physical properties of dry-cured ham subcutaneous fat[J]. Meat Science, 2015, 103: 90-95. DOI:10.1016/j.meatsci.2015.01.008 |
| [20] |
GAJDOŠ P, HAMBALKO J, NICAUD J M, et al. Overexpression of diacylglycerol acetyltransferase from Euonymus europaeus in Yarrowia lipolytica leads to the production of single-cell oil enriched with 3-acetyl-1, 2-diacylglycerols[J]. Yeast, 2020, 37(1): 141-147. DOI:10.1002/yea.3442 |
| [21] |
ZHANG Z S, ZHANG L X, XIE Q F, et al. Effect of accelerated storage on fatty acids, thermal properties and bioactive compounds of kenaf seed oil[J]. Journal of Food Science, 2019, 84(8): 2121-2127. DOI:10.1111/1750-3841.14653 |
| [22] |
YAMAMOTO Y, IMORI Y, HARA S. Oxidation behavior of triacylglycerol containing conjugated linolenic acids in sn-1(3) or sn-2 position[J]. Journal of Oleo Science, 2014, 63(1): 31-37. DOI:10.5650/jos.ess13129 |
| [23] |
JUMINA, NURMALA A, FITRIA A, et al. Monomyristin and monopalmitin derivatives: synthesis and evaluation as potential antibacterial and antifungal agents[J]. Molecules, 2018, 23(12): 3141. DOI:10.3390/molecules23123141 |
| [24] |
JENSEN R G, NEWBURG D S. Bovine milk lipids[M]. .
|
| [25] |
GRESTI J, BUGAUT M, MANIONGUI C, et al. Composition of molecular species of triacylglycerols in bovine milk fat[J]. Journal of Dairy Science, 1993, 76(7): 1850-1869. DOI:10.3168/jds.S0022-0302(93)77518-9 |
| [26] |
KAYLEGIAN K E, LINDSAY R C. Milk fat usage and modification[M]. .
|
| [27] |
FOX P F, UNIACKE-LOWE T, MCSWEENEY P L H, et al. Dairy chemistry and biochemistry[M]. Switzerland: Springer, 2015.
|
| [28] |
PRASAD P, SAVYASACHI S, REDDY L P A, et al. Physico-chemical characterization, profiling of total lipids and triacylglycerol molecular species of omega-3 fatty acid rich B. arvensis seed oil from India[J]. Journal of Oleo Science, 2019, 68(3): 209-223. DOI:10.5650/jos.ess18219 |
| [29] |
ZHAO X M, QIU X. Very long chain polyunsaturated fatty acids accumulated in triacylglycerol are channeled from phosphatidylcholine in Thraustochytrium[J]. Frontiers in Microbiology, 2019, 10: 645. DOI:10.3389/fmicb.2019.00645 |
| [30] |
PRADO L A, SCHMIDELY P, NOZIÈRE P, et al. Milk saturated fatty acids, odd- and branched-chain fatty acids, and isomers of C18:1, C18:2, and C18:3n-3 according to their duodenal flows in dairy cows: a meta-analysis approach[J]. Journal of Dairy Science, 2019, 102(4): 3053-3070. DOI:10.3168/jds.2018-15194 |
| [31] |
MARQUES J A, DEL VALLE T A, GHIZZI L G, et al. Increasing dietary levels of docosahexaenoic acid-rich microalgae: ruminal fermentation, animal performance, and milk fatty acid profile of mid-lactating dairy cows[J]. Journal of Dairy Science, 2019, 102(6): 5054-5065. DOI:10.3168/jds.2018-16017 |
| [32] |
KLIEM K E, REYNOLDS C K, HUMPHRIES D J, et al. Incremental effect of a calcium salt of cis-monounsaturated fatty acids supplement on milk fatty acid composition in cows fed maize silage-based diets[J]. Journal of Dairy Science, 2013, 96(5): 3211-3221. DOI:10.3168/jds.2012-6211 |
| [33] |
WANG H, AIROLA M V, REUE K. How lipid droplets "TAG" along: glycerolipid synthetic enzymes and lipid storage[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2017, 1862(10): 1131-1145. DOI:10.1016/j.bbalip.2017.06.010 |
| [34] |
COLEMAN R A, LEE D P. Enzymes of triacylglycerol synthesis and their regulation[J]. Progress in Lipid Research, 2004, 43(2): 134-176. DOI:10.1016/S0163-7827(03)00051-1 |
| [35] |
CHRISTIE W W. Structure of the triacyl-sn-glycerols in the plasma and milk of the rat and rabbit[J]. Journal of Dairy Research, 1985, 52(1): 219-222. DOI:10.1017/S0022029900024055 |
| [36] |
FARESE R V, J r, WALTHER T C. Lipid droplets go nuclear[J]. The Journal of Cell Biology, 2016, 212(1): 7-8. DOI:10.1083/jcb.201512056 |
| [37] |
SUN Y T, LUO J, ZHU J J, et al. Effect of short-chain fatty acids on triacylglycerol accumulation, lipid droplet formation and lipogenic gene expression in goat mammary epithelial cells[J]. Animal Science Journal, 2016, 87(2): 242-249. DOI:10.1111/asj.12420 |
| [38] |
COOPER S M, GRIGOR M R. Fatty acid specificities of microsomal acyltransferase esterifying positions-1 and -2 of acylglycerols in mammary glands from lactating rats[J]. The Biochemical Journal, 1980, 187(2): 289-295. DOI:10.1042/bj1870289 |
| [39] |
MARSHALL M O, KNUDSEN J. Biosynthesis of triacylglycerols containing short-chain fatty acids in lactating cow mammary gland[J]. European Journal of Biochemistry, 1977, 81(2): 259-266. DOI:10.1111/j.1432-1033.1977.tb11947.x |
| [40] |
SMITH S J, CASES S, JENSEN D R, et al. Obesity resistance and multiple mechanisms of triglyceride synthesis in mice lacking Dgat[J]. Nature Genetics, 2000, 25(1): 87-90. DOI:10.1038/75651 |
| [41] |
SUN B C, GUO X J, FAN C M, et al. Newly identified essential amino acids affecting Chlorella ellipsoidea DGAT1 function revealed by site-directed mutagenesis[J]. International Journal of Molecular Sciences, 2018, 19(11): 3462. DOI:10.3390/ijms19113462 |
| [42] |
VARGAS-BELLO-PÉREZ E, CANCINO-PADILLA N, GELDSETZER-MENDOZA C, et al. Effects of dietary polyunsaturated fatty acid sources on expression of lipid-related genes in bovine milk somatic cells[J]. Scientific Reports, 2020, 10: 14850. DOI:10.1038/s41598-020-71930-x |



