2. 华南农业大学动物科学学院, 广东省动物营养与调控重点实验室, 广州 510642
2. Guangdong Key Laboratory of Animal Nutrition and Regulation, College of Animal Science, South China Agricultural University, Guangzhou 510642, China
白藜芦醇(3, 4, 5-三羟二苯乙烯)是一种生物活性强的天然多酚类化合物,20世纪40年代首次从白藜芦根中分离出来,广泛存在于葡萄、李子、浆果和花生等植物中,是植物对包括紫外线辐射、化学毒素、真菌及细菌感染在内的多种有害环境刺激产生的反应产物。白藜芦醇具有不同的官能团,包括酚羟基、芳香环和1个双键,这些官能团为白藜芦醇改性为具有更多样化疗效的活性衍生物提供了巨大的潜力。研究表明,白藜芦醇及其代谢衍生物均有抗氧化、抗炎症等促进健康的多种功能,并能有效预防如心血管疾病、糖尿病、衰老、神经变性和癌症等疾病[1]。近年来,畜牧行业对其的研究也越来越多,因此,本文综述了白藜芦醇的代谢、白藜芦醇及其代谢衍生物的生物学功能、分子调控机制以及在畜牧生产中的研究进展,旨在为进一步促进白藜芦醇及其代谢衍生物在动物生产上的应用提供参考。
1 白藜芦醇在机体的代谢过程及其代谢衍生物的研究进展白藜芦醇在疾病预防中的作用不可忽视,但有关其在体内生物利用度和代谢的信息尚不完整,其代谢物的结构和通路尚不十分清楚。白藜芦醇的相对分子质量为228.247,在机体内被代谢成共轭硫酸盐、葡萄糖醛酸苷等,其中反式白藜芦醇-3-O-葡萄糖醛酸苷和反式白藜芦醇-3-O-硫酸盐是白藜芦醇最丰富的代谢物。肠道是消化吸收营养物质及防止摄入潜在有害的化合物的主要器官。白藜芦醇在动物肠道内被视为异源物质,通过肠上皮细胞到达血液[2],因而白藜芦醇第1个代谢位点是肠上皮细胞[3]。
1.1 组织器官中的代谢小肠细胞吸收白藜芦醇后,通过磺基转移酶家族1A成员1(sulfotransferase family 1A member 1,SULT1A1)及UDP葡萄糖醛酸转移酶家族1成员A1(UDP glucuronosyltransferase family 1 member A1,UGT1A1)对其分别进行硫酸化和葡萄糖醛酸化。缀合的白藜芦醇通过顶膜上的抗乳腺癌蛋白(breast cancer resistance protein,BRCP)、多药耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)及基底外侧膜上的多药耐药相关蛋白3(multidrug resistance-associated protein3,MRP3)3种转运蛋白转运出细胞[2]。而少量没有被缀合的白藜芦醇则通过基底外侧膜离开肠上皮细胞。此后,白藜芦醇及其代谢产物离开肠细胞进入门静脉循环。在肝脏中,SULT1A1、UGT1A1和UGT1A9进一步缀合白藜芦醇。缀合的白藜芦醇和代谢产物通过肠肝循环,在肝脏水解后排入肠中被重新吸收,并进入门静脉循环再次到达肝脏代谢。白藜芦醇及代谢产物从肝脏进入全身循环,并被周围组织如脂肪组织吸收[4]。肾脏也参与白藜芦醇的代谢及极性白藜芦醇代谢产物排泄[5]。动物和人之间白藜芦醇的代谢不尽相同。大鼠和小鼠的肝微粒体的葡萄糖醛酸化活性水平高于人和狗的微粒体(分别为应用剂量的90%和65%)[6]。白藜芦醇葡萄糖醛酸化的立体选择性也存在明显的物种依赖性差异。在人和狗肝微粒体中,白藜芦醇-3-O-葡萄糖醛酸和白藜芦醇-4-O-葡萄糖醛酸的平均比率为5 ∶ 1,而在啮齿动物中,这个比例很低(小鼠为45 ∶ 1;大鼠为50 ∶ 1)[7]。白藜芦醇葡萄糖醛酸化反应的动力学曲线中也存在着物种依赖性差异。在所有物种中,狗微粒体仅形成白藜芦醇-3-O-葡萄糖醛酸和白藜芦醇-4-O-葡糖醛酸[7]。
1.2 肠道微生物代谢在结肠中白藜芦醇及其代谢衍生物可通过肠道菌群进一步代谢。白藜芦醇和缀合的代谢衍生物离开小肠的顶膜并移向大肠,在那里它们可以被肠道菌群代谢[8]。白藜芦醇在微生物的作用下主要代谢衍生物是二氢白藜芦醇(DHR)。肠道细菌通过破坏白藜芦醇的2个酚环之间的双键将其代谢为DHR。除DHR外,反式-3, 4′-二羟基-二苯乙烯和半月苔素也被确定为人尿中白藜芦醇的肠道代谢产物。而后肠道细菌产生的DHR、反式-3, 4′-二羟基-二苯乙烯和半月苔素,在后段肠道被吸收后由尿液排出或者排泄[9]。同时,白藜芦醇微生物代谢衍生物被肠道吸收后,到达肝脏以及其他组织进行进一步代谢或排泄[10]。
1.3 白藜芦醇代谢衍生物白藜芦醇具有不同的官能团,包括酚羟基、芳香环和1个双键,这些官能团为白藜芦醇改性衍生物提供了多样化疗效的潜力[11-12]。近年来,研究人员合成了一系列白藜芦醇代谢衍生物,包括甲氧基衍生物(紫檀芪、白藜芦醇三甲醚、四甲氧基对二苯代乙烯、五甲氧红对二苯代乙烯等),羟化衍生物(二羟基对二苯代乙烯、四羟基对二苯代乙烯、六羟基对二苯代乙烯等),卤化衍生物(4’-溴代白藜芦醇、2-环氧氯丙烷-白藜芦醇、4-碘代白藜芦醇等)[13-14]。白藜芦醇的甲氧基化、羟基化和卤化衍生物因其具有不同治疗疾病的潜力而受到了特别关注,其中研究的最多且效益最高的衍生物就是紫檀芪[15]。
2 白藜芦醇及其代谢衍生物的生物学功能 2.1 抗氧化功能白藜芦醇的结构中存在着3个羟基基团,是一种潜在的自由基消除剂,其结构中4-羟基苯二烯元素提供了很好的抗氧化性能。白藜芦醇的细胞防御体系通过调节几种细胞抗氧化剂的途径,从而平衡细胞的氧化还原状态来发挥其直接和间接细胞抗氧化剂的能力。直接机制:白藜芦醇通过氢原子转移和顺序质子损失电子转移清除自由基活性和活性炭,并能直接消除无细胞系统中的过氧亚硝酸盐[16]。间接机制:白藜芦醇通过调节超氧化物歧化酶1(SOD1)、谷胱甘肽过氧化物酶(GSH-Px)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚基4(NOX4)活性降低体内氧化应激[17]。
白藜芦醇是一种强大的抗氧化剂,但其生物利用率低的问题阻碍了它发挥更强大的功能。紫檀芪是白藜芦醇的甲氧基衍生物,紫檀芪表现出更稳定以及更高效的生物利用度。紫檀芪可保护红细胞膜抵御过氧化氢诱导的脂质过氧化应激,其功能结构与白藜芦醇相似。紫檀芪能通过增加血红素加氧酶-1(HO-1)、SOD、过氧化氢酶(CAT)和GSH-Px的表达缓解机体氧化应激[18]。目前为了更好发挥白藜芦醇的利用率,通过酯化过程产生白藜芦醇代谢衍生物,以改善其亲脂性,已合成了多种不同的酯化白藜芦醇化合物,这些代谢衍生物能够有效抑制脂蛋白的氧化,并抑制羟基自由基引起的DNA断裂。结果表明这些代谢衍生物能更广泛地作为抗氧化剂用于各种商品中。
2.2 抗炎功能白藜芦醇是酸性和两亲性的非氮多酚,具有抗炎活性,可通过作用于炎症的不同阶段来预防炎症。环氧合酶(COX)和脂氧合酶参与了促炎介质的合成,白藜芦醇可以通过抑制COX-1途径选择性地抑制COX活性[19]。白藜芦醇能显著抑制白细胞介素(IL)家族如IL-8、IL-1、IL-6的表达[20]。在脂多糖(LPS)刺激的鼠巨噬细胞中,白藜芦醇通过下调炎症标记物如IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),抑制信号转导子和转录激活子(STAT)1/STAT3,以及磷酸化丝裂原活化蛋白激酶(MAPK)来缓解LPS导致的炎症[21]。白藜芦醇还能通过激活蛋白激酶α(AMPKα)/沉默信息调节因子1(SIRT1)途径降低炎症水平并改善肝脂肪变性[22]。
2.3 抗菌功能白藜芦醇具有抑制某些病原微生物(包括革兰氏阳性、革兰氏阴性细菌和真菌)生长的能力。白藜芦醇具有多个抗菌靶标,能与细菌真菌中的多种蛋白质相互作用。白藜芦醇能与ATP水解酶或者ATP合酶结合,抑制细菌ATP的合成。白藜芦醇的抗菌活性主要是通过导致细菌内DNA片段化,抑制细菌分裂蛋白——丝状温度敏感蛋白Z(FtsZ)和Z环的形成来实现的,Z环形成是细菌分裂增殖必不可少的过程[23]。
研究表明,不同白藜芦醇的浓度抑菌效果却有不同。当白藜芦醇浓度小于50 mg/mL时能抑制包括毛癣真菌、絮状表皮真菌、白色念珠菌以及蜡状芽孢杆菌、嗜低温弓形杆菌、结核分歧杆菌等革兰氏阳性菌生长,还能抑制幽门螺杆菌等革兰氏阴性菌的生长[24-29];当白藜芦醇浓度在100~200 mg/mL时能抑制金黄色葡萄球菌、粪肠球菌、化脓性链球菌等革兰氏阳性菌生长[26];而当白藜芦醇浓度大于200 mg/mL时则能抑制大肠杆菌、肠炎沙门氏菌等病原菌生长[26, 29]。
3 白藜芦醇的分子调控机制白藜芦醇的多样生物效应主要在于它靶向作用于细胞内多种分子,其中最著名的就是激活去乙酰化酶家族成员——SIRT1。SIRT1被激活后可调节细胞内重要的生理生化过程,如DNA修复、细胞生存、糖异生作用、细胞周期调控、脂质代谢、脂肪调动和胰岛素抵抗等[30]。值得注意的是,SIRT1介导的这些生理功能与白藜芦醇改善线粒体呼吸代谢和脂质氧化作用相关。通过激活SIRT1,白藜芦醇在细胞内触发多种代谢转录调控子的去乙酰化,如调节线粒体生物合成的关键基因氧化物酶体增殖物激活受体γ(PPARγ)辅激活因子-1α(PGC-1α)。去乙酰化的PGC-1α能提高线粒体基因表达的转录因子和核受体相关基因的表达[31-32]。
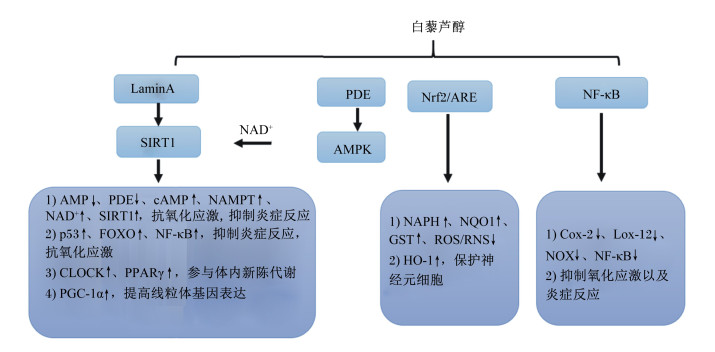
白藜芦醇分子调控机制(图 1):1)白藜芦醇通过调节LaminA激活SIRT1,SIRT1与不同底物相互作用起到抑制炎症、抗氧化应激、参与体内新陈代谢以及线粒体基因表达的作用;2)白藜芦醇通过PDEs刺激AMPK提高SIRT1的共底物NAD+的产生,从而提高SIRT1的活性;3)白藜芦醇通过激活核因子红系2相关因子/抗氧化反应元件(Nrf2/ARE)通路促进氧化还原平衡以及介导HO-1的表达来保护神经元细胞;4)白藜芦醇通过抑制核转录因子-κB(NF-κB)通路控制氧化应激以及炎症反应。
|
图中“↑”表示物质活性上升,“↓”表示物质活性下降。In the figure, “↑” indicates the increase of substance activity, and “↓” indicates the decrease of substance activity. LaminA:核纤层蛋白A抗原nuclear fibrin A antigen;PDE:磷酸二酯酶phosphodiesterase;AMPK: 腺苷酸活化蛋白激酶adenosine monophosphate activated protein kinase; SIRT1:沉默信息调节因子1 silent information regulator 1; CLOCK: 钟基因clock gene; NAMPT:烟酰胺磷酸核糖基转移酶nicotinamide phosphoribosyltransferase;Nrf2: 红系衍生的核因子2相关因子erythroid derived nuclear factor 2 related factors;ARE:抗氧化反应元件antioxidant response element;NF-κB: 核转录因子-κB nuclear transcriptional factor-κB;FOXO:叉头转录因子forkhead transcription factor;PPARγ:氧化物酶体增殖物激活受体γ hydridesome proliferator activated receptor γ;PGC-1α:PPARγ辅激活因子-1α PPARγ coactivator-1α;NQO1: NAD(P)H脱氢酶1 NAD(P)H dehydrogenase 1; GST: 谷胱甘肽转移酶glutathione transferase;ROS: 活性氧簇reactive oxygen species; RNS: 活性氮簇reactive nitrogen species; HO-1:血红素氧化酶-1 heme oxidase-1;COX-2: 环氧合酶-2 cyclooxygenase-2;NOX: NADPH氧化酶NADPH oxidase;LOX-12: 花生四烯酸12-脂氧合酶arachidonic acid 12-lipoxygenase。 图 1 白藜芦醇分子调控机制 Fig. 1 Molecular regulatory mechanism of resveratrol |
SIRT1与不同的底物相互作用,在生物体内发挥着许多重要的作用(图 1):1)作用于p53基因、叉头转录因子(FOXO)、NF-κB等底物调节细胞周期,促进DNA损伤修复,维持基因组稳定,抑制炎症,抗氧化应激,增强细胞活性及细胞存活能力;2)作用于钟基因(CLOCK)、PPARγ等底物参与体内新陈代谢,维持糖脂等代谢稳定;3)去乙酰化线粒体生物合成的关键基因PGC-1α,提高线粒体基因表达的转录因子和核受体相关基因的表达[31-32]。研究表明,抗氧化通路的Nrf2的表达受到SIRT1的正调控,而PGC-1α作为线粒体的能量因子,能直接调控Nrf2的表达[33]。白藜芦醇可以促进SIRT1的蛋白激活剂LaminA与SIRT1的结合,进而提高SIRT1的脱乙酰酶活性,并且会以SIRT1依赖的方式表现出抗氧化、抗炎等特性(图 1)[34]。
然而,另一些研究则认为白藜芦醇是通过作用于AMPK磷酸化PGC-1α调控线粒体功能,从而影响下游基因的表达。白藜芦醇激活SIRT1是通过激活AMP的AMPK依赖性机制间接导致的[35]。白藜芦醇直接抑制AMP循环来降解磷酸二酯酶(PDE),使得cAMP水平升高,通过刺激AMPK介导的烟酰胺磷酸核糖基转移酶(NAMPT)的表达,提高了SIRT1的共底物NAD+的产生,从而提高SIRT1的活性(图 1)[36]。白藜芦醇也能激活Nrf2/ARE通路导致Ⅱ期解毒酶和抗氧化酶,如NADPH、醌氧化还原酶1(NQO1),GST和葡萄糖醛酸糖基转移酶(UDP)的表达增强,进而促进氧化还原平衡并消除有害的外源性/内源性物质[34, 37]。白藜芦醇还能直接通过诱导Nrf2/ARE信号通路介导的HO-1表达来保护神经元细胞免受氧化应激的影响(图 1)[19, 38]。白藜芦醇激活Nrf2从而诱导谷胱甘肽的合成,改善由吸烟引发的人肺上皮细胞的氧化应激[39]。本课题组也发现白藜芦醇能通过激活Nrf2/ARE通路,提高抗氧化酶的表达量,降低活性氧(ROS)水平,缓解线粒体损伤,从而缓解呕吐毒素引起的猪肠道上皮细胞的氧化应激,促进细胞生长增殖[40]。NF-κB途径的一些靶基因,如诱导型一氧化氮合酶(iNOS)、COX-2、花生四烯酸12-脂氧合酶(LOX-12)、花生四烯酸5-脂氧合酶(LOX5)、黄嘌呤氧化还原酶和NADPH氧化酶亚基2(NOX2),可以促进活性氧/活性氮(ROS/RNS)的产生[41]。NF-κB信号通路可以被ROS/RNS以多种方式激活[41]。研究表明,白藜芦醇通过抑制NF-κB信号通路、核因子κB激酶亚基的抑制剂α(IKKα)的活化和磷酸化及降解,进而抑制促炎介质,从而抑制炎症和氧化应激(图 1)[34, 37, 42]。
4 白藜芦醇及其代谢衍生物在畜禽上的应用 4.1 白藜芦醇及其代谢衍生物在畜禽生长性能上的研究白藜芦醇可显著提高各阶段仔猪平均日增重、平均日采食量,降低仔猪料重比,对仔猪生长性能、免疫功能和细菌感染后的微生物生态系统都有改善作用[43]。白藜芦醇作为抗菌饲料添加剂的替代品也可有效提高断奶仔猪的生长性能[44]。饲粮中添加白藜芦醇对育肥猪的生长性能和胴体特性无显著影响,但可显著降低血清的甘油三酯、总胆固醇、低密度脂蛋白胆固醇和极低密度脂蛋白的含量,增加背最长肌的肌间脂肪含量[45]。
环境高温产生的热应激对畜禽生长性能产生巨大影响,造成重大经济损失。补充白藜芦醇可以通过积极调节血清代谢参数,如血清碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)和乳酸脱氢酶(LDH)活性等,并减轻热应激条件下肉鸡的组织氧化损伤,提高组织和器官中养分的吸收利用效率,提高生产性能和饲料转化率,从而改善生长性能[46]。白藜芦醇能作为饲料添加剂改善肉鸡品质。白藜芦醇显著提高鸡胸大肌的总抗氧化能力和CAT活性,降低丙二醛含量,降低滴水损失和乳酸含量[47]。
4.2 白藜芦醇及其代谢衍生物在畜禽繁殖性能上的研究母猪在妊娠后期和哺乳期都会受到较高的氧化应激。越来越多的研究表明,饲粮中的抗氧化剂,如维生素E、维生素C和硒都能有效地提高母猪的抗氧化能力,减轻氧化应激,有利于提高母猪产仔数和仔猪的生长。基础玉米饲粮中添加白藜芦醇可显著提高断奶窝重和仔猪断奶体重[48]。白藜芦醇通过Kelch样环氧氯丙烷相关蛋白-1(Keap1)-Nrf2和SIRT1通路增加胎盘中抗氧化基因的表达,提高胎盘和乳中的抗氧化状态,从而提高仔猪的抗氧化能力[48]。
紫檀芪能减缓宫内生长迟缓、断奶仔猪早期肝损伤和氧化应激,提高其生长性能[49]。添加紫檀芪能降低血浆转氨酶活性,降低肝细胞凋亡率,并防止肝超氧阴离子水平升高[50]。紫檀芪通过清除超氧化物累积,增强Nrf2信号,促进酶促抗氧化防御以及提高谷胱甘肽(GSH)氧化还原循环的代谢效率等方式,实现恢复断奶仔猪肝脏氧化还原平衡及细胞稳态[50]。
4.3 白藜芦醇及其代谢衍生物在调节畜禽免疫上的研究伪狂犬病病毒(PRV)是猪最重要的传染病之一,每年给养殖业带来巨大的经济损失。将仔猪感染伪狂犬毒后,口服白藜芦醇溶液可显著降低病毒载量,抑制组织损伤并缓解PRV感染引起的脑部炎症,提高干扰素-γ含量,降低死亡率并提高其生长性能。干扰素-γ介导的机制在急性疱疹病毒科病毒感染的控制和康复中起着关键作用,白藜芦醇抗病毒活性可能是通过干扰素-γ抑制PRV增殖和调节机体的免疫来实现的[51]。
4.4 白藜芦醇及其代谢衍生物在畜禽肠道健康上的研究饲粮中添加白藜芦醇能显著提高试验猪血清中CAT活性以及总抗氧化能力;降低试验猪空肠黏膜IL-6含量,提高空肠黏膜IL-10含量以及结肠食糜中双歧杆菌数量,有降低大肠杆菌数量的趋势[52]。饲粮中添加白藜芦醇可调节生长育肥猪结肠菌群,增强机体抗氧化与空肠黏膜抗炎的能力,改善肠道健康[43]。
小肠黏膜对于仔猪吸收营养和免疫刺激,促进仔猪健康生长发育非常重要,仔猪断奶应激会导致小肠黏膜屏障障碍、免疫力下降、腹泻和生长迟缓,带来巨大的经济损失[53]。有研究发现,高剂量白藜芦醇和姜黄素的协同作用可维持肠黏膜完整性并提高生长性能;白藜芦醇促进mRNA的稳定性,从而使抗氧化基因的表达增加,抗氧化活性增强[54]。
断奶易使仔猪产生肠道氧化应激,破坏仔猪肠道功能,绒毛变短,空肠内氧化损伤严重以及抗氧化防御系统受损,对仔猪生长发育产生不良影响。在饲粮中添加白藜芦醇和紫檀芪能显著增加绒毛长度,减少空肠凋亡细胞数[55]。紫檀芪可通过促进Nrf2的核转运以及NADPH的表达水平恢复断奶仔猪空肠的抗氧化功能,缓解空肠内氧化损伤[55]。饲粮添加敌草快导致仔猪肝脏氧化应激和线粒体功能障碍,影响仔猪生长性能;同时添加紫檀芪可通过激活SIRT1,防止线粒体肿胀、膜电位坍塌和ATP衰竭,并且促进Nrf2以及SOD的表达,恢复由敌草快导致的仔猪生长性能下降。紫檀芪比白藜芦醇在抑制敌草快诱导的肝细胞凋亡以及增加总胆固醇、超氧阴离子和脂质过氧化产物的产生方面效果更显著[55]。
5 小结和展望白藜芦醇及其代谢衍生物能促进母猪繁殖性能、缓解断奶仔猪应激、改善猪肠道菌群、改善其肠道及机体的健康状态等。尤其是白藜芦醇代谢衍生物,如紫檀芪的生物利用率比白藜芦醇更高。因而,进一步设计和开发合成白藜芦醇的代谢产物及衍生物,以提高白藜芦醇的生物利用度和药理活性更具有应用价值。本文综述了白藜芦醇及其代谢衍生物的代谢机制以及通过不同细胞信号分子,如SIRT1、Nrf2、NF-κB途径的分子调控机制,调控的抗氧化应激、抗炎、抗菌的生物学功能,并进一步探讨了白藜芦醇及其代谢衍生物紫檀芪在畜牧生产中的研究进展。目前,白藜芦醇及其代谢衍生物的研究应用还极其有限,相信未来白藜芦醇及其代谢衍生物会在提高畜禽生长性能及改善其健康状态方面得到更为广泛的应用。
| [1] |
JANG M, CAI L N, UDEANI G O, 等. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science, 1997, 275(5297): 218-220. |
| [2] |
PLANAS J M, ALFARAS I, COLOM H, et al. The bioavailability and distribution of trans-resveratrol are constrained by ABC transporters[J]. Archives of Biochemistry and Biophysics, 2012, 527(2): 67-73. DOI:10.1016/j.abb.2012.06.004 |
| [3] |
HENRY C, VITRAC X, DECENDIT A, et al. Cellular uptake and efflux of trans-piceid and its aglycone trans-resveratrol on the apical membrane of human intestinal Caco-2 cells[J]. Journal of Agricultural and Food Chemistry, 2005, 53(3): 798-803. DOI:10.1021/jf048909e |
| [4] |
WALLE T, HSIEH F, DELEGGE M H, et al. High absorption but very low bioavailability of oral resveratrol in humans[J]. Drug Metabolism and Disposition, 2004, 32(12): 1377-1382. DOI:10.1124/dmd.104.000885 |
| [5] |
SPRINGER M, MOCO S. Resveratrol and its human metabolites-effects on metabolic health and obesity[J]. Nutrients, 2019, 11(1): 143. DOI:10.3390/nu11010143 |
| [6] |
RICHES Z, STANLEY E L, BLOOMER J C, et al. Quantitative evaluation of the expression and activity of five major sulfotransferases (SULTs) in human tissues: the SULT "pie"[J]. Drug Metabolism and Disposition, 2009, 37(11): 2255-2261. DOI:10.1124/dmd.109.028399 |
| [7] |
XIE Q S, CHEN Y, LIU F, et al. Interspecies differences in metabolism of deoxypodophyllotoxin in hepatic microsomes from human, monkey, rat, mouse and dog[J]. Drug Metabolism and Pharmacokinet, 2016, 31(4): 314-322. DOI:10.1016/j.dmpk.2016.05.002 |
| [8] |
SELMA M V, ESPIN J C, TOMAS-BARBERAN F A. Interaction between phenolics and gut microbiota: role in human health[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6485-6501. DOI:10.1021/jf902107d |
| [9] |
BODE L M, BUNZEL D, HUCH M, et al. In vivo and in vitro metabolism of trans-resveratrol by human gut microbiota[J]. The America Journal Clinical Nutrition, 2013, 97(2): 295-309. DOI:10.3945/ajcn.112.049379 |
| [10] |
AZORÍN-ORTUÑO M, YÁÑEZ-GASCÑN M J, VALLEJO F, et al. Metabolites and tissue distribution of resveratrol in the pig[J]. Molecular Nutrition & Food Research, 2011, 55(8): 1154-1168. |
| [11] |
YANG T T, WANG L, ZHU M X, et al. Properties and molecular mechanisms of resveratrol: a review[J]. Pharmazie, 2015, 70(8): 501-506. |
| [12] |
OVESNA Z, HORVATHOVA-KOZICS K. ChemInform abstract: structure—activity relationship of trans-resveratrol and its analogues[J]. ChemInform, 2008, 39(28): 450-455. |
| [13] |
NAWAZ W, ZHOU Z Q, DENG S, et al. Therapeutic versatility of resveratrol derivatives[J]. Nutrients, 2017, 9(11): 1188. DOI:10.3390/nu9111188 |
| [14] |
MIKULA-PIETRASIK J, KUCZMARSKA A, KSIAŻ EK K. Biological multifunctionality of resveratrol and its derivatives[J]. Postepy Biochemii, 2015, 61(4): 336-343. |
| [15] |
ESTRELA J M, ORTEGA A, MENA S, et al. Pterostilbene: biomedical applications[J]. Critical Reviews in Clinical Laboratory Sciences, 2013, 50(3): 65-78. DOI:10.3109/10408363.2013.805182 |
| [16] |
ALOV P, TSAKOVSKA I, PAJEVA I. Computational studies of free radical-scavenging properties of phenolic compounds[J]. Current Topics in Medicinal Chemistry, 2015, 15(2): 85-104. DOI:10.2174/1568026615666141209143702 |
| [17] |
SPANIER G, XU H, XIA N, et al. Resveratrol reduces endothelial oxidative stress by modulating the gene expression of superoxide dismutase 1 (SOD1), glutathione peroxidase 1 (GPx1) and NADPH oxidase subunit (Nox4)[J]. Journal of Physiology and Pharmacology, 2009, 60(Suppl.4): 111-116. |
| [18] |
LIU H X, WU X, LUO J N, et al. Pterostilbene attenuates astrocytic inflammation and neuronal oxidative injury after ischemia-reperfusion by inhibiting NF-κB phosphorylation[J]. Frontiers in Immunology, 2019, 10: 2408. DOI:10.3389/fimmu.2019.02408 |
| [19] |
DE LA LASTRA C, SANCHEZ-FIDALGO S, VILLEGAS I, et al. New pharmacological perspectives and therapeutic potential of PPAR-γ agonists[J]. Current Pharmaceutical Design, 2004, 10(28): 3505-3524. DOI:10.2174/1381612043382909 |
| [20] |
BAGGIOLINI M, LOETSCHER P, MOSER B. Interleukin-8 and the chemokine family[J]. International Journal of Immunopharmacology, 1995, 17(2): 103-108. DOI:10.1016/0192-0561(94)00088-6 |
| [21] |
MA C F, WANG Y, SHEN A J, et al. Resveratrol upregulates SOCS1 production by lipopolysaccharide-stimulated RAW264.7 macrophages by inhibiting miR-155[J]. International Journal of Molecular Medicine, 2017, 39(1): 231-237. DOI:10.3892/ijmm.2016.2802 |
| [22] |
TIAN Y L, MA J T, WANG W D, et al. Resveratrol supplement inhibited the NF-κB inflammation pathway through activating AMPKα-SIRT1 pathway in mice with fatty liver[J]. Molecular and Cellular Biochemistry, 2016, 422(1/2): 75-84. |
| [23] |
HWANG D, LIM Y H. Resveratrol antibacterial activity against Escherichia coli is mediated by Z-ring formation inhibition via suppression of FtsZ expression[J]. Scientific Reports, 2015, 5: 10029. DOI:10.1038/srep10029 |
| [24] |
CHAN M M Y. Antimicrobial effect of resveratrol on dermatophytes and bacterial pathogens of the skin[J]. Biochemical Pharmacology, 2002, 63(2): 99-104. DOI:10.1016/S0006-2952(01)00886-3 |
| [25] |
JUNG H J, HWANG I A, SUNG W S, et al. Fungicidal effect of resveratrol on human infectious fungi[J]. Archives of Pharmacal Research, 2005, 28(5): 557-560. DOI:10.1007/BF02977758 |
| [26] |
PAULO L, FERREIRA S, GALLARDO E, et al. Antimicrobial activity and effects of resveratrol on human pathogenic bacteria[J]. World Journal of Microbiology and Biotechnology, 2010, 26(8): 1533-1538. DOI:10.1007/s11274-010-0325-7 |
| [27] |
FERREIRA S, SILVA F, QUEIROZ J A, et al. Resveratrol against Arcobacter butzleri and Arcobacter cryaerophilus: activity and effect on cellular functions[J]. International Journal of Food Microbiology, 2014, 180: 62-68. DOI:10.1016/j.ijfoodmicro.2014.04.004 |
| [28] |
SUN D Q, HURDLE J G, LEE R, et al. Evaluation of flavonoid and resveratrol chemical libraries reveals abyssinone Ⅱ as a promising antibacterial lead[J]. ChemMedChem, 2012, 7(9): 1541-1545. DOI:10.1002/cmdc.201200253 |
| [29] |
PAULO L, OLEASTRO M, GALLARDO E, et al. Anti-Helicobacter pylori and urease inhibitory activities of resveratrol and red wine[J]. Food Research International, 2011, 44(4): 964-969. DOI:10.1016/j.foodres.2011.02.017 |
| [30] |
BROOKS C L, GU W. How does SIRT1 affect metabolism, senescence and cancer?[J]. Nature Reviews Cancer, 2009, 9(2): 123-128. DOI:10.1038/nrc2562 |
| [31] |
LAGOUGE M, ARGMANN C, GERHART-HINES Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1α[J]. Cell, 2006, 127(6): 1109-1122. DOI:10.1016/j.cell.2006.11.013 |
| [32] |
RODGERS J T, LERIN C, HAAS W, et al. Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1[J]. Nature, 2005, 434(7029): 113-118. DOI:10.1038/nature03354 |
| [33] |
DO M T, KIM H G, CHOI J H, et al. Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1α/Nrf2 pathway, leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents[J]. Free Radical Biology and Medicine, 2014, 74: 21-34. DOI:10.1016/j.freeradbiomed.2014.06.010 |
| [34] |
TRUONG V L, JUN M, JEONG W S. Role of resveratrol in regulation of cellular defense systems against oxidative stress[J]. Biofactors, 2018, 44(1): 36-49. DOI:10.1002/biof.1399 |
| [35] |
PRICE N L, GOMES A P, LING A J Y, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function[J]. Cell Metabolism, 2012, 15(5): 675-690. DOI:10.1016/j.cmet.2012.04.003 |
| [36] |
LIU B H, GHOSH S, YANG X, et al. Resveratrol rescues SIRT1-dependent adult stem cell decline and alleviates progeroid features in laminopathy-based progeria[J]. Cell Metabolism, 2012, 16(6): 738-750. DOI:10.1016/j.cmet.2012.11.007 |
| [37] |
ZHANG D D. Mechanistic studies of the Nrf2-Keap1 signaling pathway[J]. Drug Metabolism Reviews, 2006, 38(4): 769-789. DOI:10.1080/03602530600971974 |
| [38] |
CHEN X L, DODD G, THOMAS S, et al. Activation of Nrf2/ARE pathway protects endothelial cells from oxidant injury and inhibits inflammatory gene expression[J]. American Journal Physiology Heart and Circulatory Physiology, 2006, 290(5): H1862-H1870. DOI:10.1152/ajpheart.00651.2005 |
| [39] |
KODE A, RAJENDRASOZHAN S, CAITO S, et al. Resveratrol induces glutathione synthesis by activation of Nrf2 and protects against cigarette smoke-mediated oxidative stress in human lung epithelial cells[J]. American Journal Physiology: Lung Cellular Molecular Physiology, 2008, 294(3): L478-L488. DOI:10.1152/ajplung.00361.2007 |
| [40] |
YANG J, ZHU C, YE J L, et al. Protection of porcine intestinal-epithelial cells from deoxynivalenol-induced damage by resveratrol via the Nrf2 signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2019, 67(6): 1726-1735. DOI:10.1021/acs.jafc.8b03662 |
| [41] |
MORGAN M J, LIU Z G. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Research, 2011, 21(1): 103-115. DOI:10.1038/cr.2010.178 |
| [42] |
CUADRADO A, MARTIN-MOLDES Z, YE J P, et al. Transcription factors NRF2 and NF-κB are coordinated effectors of the Rho family, GTP-binding protein RAC1 during inflammation[J]. Journal of Biological Chemistry, 2014, 289(22): 15244-15258. DOI:10.1074/jbc.M113.540633 |
| [43] |
刘熙文. 白藜芦醇和精油对感染细菌的仔猪生长性能、免疫和粪便微生物脱落的影响[J]. 中国饲料, 2020(8): 37-40. LIU X W. Effects of resveratrol and essential oils on growth performance, immunity and fecal microbial abscissions of piglets infected with bacteria[J]. China Feed, 2020(8): 37-40 (in Chinese). |
| [44] |
AHMED S T, HOSSAIN M E, KIM G M, et al. Effects of resveratrol and essential oils on growth performance, immunity, digestibility and fecal microbial shedding in challenged piglets[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(5): 683-690. DOI:10.5713/ajas.2012.12683 |
| [45] |
ZHANG H Z, CHEN D W, HE J, et al. Long-term dietary resveratrol supplementation decreased serum lipids levels, improved intramuscular fat content, and changed the expression of several lipid metabolism-related miRNAs and genes in growing-finishing pigs[J]. Journal of Animal Science, 2019, 97(4): 1745-1756. DOI:10.1093/jas/skz057 |
| [46] |
HU R Z, HE Y J, AROWOLO M A, et al. Polyphenols as potential attenuators of heat stress in poultry production[J]. Antioxidants (Basel), 2019, 8(3): 67. DOI:10.3390/antiox8030067 |
| [47] |
HE S P, LI S, AROWOLO M A, et al. Effect of resveratrol on growth performance, rectal temperature and serum parameters of yellow-feather broilers under heat stress[J]. Animal Science Journal, 2019, 90(3): 401-411. DOI:10.1111/asj.13161 |
| [48] |
MENG Q W, GUO T, LI G Q, et al. Dietary resveratrol improves antioxidant status of sows and piglets and regulates antioxidant gene expression in placenta by Keap1-Nrf2 pathway and SIRT1[J]. Journal of Animal Science and Biotechnology, 2018, 9: 34. DOI:10.1186/s40104-018-0248-y |
| [49] |
ZHANG H, CHEN Y N, CHEN Y P, et al. Pterostilbene attenuates liver injury and oxidative stress in intrauterine growth-retarded weanling piglets[J]. Nutrition, 2020, 81: 110940. |
| [50] |
CHEN Y N, CHEN Y P, ZHANG H, et al. Pterostilbene as a protective antioxidant attenuates diquat-induced liver injury and oxidative stress in 21-day-old broiler chickens[J]. Poultry Science, 2020, 99(6): 3158-3167. DOI:10.1016/j.psj.2020.01.021 |
| [51] |
ZHAO X H, TONG W Z, SONG X, et al. Antiviral effect of resveratrol in piglets infected with virulent pseudorabies virus[J]. Viruses, 2018, 10(9): 457. DOI:10.3390/v10090457 |
| [52] |
胡瑶莲, 张恒志, 陈代文, 等. 白藜芦醇对生长育肥猪抗氧化能力、空肠黏膜免疫及结肠菌群的影响[J]. 动物营养学报, 2019, 31(1): 459-468. HU Y L, ZHANG H Z, CHEN D W, et al. Effects of resveratrol on antioxidant capacity, jejunal mucosal immunity and colonic microflora of growing finishing pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 459-468 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.054 |
| [53] |
CHEN X L, ZENG Z Y, HUANG Z Q, et al. Effects of dietary resveratrol supplementation on immunity, antioxidative capacity and intestinal barrier function in weaning piglets[J]. Animal Biotechnology, 2019, 1-6. DOI:10.1080/10495398.2019.1683022 |
| [54] |
GAN Z D, WEI W Y, WU J M, et al. Resveratrol and curcumin improve intestinal mucosal integrity and decrease m6A RNA methylation in the intestine of weaning piglets[J]. ACS Omega, 2019, 4(17): 17438-17446. DOI:10.1021/acsomega.9b02236 |
| [55] |
ZHANG H, CHEN Y N, CHEN Y P, et al. Comparison of the protective effects of resveratrol and pterostilbene against intestinal damage and redox imbalance in weanling piglets[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 52. DOI:10.1186/s40104-020-00460-3 |




