热应激是影响畜禽生产的主要环境应激之一,高温热应激给畜禽生产造成重大损失;热应激引起畜禽的采食量下降、代谢增强、免疫功能下降,最终造成畜禽生长、生产和繁殖性能下降[1-3]。研究表明,在热应激造成的损伤中,氧化应激占主要地位;热应激会造成畜禽机体代谢增强,引起活性氧(reactive oxygen species, ROS)的过量积累并造成机体氧化-抗氧化失衡,发生氧化应激;进而引起组织细胞、蛋白质和核酸的氧化损伤[4-5]。热应激状态下,机体可激活核转录因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2),并上调其下游的抗氧化酶基因的表达,从而提高抗氧化酶活性,这有利于提高机体组织细胞对ROS的清除能力[4];热应激启动热休克反应上调了热休克蛋白(heat shock proteins,HSPs)的转录与表达,这有利于维持氧化应激和蛋白质加工之间的平衡以及细胞结构和内环境的稳定[6-7];而且,ROS和HSPs两者都可以激活核转录因子-κB(nuclear transcription factor-κB,NF-κB)进而启动免疫和炎症反应[8-10],加速清除或恢复热应激引起组织细胞的氧化损伤。
目前,热应激引起氧化应激、热休克反应以及免疫和炎症反应的试验研究常见报道[1, 11-12];然而,关于畜禽在热应激条件下机体内氧化应激、热休克反应与免疫和炎症的机制,并归纳这三者相互关系的研究却鲜有报道。热应激是限制畜禽生产的主要因素,研究热应激状态下机体氧化应激、热休克反应与免疫和炎症反应的机制及三者的相互联系,不仅有利于进一步认识热应激造成机体损伤发生和发展的过程,还可以为预防和缓解畜禽高温热应激提供理论依据。本文就热应激引起畜禽氧化应激、热休克反应与免疫和炎症反应的机制及三者之间的相互关系作一综述。
1 热应激诱导氧化应激的产生氧化还原反应是动物体内广泛存在的化学反应;细胞在有氧呼吸过程会产生包括超氧阴离子(O2-·)、过氧化氢(H2O2)和羟自由基(·OH)在内的ROS[13]。在生理条件下,机体能将ROS严格控制在极低的水平,且作为信号分子参与机体内一系列信号通路的激活。夏季高温,尤其是异常高温和持续高温常会引起畜禽机体代谢增强,发生急性或慢性热应激反应;热应激状态下,ROS的持续生成往往会引发机体产生氧化应激并造成组织细胞氧化损伤[2, 14]。ROS过量累积是氧化应激的重要因素;ROS可直接或者间接诱发基因突变、蛋白质变性和脂质过氧化[15-16]。在进化过程中,畜禽形成了一个复杂的抗氧化防御系统,如由外部供应抗氧化剂(维生素A、类胡萝卜素等)和机体内部合成的抗氧化酶[4];其中,内源性抗氧化酶包括超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和过氧化氢酶(catalase,CAT)。而脂质过氧化产物(丙二醛)含量和抗氧化酶活性,可作为衡量机体氧化应激的主要标志。一般而言,夏季高温造成长期的慢性热应激会大量地消耗机体内的抗氧化剂、损伤机体的抗氧化防御系统,导致抗氧化酶活性下降;ROS无法及时清除,使氧化-抗氧化失衡,引起机体氧化应激;然而,急性热应激状态下,畜禽机体内突然升高的ROS可刺激抗氧化酶系统,使得SOD、GPx和CAT的活性显著升高[11, 17]。
由Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)、Nrf2、抗氧化反应元件(antioxidant response element,ARE)组成的Keap1-Nrf2-ARE信号通路是调节机体抗氧化酶系统的重要通路[17]。在基础生理状态下,Nrf2在胞质内与Keap1结合组成Keap1-Nrf2复合体,并通过泛素化降解;在氧化应激状态下,高水平ROS改变了Keap1的构象并引起Keap1-Nrf2复合体解离,Nrf2得以活化并进入细胞核与ARE结合,上调抗氧化酶的基因表达,提高机体消除ROS的能力,从而抵抗环境高温等因素对机体造成的氧化损伤[17-18]。Keap1-Nrf2-ARE信号通路与热休克反应产生的HSPs在预防或缓解热应激诱导氧化应激对细胞和组织损伤方面发挥着重要作用;而且,Nrf2、热休克因子1(heat shock factor 1,HSF1)与启动免疫和炎症反应的关键因子NF-κB存在密切联系[19-21]。一般而言,机体存在较强烈或较长时间氧化应激时,抗氧化防御系统受到破坏、且组织细胞受损程度超过了HSPs的保护和修复能力,这时Nrf2受到抑制,NF-κB通路被激活并引起炎症反应的可能性更大;而轻度的氧化应激则有利于抗氧化酶和HSPs表达的代偿性增加,增强机体的抗应激能力[4]。
2 氧化应激和热休克反应 2.1 HSPs的产生HSPs是机体处于应激状态下表达的分子伴侣蛋白,广泛存在于胞内线粒体、内质网和细胞核等细胞器中;根据同源程度以及分子质量大小,HSPs可分为HSP110、HSP90、HSP70、HSP60、小分子HSPs(HSP27、HSP33等)以及泛素这6个家族[7, 22];其中HSP70家族在体内分布最广泛、表达量也最大。HSF1启动热休克反应的关键因子;在基础生理状态下,HSF1以无活性的单体形式存在;而当细胞处于应激状态时,3个HSF1单体结合形成具有活性的HSF1三聚体,而后进入细胞核与热休克启动子结合,上调HSPs的转录与表达[6-7, 23];这在机体组织细胞的抗氧化防御体系中起到重要作用。胞内ROS和Ca2+参与HSF1的磷酸化以及HSPs表达的调节。研究显示,热应激增加小鼠肺脏成纤维细胞ROS的产生,ROS可介导p38 MAPK的活化,而p38 MAPK磷酸化后可诱导HSP70和HSP27的表达[24-25]。线粒体是调节胞内Ca2+浓度的主要细胞器[26],也是ROS的靶器官之一[16, 27];线粒体脂质膜易受到ROS的攻击并出现脂质过氧化反应,造成线粒体膜的流动性下降;而且,脂质过氧化反应及其产物(丙二醛)破坏了线粒体完整性,导致线粒体膜上的Ca2+-ATP激酶活性降低,最终引起胞内Ca2+浓度增加[28]。而Ca2+通过活化钙调蛋白激酶(calcium-activated calmodulin,CaM),进而影响HSF1的磷酸化过程[29];体外试验发现,上调CaM的表达提高了小鼠胚胎成纤维细胞HSF1的活性和HSP72的表达[30]。综上所述,氧化应激因子(ROS)以及胞内Ca2+参与了HSF1的磷酸化以及HSPs表达的调节。
2.2 HSPs在氧化应激中的作用HSPs的分子伴侣功能:热应激常引起细胞生理状态发生变化、亚细胞器功能的紊乱,内质网中的未折叠蛋白或错误折叠蛋白积累过量;HSPs发挥分子伴侣功能协助多肽的正确折叠和加工,并引导异常或变性蛋白降解,维持热应激状态下细胞结构和内环境的稳定[6-7, 31]。如内质网上HSP27、HSP33可发挥分子伴侣功能,维持氧化应激和蛋白质加工之间的平衡能;而且,HSP27磷酸化后能与肌节的结构蛋白、细胞骨架结合,缓解了细胞因氧化应激而造成的肌球蛋白裂解和细胞死亡[31-32]。
HSPs的抗氧化作用:热应激破坏线粒体结构完整性,导致呼吸链受到抑制,产生大量的ROS,ROS可以刺激HSPs的产生[29]。HSPs的抗氧化作用包括2方面:一是抑制线粒体呼吸中还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的活性,减少ROS的产生[7];二是直接或间接刺激内源性抗氧化酶的产生,如HSP27可以促进谷胱甘肽自身的氧化还原循环过程,提高还原型谷胱甘肽的水平,调节机体ROS的平衡[33]。HSP70在体内分布最广泛,热应激增加了HSP70,有助于提高细胞的热耐受性[12, 34]。另外,HSP70具有抗细胞凋亡作用;HSP70可调节B淋巴细胞瘤-2(blymphocyte tumor-2,Bcl-2)的表达,而Bcl-2通过稳定线粒体膜和抑制半胱氨酸天冬氨酸蛋白酶3(caspase-3)的释放而起到了抗凋亡作用[35]。
3 氧化应激与免疫和炎症反应 3.1 免疫和炎症的激活NF-κB最初作为淋巴细胞中免疫球蛋白κ轻链基因转录所需的核内转录因子而被发现;后来证明,NF-κB是一种几乎存在于所有细胞的转录因子,广泛参与机体的防御反应、细胞凋亡及其他应激反应[9]。NF-κB的激活与Nrf2相似;在基础生理状态下,NF-κB在胞质内与其抑制蛋白κB(inhibitory κB,IκB)结合形成无活性的复合物;在热应激状态下,IκB经磷酸化后与NF-κB解离,NF-κB得以活化并进入细胞核与靶基因结合,发挥转录调节作用,导致各种炎症因子的产生,从而启动炎症反应[23]。轻度的氧化应激主要通过激活Keap1-Nrf2通路来提高机体的抗氧化防御系统;但机体出现较强烈或较长时间应激时,NF-κB通路激活并引起炎症反应的可能性更大[4]。
3.2 氧化应激引起免疫和炎症反应的途径氧化应激的主要因子(ROS)可通过Toll样受体(Toll-like receptors,TLRs)识别来启动炎症反应;TLRs主要表达于单核细胞、巨噬细胞、树突状细胞等,是免疫细胞表面的模式识别受体;不仅能识别病原相关分子模式(pathogen associated molecular patterns,PAMPs),也能识别因氧化应激而出现的损伤相关分子模式(damage associated molecular patterns,DAMPs)并诱导巨噬细胞的活化,启动免疫反应[36-37]。因此,氧化应激状态下,ROS的过表达从而被TLRs识别;ROS能通过TLR2-髓样分化因子88-NF-κB途径,启动下游炎性基因的表达,产生白细胞介素-1(IL-1)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等炎性因子,调节机体的免疫功能[38]。ROS也能启动Nalp-3炎性复合体(NACHT-LRR-PYD-containing protein3,Nalp-3)组装和活化引起炎症反应;Nalp-3由Nalp-3蛋白、接头蛋白和效应蛋白半胱氨酸天冬氨酸蛋白酶-1(caspase-1)组成,是胞内模式识别受体[39]。在氧化应激状态下,线粒体持续生成的ROS可以通过活化NF-κB而后激活Nalp-3[40];此外,ROS也可活化ERK信号通路激活Nalp-3;激活的Nalp-3炎性复合体能促进白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)的成熟,从而启动炎症反应。另外,革兰氏阴性菌细胞壁的脂多糖(lipopolysaccharide,LPS)等具有病原体相关分子模式,也是诱导机体炎症反应的因素之一。热应激会使动物肠道产生的LPS通过肠黏膜屏障转移到机体其他部位,而使血液中LPS水平的升高[41]。LPS进入血液后,与结合蛋白、特异性受体结合形成复合物后可被单核细胞、巨噬细胞识别,进而通过NF-κB路径启动炎症反应[42]。
总之,氧化应激的主要因子(ROS)可通过NF-κB或Nalp-3诱导免疫炎症发生[39-40, 43];而热应激对免疫功能影响,因机体氧化应激程度而异。轻度的氧化应激对免疫系统起到积极效应,能够提高机体对外界环境的适应性;当机体遭受较强烈或较长时间的热应激时,大量内源性ROS以及由肠道转移到机体内的LPS可诱发免疫和炎症反应[42]。氧化应激与免疫系统可通过Nrf2和NF-κB等因子进行相互调节,Nrf2和NF-κB在组织中的表达保持着微妙平衡;NF-κB的轻度表达可刺激Nrf2的表达代偿性增加,而当应激刺激过于强烈,这种平衡被打破,NF-κB过表达则会抑制Nrf2[4, 20]。此外,热休克反应与NF-κB也存在密切联系[19, 23]。
4 热休克反应与免疫和炎症反应胞内HSF1及其下游表达的HSPs具有抑制炎症的作用。HSF1可能竞争性抑制NF-κB介导的炎症过程[23];通过基因敲除技术发现,缺失HSF1基因的小鼠,增加了LPS引起的炎性因子(TNF-α、IL-6)的表达[44];即HSF1基因的缺失会提高NF-κB的活性,加速炎症反应的发展;这间接表明了HSF1具有抑制炎症的作用。而且,HSPs也能感知胞内炎症信号变化并作出应答;如HSP70与核因子抑制蛋白α(IκBα)相结合,抑制NF-κB通路从而抑制炎症反应[45]。另外,细胞质内存在一种NF-κB的自然抑制因子I-κ,通常I-κ在胞浆内以与NF-κB结合或非结合的形式存在,热休克应答可诱导I-κ基因表达,进而间接下调炎性因子的产生[19, 23]。此外,HSPs具有免疫效应。当出现较为强烈的热应激时,HSPs从细胞内分泌后释放到胞外;同时,氧化应激造成的细胞坏死也会引起胞外热休克蛋白(extracellular heat shock protein,eHSP)的增加[46]。eHSP70是目前已知的胞外热休克蛋白主要成分;eHSP70可作为抗原肽的高效载体分子,在抗原递呈、激活淋巴细胞、巨噬细胞和树突细胞等过程有重要作用[46-47]。值得注意的是,eHSP70可作为细胞坏死、组织损伤等危险信号激活免疫系统;eHSP70可被TLR2/4识别并激活髓样分化因子88-NF-κB通路,从而调节免疫系统合成和释放多种炎性因子(TNF-α、IL-1β、IL-6)[45-46]。
总之,HSPs对免疫和炎症反应可表现出双重的调节作用。一方面,HSPs可感知并抑制胞内的炎症反应,提高细胞的存活能力;另一方面,eHSPs可作为危险信号刺激免疫系统释放炎性因子,加速炎症反应的发展以利于受损组织细胞的恢复或清除。
5 氧化应激、热休克反应与免疫和炎症反应的相互关系氧化应激、热休克反应与免疫和炎症反应之间维持着动态平衡,这对于维持热应激畜禽机体的稳态起到重要的作用。一方面,热应激引起胞内ROS水平和Ca2+浓度升高,ROS和Ca2+可促发HSF1的磷酸化以及调节HSPs表达[29];HSPs的上调有利于保护机体免受氧化损伤,且HSPs可分泌或释放到胞外并参与到免疫和炎症反应过程中[7, 46]。另一方面,氧化应激因子(ROS)通过TLRs和Nalp-3激活免疫系统[39-40],加速炎症反应或免疫修复过程。而炎症反应上调了ROS水平也会加剧氧化应激程度,过量的ROS则会引起免疫细胞氧化损伤、进一步降低机体免疫功能。Nrf2通路与热休克反应在一定程度上可缓解热应激引起的氧化应激[7, 48];而且,Nrf2、HSF1和NF-κB三者存在密切关联(图 1),共同维持氧化应激、热休克反应与免疫和炎症反应之间平衡,以利于组织细胞适应各种形式的氧化应激。
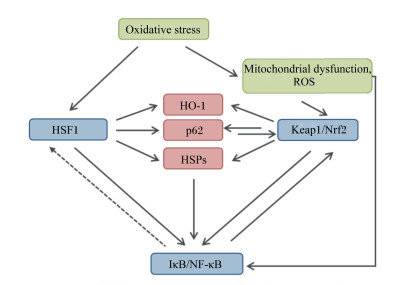
|
Oxidative stress:氧化应激;Mitochondrial dysfunction:线粒体功能障碍;ROS:活性氧reactive oxygen species;Nrf2:核转录因子E2相关因子2 nuclear factor erythroid 2-related factor 2;HSF1:热休克因子1 heat shock factor 1;IκB:抑制蛋白κB inhibitory κB;NF-κB:核转录因子-κB nuclear transcription factor-κB;HO-1:血红素加氧酶-1 heme oxygenase-1。 图 1 氧化应激状态下HSF1、Nrf2与NF-κB的相互关系 Fig. 1 Relationship among HSF1, Nrf2 and NF-κB under oxidative stress |
其一,出现氧化应激时,机体组织通过激活Nrf2上调抗氧化酶水平,加快消除过多的ROS,从而减少ROS介导的NF-κB激活[12, 20];而且,Nrf2可以阻止IκBα的降解,从而干扰NF-κB核转位和促炎基因的转录[20]。反之,NF-κB可以调节Nrf2及其下游抗氧酶基因表达;p65(NF-κB的亚基)过表达能够帮助Keap1的累积[21],进而起到抑制Nrf2的作用。其二,HSF1可能通过竞争性抑制NF-κB介导的炎症过程[44];然而,NF-κB对HSF1是否存在负调控作用,即免疫炎症反应对热休克反应的调控作用,目前还缺乏足够的认识。其三,HSF1和Nrf2两者普遍表现出抗应激刺激效应;尽管没证据显示HSF1与Nrf2存在直接的关联,但两者存在共同的靶基因;HSF1与Nrf2的活化均可上调血红素加氧酶1、接头蛋白p62和HSPs转录基因的表达[48-49],提高细胞应对有害刺激的存活能力;而且,p62的聚集可以激活Nrf2通路[50],HSF1可能通过p62间接影响到Nrf2,但具体的机制尚未见报道。另外,通过基因敲除手段发现,HSF1激活的诱导剂浓度高于Nrf2激活诱导剂的浓度[48];这提示Keap1-Nrf2通路的激活可能优先于HSF1。
总之,维持氧化应激、热休克反应与免疫和炎症反应之间的平衡是畜禽热应激防治的关键点;而且,氧化应激状态下HSF1、Nrf2与NF-κB相互紧密关系的阐明,有助于通过相应技术手段缓解热应激;其中,利用饮食等营养调控措施以维持三者之间的平衡从而缓解畜禽热应激的研究多有报道。
6 营养调控措施 6.1 维生素维生素A、维生素E和维生素C是动物机体内主要的外源性抗氧化剂,能有效清除机体新陈代谢中产生的ROS,预防或缓解热应激引起氧化应激对畜禽机体的损伤[51]。研究发现,维生素A通过Nrf2-谷胱甘肽过氧化物酶1(GPx1)-NF-κB缓解奶牛乳腺上皮细胞氧化应激;维生素A激活Nrf2信号通路上调GPx1,而GPx1对抑制蛋白κB激酶和p65有抑制作用,能减少NF-κB的激活以及下游炎性因子的表达,最终减缓热应激造成细胞的氧化损伤[52]。维生素E能将畜禽体内产生的ROO-自由基转化为ROOH,发挥抗氧化作用[53-54];此外,维生素E也是细胞膜脂质的组成成分,可有效清除细胞膜上的ROS,减缓细胞膜中多不饱和脂肪酸的氧化[55]。维生素C可缓解热应激引起机体的氧化损伤,其作为电子供体,发挥还原剂功效,并可协助维生素E发挥抗氧化功能[54];另有研究指出,维生素C能减少ROS的产生,从而缓解热应激引起的HSPs的过表达[56]。饲粮中添加维生素C,可改善热应激家禽高生产性能、繁殖性能以及产品品质等[56],但其抗热应激机制有待进一步研究。
6.2 矿物元素硒、铜和锌等矿物元素参与到内源性抗氧化酶的合成从而起到缓解热应激的作用。硒是谷胱甘肽过氧化物酶(GPx)活性中心的元素,而GPx可以清除H2O2,并将脂质过氧化物(ROOH)还原成相对稳定的醇和水[53-54]。饲粮中添加0.5 mg/kg的酵母硒,可提高蛋鸡的抗氧化能力和鸡蛋中硒的含量[57]。锌、铜作为铜锌超氧化物歧化酶的成分参与清除机体内O2-·自由基;此外,锌可通过金属硫蛋白抑制过氧化物的产生,有助于维持机体的氧化还原的平衡[58-59]。锌还改善了禽蛋的蛋壳质量;锌是碳酸酐酶的重要辅助因子,碳酸酐酶可促进二氧化碳水合形成碳酸根离子,促进蛋壳腺内碳酸钙的沉积[59]。此外,矿物质元素和维生素存在协同效应;如硒与维生素E[53],维生素E主要存在于细胞膜,而含硒的GPx存在于细胞液,能中和穿过细胞膜的ROS,与维生素E共同保护细胞膜免于过氧化反应;也有报道指出,锌和维生素C的联合使用能改善热应激肉鸡的免疫功能[60]。总之,矿物质元素和维生素的联合使用可更好地发挥抗热应激效果,具体的机制还有待研究完善。
6.3 植物提取物白藜芦醇、姜黄素和甜菜碱等植物提取物,具有抗氧化、抗炎和缓解应激等多种生物功能。白藜芦醇可能通过Nrf2、NF-κB等通路发挥生物效应[12, 61-62]。Sahin等[62]报道,热应激使鹌鹑肝脏内Nrf2的表达明显下调;通过补充白藜芦醇(400 mg/kg)能上调热应激鹌鹑肝脏中Nrf2的表达,提高SOD、CAT和GPx活性。此外,也有报道指出,白藜芦醇能下调热应激乌骨鸡空肠组织NF-κB的表达,改善热应激对肠黏膜的损伤[12]。白藜芦醇可能通过降低IKK活性,阻止IκB的磷酸化,进而抑制NF-κB的活化[63]。姜黄素通过MAPK-Nrf2-ARE信号通路缓解热诱导鸡胚成纤维细胞的氧化应激[64];姜黄素也可激活Nrf2介导的抗氧化酶系统,减轻热应激肉鸡肝脏氧化损伤[65]。甜菜碱具有促进畜禽动物生长、缓解应激等作用;甜菜碱可通过维持细胞渗透压、调节细胞电解质平衡等生物学效应[66],进而起到缓解动物热应激作用;且体外试验发现,甜菜碱通过减少ROS的产生来保护牛乳腺上皮细胞免受热应激诱导的氧化损伤和细胞凋亡[67]。因此,利用植物提取物调节机体氧化应激、热休克反应和免疫反应之间的平衡,可为防治畜禽热应激提供新思路。
6.4 其他肠道是热应激的主要靶器官,热应激诱导的氧化应激会引起造成肠道的损伤,如ROS攻击肠黏膜蛋白上的巯基,引起功能性蛋白的活性下降甚至功能丧失[68-69];而且,过氧化反应产物(丙二醛)破坏肠上皮细胞的紧密连接,增加肠黏膜屏障的通透性[70]。氨基酸营养物质如谷氨酰胺(glutamine,Gln)[71-72]和益生菌(地衣芽孢杆菌、植物乳杆菌、枯草芽孢杆菌等)[73-75]可改善热应激对动物肠道的负面影响。
Gln可作为能源物质满足肠上皮细胞和淋巴细胞的增殖分化的需要,维持肠道正常的功能;动物长期处于热应激时,内源性Gln无法满足机体的需求,补充Gln对改善肠道屏障能产生一定的积极效应[72]。有研究认为,Gln可能通过PI3K-Akt或NF-κB通路调节肠上皮细胞紧密连接结构,减少应激引起肠道黏膜通透性的改变[76]。而且,Gln可作为HSPs的诱导剂,上调HSPs的表达[77],进而提高机体的抗应激能力。另外,热应激常会引起动物肠道菌群的紊乱;而益生菌能竞争性抑制有害菌群的增殖,维持肠道菌群平衡[78-79]。饲用益生菌能上调热应激状态下,肉鸡空肠闭锁蛋白mRNA的表达、改善肠绒毛高度[80];益生菌可能通过减少TLRs-NF-κB通路的激活来缓解肠道炎症反应[75, 81]。另外,专家建议,益生菌与植物提取物、酸化剂或酶制剂等组合使用,会起到“1加1大于2”的应用效果[82],其具体的调节氧化应激、HSPs表达以及免疫功能的机制还缺乏足够的认识。
7 小结热应激诱发氧化应激是造成畜禽机体损伤的关键因素,氧化应激因子(ROS)和HSPs均可激活免疫和炎症反应;炎症反应上调ROS水平则可加剧氧化应激,而氧化应激又会损伤机体免疫系统;Nrf2通路和热休克反应在一定程度上可缓解热应激引起的氧化应激。本文归纳了热应激诱导畜禽氧化应激、热休克反应与免疫和炎症的机制及相互关系,并在此基础上总结一些营养调控缓解热应激的措施。然而,氧化应激、热休克反应与免疫和炎症这三者的更深层次联系及其机制仍有待研究。例如NF-κB能否或如何调控HSF1,即免疫和炎症反应对热休克反应的影响?另外,HSF1与Nrf2的上调都有利于清除ROS,它们是否存在密切联系?甚至,它们能否或如何影响线粒体的结构和功能?这些工作将有助于更深入的理解热应激发生和发展,并可为缓解畜禽热应激的营养调控提供新思路。
| [1] |
SEJIAN V, BHATTA R, GAUGHAN J B, et al. Review: adaptation of animals to heat stress[J]. Animal, 2018, 12(Suppl.2): S431-S444. |
| [2] |
BARRETT N W, ROWLAND K, SCHMIDT C J, et al. Effects of acute and chronic heat stress on the performance, egg quality, body temperature, and blood gas parameters of laying hens[J]. Poultry Science, 2019, 98(12): 6684-6692. DOI:10.3382/ps/pez541 |
| [3] |
BONI R. Heat stress, a serious threat to reproductive function in animals and humans[J]. Molecular Reproduction and Development, 2019, 86(10): 1307-1323. DOI:10.1002/mrd.23123 |
| [4] |
SURAI P F, KOCHISH I I, FISININ V I, et al. Antioxidant defence systems and oxidative stress in poultry biology: an update[J]. Antioxidants, 2019, 8(7): 235-270. DOI:10.3390/antiox8070235 |
| [5] |
SLIMEN I B, TAHA N, GHRAM A, et al. Heat stress effects on livestock: molecular, cellular and metabolic aspects, a review[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(3): 401-412. DOI:10.1111/jpn.12379 |
| [6] |
KURASHOVA N A, MADAEVA I M, KOLESNIKOVA L I. Expression of HSP70 heat-shock proteins under oxidative stress[J]. Advances in Gerontology, 2020, 10(1): 20-25. DOI:10.1134/S2079057020010099 |
| [7] |
SHAN Q, MA F T, WEI J Y, et al. Physiological functions of heat shock proteins[J]. Current Protein & Peptide Science, 2020, 21(8): 751-760. |
| [8] |
BOLHASSANI A, AGI E. Heat shock proteins in infection[J]. Clinica Chimica Acta, 2019, 498: 90-100. DOI:10.1016/j.cca.2019.08.015 |
| [9] |
LINGAPPAN K. NF-κB in oxidative stress[J]. Current Opinion in Toxicology, 2018, 7: 81-86. DOI:10.1016/j.cotox.2017.11.002 |
| [10] |
BARNA J, CSERMELY P, VELLAI T. Roles of heat shock factor 1 beyond the heat shock response[J]. Cellular and Molecular Life Sciences, 2018, 75(16): 2897-2916. DOI:10.1007/s00018-018-2836-6 |
| [11] |
AKBARIAN A, MICHIELS J, DEGROOTE J, et al. Association between heat stress and oxidative stress in poultry; mitochondrial dysfunction and dietary interventions with phytochemicals[J]. Journal of Animal Husbandry and Biotechnology, 2016, 7: 37-50. |
| [12] |
LIU L L, FU C X, YAN M L, et al. Resveratrol modulates intestinal morphology and HSP70/90, NF-κB and EGF expression in the jejunal mucosa of black-boned chickens on exposure to circular heat stress[J]. Food & Function, 2016, 7(3): 1329-1338. |
| [13] |
齐鸣, 谭碧娥. 自噬调节动物氧化应激反应的分子机制[J]. 动物营养学报, 2020, 32(9): 3993-4002. QI M, TAN B E. Molecular mechanism of autophagy regulating oxidative stress in animals[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 3993-4002 (in Chinese). |
| [14] |
恒景会, 田敏, 张世海, 等. 氧化应激对母畜乳腺功能的影响及其营养调控策略[J]. 动物营养学报, 2020, 32(12): 5587-5595. HENG J H, TIAN M, ZHANG S H, et al. Effects of oxidative stress on mammary gland function of female animals and its nutrition regulation strategy[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5587-5595 (in Chinese). |
| [15] |
MISHRA B, JHA R. Oxidative stress in the poultry gut: potential challenges and interventions[J]. Frontiers in Veterinary Science, 2019, 6: 60-64. DOI:10.3389/fvets.2019.00060 |
| [16] |
VENDITTI P, DI MEO S. The role of reactive oxygen species in the life cycle of the mitochondrion[J]. International Journal of Molecular Science, 2020, 21(6): 2173-2210. DOI:10.3390/ijms21062173 |
| [17] |
BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-keap1 signaling in oxidative and reductive stress[J]. Biochimica et Biophysica Acta: Molecular Cell Research, 2018, 1865(5): 721-733. DOI:10.1016/j.bbamcr.2018.02.010 |
| [18] |
LI R, JIA Z Q, ZHU H. Regulation of Nrf2 signaling[J]. Reactive Oxygen Species, 2019, 8(24): 312-322. |
| [19] |
JANUS P, PAKUȽA-CIS M G, KALINOWSKA-HEROK M, et al. NF-κB signaling pathway is inhibited by heat shock independently of active transcription factor HSF1 and increased levels of inducible heat shock proteins[J]. Genes to Cells, 2011, 16(12): 1168-1175. DOI:10.1111/j.1365-2443.2011.01560.x |
| [20] |
SIVANDZADE F, PRASAD S, BHALERAO A, et al. Nrf2 and NF-κB interplay in cerebrovascular and neurodegenerative disorders: molecular mechanisms and possible therapeutic approaches[J]. Redox Biology, 2019. DOI:10.1016/j.redox.2018.11.017 |
| [21] |
Yu M, LI H, LIU Q M, et al. Nuclear factor p65 interacts with Keap1 to repress the Nrf2-ARE pathway[J]. Cellular Signalling, 2011, 23(5): 883-892. DOI:10.1016/j.cellsig.2011.01.014 |
| [22] |
SURAI P F. Antioxidant systems in poultry biology: heat shock proteins[J]. Journal of Science, 2015, 5(12): 1188-1222. |
| [23] |
WIDȽAK P, GRAMATYKA M, KIMMEL M. Crosstalk between stress-induced NF-κB, p53 and HSF1 signaling pathways-review[J]. IFAC Proceedings Volumes, 2014, 47(4): 11518-11523. |
| [24] |
MUSTAFI S B, CHAKRABORTY P K, DEY R S, et al. Heat stress upregulates chaperone heat shock protein 70 and antioxidant manganese superoxide dismutase through reactive oxygen species (ROS), p38MAPK, and Akt[J]. Cell Stress and Chaperones, 2009, 14(6): 579-589. DOI:10.1007/s12192-009-0109-x |
| [25] |
杨桂菊, 张东霞. 黄芪多糖通过p38MAPK-HSP27通路减轻大鼠急性坏死性胰腺炎肺损伤[J]. 中国中医急症, 2017, 26(12): 2093-2096. YANG G G, ZHANG D X. A stragalus polysaccharides in reducing lung injury of rats with acute necrotizing pancreatitis by p38MAPK-HSP27 pathway[J]. Emergency of Traditional Chinese Medicine, 2017, 26(12): 2093-2096 (in Chinese). DOI:10.3969/j.issn.1004-745X.2017.12.007 |
| [26] |
VERKHRATSKY A, TREBAK M, PEROCCHI F, et al. Crosslink between calcium and sodium signalling[J]. Experimental Physiology, 2018, 103(2): 157-169. DOI:10.1113/EP086534 |
| [27] |
BOENGLER K, KOSIOL M, MAYR M, et al. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue[J]. Journal of Cachexia Sarcopenia and Muscle, 2017, 8(3): 349-369. DOI:10.1002/jcsm.12178 |
| [28] |
ROSSI A, PIZZO P, FILADI R. Calcium, mitochondria and cell metabolism: a functional triangle in bioenergetics[J]. Biochimica et Biophysica Acta: Molecular Cell Research, 2019, 1866(7): 1068-1078. DOI:10.1016/j.bbamcr.2018.10.016 |
| [29] |
刘吉茹, 张勇, 顾宪红. 动物机体热休克应答相关信号途径的研究进展[J]. 家畜生态学报, 2013, 34(7): 1-5. LIU J R, ZHANG Y, GU X H. A review on of signaling pathways related to heat shock response in animal[J]. Body Journal of Livestock Ecology, 2013, 34(7): 1-5 (in Chinese). DOI:10.3969/j.issn.1673-1182.2013.07.001 |
| [30] |
丛霞, 李华涛, 张东君, 等. Ca2+/CaM/CaMK调控热应激诱导小鼠胚胎成纤维细胞HSP72的表达[J]. 黑龙江大学自然科学学报, 2016, 33(6): 802-807. CONG X, LI H T, ZHANG D J, et al. Ca2+/CaM/CaMK regulating HSP72 expression in MEFs[J]. Journal of Natural Science of Heilongjiang University, 2016, 33(6): 802-807 (in Chinese). |
| [31] |
PARCELLIER A, SCHMITT E, BRUNET M, et al. Small heat shock proteins HSP27 and αB-crystallin: cytoprotective and oncogenic functions[J]. Antioxidants & Redox Signaling, 2005, 7(3/4): 404-413. |
| [32] |
CONCANNON C G, GORMAN A M, SAMALI A. On the role of HSP27 in regulating apoptosis[J]. Apoptosis, 2003, 8(1): 61-70. DOI:10.1023/A:1021601103096 |
| [33] |
唐姝, 徐蛟, 狄良娇, 等. 热休克蛋白的功能及其在畜牧业中的应用[J]. 南京农业大学学报, 2018, 41(4): 605-615. TANG S, XU J, DI L J, et al. The function and application of heat shock protein in animal breeding and veterinary medicine[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 605-615 (in Chinese). |
| [34] |
ZHANG J F, BAI K W, SU W P, et al. Curcumin attenuates heat-stress-induced oxidant damage by simultaneous activation of GSH-related antioxidant enzymes and Nrf2-mediated phase Ⅱ detoxifying enzyme systems in broiler chickens[J]. Poultry Science, 2018, 97(4): 1209-1219. DOI:10.3382/ps/pex408 |
| [35] |
ROUFAYEL R, KADRY S. Molecular chaperone HSP70 and key regulators of apoptosis: a review[J]. Current Molecular Medicine, 2019, 19(5): 315-325. DOI:10.2174/1566524019666190326114720 |
| [36] |
NAWAB A, AN L L, WU J, et al. Chicken Toll-like receptors and their significance in immune response and disease resistance[J]. International Reviews of Immunology, 2019, 38(6): 284-306. DOI:10.1080/08830185.2019.1659258 |
| [37] |
VIDYA M K, KUMAR V G, SEJIAN V, et al. Toll-like receptors: significance, ligands, signaling pathways, and functions in mammals[J]. International Reviews of Immunology, 2018, 37(1): 20-36. DOI:10.1080/08830185.2017.1380200 |
| [38] |
石璐璐, 徐元庆, 王哲奇, 等. 热应激诱发的氧化应激对羊的影响及其作用机制[J]. 动物营养学报, 2019, 31(7): 3016-3022. SHI L L, XU Y Q, WANG Z Q, et al. Effects of oxidative stress induced by heat stress and its mechanism in sheep and goats[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3016-3022 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.07.011 |
| [39] |
魏小林, 谢敏. NALP3炎性复合体与MAPK、NF-κB及ROS信号通路之间的关系[J]. 国际呼吸杂志, 2015, 6(6): 476-480. WEI X L, XIE M. Relationship between Nalp-3 inflammasome and MAPK, NF-κB, ROS signal pathway[J]. International Respiratory Journal, 2015, 6(35): 476-480 (in Chinese). |
| [40] |
MARTINON F. Signaling by ROS drives inflammasome activation[J]. European Journal of Immunology, 2010, 40(3): 616-619. DOI:10.1002/eji.200940168 |
| [41] |
LIAN P Q, BRABER S, GARSSEN J, et al. Beyond heat stress: intestinal integrity disruption and mechanism-based intervention strategies[J]. Nutrients, 2020, 12(3): 734-765. DOI:10.3390/nu12030734 |
| [42] |
阎辉, 毛湘冰, 余冰, 等. 基于生猪疾病模型探讨营养对免疫的调控作用[J]. 动物营养学报, 2020, 32(10): 4471-4479. YAN H, MAO X B, CHEN B, et al. Nutritional regulation on immunity based on pig disease model[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4471-4479 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.001 |
| [43] |
高婷, 王子旭, 陈祝茗, 等. ROS介导的氧化应激与自噬[J]. 中国畜牧兽医, 2018, 45(3): 656-662. GAO T, WANG Z X, CHEN Z M, et al. Oxidative stress and autophagy mediated by reactive oxygen species[J]. Chinese Animal Husbandry and Veterinarian, 2018, 45(3): 656-662 (in Chinese). |
| [44] |
WU L P, HU C H, HUANG M Y, et al. Heat shock transcription factor 1 attenuates TNFα-induced cardiomyocyte death through suppression of NF-κB pathway[J]. Gene, 2013, 527(1): 89-94. DOI:10.1016/j.gene.2013.05.024 |
| [45] |
COSTA-BEBER L C, HIRSCH G E, HECK T G, et al. Chaperone duality: the role of extracellular and intracellular HSP70 as a biomarker of endothelial dysfunction in the development of atherosclerosis[J]. Archives of Physiology and Biochemistry, 2020. DOI:10.1080/13813455.2020.1745850 |
| [46] |
DE MAIO A. Extracellular HSP70:export and function[J]. Current Protein & Peptide Science, 2014, 15(3): 225-231. |
| [47] |
邓鸿敖, 张红艳, 熊林朋, 等. 细胞外热休克蛋白70对严重烫伤大鼠肠道免疫功能的影响[J]. 中华烧伤杂志, 2016, 32(5): 272-276. DENG H A, ZHANG H Y, XIONG L P, et al. Effects of extracellular heat shock protein 70 on intestinal immune function of rats with severe scald[J]. Chinese Journal of Burn, 2016, 32(5): 272-276 (in Chinese). DOI:10.3760/cma.j.issn.1009-2587.2016.05.004 |
| [48] |
INOUYE S, HATORI Y, KUBO T, et al. Nrf2 and HSF1 coordinately regulate heme oxygenase-1 expression[J]. Biochemical and Biophysical Research Communications, 2018, 506(1): 7-11. DOI:10.1016/j.bbrc.2018.10.030 |
| [49] |
NAIDU S D, KOSTOV R V, DINKOVA-KOSTOVA A T. Transcription factors HSF1 and Nrf2 engage in crosstalk for cytoprotection[J]. Trends in Pharmacological Sciences, 2015, 36(1): 6-14. DOI:10.1016/j.tips.2014.10.011 |
| [50] |
JIANG T, HARDER B, DE LA VEGA M R, et al. p62 links autophagy and Nrf2 signaling[J]. Free Radical Biology and Medicine, 2015, 88: 199-204. DOI:10.1016/j.freeradbiomed.2015.06.014 |
| [51] |
SURAI P F, KOCHISH I I, FISININ V I. Antioxidant systems in poultry biology: nutritional modulation of vitagenes[J]. European Poultry Science, 2017. DOI:10.1399/eps.2017.214 |
| [52] |
石惠宇. 维生素A通过Nrf2/谷胱甘肽过氧化物酶1/NF-κB信号通路缓解奶牛乳腺上皮细胞氧化应激的机理研究[D]. 博士学位论文. 呼和浩特: 内蒙古农业大学, 2018. SHI H Y.The mechanism on vitamin A alleviating oxidative stress in the bovine mammary epithelial cells by Nrf2/glutathione peroxidase 1/NF-κB signaling pathway[D].Ph.D.Thesis.Hohhot: Inner Mongolia Agricultural University, 2018.(in Chinese) |
| [53] |
SUN L H, HUANG J Q, DENG J, et al. Avian selenogenome: response to dietary Se and vitamin E deficiency and supplementation[J]. Poultry Science, 2019, 98(10): 4247-4254. DOI:10.3382/ps/pey408 |
| [54] |
SHAKERI M, OSKOUEIAN E, LE H H, et al. Strategies to combat heat stress in broiler chickens: unveiling the roles of selenium, vitamin E and vitamin C[J]. Veterinary Sciences, 2020, 7(2): 71-90. DOI:10.3390/vetsci7020071 |
| [55] |
MIYAZAWA T, BURDEOS G C, ITAYA M, et al. Vitamin E: regulatory redox interactions[J]. Iubmb Life, 2019, 71(4): 430-441. DOI:10.1002/iub.2008 |
| [56] |
ADITYA M, PRAGATI P, SINGH H S, et al. Effect of ascorbic acid on mRNA expression of HSP70 gene in WLH egg type growers during heat stress[J]. Journal of Animal Research, 2017, 7(5): 821-825. DOI:10.5958/2277-940X.2017.00126.7 |
| [57] |
LIU H, YU Q F, TANG X P, et al. Effect of selenium on performance, egg quality, egg selenium content and serum antioxidant capacity in laying hens[J]. Pakistan Journal of Zoology, 2020, 52(2): 635-640. |
| [58] |
STEFANELLO C, SANTOS T C, MURAKAMI A E, et al. Productive performance, eggshell quality, and eggshell ultrastructure of laying hens fed diets supplemented with organic trace minerals[J]. Poultry Science, 2014, 93(1): 104-113. DOI:10.3382/ps.2013-03190 |
| [59] |
符臻鸣, 杨海明, 刘金河, 等. 锌在蛋鸡生产中的研究进展[J]. 家畜生态学报, 2019, 40(11): 6-11, 44. FU Z M, YANG H M, LIU J H, et al. Research progress of zinc in laying hen production[J]. Journal of Domestic Animal Ecology, 2019, 40(11): 6-11, 44 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.11.002 |
| [60] |
朱春梅, 张凌洪, 王军. 锌和维生素C对热应激条件下肉鸡生长性能和免疫反应的影响[J]. 中国饲料, 2019(16): 87-90. ZHU C M, ZHANG L H, WANG J. Effects of zinc and vitamin C on growth performance and immune response of broilers under heat stress[J]. Chinese Feed, 2019(16): 87-90 (in Chinese). |
| [61] |
HE S P, YU Q F, HE Y J, et al. Dietary resveratrol supplementation inhibits heat stress-induced high-activated innate immunity and inflammatory response in spleen of yellow-feather broilers[J]. Poultry Science, 2019, 98(12): 6378-6387. DOI:10.3382/ps/pez471 |
| [62] |
SAHIN K, ORHAN C, AKDEMIR F, et al. Resveratrol protects quail hepatocytes against heat stress: modulation of the Nrf2 transcription factor and heat shock proteins[J]. Journal of Animal Physiology and Animal Nutrition, 2012, 96(1): 66-74. DOI:10.1111/j.1439-0396.2010.01123.x |
| [63] |
REN Z H, WANG L, CUI J H, et al. Resveratrol inhibits NF-κB signaling through suppression of p65 and IκB kinase activities[J]. Pharmazie, 2013, 68(8): 689-694. |
| [64] |
JIANG W, IBTISHAM F, NIU Y F, et al. Curcumin inhibits heat-induced oxidative stress by activating the MAPK-Nrf2/ARE signaling pathway in chicken fibroblasts cells[J]. Journal of Thermal Biology, 2018, 79: 112-119. |
| [65] |
ZHANG J F, BAI K W, HE J T, et al. Curcumin attenuates hepatic mitochondrial dysfunction through the maintenance of thiol pool, inhibition of mtDNA damage, and stimulation of the mitochondrial thioredoxin system in heat-stressed broilers[J]. Journal of Animal Science, 2018, 96(3): 867-879. DOI:10.1093/jas/sky009 |
| [66] |
RATRIYANTO A, MOSENTHIN R. Osmoregulatory function of betaine in alleviating heat stress in poultry[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(6): 1634-1650. DOI:10.1111/jpn.12990 |
| [67] |
LI C M, WANG Y R, LI L, et al. Betaine protects against heat exposure-induced oxidative stress and apoptosis in bovine mammary epithelial cells via regulation of ROS production[J]. Cell Stress and Chaperones, 2019, 24(2): 453-460. DOI:10.1007/s12192-019-00982-4 |
| [68] |
WANG Y J, CHEN Y, ZHANG X Y, et al. New insights in intestinal oxidative stress damage and the health intervention effects of nutrients: a review[J]. Journal of Functional Foods, 2020. DOI:10.1016/j.jff.2020.104248 |
| [69] |
陈凤鸣, 陈佳亿, 彭伟, 等. 氧化应激对猪肠道损伤机制的研究进展[J]. 动物营养学报, 2018, 30(8): 2887-2893. CHEN F M, CHEN J Y, PENG W, et al. Research progress of oxidative stress on mechanism of intestinal damage in pigs[J]. Chinese Journal of Animal Nutrition, 2018, 30(8): 2887-2893 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.08.002 |
| [70] |
SUZUKI T. Regulation of intestinal epithelial permeability by tight junctions[J]. Cellular and Molecular Life Sciences, 2013, 70(4): 631-659. DOI:10.1007/s00018-012-1070-x |
| [71] |
HU H, CHEN L, DAI S F, et al. Effect of glutamine on antioxidant capacity and lipid peroxidation in the breast muscle of heat-stressed broilers via antioxidant genes and HSP70 pathway[J]. Animals, 2020, 10(3): 404-413. DOI:10.3390/ani10030404 |
| [72] |
WU Q J, JIAO C, LIU Z H, et al. Effects of glutamine supplementation on performance, mucosal enzymes and intestinal characteristics in broilers[J]. Animal Nutrition and Feed Technology, 2020, 20(2): 243-255. DOI:10.5958/0974-181X.2020.00022.0 |
| [73] |
XIANG Q H, WANG C, ZHANG H, et al. Effects of different probiotics on laying performance, egg quality, oxidative status, and gut health in laying hens[J]. Animals, 2019, 9(12): 1110-1119. DOI:10.3390/ani9121110 |
| [74] |
YANG J J, KAI Z, ZHANG M H. Effects of the use of a combination of two bacillus species on performance, egg quality, small intestinal mucosal morphology, and cecal microbiota profile in aging laying hens[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1): 204-213. DOI:10.1007/s12602-019-09532-x |
| [75] |
YANG J, QIU Y, HU S, et al. Lactobacillus plantarum inhibited the inflammatory response induced by enterotoxigenic Escherichia coli K88 via modulating MAPK and NF-κB signalling in intestinal porcine epithelial cells[J]. Journal of Applied Microbiology, 2020. DOI:10.1111/jam.14835 |
| [76] |
LI N, JNEU J. Glutamine deprivation alters intestinal tight junctions via a PI3-K/Akt mediated pathway in Caco-2 cells[J]. Journal of Nutrition, 2009, 139(4): 710-714. DOI:10.3945/jn.108.101485 |
| [77] |
BOURGOIN-VOILLARD S, GORON A, SEVE M, et al. Regulation of the proteome by amino acids[J]. Proteomics, 2016, 16(5): 831-846. DOI:10.1002/pmic.201500347 |
| [78] |
JUDKINS T C, ARCHER D L, KRAMER D C, et al. Probiotics, nutrition, and the small intestine[J]. Current Gastroenterology Reports, 2020. DOI:10.1007/s11894-019-0740-3 |
| [79] |
JING W, JI H F. Tight junction proteins in the weaned piglet intestine: roles and regulation[J]. Current Protein & Peptide Science, 2019, 20(7): 652-660. |
| [80] |
SONG J, XIAO K, KE Y L, et al. Effect of a probiotic mixture on intestinal microflora, morphology, and barrier integrity of broilers subjected to heat stress[J]. Poultry Science, 2014, 93(3): 581-588. DOI:10.3382/ps.2013-03455 |
| [81] |
RODRIGUEZ A V, GRIET M. NF-κB in anti-inflammatory activity of probiotics: an update[J]. Current Immunology Reviews, 2016, 12(2): 74-82. |
| [82] |
印遇龙, 杨哲. 天然植物替代饲用促生长抗生素的研究与展望[J]. 饲料工业, 2020, 41(24): 1-7. YIN Y L, YANG Z. Research and prospect of natural plant substitute for antibiotic growth promoters in feed[J]. Feed Industry, 2020, 41(24): 1-7 (in Chinese). |




