2. 中国水产科学研究院长江水产研究所, 农业农村部淡水生物多样性保护重点实验室, 武汉 430223;
3. 长江大学动物科学学院, 荆州 434020
2. Key Laboratory of Freshwater Biodiversity Conservation, Ministry of Agriculture and Rural Affairs of China, Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;
3. College of Animal Science, Yangtze University, Jingzhou 434020, China
二十碳五烯酸(C20 ∶ 5n-3,EPA)和二十二碳六烯酸(C22 ∶ 6n-3,DHA)等长链多不饱和脂肪酸(LC-PUFA)是最重要的多不饱和脂肪酸(PUFA),具有调节脂质代谢的能力[1]。鱼油因富含EPA和DHA及适口性好等优点,在鱼类饲料的生产中被广泛使用[2]。但因资源受限、价格高昂以及鱼油中二噁英和多氯联苯类有毒物质等影响,在饲料配方中以来源广泛和价格低廉的植物油或动物油取代鱼油已成为趋势[3]。诸多研究证明,在饲料中添加缺乏LC-PUFA的植物油可能会导致鱼体肝脏脂肪含量过高或者肌肉EPA和DHA含量过低,进而降低肌肉的营养价值,并对鱼类健康产生负面影响[4-9]。然而,很少有研究全面关注这些指标。
鲟鱼属鲟形目鱼类,全球现存2科6属27种,均处于不同程度的濒危状态[10]。其肉质脂肪少且富含n-3高不饱和脂肪酸(HUFA),具有极高的经济价值[11]。我国是鲟鱼养殖大国,占世界鲟鱼养殖总产量的80%以上,2019年我国鲟鱼养殖产量约为10.2万t[12-13]。目前,国内养殖的商业鲟鱼主要有达乌尔鳇(Huso dauricus)、西伯利亚鲟(A. baerii)、施氏鲟(A.schrenckii)、俄罗斯鲟(A.gueldenstaedti)、匙吻鲟(Polyodon spathula)以及多种组合的杂交种[13]。杂交鲟具有生长速度快、抗病性强和经济效益高等优势,其中西伯利亚鲟×施氏鲟的杂交种(A. baerii ♀×A. schrenckii),俗称“西杂”,是我国目前主要的鲟鱼养殖品种[10]。鲟鱼商业饲料中的粗脂肪含量较高,粗脂肪含量通常大于10%,饲料中的油脂所占成本较高[12]。而鱼油极易被氧化,在养殖过程中会对鱼体生长和健康产生不利影响[10]。已有研究表明,在鱼类饲料中添加适宜的植物油替代鱼油可以取得良好的生长效果。罗琳等[14]和Liu等[15]也研究得出,适宜的大豆油和亚麻油可以作为杂交鲟饲料中鱼油的替代品。Yu等[16]研究了以鱼油、大豆油、花生油、葵花籽油、玉米油和菜籽油作为脂肪源对杂交鲟幼鱼生长、鱼体健康和脂肪酸组成的影响。目前,有关不同饲料脂肪源对杂交鲟幼鱼相关脂肪代谢酶活性、表观消化率及棕榈油作为杂交鲟饲料脂肪源等方面的研究还未见报道。因此,本研究以鱼油、大豆油、亚麻油、菜籽油和棕榈油作为脂肪源,探究不同脂肪源对杂交鲟幼鱼生长性能、体成分、养分表观消化率、肝脏脂肪代谢酶活性和血清生化指标的影响,为杂交鲟幼鱼配合饲料配方提供参考依据,也为鱼类饲料脂肪源研究提供基础数据。
1 材料与方法 1.1 试验饲料以鱼粉、豆粕和玉米蛋白粉作为蛋白质源,小麦面粉作为糖源,分别以鱼油、大豆油、菜籽油、亚麻油和棕榈油作为脂肪源,配制5种等氮等能的试验饲料,试验饲料组成及营养水平见表 1。饲料原料经粉碎后过60目分级筛,按表 1的比例精准称重,充分混匀,含量较低的饲料原料采用逐级预混法添加。采用32型制粒机(浙江民益食品机械有限公司)将饲料原料加工成直径约为2.0 mm的长条状饲料,烘干破碎后将饲料密封放置于-20 ℃冰柜中备用。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料脂肪酸组成(占总脂肪酸的百分比) Table 2 Fatty acid composition of experimental diets (percentage of total fatty acids) |
试验鱼购自武汉少潭河农业生态有限公司,养殖试验于该公司养殖基地进行。正式试验开始前2周将杂交鲟幼鱼转入聚乙烯养殖桶中暂养,并投喂自制基础饲料,使试验鱼适应饲料和养殖环境。基础饲料以混合油(鱼油∶大豆油∶亚麻油∶菜籽油∶棕榈油=1 ∶ 1 ∶ 1 ∶ 1 ∶ 1)为脂肪源,其他各原料组成按表 1进行配制。试验开始时挑选300尾健康无损伤、规格一致、初始体重(76.59±1.16) g的试验鱼,随机分配到15个直径1.2 m、高0.5 m、水深0.3 m、容量200 L的圆柱形聚乙烯养殖桶中。试验设5个组,每组3个重复,每个重复20尾鱼。养殖周期为8周。采用表观饱食法每天投喂3次,投喂时间分别为08:00、14:00和19:00。投喂结束0.5 h后进行换水,每次换水量为总水量的1/3。每天记录试验鱼死亡数量。试验采用流水养殖,养殖用水为水库水,养殖期间水温18.4~21.5 ℃,溶解氧含量6.5~8.0 mg/L,pH为7.4~7.8,氨氮含量<0.1 mg/L,亚硝酸盐含量<0.05 mg/L。
1.3 样品采集在投喂完试验鱼后1 h开始收集粪便,将收集的粪便转移至密封袋并保存于-20 ℃冰箱中待测。养殖试验结束时,将试验鱼禁食24 h后对每个养殖桶的鱼进行称重,用以计算增重率(weight gain rate,WGR)和饲料系数(feed coefficient ratio,FCR)。每个养殖桶随机取3尾鱼,麻醉(MS-222,120 mg/L)后测量体重和体长,用以计算肥满度(condition factor,CF)。用2 mL注射器于尾静脉采血,3 500 r/min离心10 min后取血清,置于-80 ℃冰箱中保存,用以测定血清生化指标。随后取内脏和肝脏并称重,用以计算脏体比(visceralsomatic index,VSI)和肝体比(hepatosomatic index,HSI),并将肝脏置于-80 ℃冰箱中保存,用以测定肝脏常规成分含量和脂肪代谢酶活性。最后取背部肌肉置于-20 ℃冰箱中保存,用以测定肌肉常规成分含量。每个养殖桶另取3尾鱼放入自封袋,置于-20 ℃冰箱中保存,用以测定全鱼常规成分含量。
1.4 样品测定饲料、全鱼、肌肉、肝脏及粪便水分含量采用105 ℃干燥法(GB/T 5009.3—2003测定),粗蛋白质含量采用凯氏定氮法(GB/T 5009.3—2003测定),粗脂肪含量采用索氏抽提法(GB/T 5009.6—2003测定),粗灰分含量采用550 ℃灼烧法(GB/T 5009.4—2003测定)。二氧化钛(TiO2)含量参照参考文献[17]的方法测定。饲料和全鱼脂肪酸含量测定使用气相色谱仪(GC-2010 plus,日本岛津公司),采用GB/T 17377—2008方法测定。肝脏脂肪代谢酶活性采用南京建成生物工程研究所生产的相关试剂盒测定,相应操作均参照说明书进行。血清生化指标采用全自动生化分析仪(BS-460,深圳迈瑞生物医疗电子股份有限公司)测定。
1.5 计算公式

|
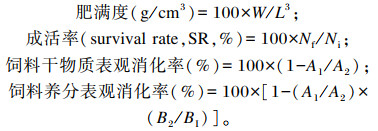
|
式中:Wf代表终末体重(g);Wi代表初始体重(g);t为试验天数(d);IT代表总摄食饲料干重(g);Nf代表试验初始鱼尾数;Ni代表试验终末鱼尾数;Wv代表鱼体内脏质量(g);Wh代表鱼体肝脏质量(g);W代表鱼体体重(g);L代表鱼体体长(cm);A1代表饲料中二氧化钛含量;A2代表粪便中二氧化钛含量;BI代表饲料中某种营养成分含量;B2代表粪便中某种营养成分含量。
1.6 数据处理数据经Excel 2010整理后,利用SPSS 20.0统计软件中的ANOVA过程进行单因素方差分析,并采用Duncan氏法进行多重比较,并进行了双变量的相关性分析,显著水平为P < 0.05。试验结果采用“平均值±标准误(mean±SE)”表示。
2 结果 2.1 饲料中不同脂肪源对杂交鲟幼鱼生长性能和形体指标的影响由表 3可知,各组之间成活率、肥满度和脏体比均无显著差异(P>0.05)。大豆油组的终末体重和增重率最高,大豆油组的终末体重显著高于亚麻油组、菜籽油组和棕榈油组(P<0.05),大豆油组的增重率显著高于鱼油组、亚麻油组、菜籽油组和棕榈油组(P<0.05)。大豆油组的特定生长率显著高于棕榈油组(P<0.05)。大豆油组的摄食量显著低于棕榈油组(P<0.05)。棕榈油组的饲料系数显著高于大豆油组(P<0.05)。亚麻油组的肝体比显著高于鱼油组和棕榈油组(P<0.05)。
|
|
表 3 饲料中不同脂肪源对杂交鲟幼鱼生长性能和形体指标的影响 Table 3 Effects of different lipid sources in diet on growth performance and morphological indices of juvenile hybrid sturgeon |
由表 3可知,各组之间粗蛋白质表观消化率无显著差异(P>0.05)。鱼油组和大豆油组的干物质表观消化率显著高于菜籽油组和棕榈油组(P<0.05)。大豆油组的粗脂肪表观消化率最高,且显著高于亚麻油组和菜籽油组(P<0.05),与鱼油组和棕榈油组无显著差异(P>0.05)。
|
|
表 4 饲料中不同脂肪源对杂交鲟幼鱼养分表观消化率的影响 Table 4 Effects of different lipid sources in diet on nutrient apparent digestibilities of juvenile hybrid sturgeon |
由表 5可知,各组之间全鱼水分、粗蛋白质和粗灰分含量,肌肉水分、粗蛋白质和粗灰分含量以及肝脏水分含量均无显著差异(P>0.05)。亚麻油组的全鱼和肝脏粗脂肪含量显著高于其他各组(P<0.05)。鱼油组的肌肉粗脂肪含量显著低于其他各组(P<0.05)。亚麻油组的肝脏粗蛋白质含量显著低于其他各组(P<0.05)。
|
|
表 5 饲料中不同脂肪源对杂交鲟幼鱼全鱼、肌肉和肝脏常规成分的影响 Table 5 Effects of different lipid sources in diet on proximate composition in whole body, muscle and liver of juvenile hybrid sturgeon |
由表 6可知,棕榈油组的全鱼脂肪酸中棕榈酸(C16 ∶ 0)含量显著高于其他各组(P<0.05)。鱼油组和棕榈油组的全鱼脂肪酸中饱和脂肪酸含量显著高于其他各组(P<0.05)。大豆油组的全鱼脂肪酸中亚油酸含量显著高于其他各组(P<0.05)。亚麻油组的全鱼脂肪酸中亚麻酸含量最高,显著高于除大豆油组的其他各组(P<0.05)。大豆油组的全鱼脂肪酸中PUFA含量显著高于其他各组(P<0.05)。鱼油组的全鱼脂肪酸中EPA+DHA含量显著高于其他各组(P<0.05)。
|
|
表 6 饲料中不同脂肪源对杂交鲟幼鱼全鱼脂肪酸组成的影响(占总脂肪酸的百分比) Table 6 Effects of different lipid sources in diet on whole body fatty acid composition of juvenile hybrid sturgeon (percentage of total fatty acids) |
由表 7可知,全鱼脂肪酸组成明显反映了试验饲料脂肪酸组成,其中各组存在极显著的相关性,相关系数均大于0.974。
|
|
表 7 试验饲料脂肪酸组成与全鱼脂肪酸回归分析和相关性分析 Table 7 Regression analysis and correlation analysis on fatty acid composition of experimental diets and fatty acid composition of whole body |
由表 8可知,各组之间肝脏肝脂酶和总脂酶活性均无显著差异(P>0.05)。鱼油组和大豆油组的肝脏脂肪酶活性显著高于其他各组(P<0.05)。亚麻油组的肝脏脂蛋白脂酶活性显著高于棕榈油组(P<0.05)。
|
|
表 8 饲料中不同脂肪源对杂交鲟幼鱼肝脏脂肪代谢酶活性的影响 Table 8 Effects of different lipid sources in diet on liver lipid metabolism enzyme activities of juvenile hybrid sturgeon |
由表 9可知,各组之间血清葡萄糖、白蛋白和高密度脂蛋白胆固醇含量及谷丙转氨酶活性均无显著差异(P>0.05)。棕榈油组的血清谷草转氨酶活性显著高于鱼油组、大豆油组和菜籽油组(P<0.05)。菜籽油组的血清总蛋白含量显著低于其他各组(P<0.05)。大豆油组的血清总胆固醇含量最低,且显著低于亚麻油组、菜籽油组和棕榈油组(P<0.05)。棕榈油组的血清甘油三酯含量显著高于菜籽油组(P<0.05)。菜籽油组的血清低密度脂蛋白胆固醇含量显著高于大豆油组(P<0.05)。
|
|
表 9 饲料中不同脂肪源对杂交鲟幼鱼血清生化指标的影响 Table 9 Effects of different lipid sources in diet on serum biochemical parameters of juvenile hybrid sturgeon |
研究表明,饲料中脂肪源之间差异实质是脂肪酸组成和比例的差异,而不同脂肪源中必需脂肪酸含量和比例的不同对鱼类生长产生的影响也不尽相同[18]。Tocher[19]研究表明,饲料中适宜的亚麻酸和亚油酸可以满足淡水鱼对必需脂肪酸的需求,而亚麻酸和亚油酸不能满足海水鱼对必需脂肪酸的需求,需要在饲料中添加EPA和DHA。本试验中,鱼油组饲料中DHA和EPA含量最高,大豆油组饲料中亚油酸含量最高。而本试验中除大豆油组外其他3组与鱼油组之间增重率差异不显著。这表明饲料中适宜的亚麻酸和亚油酸含量可以满足杂交鲟幼鱼的生长,且大豆油组亚油酸含量对杂交鲟幼鱼生长有促进作用。有趣的是,Liu等[15]研究发现,以大豆油替代鱼油作为饲料脂肪源对杂交鲟的生长无显著影响。而Yu等[16]研究却表明,以大豆油作为饲料脂肪源降低了杂交鲟的生长性能。这可能是由于杂交鲟在不同的生长阶段对必需脂肪酸的需求不同。本试验中,鱼油组的增重率较大豆油组低,这表明大豆油组饲料中脂肪酸比例较鱼油组更适合杂交鲟幼鱼的生长。鱼油组的饲料中亚油酸含量低于大豆油组可能是鱼油组增重率低于大豆油组的主要原因[20-21]。有关鱼油对杂交鲟的促生长作用仍有待于更深入地研究。
肥满度、脏体比和肝体比可以反映鱼体营养和健康状况[22]。在对大西洋鲑(Salmo salar L.)[22]和框鳞镜鲤(Cyprinus carpio var. specularis)[23]等的研究中发现,饲料中不同脂肪源对鱼体的肥满度、肝体比和脏体比无显著影响。本试验中,不同脂肪源对鱼体肥满度和脏体比没有显著影响。刘阳洋等[24]研究发现,肝脏脂肪含量的增加会导致脂肪细胞体积变大,从而容纳更多脂肪,进而造成鱼体肝体比增大。这也可能是本试验亚麻油组的肝体比最高且显著高于鱼油组和棕榈油组的原因。
3.2 饲料中不同脂肪源对杂交鲟幼鱼养分表观消化率的影响消化率是评估水产饲料原料适宜性的重要因素之一。Mozanzadeh等[25]研究表明,动物的生长与饲料中养分的表观消化率密切相关。本研究中,大豆油组的干物质和粗脂肪表观消化率均高于其他各组,这与大豆油组的生长性能结果一致。饲料中饱和脂肪酸C16 ∶ 0和C18 ∶ 0含量过高时会导致动物对粗脂肪和干物质的表观消化率降低[26]。本研究中,菜籽油组饲料C16 ∶ 0含量高于其他各组,菜籽油组和棕榈油组饲料C18 ∶ 0含量高于其他各组。这可能是造成菜籽油组的干物质和粗脂肪表观消化率低于其他各组的原因,同时也导致了菜籽油组和棕榈油组的饲料系数高于其他各组。
3.3 饲料中不同脂肪源对杂交鲟幼鱼全鱼、肌肉和肝脏常规成分的影响研究表明,饲料原料的组成显著影响鱼体成分[27]。本研究中,饲料中不同脂肪源对杂交鲟幼鱼全鱼、肌肉和肝脏的常规成分的差异主要表现在粗蛋白质和粗脂肪含量上,亚麻油组的全鱼和肝粗脂肪含量显著高于其他各组,该结果提示在饲料中添加亚麻油促进了鱼体全鱼和肝脏脂肪的沉积。这与吉富罗非鱼(Oreochromis niloticus)[28]的研究结果类似。研究表明,饲料中n-6PUFA含量较高会导致鱼体肝脏脂肪含量增高,肝脏脂肪含量的增加使得被转运到各组织中的脂肪含量增加[29]。这可能是亚麻油组全鱼和肝脏粗脂肪含量偏高的原因。同时,由于肝脏转运脂肪能力有限,大量的脂肪无法运出时会导致鱼体对蛋白质的吸收能力和沉积率降低[29]。本试验中,亚麻油组的肝脏粗蛋白质含量最低也印证了这一观点。马晶晶等[30]研究发现,HUFA能抑制脂类合成,其中DHA通过抑制脂肪包被蛋白的表达加速脂肪分解,是脂肪合成的关键抑制因子。而本试验中鱼油组肌肉粗脂肪含量显著低于菜籽油组和棕榈油组,这表明在饲料中添加适量鱼油有利于减少鱼体肌肉脂肪的沉积。
3.4 饲料中不同脂肪源对杂交鲟幼鱼全鱼脂肪酸组成的影响鱼体全鱼组织中脂肪酸组成受饲料中脂肪酸组成影响[31]。本研究发现,全鱼脂肪酸组成与饲料脂肪酸组成有极显著正相关性,相关系数均在0.95以上,其中鱼油组全鱼EPA+DHA含量显著高于植物油组,大豆油组全鱼亚油酸含量显著高于其他各组,亚麻油组全鱼亚麻酸含量显著高于其他各组,棕榈油组全鱼棕榈酸含量显著高于其他各组。在饲料中组成存在相同趋势,这表明在一定程度上饲料中脂肪酸组成决定了鱼体脂肪酸组成。在欧洲鳇(Huso huso)[32]和大菱鲆(Scophthalmus maximus)[33]中也有过相同的报道。
Yang等[34]研究表明,鱼类在脂肪代谢过程中,优先利用饲料中亚油酸并保留饲料中EPA和DHA等PUFA。本试验中,植物油组全鱼EPA和DHA含量均高于饲料中EPA和DHA的含量,这表明杂交鲟可以通过饲料中亚油酸和亚麻酸合成EPA和DHA。该结果与罗琳等[14]和刘彩霞等[35]对杂交鲟的研究结果一致。饲料是养殖鱼类生长所需EPA和DHA的主要来源[32]。本试验中,全鱼DHA含量明显高于EPA含量,这表明杂交鲟幼鱼对DHA的吸收利用能力要大于EPA,在吉富罗非鱼[28]中也出现了相同结果。这可能是因为DHA的△4双键需要通过过氧化氢酶体的氧化去除,而造成DHA在线粒体中很少被氧化,因而DHA比EPA更容易被鱼体选择性的保留[36]。
3.5 饲料中不同脂肪源对杂交鲟幼鱼肝脏脂肪代谢酶活性的影响脂肪酶是体内脂肪分解的主导酶,其活性可以反映机体对脂肪的利用能力[37]。本试验发现,鱼油组和大豆油组的肝脏脂肪酶活性显著高于其他各组。这表明在饲料中添加鱼油和大豆油可以更好地促进鱼体对脂肪的降解和吸收,提高鱼体对脂肪的利用效率[37]。而脂蛋白脂酶主要催化血浆中乳糜颗粒和极低密度脂蛋白,将甘油三酯水解成甘油和脂肪酸[38]。本试验中,亚麻油组的肝脏脂蛋白脂酶活性显著高于棕榈油组,这可能是由于亚麻油组饲料中PUFA含量高于棕榈油组,PUFA促进肝脏脂蛋白脂酶基因mRNA的表达作用加强,进而诱导肝脏脂蛋白脂酶合成增加。郑珂珂等[39]研究表明,脂蛋白脂酶活性的升高会导致肝脏游离脂肪酸含量增加,进而增加脂肪肝的风险。这也与上文中亚麻油组肝体比最高的结果对应。
3.6 饲料中不同脂肪源对杂交鲟幼鱼血清生化指标的影响鱼类血清生化指标的变化可以间接反映鱼类的营养和健康状况[40]。血清总蛋白含量能准确反映机体蛋白质的吸收与代谢情况[41]。本试验中,菜籽油组的血清总蛋白含量显著低于其他各组,这表明菜籽油可能降低了试验鱼对蛋白质的吸收能力,进而对鱼体营养状况产生不利影响[41]。血清谷丙转氨酶和谷草转氨酶活性是评价肝脏健康的指标,肝脏细胞损伤会导致其活性升高[42]。本试验中,棕榈油组的血清谷草转氨酶活性最高,表明在饲料中添加棕榈油可能对鱼体肝脏造成损伤[42];棕榈油组的血清谷草转氨酶活性最高,表明在饲料中添加棕榈油可能对鱼体肝脏造成损伤[42]。血清高密度脂蛋白和低密度脂蛋白负责机体胆固醇转运[43]。Nordoy等[43]研究表明,饲料中PUFA具有降胆固醇的效果;而本试验中缺乏PUFA的棕榈油组血清低密度脂蛋白胆固醇和总胆固醇含量最高也印证了这一观点。此外,棕榈油组的血清低密度脂蛋白胆固醇含量最高的原因可能与胆固醇酰基转移酶(ACAT)的活性有关,ACAT优先利用不饱和脂肪酸作为酯化底物,将游离胆固醇酯化形成胆固醇酯,因此富含不饱和脂肪酸的棕榈油增加了ACAT活性,进而更多的胆固醇酯被运送到低密度脂蛋白中,增加了血清低密度脂蛋白胆固醇含量[15]。本试验中,饲料中亚麻酸含量丰富的菜籽油组的血清甘油三酯的含量显著低于棕榈油组。这可能是因为HUFA能抑制鱼体甘油三酯的合成,亚麻酸作为合成DHA和EPA的前体物质,对抑制鱼体甘油三酯的合成具有促进作用[44]。
4 结论综上所述,从杂交鲟的生长性能、养分表观消化率、体成分、肝脏脂肪代谢酶活性和血清生化指标来看,饲料中添加大豆油作为脂肪源更有利于杂交鲟幼鱼的生长和健康。
| [1] |
FLACHS P, ROSSMEISL M, KOPECKY J. The effect of n-3 fatty acids on glucose homeostasis and insulin sensitivity[J]. Physiological Research, 2014, 63(Suppl.1): S93-S118. |
| [2] |
麦康森. 水产动物营养与饲料学[M]. 北京: 中国农业出版社, 2015: 47-48. MAI K S. Nutrition and feed science of aquatic animals[M]. Beijing: China Agriculture Press, 2015: 47-48 (in Chinese). |
| [3] |
HUANG F, JIANG M, WEN H, et al. Effects of different dietary lipid sources on growth performance, tissue fatty acid composition and serum lipid indices of juvenile Amur sturgeon, Acipenser schrenckii Brandt, 1869[J]. Journal of Applied Ichthyology, 2014, 30(6): 1602-1608. DOI:10.1111/jai.12598 |
| [4] |
PENG X H, LI F J, LIN S M, et al. Effects of total replacement of fish oil on growth performance, lipid metabolism and antioxidant capacity in tilapia (Oreochromis niloticus)[J]. Aquaculture International, 2016, 24(1): 145-156. DOI:10.1007/s10499-015-9914-7 |
| [5] |
DU Z Y, CLOUET P, HUANG L M, et al. Utilization of different dietary lipid sources at high level in herbivorous grass carp (Ctenopharyngodon idella): mechanism related to hepatic fatty acid oxidation[J]. Aquaculture Nutrition, 2008, 14(1): 77-92. DOI:10.1111/j.1365-2095.2007.00507.x |
| [6] |
LI Y, LIANG X, ZHANG Y, et al. Effects of different dietary soybean oil levels on growth, lipid deposition, tissues fatty acid composition and hepatic lipid metabolism related gene expressions in blunt snout bream (Megalobrama amblycephala) juvenile[J]. Aquaculture, 2016, 451: 16-23. DOI:10.1016/j.aquaculture.2015.08.028 |
| [7] |
TORRECILLAS S, MOMPEL D, CABALLERO M J, et al. Effect of fishmeal and fish oil replacement by vegetable meals and oils on gut health of European sea bass (Dicentrarchus labrax)[J]. Aquaculture, 2017, 468: 386-398. DOI:10.1016/j.aquaculture.2016.11.005 |
| [8] |
PENG M O, XU W, TAN P, et al. Effect of dietary fatty acid composition on growth, fatty acids composition and hepatic lipid metabolism in juvenile turbot (Scophthalmus maximus L.) fed diets with required n-3 LC-PUFAs[J]. Aquaculture, 2017, 479: 591-600. DOI:10.1016/j.aquaculture.2017.06.032 |
| [9] |
陈细华, 李创举, 杨长庚, 等. 中国鲟鱼产业技术研发现状与展望[J]. 淡水渔业, 2017, 47(6): 108-112. CHEN X H, LI C J, YANG C G, et al. Status and prospects of techniques in the sturgeon aquaculture industry in China[J]. Freshwater Fisheries, 2017, 47(6): 108-112 (in Chinese). DOI:10.3969/j.issn.1000-6907.2017.06.016 |
| [10] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Fishery Administration Bureau of Ministry of Agriculture and Rural Areas, National Aquatic Technology Extension Station, China Fisheries Society. China fisheries statistical yearbook 2020[M]. Beijing: China Agriculture Press, 2020 (in Chinese). |
| [11] |
WEI Q W, ZOU Y, LI P, et al. Sturgeon aquaculture in China: progress, strategies and prospects assessed on the basis of nation-wide surveys (2007-2009)[J]. Journal of Applied Ichthyology, 2011, 27(2): 162-168. DOI:10.1111/j.1439-0426.2011.01669.x |
| [12] |
孙大江. 中国鲟鱼养殖[M]. 北京: 中国农业出版社, 2015. SUN D J. Sturgeon culture in China[M]. Beijing: China Agriculture Press, 2015 (in Chinese). |
| [13] |
陈细华, 吴金平, 唐丹, 等. 中国鲟鱼饲料营养成分分析[J]. 淡水渔业, 2018, 48(6): 67-76. CHEN X H, WU J P, TANG D, et al. Analysis of nutrient components of sturgeon feeds in China[J]. Freshwater Fisheries, 2018, 48(6): 67-76 (in Chinese). DOI:10.3969/j.issn.1000-6907.2018.06.011 |
| [14] |
罗琳, 邢薇, 李铁梁, 等. 亚麻油替代鱼油对杂交鲟生长、脂肪酸组成及脂肪代谢的影响[J]. 水生生物学报, 2017, 41(5): 1010-1019. LUO L, XING W, LI T L, et al. Growth performance, fatty acid composition and lipid metabolism in juvenile hybrid sturgeon (Acipenser schrenckii Brandt♀×A.baeri Brandt) fed diets of fish oil substituted by various levels of linseed oil[J]. Acta Hydrobiologica Sinica, 2017, 41(5): 1010-1019 (in Chinese). |
| [15] |
LIU J, WANG Z, MA T, et al. Effects of totally replacing dietary fish oil by linseed oil or soybean oil on juvenile hybrid sturgeon, Acipenser baeri Brandt♀×A.schrenckii Brandt[J]. Aquaculture Nutrition, 2018, 24(1): 184-194. DOI:10.1111/anu.12546 |
| [16] |
YU H H, XING W, LI T L, et al. Effects of alternative dietary lipid sources on growth performance, health status and fillet fatty acid composition of hybrid sturgeon (Acipenser baeri Brandt♀×Acipenser schrenckii Brandt)[J]. Aquaculture Nutrition, 2020, 26(5): 1419-1430. DOI:10.1111/anu.13086 |
| [17] |
RICHTER H, LÜCKSTÄDT C, FOCKEN U, et al. Evacuation of pelleted feed and the suitability of titanium(Ⅳ) oxide as a feed marker for gut kinetics in Nile tilapia[J]. Journal of Fish Biology, 2010, 63(5): 1080-1099. |
| [18] |
ARZEL J, MARTINEZ LOPEZ F X, MÉTAILLER R, et al. Effect of dietary lipid on growth performance and body composition of brown trout (Salmo trutta) reared in seawater[J]. Aquaculture, 1994, 123(3/4): 361-375. |
| [19] |
TOCHER D R. Fatty acid requirements in ontogeny of marine and freshwater fish[J]. Aquaculture Research, 2010, 41(5): 717-732. DOI:10.1111/j.1365-2109.2008.02150.x |
| [20] |
QIU H, JIN M, LU Y, et al. Dietary lipid sources influence fatty acid composition in tissue of large yellow croaker (Larmichthys crocea) by regulating triacylglycerol synthesis and catabolism at the transcriptional level[J]. PLoS One, 2017, 12(1): e0169985. DOI:10.1371/journal.pone.0169985 |
| [21] |
张媛媛, 刘波, 戈贤平, 等. 不同脂肪源对异育银鲫生长性能、机体成分、血清生化指标、体组织脂肪酸组成及脂质代谢的影响[J]. 水产学报, 2012, 36(7): 1111-1118. ZHANG Y Y, LIU B, GE X P, et al. Effect of dietary oil sources on growth performance, body composition, the serum biochemical indices, fatty acids composition and lipid metabolism of Carassius auratus gibelio[J]. Journal of Fisheries of China, 2012, 36(7): 1111-1118 (in Chinese). |
| [22] |
ROSENLUND G, OBACH A, SANDBERG M G, et al. Effect of alternative lipid sources on long-term growth performance and quality of Atlantic salmon (Salmo salar L.)[J]. Aquaculture Research, 2001, 2(1): 323-328. |
| [23] |
程小飞, 田晶晶, 吉红, 等. 蚕蛹基础日粮中添加不同脂肪源对框鳞镜鲤生长、体成分及健康状况的影响[J]. 水生生物学报, 2013, 7(4): 656-668. CHENG X F, TIAN J J, JI H, et al. Effects of different lipid sources in the silkworm pufa-based diet for mirror carp (Cyprinus carpio var.specularis) on growth performance, body composition and health status[J]. Acta Hydrobiologica Sinica, 2013, 7(4): 56-668 (in Chinese). |
| [24] |
刘阳洋, 于海波, 武文一, 等. 饲料脂肪水平对匙吻鲟生长、体组成、消化酶活性、血清生化及抗氧化性能的影响[J]. 水产学报, 2018, 42(12): 1940-1956. LIU Y Y, YU H B, WU W Y, et al. Effects of dietary lipid levels on growth, body composition, digestive enzyme activities, serum biochemical indexes and antioxidant performance of Polyodon spathula[J]. Journal of Fisheries of China, 2018, 42(12): 1940-1956 (in Chinese). |
| [25] |
MOZANZADEH M T, AGH N, YAVARI V, et al. Partial or total replacement of dietary fish oil with alternative lipid sources in silvery-black porgy (Sparidentex hasta)[J]. Aquaculture, 2016, 451: 232-240. DOI:10.1016/j.aquaculture.2015.09.022 |
| [26] |
NG W K, SIGHOLT T, BELL J G. The influence of environmental temperature on the apparent nutrient and fatty acid digestibility in Atlantic salmon (Salmo salar L.) fed finishing diets containing different blends of fish oil, rapeseed oil and palm oil[J]. Aquaculture Research, 2004, 35(13): 1228-1237. DOI:10.1111/j.1365-2109.2004.01131.x |
| [27] |
吴美焕, 安文强, 董晓慧, 等. 饲料脂肪源对珍珠龙胆石斑鱼生长性能、血清生化指标及肝脏脂肪酸组成、脂肪代谢相关指标的影响[J]. 动物营养学报, 2020, 32(3): 1315-1326. WU M H, AN W Q, DONG X H, et al. Effects of dietary lipid sources on growth performance, serum biochemical indexes and liver fatty acids composition, lipid metabolism related indexes of Epinephelus lanceolatus×Epinephelus fuscoguttatus[J]. Chinese Journal of Animal Nutrition, 2020, 32(3): 1315-1326 (in Chinese). |
| [28] |
白富瑾, 罗莉, 黄先智, 等. 蚕蛹油等7种油脂对吉富罗非鱼生长、体组成及脂质代谢影响的比较[J]. 水产学报, 2017, 41(2): 258-270. BAI F J, LUO L, HUANG X Z, et al. Comparative study on effects of silkworm pupal oil and other six kinds of lipid on growth, body composition and lipid metabolism of GIFT Oreochromis niloticus[J]. Journal of Fisheries of China, 2017, 41(2): 258-270 (in Chinese). |
| [29] |
WATANABE T. Lipid nutrition in fish[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1982, 73(1): 3-15. DOI:10.1016/0305-0491(82)90196-1 |
| [30] |
马晶晶, 王际英, 孙建珍, 等. 饲料中DHA/EPA值对星斑川鲽幼鱼生长、体组成及血清生理指标的影响[J]. 水产学报, 2014, 38(2): 244-256. MA J J, WANG J Y, SUN J Z, et al. Effect of dietary DHA to EPA ratios on growth performance, body composition and serum physiological parameters in juvenile Platichthys stellatus[J]. Journal of Fisheries of China, 2014, 38(2): 244-256 (in Chinese). |
| [31] |
陆游, 金敏, 袁野, 等. 不同脂肪源对黄颡鱼幼鱼生长性能、体成分、血清生化指标、体组织脂肪酸组成及抗氧化能力的影响[J]. 水产学报, 2018, 42(7): 1094-1110. LU Y, JIN M, YUAN Y, et al. Effects of different lipid sources on growth performance, body composition, the serum biochemical indices, fatty acids composition and antioxidant capacity in juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Fisheries of China, 2018, 42(7): 1096-1117 (in Chinese). |
| [32] |
FALAHATKA B, ASHERI S, AMLASHI A S, et al. Canola oil, as a good alternative dietary lipid source in sturgeon: effects on growth, physiology and fatty acid profile in Beluga sturgeon Huso huso L.[J]. Aquaculture Nutrition, 2018, 24(4): 1263-1273. DOI:10.1111/anu.12664 |
| [33] |
谭青, 王际英, 李宝山, 等. n-3/n-6 HUFA对大菱鲆幼鱼生长性能、全鱼脂肪酸组成和血清生化指标的影响[J]. 水产学报, 2018, 42(5): 754-766. TAN Q, WANG J Y, LI B S, et al. Effect of dietary n-3/n-6 HUFA on growth performance, fatty acid composition of whole fish and serum biochemical indices in turbot (Scophthalmus maximus)[J]. Journal of Fisheries of China, 2018, 42(5): 754-766 (in Chinese). |
| [34] |
YANG G, JIANG W H, CHEN Y F, et al. Effect of oil source on growth performance, antioxidant capacity, fatty acid composition and fillet quality of juvenile grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2020, 26(4): 1186-1197. DOI:10.1111/anu.13075 |
| [35] |
刘彩霞, 邢薇, 刘洋, 等. 不同配比的亚麻籽油与大豆油混合油全部替代鱼油对杂交鲟生长的影响[J]. 动物营养学报, 2017, 29(12): 4386-4397. LIU C X, XING W, LIU Y, et al. Effects of total replacement of fish oil by mixed oils with different ratios of linseed oil and soybean oil on growth of hybrid sturgeon (Acipenser baeri Brandt♀×A.schrenckii Brandt)[J]. Chinese Journal of Animal Nutrition, 2017, 29(12): 4386-4397 (in Chinese). DOI:10.3969/j.issn.1006-267x.2017.12.019 |
| [36] |
LI Y Y, MONROIG O, ZHANG L, et al. Vertebrate fatty acyl desaturase with Δ4 activity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(39): 16840-16845. DOI:10.1073/pnas.1008429107 |
| [37] |
张春暖, 王爱民, 刘文斌, 等. 饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J]. 中国水产科学, 2013, 20(1): 108-115. ZHANG C N, WANG A M, LIU W B, et al. Effects of dietary lipid levels on fat deposition, lipid metabolize enzyme and antioxidantic activities of Chelon haematocheilus[J]. Journal of Fishery Sciences of China, 2013, 20(1): 108-115 (in Chinese). |
| [38] |
LOU G, XU J H, TENG Y J, et al. Effects of dietary lipid levels on the growth, digestive enzyme, feed utilization and fatty acid composition of Japanese sea bass(Lateolabrax japonicus L.) reared in freshwater[J]. Aquaculture Research, 2010, 41(2): 210-219. DOI:10.1111/j.1365-2109.2009.02319.x |
| [39] |
郑珂珂, 朱晓鸣, 韩冬, 等. 饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J]. 水生生物学报, 2010, 34(4): 815-821. ZHENG K K, ZHU X M, HAN D, et al. Effect of dietary lipid level on growth and lipoprotein lipase gene expression in Pelteobagrus vachelli[J]. Acta Hydrobiologica Sinica, 2010, 34(4): 815-821 (in Chinese). |
| [40] |
褚志鹏, 金佳利, 陈细华, 等. 不同投喂率和投喂频率对大杂交鲟幼鱼生长、体成分和生化指标的影响[J]. 中国水产科学, 2020, 27(2): 177-185. CHU Z P, JIN J L, CHEN X H, et al. Effects of different feeding rates and frequencies on the growth performance, body composition, and biochemical parameters of juvenile hybrid sturgeon[J]. Journal of Fishery Sciences of China, 2020, 27(2): 177-185 (in Chinese). |
| [41] |
AKRAMI R, GHARAEI A, MANSOUR M R, et al. Effects of dietary Onion (Allium cepa) powder on growth, innate immune response and hemato-biochemical parameters of Beluga (Huso huso linnaeus, 1754) juvenile[J]. Fish & Shellfish Immunology, 2015, 45(2): 828-834. |
| [42] |
LI X F, TIAN H Y, ZHANG D D, et al. Feeding frequency affects stress, innate immunity and disease resistance of juvenile blunt snout bream Megalobrama amblycephala[J]. Fish & Shellfish Immunology, 2014, 38(1): 80-87. |
| [43] |
NORDOY A, MARCHIOLI R, ARNESEN H, et al. n-3 polyunsaturated fatty acids and cardiovascular diseases: to whom, how much, preparations[J]. Lipids, 2001, 36(Suppl.1): S127-S129. DOI:10.1007/s11745-001-0695-7 |
| [44] |
SHEARER G C, SAVINOVA O V, HARRIS W S. Fish oil-how does it reduce plasma triglycerides[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2012, 1821(5): 843-851. |




