2. 山西农业大学动物医学学院, 太谷 030801;
3. 山西农业大学信息学院, 太谷 030801;
4. 中国水产科学院珠江水产研究所, 农业农村部渔用药物创制重点实验室, 广东省水产动物免疫技术重点实验室, 广州 510380
2. College of Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, China;
3. College of Information, Shanxi Agricultural University, Taigu 030801, China;
4. Key Laboratory of Aquatic Animal Immune Technology of Guangdong Province, Key Laboratory of Fishery Drug Development, Ministry of Agriculture and Rural Affairs, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China
炎症是机体对各种外源致炎因素刺激而产生的一种生理和病理性过程,是机体对外界刺激防御反应的重要组成部分,但是过度的炎症也是许多疾病的重要组成部分,严重的还导致生命威胁[1-3]。许多研究表明一些疾病的发生发展都会伴随有炎症的发生,二者拥有比较紧密的关系,如哮喘、癌症、动脉粥样硬化、糖尿病等[4-6]。艾叶(Artemisiae argyi)为菊科植物艾的叶,在我国大部分地区都有生长。艾叶挥发油(Artemisia argyi essential oils,AAEO)是艾叶的主要有效成分,具有多种药理功效。Zhang等[7]研究发现,AAEO具有杀虫药效,可用于杀灭谷物和中草药中昆虫;Akhbari等[8]研究表明,AAEO具有清除自由基的活性;丁圆平等[9]研究表明,AAEO可抑制肺癌A549细胞增殖并诱导细胞凋亡;葛德鹏等[10]研究表明,AAEO可作用于微生物细胞壁结构从而起到抑菌作用;Xiang等[11]研究表明,AAEO对金黄色葡萄球菌、蜡状芽孢杆菌、枯草芽孢杆菌等具有抑制作用。但是,目前对于AAEO抗炎活性特别是抗炎机制方面的研究还鲜有报道。
巨噬细胞作为机体非特异性免疫的重要参与者,不但可以参与到较多的机体免疫反应中,且在炎症反应的进程中也起着不可替代的作用[12-13]。在炎症反应中,巨噬细胞能够通过分泌细胞因子及抗原提呈等作用对炎症反应进程起到影响和调控作用[14-16]。因此,本试验通过脂多糖(LPS)诱导小鼠巨噬细胞(RAW264.7细胞)建立细胞炎症模型来研究AAEO的抗炎能力,为进一步探讨AAEO的抗炎功效及为其作为绿色安全饲用添加剂的可能提供理论依据。
1 材料与方法 1.1 试验试剂与仪器AAEO提取参照《中国药典》(2015版)水蒸气蒸馏法进行:称取艾叶500 g,粉碎后放于10 L的圆底烧瓶中,加入5 L蒸馏水浸泡过夜,水蒸气蒸馏法提取6 h,收集挥发油,经无水Na2SO2干燥后封装备用,测定AAEO产率为0.48%。AAEO主要成分为:1, 8桉叶素(1, 8 eucalyptol,2.89%)、4-萜烯醇[4-methyl-1-(1-methylethyl)-3-cyclohexen-1-ol,6.56%]、龙脑(borneol,5.94%)、樟脑(camphor,3.31%)、松油醇(p-menth-1-en-8-ola,3.82%)、2, 4, 6-三甲基苯基-2, 4, 6-三甲基苯甲酸酯(2, 4, 6-trimethylphenyl 2, 4, 6-trimethyl enzoate,4.85%)、石竹烯(caryophyllene,5.84%)。
RAW264.7细胞、胎牛血清、青霉素、链霉素、DMEM培养基、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和单核细胞趋化蛋白-1(MCP-1)试剂盒购自索莱宝科技有限公司。细胞计数试剂盒(CCK8)、LPS购自美国Sigma公司。一氧化氮(NO)试剂盒购自南京建成生物工程研究所;RNAiso Plus、反转录试剂盒、AYBR Green PCR Kit购自大连TaKaRa公司。
主要仪器包括CJX41S倒置显微镜(日本Olympus公司)、SpectraMax i3x多功能酶标仪(奥地利Molecular Devices公司)、荧光定量PCR仪(美国Bio-Rad公司)、低温高速冷冻离心机(德国Eppendorf公司)、SW-CJ-1F洁净工作台(苏州安泰空气技术有限公司)、3111型二氧化碳(CO2)培养箱(赛默飞世尔科技有限公司)。
1.2 试验方法 1.2.1 细胞培养将小鼠RAW264.7细胞置于DMEM培养液(含10%胎牛血清、100 IU/mL青霉素和100 IU/mL链霉素)中,在37 ℃、5% CO2的培养箱里培养。
1.2.2 细胞毒性的测定[17]调整对数生长期的RAW264.7细胞密度到4×105个/mL,接种于48孔培养板中,每孔100 μL。试验设置空白对照组[添加浓度为0.1%二甲基亚砜(DMSO)的培养基]和试验组[分别添加浓度为5、10、20、40、80、160 μg/mL的AAEO(提取的AAEO加入DMSO助溶,培养基稀释到试验用浓度,DMSO浓度为0.1%)],并设置3个重复孔,培养24 h后,除去孔内培养基,每孔添加100 μL的含有10% CCK8溶液的培养基,培养2 h后采用酶标仪测定每孔在波长450 nm时的吸光度。
1.2.3 试验分组及NO含量的测定调整对数生长期的RAW264.7细胞密度到5×105个/mL,接种于6孔培养板中,每孔500 μL。设置对照组(添加浓度为0.1% DMSO的培养基)、LPS组(添加浓度为1 μg/mL LPS的培养基)、不同浓度AAEO组(分别添加5、10、20 μg/mL的AAEO,预处理1 h,再添加浓度为1 μg/mL LPS的培养基),每组设置3个重复孔。培养24 h后,收集上清用于NO含量的测定,其含量应用Griess法,按照试剂盒的步骤进行测定。
1.2.4 细胞炎症因子含量的测定将处于对数生长期的RAW264.7细胞接种于12孔板(细胞密度为5×105个/mL)进行培养。依据试验分组孵育24 h后,收集细胞上清,采用酶联免疫吸附法测定TNF-α、IL-1β、IL-6和MCP-1含量,具体测定步骤按照试剂盒说明进行。
1.2.5 细胞炎症因子表达的检测将处于对数生长期的RAW264.7细胞接种于24孔板(细胞密度为1×106个/mL),依据试验分组孵育24 h后,收集细胞提取mRNA并转录为cDNA,利用荧光定量PCR仪检测TNF-α、IL-1β、IL-6和诱导型一氧化氮合酶(iNOS)的mRNA表达量,具体操作步骤按照试剂盒说明进行,β-肌动蛋白(β-actin)作为管家基因,2-ΔΔCt法计算目的基因mRNA相对表达量。NCBI数据库查询得到的基因序列,应用引物设计软件Primer Premier 6设计引物序列(表 1)。
|
|
表 1 引物序列 Table 1 Primer sequence |
应用SPSS 22.0统计软件对试验所得数据进行单因素方差分析(one-way ANOVA),数据以平均值±标准误表示,P < 0.05表示差异显著。
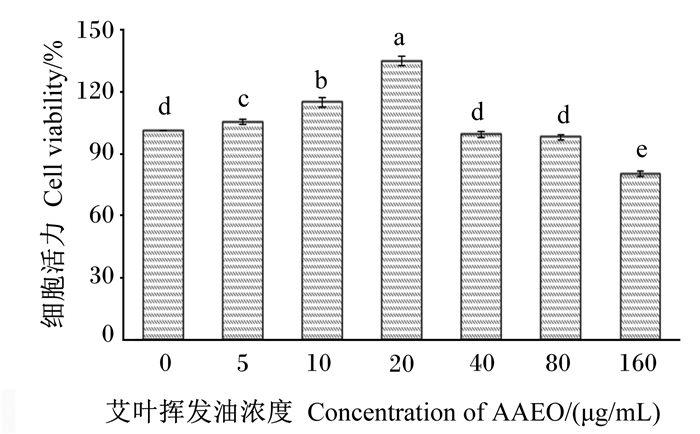
2 结果 2.1 AAEO对RAW264.7细胞毒性评价由图 1可知,与AAEO浓度为0 μg/mL时相比,AAEO浓度为5~20 μg/mL时,RAW264.7细胞活力分别上升了5.34%(P < 0.05)、14.76%(P < 0.05)和34.68%(P < 0.05);AAEO浓度为40~160 μg/mL时,RAW264.7细胞活力分别下降了0.81%(P>0.05)、2.06%(P>0.05)和19.98%(P < 0.05)。RAW264.7细胞活力在AAEO浓度为20 μg/mL时最高,在AAEO浓度为160 μg/mL时最低。因此,选择5、10、20 μg/mL作为后续试验AAEO浓度。
|
数据柱标注相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). 图 1 AAEO对RAW264.7细胞活力的影响 Fig. 1 Effects of AAEO on viability of RAW264.7 cells |
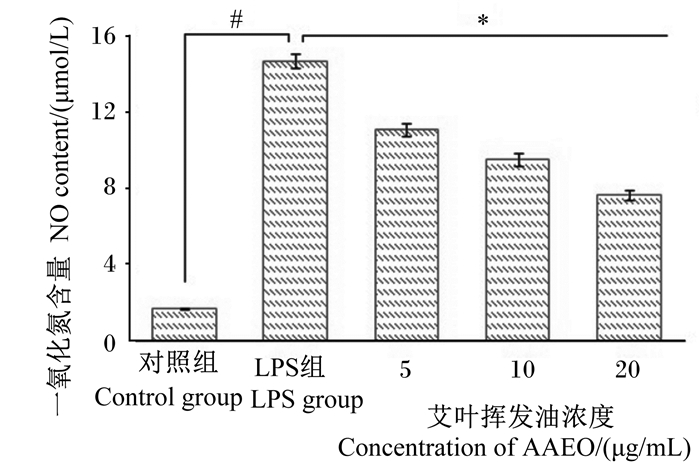
由图 2可知,与对照组相比,LPS组RAW264.7细胞NO含量显著升高(P < 0.05);与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞NO含量均显著降低(P < 0.05),分别下降了24.4%、35.0%和47.8%。相关性分析表明,AAEO浓度与NO含量呈负相关(皮尔逊相关系数为-0.907,P < 0.05)。
|
#表示与对照组比较差异显著(P < 0.05),*表示与LPS组比较差异显著(P < 0.05)。下图同。 # mean significant difference compared with the control group (P < 0.05), and * mean significant difference compared with the LPS group (P < 0.05). The same as below. 图 2 AAEO对LPS诱导的RAW264.7细胞NO含量的影响 Fig. 2 Effects of AAEO on NO content of RAW264.7 cells induced by LPS |
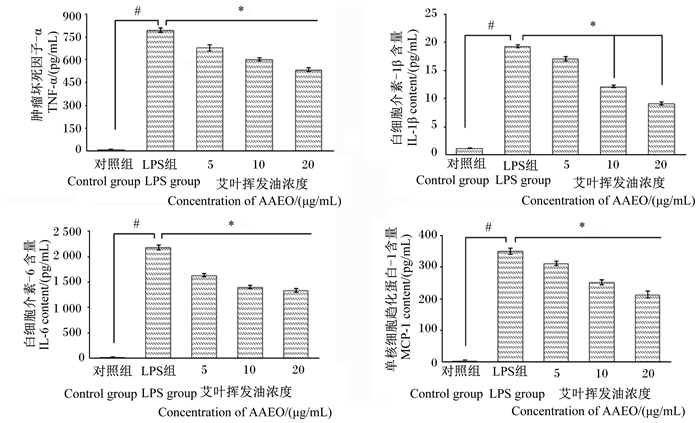
由图 3可知,与对照组相比,LPS组RAW264.7细胞TNF-α、IL-1β、IL-6和MCP-1含量均显著升高(P < 0.05)。与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞TNF-α含量显著降低(P < 0.05),分别下降了14.45%、24.29%和32.71%。相关性分析表明,AAEO浓度与TNF-α含量呈负相关(皮尔逊相关系数为-0.877,P < 0.05)。
|
图 3 AAEO对LPS诱导的RAW264.7细胞炎性因子含量的影响 Fig. 3 Effects of AAEO on cytokine contents of RAW264.7 cells induced by LPS |
与LPS组相比,10、20 μg/mL AAEO组RAW264.7细胞IL-1β含量显著降低(P < 0.05),分别下降了37.08%和52.97%。相关性分析表明,AAEO浓度与IL-1β含量呈负相关(皮尔逊相关系数为-0.706,P < 0.05)。
与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞IL-6含量显著降低(P < 0.05),分别下降了25.19%、35.87%和38.86%。相关性分析表明,AAEO浓度与IL-6含量呈负相关(皮尔逊相关系数为-0.753,P < 0.05)。
与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞MCP-1含量显著降低(P < 0.05),分别下降了11.18%、28.15%和39.20%。相关性分析表明,AAEO浓度与MCP-1含量呈负相关(皮尔逊相关系数为-0.806,P < 0.05)。
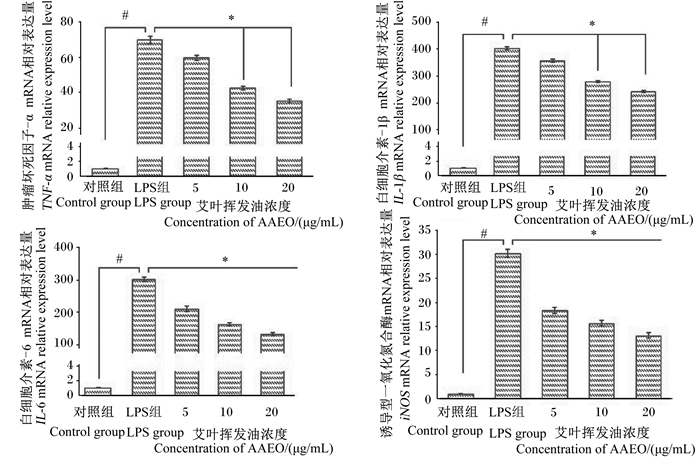
2.4 AAEO对LPS诱导的RAW264.7细胞炎性因子mRNA相对表达量的影响由图 4可知,与对照组相比,LPS组RAW264.7细胞TNF-α、IL-1β、IL-6和iNOS mRNA相对表达量均升高显著(P < 0.05)。与LPS组相比,10、20 μg/mL AAEO组RAW264.7细胞TNF-α mRNA相对表达量显著降低(P < 0.05)。相关性分析表明,AAEO浓度与TNF-α mRNA相对表达量呈负相关(皮尔逊相关系数为-0.856,P < 0.05)。
|
图 4 AAEO对LPS诱导的RAW264.7细胞炎性因子mRNA相对表达量的影响 Fig. 4 Effects of AAEO on inflammatory factors mRNA relative expression levels of RAW264.7 cells induced by LPS |
与LPS组相比,10、20 μg/mL AAEO组RAW264.7细胞IL-1β mRNA相对表达量显著降低(P < 0.05)。相关性分析表明,AAEO浓度与IL-1β mRNA相对表达量呈负相关(皮尔逊相关系数为-0.752,P < 0.05)。
与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞IL-6 mRNA相对表达量均显著降低(P < 0.05)。相关性分析表明,AAEO浓度与IL-6 mRNA相对表达量呈负相关(皮尔逊相关系数为-0.873,P < 0.05)。
与LPS组相比,5、10、20 μg/mL AAEO组RAW264.7细胞iNOS mRNA相对表达量均显著降低(P < 0.05)。相关性分析表明,AAEO浓度与iNOS mRNA相对表达呈负相关(皮尔逊相关系数为-0.806,P < 0.05)。
3 讨论炎症反应是一种复杂的宿主防御过程,是通过免疫系统调节清除不利因素侵入的过程[17]。正常情况下炎症反应体现的是对人体有利的方面,但是随着炎症介质的持续增多,会对机体组织产生严重的负面影响,导致疾病的发生、加重。LPS是革兰氏阴性菌细胞壁的重要组成部分,不但可以诱导促炎性细胞因子的释放,还可以促使炎症介质的产生,被认为是导致炎症反应的因素之一[18-19]。巨噬细胞作为免疫细胞具有多种功能,不但能够消除细胞碎片及病原微生物,还能够分泌细胞因子等介质,小鼠RAW264.7细胞拥有稳定性好、可传代培养的优点[20-21]。因此,在体外试验中常常使用LPS诱导RAW264.7细胞作为体外炎症细胞模型[22-23]。为了明确AAEO对细胞活力的作用,本试验应用CCK8法测定了不同浓度AAEO对RAW264.7细胞的毒性,并明确了试验中AAEO的安全浓度范围,结果显示,AAEO浓度在5~20 μg/mL时对RAW264.7细胞活性无抑制作用,提示此浓度范围的AAEO对RAW264.7细胞无细胞毒性作用,进一步说明本研究所采用的5、10和20 μg/mL的AAEO在LPS诱导的细胞炎症中呈现的抗炎活性并不是通过降低细胞活性来完成的。
细胞因子是由细胞释放的小分子生物活性物质,可以通过多种途径调节免疫应答和参与炎症反应[12, 24]。LPS可以诱导刺激巨噬细胞分泌TNF-α、IL-1β、IL-6和MCP-1等炎性细胞因子。TNF-α是炎症反应过程中具有关键作用的炎症介质,TNF-α在自身分泌的过程中还能够诱导白细胞介素的分泌,进一步促使炎症的反应,TNF-α分泌的增加还可以刺激MCP-1的形成,进一步引起炎症损伤[25-26]。IL-1β是一种可以诱发炎症反应以及机体防御反应的炎性细胞因子,能够激活多种免疫细胞和炎性细胞,形成与TNF-α类似的生理及代谢作用,与TNF-α协同作用,是诱导炎症反应重要的介质之一[17, 27]。IL-6来源于经过TNF-α和IL-1β诱导的细胞和组织,参与机体内信号分子之间的传递并引起炎症反应,其含量高低能够反映机体的炎症和组织损伤程度[28-29]。本试验发现,LPS诱导RAW264.7细胞可以使其分泌的细胞因子含量增加,这与于笛等[12]、高铭彤等[24]、李帅帅[30]研究结果一致。AAEO能够抑制LPS诱导的巨噬细胞促炎症因子TNF-α、IL-1β、IL-6和MCP-1的过多分泌,提示AAEO可以通过调控细胞炎症因子的分泌来体现其抗炎作用。
NO是一种生物活性物质,拥有促炎和抗炎双重作用,过多NO是有害的且能够引起各种炎症和疾病[24]。本研究通过检测发现,LPS组RAW264.7细胞NO含量比对照组显著升高,5、10、20 μg/mL AAEO组RAW264.7细胞NO含量比LPS组均显著降低,且呈现一定的剂量效应关系。由此可见,AAEO在一定程度上可以通过抑制NO的释放来呈现其抗炎功能。本试验还进一步检测了AAEO对NO的上游关键酶iNOS的mRNA和促炎性因子TNF-α、IL-1β、IL-6的mRNA表达的影响,结果显示AAEO可以抑制LPS诱导巨噬细胞炎性因子TNF-α、IL-1β、IL-6和iNOS的mRNA表达,说明AAEO可以通过抑制TNF-α、IL-1β、IL-6和iNOS的mRNA表达来发挥抗炎活性。
4 结论综上所述,AAEO可以通过调节细胞炎性因子的基因表达以及调控细胞因子和炎症介质的分泌来发挥抗炎作用。
| [1] |
LIU Z M, QIU P, LI J, et al. Anti-inflammatory polyketides from the mangrove-derived fungus Ascomycota sp.SK2YWS-L[J]. Tetrahedron, 2018, 74(7): 746-751. DOI:10.1016/j.tet.2017.12.057 |
| [2] |
QIN J J, WANG W, ZHANG R W. Novel natural product therapeutics targeting both inflammation and cancer[J]. Chinese Journal of Natural Medicines, 2017, 15(6): 401-416. DOI:10.1016/S1875-5364(17)30062-6 |
| [3] |
罗捷然. 新型苯并噁唑酮衍生物W3D对LPS诱导的RAW264.7细胞抗炎活性及其作用机制的研究[D]. 硕士学位论文. 太原: 山西医科大学, 2018. LUO J R. Anti-inflammatory effect and mechanism of anovel benzoxazolone derivative W3D in LPS-induced RAW264.7 cells[D]. Master's Thesis. Taiyuan: Shanxi Medical University, 2018. (in Chinese) |
| [4] |
KURAKULA K, VOS M, LOGIANTARA A, et al. Nuclear receptor Nur77 attenuates airway inflammation in miceby suppressing NF-κB activity in lung epithelial cells[J]. The Journal of Immunology, 2015, 195(4): 1388-1398. DOI:10.4049/jimmunol.1401714 |
| [5] |
程晓亮, 范佳双, 戴丽芬, 等. 塞来昔布通过调控炎症反应对糖尿病神经病变大鼠缓解作用的机制研究[J]. 中国临床药理学杂志, 2020, 36(18): 2875-2879. CHENG X L, FAN J S, DAI L F, et al. Mitigative effect and mechanism of celecoxib in diabetic neuropathy rats through regulation of inflammatory response[J]. The Chinese Journal of Clinical Pharmacology, 2020, 36(18): 2875-2879 (in Chinese). |
| [6] |
金洋, 郑桐森, 张艳桥. Gankyrin在炎症相关性癌症中的作用机制研究进展[J]. 现代肿瘤医学, 2019, 27(7): 1247-1251. JIN Y, ZHANG T S, ZHANG Y Q. Progress in the mechanism of Gankyrin in inflammation associated cancers[J]. Journal of Modern Oncology, 2019, 27(7): 1247-1251 (in Chinese). DOI:10.3969/j.issn.1672-4992.2019.07.038 |
| [7] |
ZHANG W J, YOU C X, YANG K, et al. Bioactivity of essential oil of Artemisia argyi Lévl.et Van. and its main compounds against Lasioderma serricorne[J]. Journal of Oleo Science, 2014, 63(8): 829-837. DOI:10.5650/jos.ess14057 |
| [8] |
AKHBARI M, AGHAJANI Z, ESMAEILI B. Comparative study of antioxidant activity of extracts and essential oils composition of Artemisia absinthium L. prepared by two different methods[J]. Journal of Essential Oil Bearing Plants, 2014, 17(5): 954-959. DOI:10.1080/0972060X.2014.901628 |
| [9] |
丁圆平, 刘靖怡, 田洋, 等. 艾叶挥发油对A549细胞的抑制作用[J]. 中成药, 2019, 41(9): 2063-2068. DING Y P, LIU J Y, TIAN Y, et al. Inhibitory effects of volatile oils from Artemisia argyi folium on A549 cells[J]. Chinese Traditional Patent Medicine, 2019, 41(9): 2063-2068 (in Chinese). DOI:10.3969/j.issn.1001-1528.2019.09.009 |
| [10] |
葛德鹏, 李森, 黄凯, 等. 不同溶剂同时蒸馏萃取艾叶挥发油的抑菌活性[J]. 食品与生物技术学报, 2020, 39(3): 41-48. GE D P, LI S, HUANG K, et al. Antimicrobial activities of Artemisia argyi essential oils extracted by simultaneous distillation using different solvent systems[J]. Journal of Food Science and Biotechnology, 2020, 39(3): 41-48 (in Chinese). DOI:10.3969/j.issn.1673-1689.2020.03.006 |
| [11] |
XIANG F, BAI J H, TAN X B, et al. Antimicrobial activities and mechanism of the essential oil from Artemisia argyi Levl.et Van. var. argyi cv. Qiai[J]. Industrial Crops and Products, 2018, 125: 582-587. DOI:10.1016/j.indcrop.2018.09.048 |
| [12] |
于笛, 周伟, 郭增旺, 等. 绿豆寡肽对脂多糖诱导巨噬细胞RAW264.7的抗炎作用[J]. 中国食品学报, 2020, 20(8): 41-48. YU D, ZHOU W, GUO Z W, et al. Anti-inflammatory effect of mung bean peptide on lipopolysaccharide-induced macrophage RAW264.7[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(8): 41-48 (in Chinese). |
| [13] |
吴惠娟, 韦曲星, 张盛昔, 等. 甘露糖对巨噬细胞炎症反应的双向调节作用[J]. 中山大学学报(医学科学版), 2020, 41(4): 549-557. WU H J, WEI Q X, ZHANG S X, et al. Dual-directional regulation effects of mannose on inflammatory response of macrophages[J]. Journal of Sun Yat-sen University (Medical Science Edition), 2020, 41(4): 549-557 (in Chinese). |
| [14] |
刘娜娜, 欧希龙, 郑中伟, 等. 外源性巨噬细胞对小鼠细菌性腹膜炎的治疗作用[J]. 世界华人消化杂志, 2016, 24(7): 1076-1081. LIU N, OU X L, ZHENG Z W, et al. Therapeutic effects of exogenous macrophages in mice with bacterial peritonitis[J]. World Chinese Journal of Digestology, 2016, 24(7): 1076-1081 (in Chinese). |
| [15] |
KINDT N, JOURNE F, LAURENT G, et al. Involvement of macrophage migration inhibitory factor in cancer and novel therapeutic targets[J]. Oncology Letters, 2016, 12(4): 2247-2253. DOI:10.3892/ol.2016.4929 |
| [16] |
陈广勇, 韩乾杰, 张玲玲, 等. 黄芪多糖对脂多糖刺激小鼠巨噬细胞形态及免疫功能的影响[J]. 动物营养学报, 2020, 32(9): 4358-4365. CHEN G Y, HAN Q J, ZHANG L L, et al. Effects of Astragalus polysaccharides on morphology and immune function of lipopolysaccharide stimulated macrophages in mice[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4358-4365 (in Chinese). |
| [17] |
李静, 金倫喆, 金洪光. 白术提取物苍术酮对脂多糖诱导的BV2细胞神经炎性影响及相关机制研究[J]. 天然产物研究与开发, 2020, 32(5): 826-830. LI J, JIN L Z, JIN H G. Effects and mechanism of Atractylone from rhizomes of Atractylodes macrocephala Koidzumi in LPS-induced neuro-inflammation in BV2 microglial cells[J]. Natural Product Research and Development, 2020, 32(5): 826-830 (in Chinese). |
| [18] |
王翠芳, 王特日格乐, 丹妮, 等. 不同浓度乙醇洗脱沙葱黄酮对脂多糖诱导的小鼠腹腔巨噬细胞的抗炎作用[J]. 动物营养学报, 2019, 31(1): 342-350. WANG C F, WANGTERIGELE, DAN N, et al. Anti-inflammatory effects of different concentrations of ethanol elutions of Allium mongolicum Regel flavonoids on lipopolysaccharide-induced mouse peritoneal macrophage[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 342-350 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.041 |
| [19] |
ZHANG X, SUN C Y, ZHANG Y B, et al. Kegan Liyan oral liquid ameliorates lipopolysaccharide-induced acute lung injury through inhibition of TLR4-mediated NF-κB signaling pathway and MMP-9 expression[J]. Journal of Ethnopharmacology, 2016, 186: 91-102. DOI:10.1016/j.jep.2016.03.057 |
| [20] |
GORDON S, TAYLOR P R. Monocyte and macrophage heterogeneity[J]. Nature Reviews Immunology, 2005, 5(12): 953-964. DOI:10.1038/nri1733 |
| [21] |
田璐. 艾叶化学成分分析及其抗炎功效研究[D]. 硕士学位论文. 广州: 暨南大学, 2017. TIAN L. Research on chemical constituents and anti-inflammatory effects of Artemisia argyi[D]. Master's Thesis. Guangzhou: Jinan University, 2017. (in Chinese) |
| [22] |
LEE J W, BAE C J, CHOI Y J, et al. 3, 4, 5-trihydroxycinnamic acid inhibits lipopolysaccharide (LPS)-induced inflammation by Nrf2 activation in vitro and improves survival of mice in LPS-induced endotoxemia model in vivo[J]. Molecular and Cellular Biochemistry, 2014, 390(1): 143-153. |
| [23] |
JAVED S, LI W M, ZEB M, et al. Anti-inflammatory activity of the wild mushroom, Echinodontium tinctorium, in RAW264.7 macrophage cells and mouse microcirculation[J]. Molecules, 2019, 24(19): 3509. DOI:10.3390/molecules24193509 |
| [24] |
高铭彤, 王佳奇, 陈凯, 等. 精氨酸双糖苷对脂多糖诱导的巨噬细胞分泌炎症因子的影响[J]. 中国兽药杂志, 2016, 50(11): 65-69. GAO M T, WANG J Q, CHEN K, et al. Effects of arginyl-fructosyl-glucose on the secretion of inflammatory cytokines in macrophages induced by lipopolysaccharide[J]. Chinese Journal of Veterinary Medicine, 2016, 50(11): 65-69 (in Chinese). |
| [25] |
TAVAKOLPOUR S, TAVAKOLPOUR V. Interleukin 4 inhibition as a potential therapeutic in pemphigus[J]. Cytokine, 2016, 77: 189-195. DOI:10.1016/j.cyto.2015.09.017 |
| [26] |
杜静静, 周冰之, 王陈芳, 等. 盐酸罗格列酮对糖尿病肾病大鼠血清TNF-α, IL-6, MCP-1表达的影响[J]. 浙江临床医学, 2014, 16(10): 1552-1554. DU J J, ZHOU B Z, WANG C F, et al. Effect of rosiglitazone hydrochloride on the expression of serum TNF-α, IL-6 and MCP-1 in rats with diabetic nephropathy[J]. Zhejiang Clinical Medical Journal, 2014, 16(10): 1552-1554 (in Chinese). |
| [27] |
陈剑杰, 曹谨玲, 罗永巨, 等. 氟对鲤鱼鳃组织免疫相关酶及IL-1β表达影响[J]. 核农学报, 2014, 28(6): 1092-1098. CHEN J J, CAO J L, LUO Y J, et al. Effects of fluoride on the activity of immune-related enzymes and IL-1β protein expression in gill of carp (Cyprinus carpio)[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(6): 1092-1098 (in Chinese). |
| [28] |
JONES S A. Directing transition from innate to acquired immunity: defining a role for IL-6[J]. The Journal of Immunology, 2005, 175(6): 3463-3468. DOI:10.4049/jimmunol.175.6.3463 |
| [29] |
MÖLLER B, VILLIGER P M. Inhibition of IL-1, IL-6, and TNF-α in immune-mediated inflammatory diseases[J]. Springer Seminars in Immunopathology, 2006, 27(4): 391-408. DOI:10.1007/s00281-006-0012-9 |
| [30] |
李帅帅. 桑黄的化学成分及其抗炎活性研究[D]. 硕士学位论文. 延吉: 延边大学, 2018. LI S S. Study on chemical constituents from Phellinus igniarius quel and their anti-inflammatory activities[D]. Master's Thesis. Yanji: Yanbian University, 2018. (in Chinese) |




