厚朴酚是中药厚朴中重要的有效活性成分之一,具有抗氧化、抗菌、抗炎症、抗抑郁等多种生物学功效[1]。研究显示,厚朴酚具有显著的抗氧化功效,在多种细胞和动物模型中均可有效减缓氧化应激[2-3]。同时,厚朴酚也可广泛地参与多种重要细胞信号通路和关键蛋白功能的调节。它可参与关键转录因子核因子E2相关因子2(NRF2)和核因子-κB(NF-κB) 功能的调节,也可作为过氧化物酶体增殖剂激活受体γ(PPARγ)和维甲酸X受体α(RXRα)的配体发挥PPARγ激动剂功能[4-6]。此外,厚朴酚也能经由蛋白激酶B/哺乳动物雷帕霉素靶蛋白(Akt/mTOR)通路诱导自噬的发生,或通过诱导细胞凋亡抑制肿瘤生长[7-8]。
前期研究显示,厚朴酚(80 μmol/L)可缓解小鼠妊娠期间多种不利因素的影响和促进后代小鼠的发育,其抗抑郁功效可通过神经-内分泌系统影响妊娠过程[9]。此外,有研究表明,厚朴酚可浓度依赖地抑制母鼠子宫肌肉收缩[10],显示出对妊娠过程及结局的潜在调节功效。然而,厚朴酚在妊娠动物上的研究仍未见报道,其对妊娠动物胚胎发育、血清抗氧化及子宫内膜关键基因表达的影响依旧未知。水杨酸钠是一种非甾体抗炎镇痛药(NSAIDs),具有一定的妊娠毒性,大剂量使用会导致胎儿畸变。研究显示,300 mg/kg水杨酸钠灌胃妊娠母鼠可导致子宫内膜同源盒(HOX)基因表达异常,并可引发后代小鼠多余肋骨的产生[11-12]。此外,一些研究也发现,使用浓度大于200 mg/kg的水杨酸钠灌胃妊娠母鼠可引起胚胎吸收率和死亡率显著上升,表现出显著的胚胎毒性[13-14]。厚朴酚对炎症等相关信号通路的调节作用可能有助于缓解水杨酸钠引发的损伤。因此,本研究通过构建水杨酸钠诱导妊娠损伤模型,以研究厚朴酚在妊娠小鼠妊娠损伤条件下对其胚胎发育、血清抗氧化及子宫内膜关键基因表达的影响,并对其可能的作用机制进行探究。
1 材料与方法 1.1 试剂与材料厚朴酚购于成都某生物科技有限公司;水杨酸钠为分析纯(含量>99%),购于上海国药集团;丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)分析试剂盒购于南京建成生物工程研究所。
1.2 试验动物试验用昆明小鼠购于湖北省武汉市疾病控制中心实验动物中心。
1.3 试验设备与仪器低温高速离心机(德国Eppendorf公司)、微型移液器(德国Eppendorf公司)、超微量分光光度计(德国IMPLEN公司)、实时荧光定量PCR仪(德国Roche公司)、多功能分光光度计(日本岛津公司)。
1.4 试验设计选取6~8周龄、体重[(37.24±3.53) g]接近的雌鼠96只,随机分为4组,每组6个重复,每个重复4只,分别为对照组、模型组(Ⅰ组)和修复组(Ⅱ和Ⅲ组)。正常饲养5 d后,开始合笼,以阴栓出现记为妊娠第0天(GD0),因此妊娠第4天记为GD4,妊娠第9天记为GD9。所有小鼠饲喂基础饲粮,对照组给予正常饮水[含1%二甲基亚砜(DMSO)],Ⅰ、Ⅱ、Ⅲ组于饮水(含1% DMSO)中加入厚朴酚,使其浓度分别为0、80和800 μmol/L。同时,在GD1~GD4期间,于每日09:00通过灌胃针给予妊娠小鼠按体重灌胃280 mg/kg的水杨酸钠,灌胃后禁水1 h,其他时间保证自由采食和饮水。
1.5 血清和组织样品的收集于GD4、GD9时,分别从每组各取3只小鼠(共12只)进行眼球采血,并断颈处死,器官称重后,取子宫分离胎盘和胚胎后称重,再次分离子宫内膜,并将胎盘、胚胎和子宫内膜分别保存于-80 ℃冰箱。
1.6 基因表达的检测分析于GD4、GD9时,子宫内膜组织样品使用RNAiso Plus(TaKaRa)进行总RNA的提取,所得总RNA进行纯度与浓度的测定后,从每个样品中分别取1.5 μg用于cDNA的合成,反转录试剂盒为PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)。应用Primer Premier 5.0分别设计NRF2、还原型辅酶/醌氧化还原酶1(NQO1)、血红素加氧酶-1(HO-1)、同源盒基因A10(HOXA10)、白血病抑制因子受体(LIFR)、E-钙黏蛋白1(CDH1)和甘油醛-3-磷酸脱氢酶(GAPDH)基因引物,引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
实时荧光定量PCR的检测在罗氏LightCycle 96 Instrument仪器上进行,荧光定量分析使用的试剂盒为TaKaRa公司的TB Green ® Premix Ex TaqTM Ⅱ。相关试剂的添加严格依照说明书进行。优化后的反应条件为:95 ℃预变性5 min;95 ℃变性10 s,退火15 s,72 ℃延伸15 s,共40个循环,熔解曲线阶段95 ℃ 15 s,60 ℃ 1 min,95 ℃ 5 s。GADPH基因作为内参基因,相关蛋白基因的表达通过2-ΔΔCt方法计算得到。
1.7 血清抗氧化性能检测血清中MDA含量、SOD活性、T-AOC的检测使用南京建成生物工程研究所相关试剂盒,并严格按照说明书,使用多功能分光光度计检测。
1.8 统计分析统计分析利用Graphpad prism 5软件进行,其中对照组与Ⅰ组采用Student’s t检验分析,Ⅰ、Ⅱ、Ⅲ组之间比较采用one-way ANOVA检验处理。抗氧化性能、基因表达分析数据均来自至少3次独立重复试验。试验数据以平均值±标准误表示,当P<0.05时表示差异具有统计学意义。
2 结果与分析 2.1 厚朴酚及水杨酸钠处理对妊娠小鼠体增重的影响如图 1所示,各组妊娠小鼠体增重无显著差异(P>0.05),显示出水杨酸钠并不显著影响妊娠小鼠自然增重,厚朴酚添加对妊娠小鼠体增重也无显著影响(P>0.05)。
|
图 1 厚朴酚及水杨酸钠处理对妊娠小鼠体增重的影响 Fig. 1 Effects of magnolol and sodium salicylate treatment on weight gain of pregnant mice |
如表 2所示,各组间妊娠体重及器官重无显著差异(P>0.05)。相较于对照组,Ⅰ组子宫全重和胚胎数显著降低(P < 0.05),而Ⅱ组子宫全重及Ⅲ组子宫全重和胚胎数相较于Ⅰ组显著增加(P < 0.05),并与对照组无显著差异(P>0.05),表明厚朴酚的添加可缓解水杨酸钠引起的妊娠小鼠子宫失重和胚胎损失。
|
|
表 2 厚朴酚及水杨酸钠处理对妊娠小鼠器官重和胚胎数的影响 Table 2 Effects of magnolol and sodium salicylate treatment on organ weight and fetus number of pregnant mice |
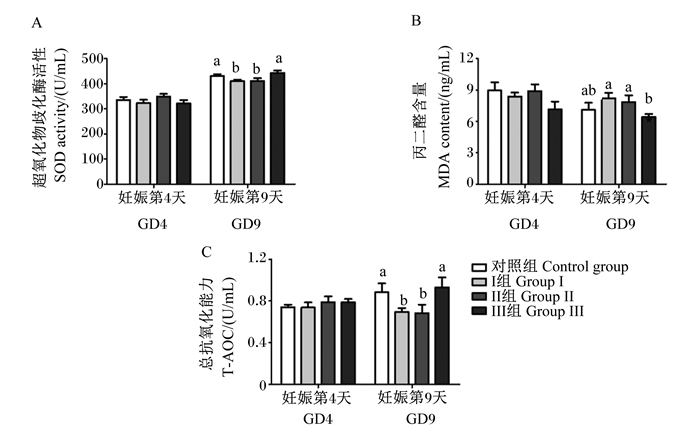
如图 2所示,血清中MDA含量、SOD活性和T-AOC的测定结果显示,相比于对照组,Ⅰ组在GD9时血清中SOD活性和T-AOC显著下降(P < 0.05),MDA含量显著上调(P < 0.05);而厚朴酚处理可抑制这一变化,Ⅲ组血清中SOD活性和T-AOC显著上升(P < 0.05),而MDA含量显著下降(P < 0.05)。这一现象表明水杨酸钠处理可引起妊娠中期小鼠体内抗氧化能力的下降,加重氧化应激,而厚朴酚的加入有助于缓解这一应激反应。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Data column with different small letter superscripts mean significant difference (P < 0.05). The same as below. 图 2 厚朴酚及水杨酸钠处理对妊娠小鼠血清抗氧化能力的影响 Fig. 2 Effects of magnolol and sodium salicylate treatment on serum antioxidant ability of pregnant mice |
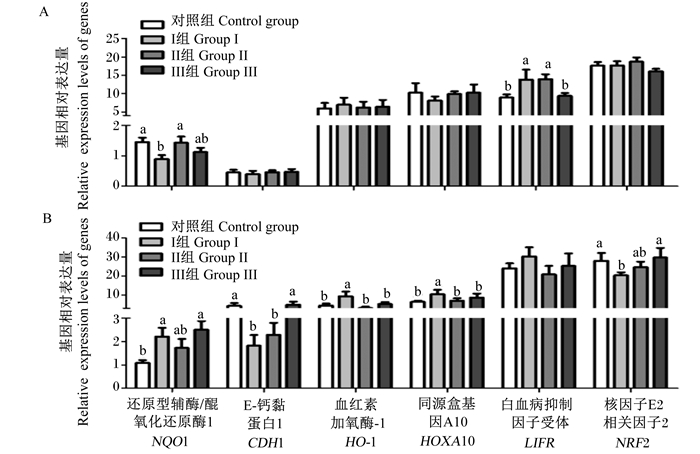
在GD4时,相比于对照组,Ⅰ组中子宫内膜NQO1基因相对表达量显著降低(P < 0.05),而LIFR基因相对表达量显著上调(P < 0.05),Ⅲ组中子宫内膜NQO1和LIFR基因相对表达量趋近对照组(图 3-A)。在GD9时,与对照组相比,Ⅰ组子宫内膜中CDH1和NRF2基因相对表达量显著降低(P < 0.05),HO-1和HOXA10基因相对表达量显著上升(P < 0.05),而相比于Ⅰ组,Ⅲ组子宫内膜CDH1基因相对表达量显著上升(P < 0.05),HO-1和HOXA10基因相对表达量显著下降(P < 0.05),上述结果表明,厚朴酚可消除水杨酸钠对多个基因表达的影响,显示出厚朴酚对水杨酸钠作用的抑制(图 3-B)。
|
图A和图B分别为GD4和GD9时基因相对表达量。 Fig. A and Fig. B were the relative expression levels of genes in GD4 and GD9. 图 3 厚朴酚及水杨酸钠处理对妊娠小鼠子宫内膜重要基因相对表达量的影响 Fig. 3 Effects of magnolol and sodium salicylate treatment on relative expression levels of important genes in endometrium of pregnant mice |
水杨酸钠所属NSAID类药物具有抗氧化、抗炎症等多种药理功效,是一类广泛使用的抗炎药物,但其大剂量使用可引发胚胎损失,甚至导致妊娠动物孕产期死亡[15]。本研究中,对妊娠早期小鼠灌胃280 mg/kg水杨酸钠可引起胚胎数和子宫全重显著降低,显示出高浓度水杨酸钠对妊娠小鼠具有显著的胚胎毒性,可诱导妊娠小鼠胚胎损伤发生。80和800 μmol/L厚朴酚均可显著抑制水杨酸钠引发的子宫全重降低,并抑制胚胎死亡,呈现一定的浓度依赖性,表明厚朴酚可缓解高浓度水杨酸钠对妊娠小鼠的胚胎毒性。
有报道指出,水杨酸钠的抗氧化功效与其对HO-1蛋白表达的诱导密切相关[16-17]。HO-1蛋白是NRF2的下游蛋白,可调节细胞内的氧化状态[4]。SOD是存在于动植物体内重要的抗氧化酶类,而T-AOC可直接显示待测样品的抗氧化能力,是评估机体抗氧化水平的重要指标。MDA是脂质过氧化产物,其高低可反映机体发生脂质过氧化的水平,是评估机体抗氧化水平的负向指标。本研究中,水杨酸钠处理可诱导子宫内膜中HO-1表达水平在GD4时呈上升趋势,而在GD9时显著上调。然而,高浓度水杨酸钠处理并未缓解妊娠小鼠体内氧化压力,血清SOD的活性和T-AOC均显著下调,而MDA含量显著上升,反映出妊娠小鼠体内氧化应激水平呈上升状态,这一现象可能与水杨酸钠浓度过高有关。机体内自由基,如活性氧(ROS)、羟自由基、氧自由基等,除引发机体氧化损伤反应外,也可作为重要的细胞信号分子。研究发现,适量过氧化氢可以诱导抗氧化酶基因表达,提高细胞及机体抗氧化能力[18]。同时,研究表明NSAID类药物也可引起细胞内ROS等上调,增加机体氧化压力[19-20]。因此,母鼠体内氧化应激水平的上调可能是由于高浓度水杨酸钠处理引发的抗氧化功能升高不足以覆盖其带来的氧化压力,引发氧化应激。相对于水杨酸钠处理,水杨酸钠灌胃后再添加800 μmol/L厚朴酚可显著提高血清SOD活性和T-AOC,而降低MDA含量,显示出厚朴酚对水杨酸钠引起的妊娠小鼠血清抗氧化损伤的恢复作用。
母体代谢系统的改变与胚胎发育的阶段密切相关。妊娠小鼠中,胚胎在GD4时开始着床,胚胎植入及子宫内膜的蜕膜化调节最终影响活胚胎数。白血病抑制因子(LIF)是机体内重要的调节因子,可广泛参与细胞分化、促炎症和/或细胞凋亡等进程,并对妊娠的开始与维持发挥着重要功能[21]。LIFR是LIF的受体,可以募集gp130形成复合物并激活Janus激酶-信号转导与转录激活子(JAK-STAT3)途径[22]。LIFR基因的缺失或干扰会导致胚胎植入失败,引发不孕,但其过表达的影响依旧未知。有研究显示,LIFR基因在整个妊娠阶段子宫内膜均有表达,但其表达水平和对STAT3的激活作用则呈现妊娠阶段的特异性,并受孕激素水平高度调控[23]。本研究中,水杨酸钠处理引发GD4时子宫内膜LIFR基因上调表达,推测这一基因表达上调可能对胚胎植入形成干扰,引起胚胎植入与发育障碍,导致胚胎数降低。而添加厚朴酚浓度为800 μmol/L时可显著抑制水杨酸钠处理引发的LIFR基因上调,并可显著抑制水杨酸钠引发的胚胎死亡,表明适当浓度的厚朴酚对LIFR基因相对表达量具有调节作用,该调节作用可能有助于缓解水杨酸钠引发的妊娠损伤。
小鼠胚胎器官发育约起始于GD6,这一过程受母体和胚胎组织释放的多种激素和细胞因子等调节。CDH1编码的蛋白质-E-钙黏蛋白,其下调或缺失能够解离β-连环蛋白(β-catenin),并可进一步激活无翼型MMTV整合位点家族/β-catenin(Wnt/β-catenin)信号通路[24-25],该通路能广泛地参与调节器官组织的生长发育。研究认为NSAIDs药物可通过启动子甲基化和miRNA途径调节CDH1基因表达[26],已有报道指出,水杨酸类药物可调节CDH1基因启动子的甲基化[27]。在对照组中,CDH1在GD9时子宫内膜的表达水平是GD4时的10倍,这一结果显示出CDH1对妊娠早、中期子宫内膜可能具有重要调节的作用。水杨酸钠处理可显著抑制GD9时子宫内膜中CDH1表达水平,当添加厚朴酚浓度达到800 μmol/L时可恢复水杨酸钠引起的CDH1基因相对表达量下调,使其达到对照组水平。此外,Taylor等[28]研究表明,HOXA10基因缺失小鼠的排卵正常,但胚胎植入受到了干扰。同时,该研究还发现HOXA10缺失胚胎可以植入正常小鼠的子宫中,但是正常胚胎不能植入具有HOXA10基因缺失的小鼠子宫中[28]。这些结果表明,HOXA10在调节胚胎植入过程中具有重要作用。本研究中,HOXA10在GD4时各组中的基因相对表达量无显著差异,但在GD9时,受水杨酸钠调节而显著上调,这一上调可在厚朴酚的处理下恢复至对照组水平。厚朴酚对HOXA10的调节作用与其浓度未呈现出相关性,较低浓度厚朴酚即可实现对子宫内膜中HOXA10基因相对表达量的调节,表明HOXA10可能是厚朴酚调节子宫内膜功能的重要靶点。
4 结论试验结果表明,高浓度水杨酸钠处理可引起妊娠小鼠胚胎数和子宫全重显著降低,引发血清SOD活性和T-AOC下调,提高血清MDA含量,并能显著影响子宫内膜LIFR、CDH1和HOXA10等基因相对表达量。厚朴酚的添加可提高妊娠小鼠胚胎数和子宫全重,上调血清SOD活性和T-AOC,降低MDA含量,抑制水杨酸钠引起的子宫内膜LIFR、CDH1和HOXA10基因相对表达量变化,有效缓解水杨酸钠引起的胚胎毒性和妊娠小鼠氧化损伤。
| [1] |
ZHANG J H, CHEN Z X, HUANG X H, et al. Insights on the multifunctional activities of magnolol[J]. Biomed Research International, 2019, 2019: 1847130. |
| [2] |
HUANG S H, CHEN Y, TUNG P Y, et al. Mechanisms for the magnolol-induced cell death of CGTH W-2 thyroid carcinoma cells[J]. Journal of Cellular Biochemistry, 2007, 101(4): 1011-1022. DOI:10.1002/jcb.21100 |
| [3] |
KIM G D, OH J, PARK H J, et al. Magnolol inhibits angiogenesis by regulating ROS-mediated apoptosis and the PI3K/AKT/mTOR signaling pathway in mES/EB-derived endothelial-like cells[J]. International Journal of Oncology, 2013, 43(2): 600-610. DOI:10.3892/ijo.2013.1959 |
| [4] |
TSE A K W, WAN C K, ZHU G Y, et al. Magnolol suppresses NF-κB activation and NF-κB regulated gene expression through inhibition of IkappaB kinase activation[J]. Molecular Immunology, 2007, 44(10): 2647-2658. DOI:10.1016/j.molimm.2006.12.004 |
| [5] |
ZHANG H T, XU X, CHEN L L, et al. Molecular determinants of magnolol targeting both RXRα and PPARγ[J]. PLoS One, 2011, 6(11): e28253. DOI:10.1371/journal.pone.0028253 |
| [6] |
DREIER D, LATKOLIK S, RYCEK L, et al. Linked magnolol dimer as a selective PPARγ agonist-structure-based rational design, synthesis, and bioactivity evaluation[J]. Scientific Reports, 2017, 7(1): 13002. DOI:10.1038/s41598-017-12628-5 |
| [7] |
KUMAR S, GURU S K, PATHANIA A S, et al. Autophagy triggered by magnolol derivative negatively regulates angiogenesis[J]. Cell Death & Disease, 2013, 4(10): e889. |
| [8] |
LI H B, YI X, GAO J M, et al. Magnolol-induced H460 cells death via autophagy but not apoptosis[J]. Archives of Pharmacal Research, 2007, 30(12): 1566-1574. DOI:10.1007/BF02977326 |
| [9] |
高厚明, 刘志承, 石巧玲, 等. 厚朴酚改善LPS诱导的小鼠抑郁行为和大脑细胞因子的研究[J]. 中医药通报, 2016, 15(2): 56-58. GAO H M, LIU Z C, SHI Q L, et al. Study on magnolol in improving depression behavior and brain cytokines in mice induced by LPS[J]. Traditional Chinese Medicine Journal, 2016, 15(2): 56-58 (in Chinese). |
| [10] |
LU Y C, CHEN H H, KO C H, et al. The mechanism of honokiol-induced and magnolol-induced inhibition on muscle contraction and Ca2+ mobilization in rat uterus[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2003, 368(4): 262-269. DOI:10.1007/s00210-003-0802-8 |
| [11] |
FOULON O, JAUSSELY C, REPETTO M, et al. Postnatal evolution of supernumerary ribs in rats after a single administration of sodium salicylate[J]. Journal of Applied Toxicology, 2000, 20(3): 205-209. DOI:10.1002/(SICI)1099-1263(200005/06)20:3<205::AID-JAT635>3.0.CO;2-G |
| [12] |
WÉRY N, FOULON O, BLACKER A, et al. Vertebral malformations induced by sodium salicylate correlate with shifts in expression domains of Hox genes[J]. Reproductive Toxicology, 2005, 20(1): 39-45. DOI:10.1016/j.reprotox.2004.12.014 |
| [13] |
ZHANG Q Q, YE X F, WANG L Z, et al. Embryo-fetal development toxicity of honokiol microemulsion intravenously administered to pregnant rats[J]. Regulatory Toxicology and Pharmacology, 2016, 74: 117-122. DOI:10.1016/j.yrtph.2015.11.012 |
| [14] |
BERGMAN K, CEKAN E, SLANINA P, et al. Effects of dietary sodium selenite supplementation on salicylate-induced embryo- and fetotoxicity in the rat[J]. Toxicology, 1990, 61(2): 135-146. DOI:10.1016/0300-483X(90)90015-9 |
| [15] |
DAVIS D P, DASTON G P, ODIO M R, et al. Maternal reproductive effects of oral salicylic acid in Sprague-Dawley rats[J]. Toxicology Letters, 1996, 84(3): 135-141. DOI:10.1016/0378-4274(95)03538-9 |
| [16] |
WANG W, CHEN S R, ZHOU Z P, et al. Aspirin suppresses neuronal apoptosis, reduces tissue inflammation, and restrains astrocyte activation by activating the Nrf2/HO-1 signaling pathway[J]. Neuroreport, 2018, 29(7): 524-531. DOI:10.1097/WNR.0000000000000969 |
| [17] |
MONG M C, YIN M C. Nuclear factor κB-dependent anti-inflammatory effects of s-allyl cysteine and s-propyl cysteine in kidney of diabetic mice[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3158-3165. DOI:10.1021/jf3002685 |
| [18] |
LU S Y, SU W, LI H H, et al. Abscisic acid improves drought tolerance of triploid bermudagrass and involves H2O2-and NO-induced antioxidant enzyme activities[J]. Plant Physiology and Biochemistry, 2009, 47(2): 132-138. DOI:10.1016/j.plaphy.2008.10.006 |
| [19] |
GIARDINA C, INAN M S. Nonsteroidal anti-inflammatory drugs, short-chain fatty acids, and reactive oxygen metabolism in human colorectal cancer cells[J]. Biochimica et Biophysica Acta: Molecular Cell Research, 1998, 1401(3): 277-288. DOI:10.1016/S0167-4889(97)00140-7 |
| [20] |
SARKAR S, BUHA D. Effect of ripe fruit pulp extract of Cucurbita pepo Linn.in aspirin induced gastric and duodenal ulcer in rats[J]. Indian Journal of Experimental Biology, 2008, 46(9): 639-645. |
| [21] |
PAIVA P, MENKHORST E, SALAMONSEN L, et al. Leukemia inhibitory factor and interleukin-11:critical regulators in the establishment of pregnancy[J]. Cytokine & Growth Factor Reviews, 2009, 20(4): 319-328. |
| [22] |
WANG X J, QIAO Y, XIAO M M, et al. Opposing roles of acetylation and phosphorylation in LIFR-dependent self-renewal growth signaling in mouse embryonic stem cells[J]. Cell Reports, 2017, 18(4): 933-946. DOI:10.1016/j.celrep.2016.12.081 |
| [23] |
YOO I, CHAE S, HAN J, et al. Leukemia inhibitory factor and its receptor: expression and regulation in the porcine endometrium throughout the estrous cycle and pregnancy[J]. Asian-Australasian Journal of Animal Sciences, 2019, 32(2): 192-200. DOI:10.5713/ajas.18.0429 |
| [24] |
GOTTARDI C J, WONG E, GUMBINER B M. E-cadherin suppresses cellular transformation by inhibiting β-catenin signaling in an adhesion-independent manner[J]. The Journal of Cell Biology, 2001, 153(5): 1049-1060. DOI:10.1083/jcb.153.5.1049 |
| [25] |
ORSULIC S, HUBER O, ABERLE H, et al. E-cadherin binding prevents beta-catenin nuclear localization and beta-catenin/LEF-1-mediated transactivation[J]. Journal of Cell Science, 1999, 112(8): 1237-1245. DOI:10.1242/jcs.112.8.1237 |
| [26] |
YIANNAKOPOULOU E. Targeting epigenetic mechanisms and microRNAs by aspirin and other non steroidal anti-inflammatory agents-implications for cancer treatment and chemoprevention[J]. Cellular Oncology, 2014, 37(3): 167-178. DOI:10.1007/s13402-014-0175-7 |
| [27] |
TAHARA T, SHIBATA T, NAKAMURA M, et al. Chronic aspirin use suppresses CDH1 methylation in human gastric mucosa[J]. Digestive Diseases and Sciences, 2010, 55(1): 54-59. DOI:10.1007/s10620-008-0701-4 |
| [28] |
TAYLOR S H, HEUVEL G B V, IGARASHI P. A conserved Hox axis in the mouse and human female reproductive system: late establishment and persistent adult expression of the Hoxa cluster genes[J]. Biology of Reproduction, 1997, 57(6): 1338-1345. DOI:10.1095/biolreprod57.6.1338 |




