2. 河南牧业经济学院, 郑州 450011
2. Henan University of Animal Husbandry and Economy, Zhengzhou 450011, China
温度、湿度、空气和饲粮的改变会引起动物应激,严重时会引起动物肠功能障碍,导致进食行为异常或肠绒毛损伤等肠道问题,通常表现为腹泻、采食量下降和死亡率升高等[1]。肠道损伤在动物养殖生产过程中持续发生,预防和修复肠道损伤是提高养殖水平、保证养殖效益的重要措施之一。当肠道发生损伤时,修复就是恢复肠道健康的首要策略,除蛋氨酸和精氨酸等功能性氨基酸外,一些益生菌、益生元、微量元素和植物提取物也都有修复肠道、降低腹泻率的功能,可以有效地提高动物的经济报酬,但是益生元不被机体吸收,相比益生菌具有更稳定的特点[2-3]。王丽[4]发现壳寡糖可以有效地改善糖尿病大鼠的氧化损伤,降低大鼠血清中的超氧化物歧化酶(SOD)活性,提高肾脏中的丙二醛(MDA)含量,可以起到清除自由基的效果,表明壳寡糖可以在一定程度上修复糖尿病模型大鼠氧化损伤的肾脏。马宁等[5]利用益生菌乳酸菌和功能性寡糖的混合微生态制剂处理肠道受损小鼠,功能性制剂可以有效地改善肠道菌群,增加肠道平滑肌的收缩功能。同样,段永艳[6]在低温应激罗非鱼饲料中补充L-精氨酸和寡糖,不但可以提高罗非鱼在应激情况下的免疫能力,同样还会提高罗非鱼的抗氧化能力和基因修复能力。吴士[7]也发现魔芋甘露低聚糖和益生菌的混合使用,可以有效降低肠上皮细胞损伤所产生的炎症因子,降低细胞的损伤程度。前期研究表明,不同浓度的阿司匹林(ASA)可以导致不同程度的肠道损伤,而甘露寡糖(MOS)浓度在600 mg/kg时,效果最好,低于该浓度效果较差,高于该浓度效果与该浓度效果一致,所以选择600 mg/kg作为修复浓度[8]。MOS作为一种功能性寡糖,可以通过调节动物肠道菌群、提高机体免疫能力和维持上皮屏障功能完整性能等有效地提高动物的生长性能[9-10]。但对于单独使用MOS对肠道损伤进行修复的研究相对较少,通常采用MOS和益生菌的混合添加,或者是MOS和其他益生元共同使用来进行研究。因此,本研究拟采用600 mg/kg的MOS来对不同浓度ASA所导致的肠道损伤进行修复,探讨MOS对大鼠肠道损伤修复的作用效果。
1 材料与方法 1.1 试验材料受试物:ASA(河南某生物科技有限公司,98%);MOS(某酵母股份有限公司,PW120)。
试验动物:SD大鼠购于河南省试验动物中心[SCXK(豫)2017—0001]。
主要设备仪器:切片机(金华市益迪医疗设备有限公司,YD-202A)、高速离心机(上海卢湘仪离心机仪器有限公司,2018113100)、正置倒置一体荧光显微镜(美国Echo公司,RVL-100-G)、酶标仪(帝肯奥地利有限责任公司,1711012817)。
1.2 试验设计试验采用单因素试验设计,36只6周龄SPF级SD雄性大鼠,体重为150~180 g,随机分为6组,每组6个重复,即空白组、模型组、MOS组、ASA1组、ASA2组和ASA3组,具体试验设计见表 1。大鼠进行单笼饲养,自由采食和饮水,饲养过程中每天更换饮水,每2 d更换1次垫料。适应期1周,正式试验3周。
|
|
表 1 试验设计 Table 1 Test design |
正式试验开始前对大鼠进行称重记录初体重,试验期间每天定时对大鼠的饲粮重和体重进行称重记录,试验结束前1天禁食,自由饮水,解剖前称量记录末体重,计算体增重(BWG)、平均日增重(ADG)、平均日采食量(ADFI)及饲料转化率(FCR)。曲颈处死大鼠后进行解剖,对脏器进行称重记录。计算脏器指数,公式如下:
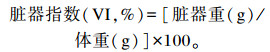
|
采用摘眼球方法对大鼠取血,血液在室温下自然凝固,3 000 r/min下离心20 min,收集血清,-20 ℃保存备用。对大鼠的血清溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)、髓过氧化物酶(MPO)活性及白细胞介素-2(IL-2)、D-乳酸(D-Lac)含量进行检测。具体操作方法严格按照上海鑫乐生物科技有限公司试剂盒说明书进行,最后在酶标仪450 nm的波长下测量吸光度。
1.3.3 肠道组织学的观察与测定取大鼠在空肠中段取5 cm,用pH为7.2的磷酸盐缓冲液(PBS)进行清洗,后在10%福尔马林中室温下保存,将肠段用流动水冲洗12 h,用梯度乙醇脱水,二甲苯透明,经过石蜡包埋,制作切片,利用苏木精-伊红染色后,用显微镜观察肠道绒毛,测量绒毛高度(VH)和隐窝深度(CD),并计算绒毛高度/隐窝深度比值(VH/CD)。
1.3.4 肠道黏液量的测定在肠道距幽门10 cm处取5 cm,PBS中保存;将肠道匀浆后加入1 mL的PBS溶液,成悬浮状。在4 ℃时,以15 000 r/min离心15 min。加入高碘酸(0.1%,100 μL)在37 ℃下孵育2 h,加入100 μL希夫试剂,室温下孵育30 min。在紫外可见分光光度计555 nm的波长下测量吸光度[11]。
1.3.5 肠道黏膜分泌型免疫球蛋白A(sIgA)含量测定截取5 cm靠近十二指肠的空肠处的肠组织,将肠段在纱布上剪开铺平,用玻璃片刮取肠黏膜置于离心管中,-80 ℃存放,采用酶联免疫吸附试验(ELISA)检测黏膜sIgA含量,按照sIgA试剂盒(上海鑫乐生物科技有限公司)说明书进行试验操作,最后在酶标仪450 nm的波长下测量吸光度[12]。
1.4 统计分析试验数据是以平均值±标准差表示,以SAS 9.1统计软件进行单因素方差分析,以P<0.05作为差异显著性判断标准。
2 结果 2.1 MOS对大鼠生长性能和脏器指数的影响由表 2可知,与空白组相比,模型组的生长性能均有下降趋势,大鼠的BWG、ADG、ADFI和FCR分别降低了14.67%、31.22%、9.34%和23.81%(P>0.05)。与模型组相比,MOS可以提高ASA3组大鼠的BWG、ADFI和FCR,分别提高了7.97%、2.13%和6.25%(P>0.05)。ASA1和ASA2组的生长性能均低于空白组,但是差异不显著(P>0.05)。
|
|
表 2 MOS对大鼠生长性能影响 Table 2 Effects of MOS on growth performance of rats |
由表 3可知,与空白组相比,模型组的肝脏指数、脾脏指数和胸腺指数分别降低了9.70%、9.10%和15.79%(P>0.05),MOS组肝脏指数和脾脏指数分别升高了1.39%和9.09%(P>0.05)。与模型组相比,ASA3组肝脏指数、脾脏指数和胸腺指数分别升高了1.02%、5.00%和6.25%(P>0.05)。
|
|
表 3 MOS对大鼠脏器指数的影响 Table 3 Effects of MOS on organ indexes of rats |
由表 4可知,与对照组相比,模型组血清LZM和T-SOD活性显著降低(P<0.05),分别降低了45.22%和46.14%,而血清MPO活性及IL-2和D-Lac含量显著增加(P<0.05),分别提高了106.60%、38.80%、137.93%;ASA1组血清MPO活性和D-Lac含量分别提高了39.82%和12.58%(P<0.05),但IL-2含量及LZM和T-SOD活性不存在显著差异(P>0.05);ASA2组血清LZM、MPO和T-SOD活性和D-Lac含量存在显著差异(P<0.05)。与模型组相比,ASA3组血清MPO活性和IL-2、D-Lac含量分别降低了17.80%、13.21%、2.90%,LZM和T-SOD活性分别提高了5.70%和17.69%,但只有T-SOD达到显著差异(P<0.05)。
|
|
表 4 MOS对大鼠血清生化指标的影响 Table 4 Effects of MOS on serum biochemical indexes of rats |
由表 5可知,与空白组相比,模型组VH、CD与VH/CD分别降低了24.27%、9.66%和14.98%,但只有VH和VH/CD达到显著水平(P<0.05);而MOS组的VH和CD分别增加了2.62%和9.22%(P>0.05);ASA1和ASA2组的VH均有一定程度的降低,分别降低了9.88%和14.56%(P<0.05),而CD和VH/CD与空白组相比均无显著差异(P>0.05)。与模型组相比较,ASA3组VH和VH/CD分别提高了2.79%和10.85%,VH/CD达到显著水平(P<0.05)。
|
|
表 5 MOS对大鼠肠道发育的影响 Table 5 Effects of MOS on intestinal morphology of rats |
由表 6可知,与空白组相比,模型组黏膜sIgA含量减少了30.32%(P<0.05),ASA1组黏膜sIgA含量与空白组不存在显著差异(P>0.05),ASA2组和ASA3组分别降低了7.39%和12.50%(P<0.05);与模型组相比,ASA3组升高了25.59%(P<0.05);与空白组相比,模型组黏液量降低了12.42%,其他ASA组相对于空白组均有一定程度的降低,但是都不存在显著差异(P>0.05)。
|
|
表 6 MOS对大鼠黏液量和黏膜sIgA含量的影响 Table 6 Effects of MOS on mucus volume and mucosal sIgA content of rats |
很多研究证明了MOS具有益生作用,不仅可以提高养殖动物的生长性能和免疫能力,还可以改善动物的肠道形态和肠道菌群免疫能力[13-14]。但是关于生长性能的试验结果却有所不同。熊阿玲等[15]在不同生长阶段肉鸡的饲粮中添加0.3~0.6 g/kg的MOS,可以提高1~42日龄的肉鸡的ADG和ADFI。而与本试验结果相同的是Biggs等[16]在肉鸡的饲粮中补充MOS,并不会影响生长肉鸡的生长性能。本试验大鼠的ADG、ADFI和FCR并没有因为添加MOS而受到影响。肝脏、脾脏和胸腺作为动物的免疫器官,这些免疫器官的指数大小可以用来评价机体免疫状态[17]。本试验中,ASA1、ASA2和ASA3组的肝脾指数相较于模型组都有一定升高的趋势,这一点也与沈文康等[18]在小鼠的试验中得到的结果相同。ASA3组的肝脏指数与模型组相比都出现了一定幅度的上升,但是效果不明显。这也表明了灌服600 mg/kg的MOS对ASA损伤大鼠的生长性能和免疫能力的修复效果不明显。
大鼠血清中的IL-2含量和LZM活性也可以反映大鼠的免疫能力,而血清MPO与T-SOD活性可以反映ASA致大鼠损伤机体的氧化应激水平,血清D-Lac含量则可以反映肠道的通透性。本试验中的模型组大鼠血清中的IL-2含量升高了38.8%,LZM活性降低了45.22%,后经过600 mg/kg的MOS处理后,IL-2含量降低了13.21%,LZM活性提高了5.70%,虽然有所改善,但是不存在显著差异。另外经过50和100 mg/kg ASA损伤的大鼠血清IL-2含量恢复到了一个正常的范围内,与IL-2含量变化不同的是,ASA3组(200 mg/kg ASA损伤)的血清T-SOD活性比模型组高了17.69%,出现显著差异,但是ASA3组的活性仍低于空白组,且存在显著差异。SOD活性的提高表明MOS可以有效地提高大鼠的抗氧化能力,降低大鼠氧化损伤造成的危害。郭志勋等[19]在鱼饲料中添加益生元低聚糖,鱼血清中的LZM和SOD活性都有一个很明显的提升作用。同样,梁金逢等[20]的试验表明,MOS配合复合益生菌可以提高育成期牛血清中的SOD的活性,提高抗氧化能力。血清中D-Lac含量的升高表明肠道损伤导致了肠道黏膜屏障功能受损,肠道细菌产生的代谢废物透过肠屏障进入血液循环。刘静波等[21]在断奶仔猪的肠道屏障试验结果中指出,摄入短链果寡糖可以显著降低仔猪血清中D-Lac含量,保护肠道屏障功能。而本试验结果表明,添加MOS不会对大鼠的肠道通透性有影响,而且MOS对200 mg/kg ASA损伤大鼠的肠道通透性并没有很明显的修复作用,对于50、100 mg/kg ASA所导致的肠道损伤虽然有一定的修复趋势,但并没有达到损伤前的健康水平,表明灌服600 mg/kg的MOS对大鼠肠道轻微损伤有修复的作用。
肠道形态直接关系到动物的生长性能,良好的肠道形态可以促进机体对营养物质的消化吸收。VH可以体现出动物肠道与营养物质接触面积,其值越高表明动物的吸收能力越强,CD与肠上皮生长速率有关,VH/CD反映出肠道的功能状态[22]。本试验中,模型组的VH、CD与VH/CD都出现下降趋势,表明肠道损伤动物的肠道形态遭到了破坏,模型组的VH、VH/CD较空白组分别降低了24.27%和14.98%。本试验与Galdino等[23]的研究结果是一致的,添加寡糖可以改善损伤动物的肠道形态。同样的,Hagiographa等[24]在鹌鹑的饲粮中添加MOS,可以显著提高空肠VH。本试验中,在50、100和200 mg/kg ASA导致的肠道损伤动物饲粮中补充MOS,3个试验组的VH都没有出现显著变化,但是ASA3组的VH/CD与模型组相比上升了10.85%,达到了与空白组相同的水平,ASA1和ASA2组的CD都与空白组无显著差异,处于健康状态。这表明MOS对肠道损伤大鼠的肠道形态具有一定的修复作用。
肠道作为机体最大的免疫器官和消化外界营养物质的场所,肠道免疫屏障也是至关重要的,而黏液和免疫蛋白是维持肠道屏障功能健康的主要成分[25-26]。喻振等[27]在5-氟尿嘧啶诱导的大鼠肠黏膜损伤模型中,模型组的大鼠肠道sIgA含量显著降低。本试验中ASA2和ASA3组的黏膜sIgA含量变化可以看出后添加MOS可以提高免疫蛋白的含量,但是并不会使sIgA含量恢复到正常水平,而ASA1组的黏膜sIgA含量可以恢复到健康状态。大鼠sIgA含量的增加表明MOS可以降低肠道内的细菌和抗原等物质对肠道的损伤,修复改善了肠黏膜损伤导致的sIgA含量减少的情况。同样,本试验中的所有试验组肠道黏液量都不存在显著差异,MOS并不会减少大鼠肠道黏液量的分泌,表明肠道损伤的大鼠,后期补充MOS虽然可以提高大鼠肠道黏膜免疫,但对肠道损伤的修复没有明显作用。
4 结论在本试验条件下,大鼠灌服600 mg/kg MOS对不同剂量ASA导致的大鼠肠道损伤修复作用不同。MOS可以提高ASA1组大鼠血清IL-2含量、LZM活性及黏膜sIgA含量,显著提高ASA2组血清中的IL-2含量。在肠道形态方面,600 mg/kg的MOS可以有效提高不同剂量ASA损伤大鼠VH/CD,表明肠道损伤的大鼠经灌服MOS后,对ASA导致的大鼠肠道损伤具有一定的修复作用。
| [1] |
余哲琪, 温静, 陈忠. 热应激对家禽肠道结构与功能影响的研究概况[J]. 动物医学进展, 2019, 40(9): 118-121. YU Z Q, WEN J, CHEN Z. Overview of effects of heat stress on structure and function of intestine in poultry[J]. Progress in Veterinary Medicine, 2019, 40(9): 118-121 (in Chinese). DOI:10.3969/j.issn.1007-5038.2019.09.024 |
| [2] |
黄登桂, 周加义, 高春起, 等. 产肠毒素大肠杆菌对仔猪肠道黏膜屏障功能的影响及其损伤修复研究进展[J]. 动物营养学报, 2019, 31(1): 48-56. HUANG D G, ZHOU J Y, GAO C Q, et al. Research progress of effects of enterotoxigenic Escherichia coli on intestinal mucosal barrier function and injury repair of piglets[J]. Chinese Journal of animal nutrition, 2019, 31(1): 48-56 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.006 |
| [3] |
ALLOUI M N, SZCZUREK W, ŚWIATKIEWICZ S. The usefulness of prebiotics and probiotics in modern poultry nutrition: a review[J]. Annals of Animal Science, 2013, 13(1): 17-32. DOI:10.2478/v10220-012-0055-x |
| [4] |
王丽. 壳寡糖胍的微波合成及对糖尿病大鼠氧化损伤的修复作用[D]. 硕士学位论文. 天津: 天津大学, 2017. WANG L. Microwave-assisted synthesis of chitooligosaccharide guanidine and its repairment effect on oxidative damage of diabetic rats[D]. Master's Thesis. Tianjin: Tianjin University, 2017. (in Chinese) |
| [5] |
马宁, 张志宏, 钱爽, 等. 微生态制剂对小鼠受损肠道的修复作用[J]. 中国医学创新, 2017, 14(25): 28-31. MA N, ZHANG Z H, QIAN S, et al. Effect of microecological preparation on restore of damaged intestinal tract in mice[J]. Chinese Medical Innovations, 2017, 14(25): 28-31 (in Chinese). DOI:10.3969/j.issn.1674-4985.2017.25.007 |
| [6] |
段永艳. L-精氨酸、寡糖在急性低温应激条件下对罗非鱼免疫系统及基因损伤与修复的影响[D]. 硕士学位论文. 广州: 华南师范大学, 2012. DUAN Y Y. Effects of L-arginine and oligosaccharide on immune system and gene damage and repair of tilapia under acute low-temperature stress[D]. Master's Thesis. Guangzhou: South China Normal University, 2012. (in Chinese) |
| [7] |
吴士. 魔芋甘露低聚糖与枯草芽孢杆菌对肠上皮细胞损伤的协同修复作用[D]. 硕士学位论文. 武汉: 华中农业大学, 2017. WU S. Synergistic effect of konjac mannose oligosaccharide and Bacillus subtilis on intestinal epithelial cell injury[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2017. (in Chinese) |
| [8] |
陈勇江. 甘露寡糖对大鼠肠道损伤修复机制的研究[D]. 硕士学位论文. 郑州: 河南工业大学, 2020. CHEN Y J. Study on the mechanism of manna oligosaccharide on the repairment of intestinal injury of rats[D]. Master's Thesis. Zhengzhou: Henan University of Technology, 2020. (in Chinese) |
| [9] |
陈勇江, 王金荣, 苏兰利, 等. 甘露寡糖的作用机制及其在动物生产中的应用[J]. 饲料研究, 2019, 42(1): 118-120. CHEN Y J, WANG J R, SU L L, et al. Mechanism of manno-oligosaccharides and its application in animal production[J]. Feed Research, 2019, 42(1): 118-120 (in Chinese). |
| [10] |
TORRECILLAS S, MONTERO D, IZQUIERDO M. Improved health and growth of fish fed mannan oligosaccharides: potential mode of action[J]. Fish & Shellfish Immunology, 2014, 36(2): 525-544. |
| [11] |
SUYAMA Y, HANDA O, NAITO Y, et al. Mucus reduction promotes acetyl salicylic acid-induced small intestinal mucosal injury in rats[J]. Biochemical and Biophysical Research Communications, 2018, 498(1): 228-233. DOI:10.1016/j.bbrc.2018.02.202 |
| [12] |
邱杰, 唐合兰, 陈英, 等. 正加速度暴露下大鼠肠黏膜屏障损伤及sIgA水平的变化[J]. 解放军医学杂志, 2016, 41(10): 865-868. QIU J, TANG H L, CHEN Y, et al. Effects of positive acceleration exposure on intestinal mucosal barrier and sIgA level in rats[J]. Medical Journal of Chinese People's Liberation Army, 2016, 41(10): 865-868 (in Chinese). DOI:10.11855/j.issn.0577-7402.2016.10.14 |
| [13] |
郭婷婷, 胡丹丹, 金亚东, 等. 甘露寡糖对泌乳早期奶牛瘤胃发酵及生产性能影响的研究[J]. 饲料工业, 2017, 38(17): 56-60. GUO T T, HU D D, JIN Y D, et al. Effect of mannose oligosaccharides on rumen fermentation and performance of early lactating dairy cows[J]. Feed Industry, 2017, 38(17): 56-60 (in Chinese). |
| [14] |
吴峰洋, 李冲, 崔嘉, 等. 甘露寡糖对兔肠道健康及功能形态的影响[J]. 家畜生态学报, 2017, 38(6): 5-7, 36. WU F F, LI C, CUI J, et al. Effects of manna oligosaccharides on intestinal health and functional morphology of rabbits[J]. Journal of Domestic Animal Ecology, 2017, 38(6): 5-7, 36 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.06.002 |
| [15] |
熊阿玲, 包龙飞, 许兰娇, 等. 饲粮中添加甘露寡糖对肉仔鸡生长性能及组织天然免疫相关基因表达的影响[J]. 中国粮油学报, 2019, 34(9): 80-87. XIONG A L, BAO L F, XU L J, et al. Effects of dietary supplementation of mannan-oligosaccharides on growth performance and innate immunity-associated gene expressions in tissues of broiler chickens[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(9): 80-87 (in Chinese). DOI:10.3969/j.issn.1003-0174.2019.09.014 |
| [16] |
BIGGS P, PARSONS C M. The effects of several organic acids on growth performance, nutrient digestibilities, and cecal microbial populations in young chicks[J]. Poultry Science, 2008, 87(12): 2581-2589. DOI:10.3382/ps.2008-00080 |
| [17] |
ATTIA Y A, AL-KHALAIFAH H, IBRAHIM M S, et al. Blood hematological and biochemical constituents, antioxidant enzymes, immunity and lymphoid organs of broiler chicks supplemented with propolis, bee pollen and mannan oligosaccharides continuously or intermittently[J]. Poultry Science, 2017, 96(12): 4182-4192. DOI:10.3382/ps/pex173 |
| [18] |
沈文康, 张明军, 赵宁芳, 等. 甘露寡糖对免疫低下小鼠免疫力的影响[J]. 湖南畜牧兽医, 2015(4): 13-15. SHEN W K, ZHANG M J, ZHAO N F, et al. Effects of mannose oligosaccharides on immunity of immune-impaired mice[J]. Hunan Animal Science, and Veterinary Medicine, 2015(4): 13-15 (in Chinese). DOI:10.3969/j.issn.1006-4907.2015.04.006 |
| [19] |
郭志勋, 林黑着, 徐力文, 等. 饲料中添加半乳低聚糖对军曹鱼生长、部分血清免疫和生化因子的影响[J]. 南方水产, 2011, 7(1): 56-61. GUO Z X, LIN H Z, XU L W, et al. Effects of galacto-oligosaccharides in feed on growth, serum immunity and biochemical factors of cobia[J]. Southern China Fisheries Science, 2011, 7(1): 56-61 (in Chinese). DOI:10.3969/j.issn.2095-0780.2011.01.009 |
| [20] |
梁金逢, 文信旺, 周晓情, 等. TMR日粮添加寡糖和复合益生菌对育成牛生长性能、免疫功能及抗氧化功能的影响[J]. 饲料工业, 2019, 40(15): 41-44. LIANG J F, WEN J X, ZHOU X Q, et al. Effects of TMR diets added oligosaccharide and compound probiotics on the growth performance, immune function and antioxidant function of breeding cattle[J]. Feed Industry Magazine, 2019, 40(15): 41-44 (in Chinese). |
| [21] |
刘静波, 曹山川, 杨勇, 等. 短链果寡糖对断奶仔猪肠道氧化还原状态和屏障功能的影响[J]. 动物营养学报, 2019, 31(8): 3863-3871. LIU J, CAO S C, YANG Y, et al. Effects of short chain fructo-oligosaccharide on intestinal redox status and barrier function of weaning piglets[J]. Chinese Journal of Animal Nutrition, 2019, 31(8): 3863-3871 (in Chinese). |
| [22] |
姚浪群, 萨仁娜, 佟建明, 等. 安普霉素对仔猪肠道微生物及肠壁组织结构的影响[J]. 畜牧兽医学报, 2003, 34(3): 250-257. YAO L Q, TONG J M, SA R N, et al. Effect of apramycin on intestinal flora and intestinal morphology of piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2003, 34(3): 250-257 (in Chinese). DOI:10.3321/j.issn:0366-6964.2003.03.009 |
| [23] |
GALDINO F M P, ANDRADE M E R, DE BARROS P A V, et al. Pretreatment and treatment with fructo-oligosaccharides attenuate intestinal mucositis induced by 5-FU in mice[J]. Journal of Functional Foods, 2018, 49: 485-492. DOI:10.1016/j.jff.2018.09.012 |
| [24] |
HAJIAGHAPOUR M, REZAEIPOUR V. Comparison of two herbal essential oils, probiotic, and mannan-oligosaccharides on egg production, hatchability, serum metabolites, intestinal morphology, and microbiota activity of quail breeders[J]. Livestock Science, 2018, 210: 93-98. DOI:10.1016/j.livsci.2018.02.007 |
| [25] |
ELDERMAN MSOVRAN B, HUGENHOLTZ F, et al. The effect of age on the intestinal mucus thickness, microbiota composition and immunity in relation to sex in mice[J]. PLoS One, 2017, 12(9): e0184274. DOI:10.1371/journal.pone.0184274 |
| [26] |
吴英韬. 益生菌对5-氟尿嘧啶诱发大鼠肠粘膜损伤的保护作用研究[D]. 硕士学位论文. 大连: 大连医科大学, 2014. WU Y T. Research on protective effect of probiotics to 5-Fu induced rats' intestinal mucosa injury[D]. Master's Thesis. Dalian: Dalian Medical University, 2014. (in Chinese) |
| [27] |
喻振, 于瑞莲, 邵佳蔚, 等. 人工蝉花对5-氟尿嘧啶诱发大鼠肠黏膜损伤的修复作用研究[J]. 中国药房, 2019, 30(21): 2973-2979. YU Z, YU R L, SHAO J W, et al. Study on repair effect of artificial isaria cicadae on intestinal mucosal injury induced by 5-fluorouracil in rats[J]. China pharmacy, 2019, 30(21): 2973-2979 (in Chinese). |




