鸡肉是我国仅次于猪肉的第二大肉类消费品。风味是人们选择鸡肉产品的重要因素,它主要由动物体内风味前体物质的种类和含量决定,并在宰后通过热处理产生挥发性芳香气体和非挥发性滋味物质而得以体现。脂质是影响肉品质的重要因素,与风味有着密切的联系[1]。因此,本文综述了鸡肉风味形成的前体物质、脂质与鸡肉风味的关系及相关调控因子以及功能性成分对脂质代谢和鸡肉风味的影响,为深入理解鸡肉风味的形成提供理论参考,为改善鸡肉风味的研究提供方向。
1 风味前体物质鸡肉风味包括肉的滋味和肉的香气,均来源于生肉中的风味前体物质。风味前体物质可分为水溶性风味前体物质和脂质。水溶性风味前体物质包括游离糖、无机盐、游离氨基酸、肽、核糖、核苷酸、硫胺素等,是形成鲜、甜、苦、咸、酸5种基本味道的因素,是主要的滋味呈味物质[2]。脂质主要以皮下脂肪、肌间脂肪和肌内脂肪(intramuscular fat,IMF)3种形式存在,皮下脂肪和肌间脂肪对肉品风味形成的作用较小[3],而IMF中由于富含大量不饱和脂肪酸的磷脂,如油酸、亚麻酸和花生四烯酸等,对风味的形成具有重要作用,是不同物种间油脂衍生的挥发性气体成分差异的主要原因[4]。Mottram等[3]将有磷脂的肉制品与脱脂肉制品进行比较,结果显示前者的风味物质指标均高于后者,这说明磷脂也是风味形成的主要物质。风味前体物质的种类和含量决定了鸡肉最后的风味,品种是影响风味的因素之一。吴琼等[5]对5个不同品种的雉鸡肌肉营养成分进行分析表明,不同雉鸡肌肉常规营养成分、胆固醇、肌苷酸、氨基酸和脂肪酸组成基本一致,但含量有一定差异。除此之外,如性别、日龄、饲料、老化和烹饪条件等都会影响风味形成[6]。
2 脂质对风味的影响脂质是重要的风味前体物质,其对鸡肉风味的影响主要集中在挥发性风味化合物上,体现为鸡肉的香气。风味化合物可由美拉德反应、硫胺素降解、脂质氧化降解以及脂质氧化与美拉德反应互作共同产生[7],脂质对鸡肉风味的影响主要通过后2种方式。滕迪克等[8]认为,脂肪氧化降解产生的香味物质可能是形成不同品种肉类特殊风味的原因。研究表明,绝大部分的挥发性风味化合物来自脂质氧化降解,尤其是不饱和脂肪酸氧化降解产生了许多风味化合物[9]。除此之外,脂肪酸可以与美拉德反应中的中间化合物反应,形成具有较低气味阈值的风味化合物,提升对风味的潜在影响,而来源于美拉德反应和硫胺素降解产生的挥发性风味化合物仅占一小部分[10-12]。Madruga等[13]也有类似发现,在煮熟的山羊肉中测定到136种化合物,其中有98种(包括27种醛、25种烃、19种酮、16种醇、5种羧酸和6种呋喃)是由脂质氧化形成的,38种是通过美拉德反应形成的挥发性化合物(包括杂环氧、氮、含硫化合物及非杂环化合物)。
2.1 脂质氧化对风味的影响鸡胸肉中富含单不饱和脂肪酸和多不饱和脂肪酸,两者分别占总脂肪酸比例的31.86%~34.66%和24.50%~31.22%,且在多不饱和脂肪酸中,亚油酸含量极其丰富[14]。经过脂质氧化降解,可以生成数百种的挥发性化合物,包括烃、醛、醇、酮、酯以及一些含氧杂环化合物等[14]。相关研究表明,醛在肉的香气中起着至关重要的作用,不饱和脂肪酸氧化生成多种醛,如己醛、戊醛、壬醛、庚醛、辛醛、(E)-2-辛烯醛、(Z)-2-癸烯醛、(E)-2-癸烯醛、(E)-2-癸烯醛和(E)-2-己烯醛等[13]。在鸡肉的风味化合物中,亚油酸氧化产生的己醛和(E, E)-2, 4-癸二烯醛是最丰富的醛类,其中(E, E)-2, 4-癸二烯醛与油炸香味和脂肪香味有关,由于气味阈值更低,被认为对风味的影响作用更大,与脂质氧化产物γ-十二内酯共同作为鸡肉风味的特征成分[15]。肉在烹调中的快速反应可以产生令人满意的味道,但是也会在过氧化或长期储存中产生一些不良的风味。鸡肉中较高水平的不饱和脂肪酸,使得鸡肉比红肉更容易因脂质氧化而产生异味[16]。由于气味阈值低,含硫、含氮的杂环化合物即使在低浓度的条件下也会对鸡肉香味造成显著的负面影响[2]。此外,α-生育酚的缺乏会致使鸡肉产生不良气味,例如“过加热异味”,从而影响整体风味[17]。
2.2 脂质氧化与美拉德反应相互作用对风味的影响脂质氧化降解产生的醛类物质或磷脂中极性基团上的氨基可以与美拉德反应相互作用。一方面,通过减少由美拉德反应产生的含硫化合物,改善肉的风味;另一方面,与美拉德反应共同生成挥发性化合物,如醇类、烷基呋喃类等物质,从而影响肉的风味[18]。由于脂质参与美拉德反应共同生成的产物种类和含量都比较少,且不显著影响整体气味模型的变化,因此,认为减少美拉德反应产生的含硫化合物是整个互作反应影响肉风味的有效方式,对于富含不饱和脂肪酸的鸡肉而言,互作反应影响尤其显著。
3 家禽脂质的合成与调控 3.1 家禽脂质沉积的基本过程家禽的脂质合成与哺乳动物不同,家禽的肝外组织合成脂肪酸很有限,肝脏是脂肪酸从头合成的主要器官,家禽脂质沉积是一个脂质合成、转运和分解3者结合的动态过程。葡萄糖首先在肝脏分解为乙酰辅酶A,在乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪合成酶(fatty acid synthetase,FAS)和二酯酰甘油酰基转移酶(diacylglycerol acyltransferase,DGAT)等酶以及供氢体还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的作用下再转化为甘油三酯(triglyceride,TG)或胆固醇,其中苹果酸酶(malic enzyme,ME)可通过苹果酸-丙酮酸循环促进NADPH的合成,是家禽肝脏脂质合成能量供应的主要来源[19]。在血液中,胆固醇和TG由极低密度脂蛋白(very low density lipoprotein,VLDL)携带运输至脂肪组织,在毛细血管内皮上VLDL携带的TG经脂蛋白脂酶(lipoprotein lipase,LPL)水解成脂肪酸和甘油,并在脂肪细胞中重新酯化后储存或利用[20]。TG在脂肪细胞的分解受3种酶调控,依次为甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)、激素敏感脂酶(hormone-sensitive lipase,HSL)和单酰甘油脂酶(monoacylglycerol lipase,MGL)。其中ATGL是近年研究发现的TG水解限速酶,HSL主要水解来自TG中1′和3′位置的酯键,并由MGL完成最后一步水解,生成甘油和脂肪酸,以上过程详见图 1。
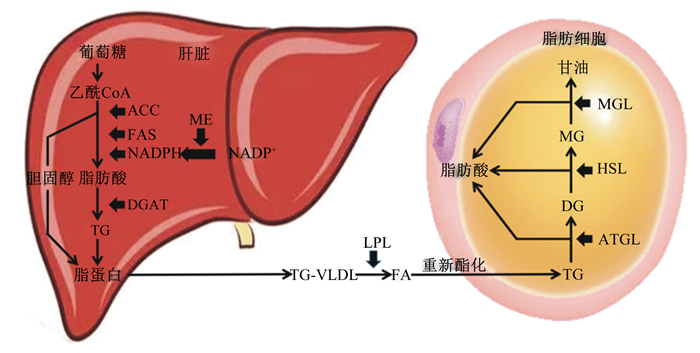
|
ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase;FAS:脂肪酸合成酶fatty acid synthetase;NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸nicotinamide adenine dinucleotide phosphate;ME:苹果酸酶malic enzyme;NADP+:烟酰胺腺嘌呤二核苷酸磷酸oxidized form of nicotinamide adenine dinucleotide phosphate;DGAT:二酰基甘油酰基转移酶acyl-CoA: diacylglycerol acyltransferase;VLDL:极低密度脂蛋白very low density lipoprotein;LPL:脂蛋白脂酶lipoprotein lipase;FA;脂肪酸fatty acid;TG:甘油三酯triglyceride;ATGL:甘油三酯脂肪酶adipose triglyceride lipase;DG:二酰甘油diacylglycerol;HSL:激素敏感脂酶hormone-sensitive lipase;MG:单酰甘油monoacylglycerol;MGL:单酰甘油脂酶monoacylglycerol lipase。 图 1 家禽脂质沉积基本过程 Fig. 1 Basic process of lipid deposition in poultry |
IMF含量是确定肉质的重要特征,对肉的嫩度、水分含量和味道具有积极作用。腹部脂肪的过多沉积会对饲料效率和胴体质量产生负面影响,因此,在不增加动物整体脂肪沉积的前提下,提高IMF的比例对风味或肉品质都具有重要意义。IMF与皮下脂肪在代谢中存在不同的调控机制,其中IMF与皮下脂肪的合成前体和调控脂肪酸合成的酶活性均存在差异,但其间的沉积差异尚未有系统的研究结果[21]。现有研究中,通过全基因组关联分析、基因多态性分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析和组学(转录组学、表观基因组学、蛋白质组学和代谢组学)等方法[22-23],筛选了一些与脂质代谢有关的调控因子,如腺苷单磷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)、脂肪酸结合蛋白(fatty acid binding proteins,FABPs)、脂滴包被蛋白1(perilipin 1,PLIN1)等,这些调控因子在鸡脂肪代谢的调控上起着关键作用。
3.2.1 脂质代谢相关调控因子 3.2.1.1 AMPKAMPK以一种异源三聚体复合物的形式在细胞中广泛存在,调控动物能量、脂质和蛋白质代谢并维持其稳态。在生物体脂质代谢过程中,AMPK通过直接磷酸化脂质代谢相关酶以及转录因子来调控机体的脂质合成或分解。固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)是机体调控脂质合成的重要核转录因子,SREBP-1c主要通过如ACC1、FAS、硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)等下游脂质合成相关基因的表达来调控脂质代谢,ACC和FAS是脂肪酸合成的关键酶,SCD1是单不饱和脂肪酸合成的限速酶,可催化棕榈酸酯和硬脂酸酯转化为相应的不饱和脂肪酸(C16 ∶ 1和C18 ∶ 1),进一步用于胆固醇和磷脂的合成;SREBP-2主要参与胆固醇代谢,其中3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)是胆固醇合成的限速酶。AMPK一方面可直接磷酸化SREBP-1c的Ser372位点或SREBP-2,通过使该蛋白水解或抑制其核转位过程导致脂质合成相关的靶基因表达受阻,从而下调脂肪酸和胆固醇的合成[24];另一方面,AMPK磷酸化抑制ACC2的活性,通过降低丙二酰辅酶A的合成从而提高其介导的肉碱棕榈酰转移酶1(carnitine palmityl transferase 1,CPT1)的活性,促进脂肪酸的氧化[25]。AMPK还可作用于HMGCR的Ser871位点,磷酸化抑制其活性从而起到抑制胆固醇合成的作用[26]。此外,AMPK还可以通过提高过氧化物体增殖体激活受体共激活因子-1α(peroxisome proliferators activated receptor-γ co-activator-1α,PGC-1α)蛋白的表达水平来改善脂肪酸β氧化。PGC-1α是真核生物控制能量稳态的重要调节剂,现研究证明其在线粒体生物发生、葡萄糖和脂肪酸代谢等过程发挥重要作用[27]。以上有关AMPK对家禽脂质代谢的调控机制详见图 2。胡庆美[28]研究发现,重组脂联素通过激活鸡成肌细胞中AMPK/ACC/CPT1信号通路,使成肌细胞对脂肪酸和葡萄糖的摄入增加,脂质氧化利用加强,在细胞内起降脂作用,并在一定程度上增加了PGC-1α/β蛋白的表达水平。Gan等[29]在鸡脂肪细胞上也有一致的结果。近期研究表明,干扰PGC-1β蛋白及mRNA的表达,降低了PPARγ、SREBP-1c和FAS的mRNA表达水平以及PPARγ、SREBP-1c和脂肪型脂肪酸结合蛋白(A-FABP)的蛋白表达水平,说明PGC-1β介导调控了鸡前脂肪细胞的分化和脂质沉积[30]。在哺乳动物中也有类似发现,通过在猪饲粮中添加额外亮氨酸可以抑制AMPK通路来加强骨骼肌中脂质合成能力,从而增加骨骼肌中IMF的积累以及单不饱和脂肪酸的合成[25]。Xiao等[31]在小鼠体内外试验发现,过表达胰岛素样生长因子结合蛋白5(insulin like growth factor binding protein 5,IGFBP5)抗体通过激活AMPK通路有效抑制了肝脂质积累和胰岛素抵抗,伴随着SREBP-1c介导的与脂肪生成相关的FAS和ACC1基因表达的下调[32],上调了脂肪酸氧化相关基因如PPARα、CPT1A和酯酰辅酶A氧化酶1(acyl-coenzyme A oxidase 1,ACOX1)的表达,从而减少了HepG2细胞内脂滴,并促进了葡萄糖摄取和糖原生成。
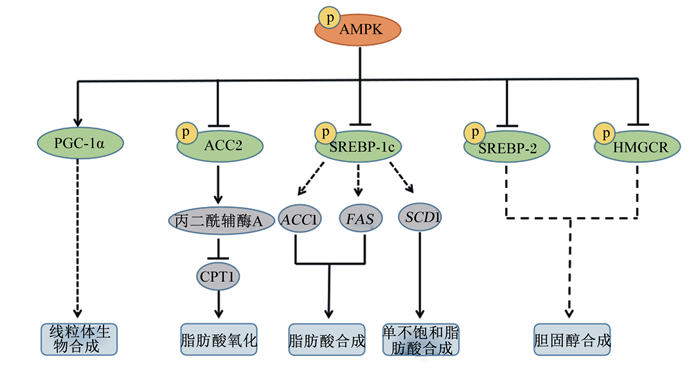
|
AMPK:腺苷酸活化蛋白激酶AMP-activated protein kinase;PGC-1α:过氧化物酶体增殖物激活受体-γ共激活因子-1α peroxisome proliferators activated receptor-γ co-activator-1α;ACC1/2:乙酰辅酶A羧化酶1/2 acetyl-CoA carboxylase 1/2;CPT1:肉碱棕榈酰转移酶1 carnitine palmityl transferase 1;SREBP-1c:固醇调节元件结合蛋白-1c sterol regulatory element binding protein-1c;FAS:脂肪酸合成酶fatty acid synthetase;SCD1:硬脂酰辅酶A去饱和酶1 stearoyl-CoA desaturase 1;SREBP-2:固醇调节元件结合蛋白-2 sterol regulatory element binding protein-2;HMGCR:3-羟基-3-甲基戊二酸单酰辅酶A还原酶3-hydroxy-3-methylglutaryl-CoA reductase。 图 2 AMPK对家禽脂质代谢的调控机制 Fig. 2 Regulatory mechanism of AMPK on lipid metabolism in poultry[24-27] |
PPARs控制包括脂质代谢许多细胞内的代谢过程,属于配体诱导核受体,具有PPARα、PPARβ/δ、PPARγ 3种亚型。PPARα基因与脂肪酸氧化有关,可通过上调乙酰辅酶A氧化酶表达、促进脂肪酸水解以及脂肪酸去饱和作用参与脂肪酸的氧化[33]。在肉鸡中,PPARα相对基因表达水平与肝组织的脂肪含量呈负相关[34]。PPARβ/δ可促进能量的消耗,非激活状态下的PPARβ/δ可通过竞争过氧化物酶体增殖剂激活受体反应元件(peroxisome proliferator responsive element,PPRE)抑制PPARα和PPARγ靶基因表达。与PPARα和PPARβ/δ作用相反,PPARγ基因可调控前脂肪细胞分化以及细胞中脂肪的沉积。在脂肪组织中,PPARγ主要负责调节脂肪酸的储存和释放,其表达可诱导脂肪代谢相关基因A-FABP或载脂蛋白B(apolipoprotein B,Apo-B)的表达。在小鼠的PPARγ基因敲除试验中,试验组小鼠体脂肪含量显著低于对照组[35]。此外,Chen等[36]对五华鸡的研究表明,PPARγ基因的高水平表达与雌性五华鸡的高IMF含量相关,推测PPARγ基因可能是雌性鸡IMF选择的候选基因。
3.2.1.3 FABPsFABPs是一类与长链脂肪酸溶解度及转运相关的胞内蛋白质,与长链脂肪酸之间具有高亲和力,是组织中脂质积累的良好标志物。研究表明,A-FABP基因是IMF沉积的一个候选基因,可促进肌肉脂肪细胞分化过程中TG的积累,主要在脂肪组织中表达[37]。A-FABP可与磷酸化的HSL相互作用,通过使细胞中游离脂肪酸释放从而激活负反馈机制或影响脂滴表面复合物的形成抑制脂质水解作用,A-FABP的减少则加强了脂质水解作用[38]。有报道指出,A-FABP基因可能通过PPARγ途径影响鸡的脂质代谢,过表达可加强脂质沉积并使上皮型脂肪酸结合蛋白(E-FABP)基因表达水平急剧下降,说明A-FABP与E-FABP基因之间存在补偿性机制,但其中机理尚未明确[39]。在鸡的研究中,通过实时荧光定量PCR技术发现,A-FABP的mRNA表达水平与IMF含量存在显著正相关[40],心型脂肪酸结合蛋白(H-FABP)的mRNA表达水平与IMF含量呈显著负相关[41]。此外,FABP基因的多态性可能是动物肉脂性状分子改良的不错方向,相关报道认为肝脏型脂肪酸结合蛋白(L-FABP)的基因多态性与鸡腹部脂肪含量及占比有关,该基因可作为控制鸡腹脂性状的候选基因或与控制该性状的主基因连锁[42]。
3.2.1.4 PLIN1PLIN1和PPARγ基因分别是脂肪分解的主效基因和脂肪代谢协同因子,PLIN1基因属于PPARγ信号通路,PPARγ位于PLIN1的上游,对PLIN1基因的表达具有调控作用。PLIN1是定位于脂滴表面的高度磷酸化蛋白,正常状态下PLIN1可以充当屏障,阻止脂肪细胞中ATGL接近从而抑制脂解作用[43],而在被激活的情况下,例如在儿茶酚胺的刺激下,通过蛋白激酶A(protein kinase A,PKA)磷酸化PLIN1可以间接激活ATGL并促进脂解[44-45]。在脂肪细胞分化中,PPARγ可能与其结合位点PPRE结合形成复合物,通过局部DNA脱甲基作用,增强PLIN1基因的表达[46-47]。脂肪形成过程中,PLIN1可以正调控SREBP-1c,使FAS和ACC基因的表达上调,从而导致TG积累促进脂滴形成[48]。此外,细胞死亡DNA片段45类效应因子(cell death-inducing DNA fragmentation factor 45-like effectors,CIDEs)是一种参与脂滴融合和生长相关的酶,与PLIN共同定位在脂滴上,其表达可增加细胞内TG含量[49]。值得注意的是,有研究表明,通过激活PPARγ信号通路,PLIN1可与CIDE互相协同作用,促进脂滴形成[50-51];较高水平的PLIN1和CIDE表达共同促进了鸡肉中较高水平的脂肪积累[18, 52]。研究也发现,PLIN1基因作为调节多个物种IMF含量的候选基因,其表达水平与IMF含量呈正相关[50, 53]。
综上所述,AMPK是糖脂代谢的重要因子,抑制脂肪合成并促进脂肪的分解;PPARs不同亚型在脂质代谢中作用不同,PPARα和PPARβ/δ促进能量消耗,而PPARγ促进脂质合成与沉积;FABPs是机体中重要的脂肪酸转运蛋白,不同种类在机体表达具有组织特异性;PLIN1则与脂肪细胞脂滴形成和扩大密切相关;其中PPARγ、A-FABP、PLIN1等基因的表达水平都与鸡肉IMF含量呈正相关,L-FABP基因多态性与鸡腹部脂肪含量相关。目前对家禽脂质代谢的研究取得了一些进展,但由于IMF与皮下脂肪细胞外部环境不同,受不同外部条件调控,不同基因分别在其中表达的作用大小差异以及不同的机制尚不明确,有待进一步的研究发现。
4 功能性成分对脂质代谢的影响为了能从饲粮水平调控鸡肉的品质和风味,近年来,家禽肉品质研究者对某些功能性成分对肉鸡脂质代谢和风味的影响做了部分研究。研究发现,饲粮中添加丙酮酸肌酸可减少肉鸡肝脏和血清中TG含量及血清中低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量,并促进肝脏中PPARα和CPT1的mRNA表达,通过促进脂肪酸的β氧化,显著降低了腹脂沉积[54]。饲粮中添加葛藤黄酮提取物可提高肉鸡血清中高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、胰高血糖素和甲状腺素含量,降低血清中TG含量和肝脏中FAS和ACC酶活性,并增加腹脂中HSL活性,从而抑制脂肪合成,促进脂肪分解[55]。胡忠泽等[56]报道,添加350 mg/kg姜黄素可显著降低42日龄淮南王鸡的腹脂率、皮下脂肪和肌间脂肪宽度,分别降低34.48%、23.65%和27.35%。Shen等[57]报道,添加0.1%~0.5%竹叶提取物可显著降低肉鸡腹部脂肪含量,其中伴随着血清中TG和LDL-C含量的下降,通过降低肝脏中HMGCR的mRNA表达水平从而抑制胆固醇合成,改善胆固醇代谢。Jin等[58]报道,饲粮中添加7.5和15.0 mg/kg盐酸吡格列酮可显著降低黄羽鸡血清中TG含量,并随添加量的增加线性提高了鸡肉中IMF和多不饱和脂肪酸含量,鸡肉品质和风味得到改善。Wan等[59]研究表明,饲粮中添加100 mg/kg番茄红素降低了肉鸡腹部脂肪沉积和血脂含量,该作用可能是通过激活AMPK信号通路,从而下调了肝脏FAS和ACC活性使脂肪酸的生物合成受到抑制来实现的。此外,烟酸[60]、叶酸[61]和硫磺酸[62]等功能性成分也被证明对机体脂质代谢具有调控作用。
5 小结在家禽脂肪代谢过程中,AMPK、PPARs、FABPs和PLIN1等调控因子通过调控线粒体生物合成、脂肪酸转运、脂肪细胞增殖分化以及调控脂质合成与分解相关的酶等途径影响IMF和皮下脂肪的相对含量。同时,脂质作为重要的风味前体物质,在热反应中主要通过脂质氧化以及脂质氧化与美拉德反应的互作最后造成鸡肉风味上的差异。在实际应用中,可在饲粮中添加相关功能性物质或富含该成分的植物来调节家禽脂质代谢,但由于鸡脂肪沉积具有组织差异性,其中IMF有助于鸡肉特异性风味产生,皮下脂肪的过量沉积造成饲料资源的浪费且影响鸡肉风味品质。因此,进一步探究相关基因在家禽不同部位调控脂质代谢之间的差异以及某些功能性物质对信号传导途径的影响和热反应中风味物质转化机理,将对改善鸡肉风味具有重要意义。
| [1] |
FRANK D, JOO S T, WARNER R. Consumer acceptability of intramuscular fat[J]. Korean Journal for Food Science of Animal Resources, 2016, 36(6): 699-708. DOI:10.5851/kosfa.2016.36.6.699 |
| [2] |
MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4 |
| [3] |
MOTTRAM D S, EDWARDS R A. The role of triglycerides and phospholipids in the aroma of cooked beef[J]. Journal of the Science of Food and Agriculture, 1983, 34(5): 517-522. DOI:10.1002/jsfa.2740340513 |
| [4] |
PÉREZ-ALVAREZ J A, SENDRA-NADAL E, SÁNCHEZ-ZAPATA E J. Poultry flavor: general aspects and applications[M]//GUERRERO-LEGARRETA I. Handbook of Poultry Science and Technology, Volume 2. Hoboken, NJ: John Wiley & Sons, Inc., 2010.
|
| [5] |
吴琼, 孙艳发, 夏李意, 等. 不同雉鸡肌肉营养成分分析和评价[J]. 动物营养学报, 2020, 32(1): 148-159. WU Q, SUN Y F, XIA L Y, et al. Analysis and evaluation of muscle nutrition components of pheasant of different species[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 148-159 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.020 |
| [6] |
KHAN M I, JO C, TARIQ M R. Meat flavor precursors and factors influencing flavor precursors-A systematic review[J]. Meat Science, 2015, 110: 278-284. DOI:10.1016/j.meatsci.2015.08.002 |
| [7] |
PEGG R B, SHAHIDI F. COOKING OF MEAT|Flavor development[M]//DIKEMAN M, DEVINE C. Encyclopedia of meat sciences. Oxford: Elsevier Ltd., 2014: 377-384.
|
| [8] |
滕迪克, 许洪高, 袁芳, 等. 脂质降解产物在肉类香气形成中的作用[J]. 中国调味品, 2008, 33(6): 71-76, 83. TENG D K, XU H G, YUAN F, et al. The contribution of lipids degradation products to meat aroma[J]. China Condiment, 2008, 33(6): 71-76, 83 (in Chinese). DOI:10.3969/j.issn.1000-9973.2008.06.016 |
| [9] |
VAN BA H, RYU K S, LAN N T K, et al. Influence of particular breed on meat quality parameters, sensory characteristics, and volatile components[J]. Food Science and Biotechnology, 2013, 22(3): 651-658. DOI:10.1007/s10068-013-0127-4 |
| [10] |
尹靖东. 动物肌肉生物学与肉品科学[M]. 北京: 中国农业大学出版社, 2011. YIN J D. Animal muscle biology and meat science[M]. Beijing: China Agricultural University Press, 2011 (in Chinese). |
| [11] |
AASLYNG M D, SCHÄFER A. The effect of free fatty acids on the odour of pork investigated by sensory profiling and GC-O-MS[J]. European Food Research and Technology, 2008, 226(5): 937-948. DOI:10.1007/s00217-007-0647-3 |
| [12] |
ELMORE J S, CAMPO M M, ENSER M, et al. Effect of lipid composition on meat-like model systems containing cysteine, ribose, and polyunsaturated fatty acids[J]. Journal of Agricultural and Food Chemistry, 2002, 50(5): 1126-1132. DOI:10.1021/jf0108718 |
| [13] |
MADRUGA M S, ELMORE J S, ORUNA-CONCHA M J, et al. Determination of some water-soluble aroma precursors in goat meat and their enrolment on flavour profile of goat meat[J]. Food Chemistry, 2010, 123(2): 513-520. DOI:10.1016/j.foodchem.2010.04.004 |
| [14] |
CHMIEL M, ROSZKO M, ADAMCZAK L, et al. Influence of storage and packaging method on chicken breast meat chemical composition and fat oxidation[J]. Poultry Science, 2019, 98(6): 2679-2690. DOI:10.3382/ps/pez029 |
| [15] |
ZHANG M, CHEN X, HAYAT K, et al. Characterization of odor-active compounds of chicken broth and improved flavor by thermal modulation in electrical stewpots[J]. Food Research International, 2018, 109: 72-81. DOI:10.1016/j.foodres.2018.04.036 |
| [16] |
JAYASENA D D, UK AHN D, NAM K C, et al. Flavour chemistry of chicken meat: a review[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(5): 732-742. DOI:10.5713/ajas.2012.12619 |
| [17] |
赵文华, 王桂瑛, 王雪峰, 等. 鸡肉中挥发性风味物质及其影响因素的研究进展[J]. 食品工业科技, 2019, 40(21): 337-343, 351. ZHAO W H, WANG G Y, WANG X F, et al. Research progress of volatile flavor compounds in chicken and their influencing factors[J]. Science and Technology of Food Industry, 2019, 40(21): 337-343 (in Chinese). |
| [18] |
HELLWIG M, HENLE T. Baking, ageing, diabetes: a short history of the Maillard reaction[J]. Angewandte Chemie International Edition, 2014, 53(39): 10316-10329. DOI:10.1002/anie.201308808 |
| [19] |
HILLGARTNER F B, SALATI L M, GOODRIDGE A G. Physiological and molecular mechanisms involved in nutritional regulation of fatty acid synthesis[J]. Physiological Reviews, 1995, 75(1): 47-76. DOI:10.1152/physrev.1995.75.1.47 |
| [20] |
RICOULT S J H, MANNING B D. The multifaceted role of mTORC1 in the control of lipid metabolism[J]. EMBO Reports, 2013, 14(3): 242-251. DOI:10.1038/embor.2013.5 |
| [21] |
HOOD R L, ALLEN C E. Lipogenesis in isolated intramuscular adipose tissue from four bovine muscles[J]. Journal of Animal Science, 1978, 46(6): 1626-1633. DOI:10.2527/jas1978.4661626x |
| [22] |
LI G X, ZHAO Y L, LI Y F, et al. Weighted gene coexpression network analysis identifies specific transcriptional modules and hub genes related to intramuscular fat traits in chicken breast muscle[J]. Journal of Cellular Biochemistry, 2019, 120(8): 13625-13639. DOI:10.1002/jcb.28636 |
| [23] |
WANG Y, HUI X H, WANG H E, et al. Association of H-FABP gene polymorphisms with intramuscular fat content in Three-yellow chickens and Hetian-black chickens[J]. Journal of Animal Science and Biotechnology, 2016, 7: 9. DOI:10.1186/s40104-016-0067-y |
| [24] |
LI Y, XU S Q, MIHAYLOVA M M, et al. AMPK phosphorylates and inhibits SREBp activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metabolism, 2011, 13(4): 376-388. DOI:10.1016/j.cmet.2011.03.009 |
| [25] |
LUO Y H, ZHANG X, ZHU Z P, et al. Surplus dietary isoleucine intake enhanced monounsaturated fatty acid synthesis and fat accumulation in skeletal muscle of finishing pigs[J]. Journal of Animal Science and Biotechnology, 2018, 9: 88. DOI:10.1186/s40104-018-0306-5 |
| [26] |
任静, 朱仲玲, 阎昭. AMPK对脂质代谢调控作用的研究进展[J]. 天津医科大学学报, 2019, 25(5): 540-543. REN J, ZHU Z L, YAN Z. Research progress of AMPK on lipid metabolism regulation[J]. Journal of Tianjin Medical University, 2019, 25(5): 540-543 (in Chinese). |
| [27] |
LI L L, ZHANG H H, YAO Y, et al. (-)-Hydroxycitric acid suppresses lipid droplet accumulation and accelerates energy metabolism via activation of the adiponectin-AMPK signaling pathway in broiler chickens[J]. Journal of Agricultural and Food Chemistry, 2019, 67(11): 3188-3197. DOI:10.1021/acs.jafc.8b07287 |
| [28] |
胡庆美. 脂联素对鸡原代肝细胞、成肌细胞和脂肪细胞脂质代谢的影响及机制[D]. 硕士学位论文. 泰安: 山东农业大学, 2020. HU Q M. Effect and mechanism of adiponectin on lipid metabolism in chicken primary hepatocytes, myoblast cells and adipocytes[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2020. (in Chinese) |
| [29] |
GAN L, YAN J, LIU Z J, et al. Adiponectin prevents reduction of lipid-induced mitochondrial biogenesis via AMPK/ACC2 pathway in chicken adipocyte[J]. Journal of Cellular Biochemistry, 2015, 116(6): 1090-1100. DOI:10.1002/jcb.25064 |
| [30] |
SONG W Z, ZHONG C L, YUAN Y C, et al. Peroxisome proliferator-activated receptor-coactivator 1-beta (PGC-1β) modulates the expression of genes involved in adipogenesis during preadipocyte differentiation in chicken[J]. Gene, 2020, 741: 144516. DOI:10.1016/j.gene.2020.144516 |
| [31] |
XIAO Z, CHU Y F, QIN W S. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating AMPK pathway in non-alcoholic fatty liver disease[J]. Life Sciences, 2020, 256: 117997. DOI:10.1016/j.lfs.2020.117997 |
| [32] |
KIM K Y, PARK K I, GI LEE S, et al. Deoxypodophyllotoxin in Anthriscus sylvestris alleviates fat accumulation in the liver via AMP-activated protein kinase, impeding SREBP-1c signal[J]. Chemico-Biological Interactions, 2018, 294: 151-157. DOI:10.1016/j.cbi.2018.08.025 |
| [33] |
ABDULLA N R, LOH T C, FOO H L, et al. Influence of dietary ratios of n-6:n-3 fatty acid on gene expression, fatty acid profile in liver and breast muscle tissues, serum lipid profile, and immunoglobulin in broiler chickens[J]. Journal of Applied Poultry Research, 2019, 28(2): 454-469. DOI:10.3382/japr/pfz008 |
| [34] |
ROYAN M, MENG G Y, OTHMAN F, et al. Effects of conjugated linoleic acid, fish oil and soybean oil on PPARs (α·γ) mRNA expression in broiler chickens and their relation to body fat deposits[J]. International Journal of Molecular Sciences, 2011, 12(12): 8581-8595. DOI:10.3390/ijms12128581 |
| [35] |
JONES J R, BARRICK C, KIM K A, et al. Deletion of PPARγ in adipose tissues of mice protects against high fat diet-induced obesity and insulin resistance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(17): 6207-6212. DOI:10.1073/pnas.0306743102 |
| [36] |
CHEN X Y, NIU J J, GENG Z Y. Gene expression and plasma lipid content in relation to intramuscular fat in Chinese indigenous Wuhua chicken[J]. Journal of Applied Poultry Research, 2017, 26(3): 391-400. DOI:10.3382/japr/pfx007 |
| [37] |
XIAO Z, CHU Y F, QIN W S. IGFBP5 modulates lipid metabolism and insulin sensitivity through activating AMPK pathway in non-alcoholic fatty liver disease[J]. Life Sciences, 2020, 256: 117997. DOI:10.1016/j.lfs.2020.117997 |
| [38] |
SMITH A J, THOMPSON B R, SANDERS M A, et al. Interaction of the adipocyte fatty acid-binding protein with the hormone-sensitive lipase: regulation by fatty acids and phosphorylation[J]. Journal of Biological Chemistry, 2007, 282(44): 32424-32432. DOI:10.1074/jbc.M703730200 |
| [39] |
SHI H, WANG Q G, WANG Y X, et al. Adipocyte fatty acid-binding protein: an important gene related to lipid metabolism in chicken adipocytes[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 157(4): 357-363. DOI:10.1016/j.cbpb.2010.08.005 |
| [40] |
沙尔山别克·阿不地力大, 舒婷, 吴旭升, 等. 拜城油鸡A-FABP、H-FABP和PPAR-PPAR-γ基因mRNA表达的发育性变化及其与肌内脂肪含量的相关性研究[J]. 中国家禽, 2019, 41(14): 5-11. SHAERSHANBIEKE A, SHU T, WU X S, et al. Developmental changes of mRNA expression of A-FABP, H-FABP and PPAR-PPAR-γ gene and its correlation with intramuscular fat content in Baichen oil chicken[J]. Chinese poultry, 2019, 41(14): 5-11 (in Chinese). |
| [41] |
屠云洁, 苏一军, 王克华, 等. 利用实时荧光定量RT-PCR检测鸡A-FABP和H-FABP基因的差异表达[J]. 中国畜牧杂志, 2010, 46(7): 1-4. TU Y J, SU Y J, WANG K H, et al. Relative expression of A-FABP and H-FABP genes in chicken measured by real-time PCR[J]. Chinese Journal of Animal Science, 2010, 46(7): 1-4 (in Chinese). |
| [42] |
WANG Q, LI H, LI N, et al. Tissue expression and association with fatness traits of liver fatty acid-binding protein gene in chicken[J]. Poultry Science, 2006, 85(11): 1890-1895. DOI:10.1093/ps/85.11.1890 |
| [43] |
BRASAEMLE D L, RUBIN B, HARTEN I A, et al. Perilipin A increases triacylglycerol storage by decreasing the rate of triacylglycerol hydrolysis[J]. Journal of Biological Chemistry, 2000, 275(49): 38486-38493. DOI:10.1074/jbc.M007322200 |
| [44] |
MACPHERSON R, PETERS S. Piecing together the puzzle of perilipin proteins and skeletal muscle lipolysis[J]. Applied Physiology, Nutrition, and Metabolism, 2015, 40(7): 641-651. DOI:10.1139/apnm-2014-0485 |
| [45] |
TANSEY J T, HUML A M, VOGT R, et al. Functional studies on native and mutated forms of perilipins.A role in protein kinase A-mediated lipolysis of triacylglycerols in Chinese hamster ovary cells[J]. Journal of Biological Chemistry, 2003, 278(10): 8401-8406. DOI:10.1074/jbc.M211005200 |
| [46] |
FUJIKI K, SHINODA A, KANO F, et al. PPARγ-induced PARylation promotes local DNA demethylation by production of 5-hydroxymethylcytosine[J]. Nature Communications, 2013, 4: 2262. DOI:10.1038/ncomms3262 |
| [47] |
ARIMURA N, HORIBA T, IMAGAWA M, et al. The peroxisome proliferator-activated receptor γ regulates expression of the perilipin gene in adipocytes[J]. Journal of Biological Chemistry, 2004, 279(11): 10070-10076. DOI:10.1074/jbc.M308522200 |
| [48] |
TAKAHASHI Y, SHINODA A, FURUYA N, et al. Perilipin-mediated lipid droplet formation in adipocytes promotes sterolregulatory element-binding protein-1 processing and triacylglyceride accumulation[J]. PLoS One, 2013, 8(5). |
| [49] |
XU L, ZHOU L K, LI P. CIDE proteins and lipid metabolism[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2012, 32(5): 1094-1098. DOI:10.1161/ATVBAHA.111.241489 |
| [50] |
LI B J, WENG Q N, DONG C, et al. A key gene, PLIN1, can affect porcine intramuscular fat content based on transcriptome analysis[J]. Genes, 2018, 9(4): 194. DOI:10.3390/genes9040194 |
| [51] |
ZHOU L K, XU L, YE J, et al. Cidea promotes hepatic steatosis by sensing dietary fatty acids[J]. Hepatology, 2012, 56(1): 95-107. DOI:10.1002/hep.25611 |
| [52] |
PENG G, HUANG E F, RUAN J M, et al. Effects of a high energy and low protein diet on hepatic and plasma characteristics and Cidea and Cidec mRNA expression in liver and adipose tissue of laying hens with fatty liver hemorrhagic syndrome[J]. Animal Science Journal, 2019, 90(2): 247-254. DOI:10.1111/asj.13140 |
| [53] |
RESNYK C W, CHEN C M, HUANG H Z, et al. RNA-Seq analysis of abdominal fat in genetically fat and lean chickens highlights a divergence in expression of genes controlling adiposity, hemostasis, and lipid metabolism[J]. PLoS One, 2015, 10(10): e0139549. DOI:10.1371/journal.pone.0139549 |
| [54] |
王曼. 丙酮酸肌酸对肉鸡脂肪代谢和蛋白质代谢的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2010. WANG M. Effects of pyruvate creatine on fat metabolism and protein metabolism of broilers[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2010. (in Chinese) |
| [55] |
吕梦云. 葛藤黄酮提取物对肉鸡生产性能和脂肪代谢的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2017. LYU M Y. Effects of flavonoids extracts from Pueraria pueraria on performance and fat metabolism of broilers[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2017. (in Chinese) |
| [56] |
胡忠泽, 闻爱友, 王立克, 等. 姜黄素对淮南王鸡脂肪沉积的影响[J]. 畜牧与饲料科学, 2009, 30(5): 24-25. HU Z Z, WEN A Y, WANG L K, et al. Effect of curcumin on fat deposition of Huainan king chicken[J]. Animal Husbandry and Feed Science, 2009, 30(5): 24-25 (in Chinese). DOI:10.3969/j.issn.1672-5190.2009.05.012 |
| [57] |
SHEN M, XIE Z, JIA M, et al. Effect of bamboo leaf extract on antioxidant status and cholesterol metabolism in broiler chickens[J]. Animals, 2019, 9(9): 699. DOI:10.3390/ani9090699 |
| [58] |
JIN C, ZENG H, XIE W, et al. Dietary supplementation with pioglitazone hydrochloride improves intramuscular fat, fatty acid profile, and antioxidant ability of thigh muscle in yellow-feathered chickens[J]. Journal of the Science of Food and Agriculture, 2020, 100(2): 665-671. DOI:10.1002/jsfa.10062 |
| [59] |
WAN X L, YANG Z F, JI H R, et al. Effects of lycopene on abdominal fat deposition, serum lipids levels and hepatic lipid metabolism related enzymes in broiler chickens[J]. Asian-Australasian Journal of Animal Sciences, 2020. DOI:10.5713/ajas.20.0432 |
| [60] |
JIANG R R, ZHAO G P, ZHAO J P, et al. Influence of dietary nicotinic acid supplementation on lipid metabolism and related gene expression in two distinct broiler breeds of female chickens[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(5): 822-829. DOI:10.1111/jpn.12138 |
| [61] |
LIU Y, LIU X, ZHOU J, et al. Folic acid perfusion administration reduced abdominal fat deposition in starter Arbor Acres broilers[J]. Poultry Science, 2019, 98(12): 6816-6825. DOI:10.3382/ps/pez413 |
| [62] |
HAN H L, ZHANG J F, YAN E F, et al. Effects of taurine on growth performance, antioxidant capacity, and lipid metabolism in broiler chickens[J]. Poultry Science, 2020, 99(11): 5707-5717. DOI:10.1016/j.psj.2020.07.020 |




