2. 重庆市畜牧科学院, 重庆 402460;
3. 农业农村部养猪科学重点实验室, 重庆 402460;
4. 西南科技大学生命科学与工程学院, 绵阳 621010
2. Chongqing Academy of Animal Science, Chongqing 402460, China;
3. Key Laboratory of Pig Industry Sciences, Ministry of Agriculture, Chongqing 402460, China;
4. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China
胃肠道是哺乳动物最大的内分泌器官,肠内分泌细胞(enteroendocrine cells, EECs)约占肠壁细胞的1%。受到消化道内营养物质或小分子化合物的刺激,动物的EECs能分泌产生20多种不同的激素[1]。这些肠道激素通过“肠-脑”信号轴影响大脑中枢的信号指令传递,或者经由循环系统到达肝脏、胰腺、肌肉等不同靶器官,与细胞上相应的受体结合,进而产生不同的生物学效应[2]。胆囊收缩素(cholecystokinin, CCK)、胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)和饥饿素(ghrelin)是3种主要的肠道激素,它们在调节食欲、肠道运动、血糖、能量消耗等方面发挥着重要的作用[3-5]。
人和动物的肠道中寄居了大量微生物(以细菌为主),它们与宿主形成共生关系,参与宿主的健康生长、器官发育、消化代谢和免疫[6]。越来越多的研究证实了“微生物-肠-脑轴”信息传递途径的重要性,三者相互影响,相互作用[7-9]。肠道内的细菌依靠其代谢产物对宿主的生理稳态产生复杂的调控作用,包括调控EECs的发育和肠道激素的产生与释放。无菌鼠EECs数量明显减少,肠道激素水平降低[10]。肠道菌群代谢产生的短链脂肪酸(short-chain fatty acids, SCFAs)能够直接刺激EECs分泌激素和小肽,如GLP-1和酪酪肽(peptide tyrosine tyrosine, PYY)[8-9]。但是,目前关于肠道细菌如何影响和调节宿主肠道激素分泌还缺乏深入的了解。
肠道菌群的定植对于初生动物的快速生长和器官发育十分重要,甚至影响其终生的健康[11-12]。在动物幼龄阶段,肠道菌群更容易受到外界环境的影响[13]。因此,通过益生菌、益生元或者菌群移植等方法进行早期干预,定向调整肠道菌群组成对促进幼畜的生长和代谢具有重要意义。粪菌移植(fecal microbiota transplantation,FMT)通常是将健康供体的粪便微生物群落整体转移到受体体内,快速改变后者的肠道菌群组成[14]。随着外源菌群的植入,受体动物的生理和代谢表型往往也会随之变化,产生与供体动物相似的特征。近年来,一些在猪上开展的研究表明,使用FMT方法引入外源“健康”或者“功能”菌群能够快速、有效地改善受体动物的肠道健康,优化肠道菌群,增强免疫机能,强化代谢功能[15-17]。但是FMT介导的肠道菌群变化是否波及EECs和肠道激素水平还不清楚。
本试验在新生仔猪上进行FMT,引入健康成年猪的肠道菌群,探究FMT介导的外源微生物植入是否会对受体仔猪肠道菌群组成、肠道发育和功能、肠道激素分泌产生影响,并着重分析肠道菌群与肠道激素之间的相关性,以期为深入诠释“微生物-肠-脑”轴的互作关系和推进菌群移植在动物生产中的应用提供理论依据。
1 材料与方法 1.1 试验动物本试验经由重庆市畜牧科学院学术委员会批准,并遵守相关规定执行。动物试验于2019年3—6月在重庆市畜牧科学院武陶试验猪场(重庆,荣昌)开展。
1.2 供体动物及粪菌悬液制备选择5头健康成年公猪(杜洛克×长白×大白,6月龄)作为候选供体,使用无抗饲粮饲喂6周。采集猪的静脉血,试剂盒检测猪霍乱病毒、猪细小病毒、猪圆环病毒2、猪生殖呼吸综合症病毒、伪狂犬病病毒、口蹄疫病毒、猪肺炎支原体等病原体,筛选出1头无特定病原体的猪作为正式供体。
收集供体猪的新鲜粪便,置于厌氧采样袋中,冷藏保存,运至实验室。称取10 g粪便,在厌氧工作站(Baker公司)中按1 ∶ 9(质量体积比)的比例加入无菌磷酸盐缓冲液(phosphate buffer saline,PBS)(0.1 mol/L,pH=7.2),振荡混匀,依次通过2.0、1.0、0.5 mm无菌不锈钢筛子,去除大分子颗粒。浑浊液低速离心后去除上清,沉淀物用无菌PBS溶液重悬,加入25%甘油后制备成粪菌悬液,无菌离心管分装后-80 ℃冷冻保存,使用前37 ℃水浴1 h。
1.3 仔猪饲养与处理选取6窝相同出生日龄的新生“长×荣”二杂仔猪,根据仔猪数量分为2组,每组3窝[每组仔猪数量大于30头,平均体重(1.12±0.33) kg,2组间平均体重无显著差异(P>0.05)]。出生后3~7 d,FMT组仔猪每天经口服灌喂粪菌悬液1 mL(细菌量为5×108 CFU/mL),每天灌喂1次,连续灌喂5 d,当天灌喂之后离心管内残留的菌液涂抹在母猪乳头和皮肤上。对照组仔猪以相同的方式灌喂等量无菌生理盐水。FMT组和对照组猪圈进行隔离,不予接触。28日龄时,每组挑选接近平均体重的6头健康仔猪采集静脉血后屠宰,洁净环境下采集十二指肠、回肠、结肠及内容物样品用于检测。试验期间仔猪均由母猪母乳喂养,其他程序按猪场常规饲养管理方法进行。
1.4 检测指标与方法 1.4.1 生长性能所有仔猪在3、7和28日龄时称重,计算试验期间2组仔猪的平均日增重(average daily gain,ADG)。
平均日增重(g/d)=总增重/试验天数。
1.4.2 肠道形态取十二指肠中段约1 cm,用预冷的生理盐水冲洗后,4%中性甲醛固定,常规脱水,石蜡包埋切片,然后进行苏木精-伊红(hematoxylin-eosin,HE)染色和过碘酸-雪夫染色(periodic acid-Schiff staining,PAS)。光学显微镜下拍照,每张切片选取5个视野进行图像采集和分析,使用图像分析软件Image Pro-Plus 6.0测定十二指肠绒毛高度、隐窝深度、肠壁厚度及杯状细胞数量,计算绒隐比(绒毛高度/隐窝深度)。
1.4.3 基因表达肠道中防御素基因[猪β防御素2(porcine β-defensin 2,pBD2)、猪源抗菌肽1-5(protegrins1-5,pG1-5)、猪附睾蛋白2剪接变异体c(porcine epididymis protein 2 splicing variant c,pEP2c)]和肠道激素受体[胆囊收缩素A受体(cholecystokinin A receptor,CCKAR)、胆囊收缩素B受体(cholecystokinin B receptor,CCKBR)、胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)、生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)]的mRNA相对表达量采用实时荧光定量PCR(qRT-PCR)法进行检测。取回肠中段1 cm,经生理盐水冲洗后液氮速冻保存。冻存样品在液氮中研磨,使用Trizol试剂盒(Sigma公司)提取组织中的总RNA,反转录为cDNA,使用qRT-PCR扩增试剂盒(TaKaRa公司)进行PCR。qRT-PCR使用Q6荧光定量PCR仪(Thermo Fisher公司)完成,采用2-△△Ct法计算目标基因的mRNA相对表达量,β-肌动蛋白(β-actin)作为内参基因。PCR引物设计参照NCBI网站GenBank中相关基因的序列,由上海生工生物工程股份有限公司设计、合成。引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
仔猪前腔静脉采血10 mL,室温静置30 min后离心10 min(3 000 r/min)分离血清。仔猪血清中GLP-1、CCK、ghrelin水平使用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法进行检测,猪GLP-1、CCK、ghrelin的ELISA微量检测试剂盒采购自上海酶联生物科技有限公司(试剂盒货号分别为ml000098、ml002410、ml026765),具体操作步骤按照试剂盒的说明书进行。
仔猪肠道组织中GLP-1、CCK、ghrelin的表达水平采用免疫组织化学法进行测定。GLP-1、CCK、ghrelin兔多克隆抗体浓度参照试剂盒(均购自Bioss公司,抗体货号分别为bs-0933R、bs-0764R、bs-0467R)的说明书。回肠和结肠组织的石蜡切片经脱蜡复水后,用PBS浸泡5 min,经抗原修复、阻断剂阻断、封闭液封闭后,滴加一抗孵育,阴性对照不加入目标抗体,用PBS代替一抗。滴加二氨基联苯胺(DAB)显色液。光镜下观察显色,适时终止反应。自来水冲洗10 min后按HE染色步骤进行复染,封片镜检。
1.4.5 肠道菌群组成仔猪屠宰后,在洁净环境下快速收集回肠和结肠内容物,液氮保存,用于DNA的提取。采用16S rDNA扩增子测序(16S V3~V4区)分析肠道内容物中的菌群多样性和组成,微生物测序由上海美吉生物医药科技有限公司完成。将测序得到的优化序列进行操作分类单元(operational taxonomic unit, OTU)聚类分析(97%相似性)和物种分类学分析,采用QIIME 1.7.0默认参数计算各样品的alpha多样性指数(ACE、Chao1、Shannon指数)和物种分布。使用R 2.15.3软件对样品之间的菌群结构相似度进行主成分分析(principal component analysis,PCA)。
1.4.6 相关性分析分别将回肠和结肠中丰度前30位的菌属与肠道中CCK、GLP-1、ghrelin的表达水平进行Spearman相关性分析,P < 0.05时表示相关性达到显著水平,P < 0.01时表示相关性达到极显著水平。
1.5 数据统计与分析试验数据采用SPSS 22.0软件进行Student’s t检验分析,数据以平均值±标准误表示。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 FMT对仔猪生长性能和肠道发育的影响由图 1可知,FMT改变了受体仔猪的生长性能和肠道发育。2组仔猪出生体重无显著差异(P>0.05),但在28日龄时,FMT组仔猪的平均日增重比对照组仔猪提高了约36.1%(P < 0.01)。与对照组仔猪相比,FMT仔猪十二指肠的绒毛高度和绒隐比极显著降低(P < 0.01),而隐窝深度极显著增加(P < 0.01),肌层厚度略有增加(P>0.05),提示FMT促进了仔猪肠道发育。此外,值得注意的是,FMT仔猪肠道中的杯状细胞数量较对照组显著减少(P < 0.05),pBD2的相对表达量也较对照组极显著降低(P < 0.01)。
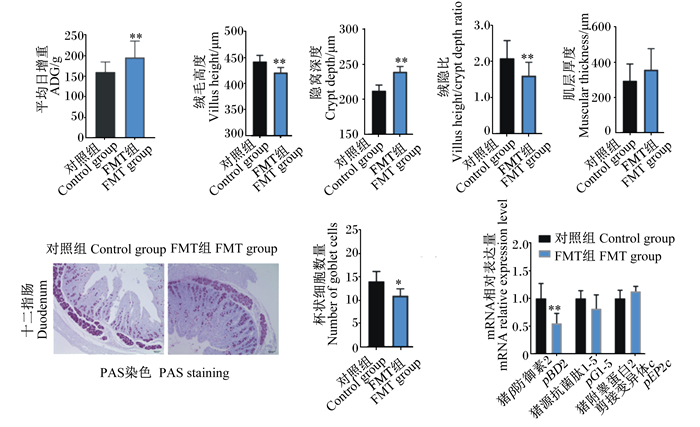
|
*表示与对照组相比差异显著(P < 0.05),**表示与对照组相比差异极显著(P < 0.01)。图 2、图 3和图 4同。 * mean significant difference compared with control group (P < 0.05), and ** mean extremely significant difference compared with control group (P < 0.01). The same as Fig. 2, Fig. 3 and Fig. 4. 图 1 FMT对仔猪生长性能和肠道发育的影响 Fig. 1 Effects of FMT on growth performance and intestine development of piglets (n=6) |
肠道分泌产生的激素经血液循环系统到达大脑、肝脏等其他组织器官发挥重要生理调节作用。ELISA检测结果显示,FMT组仔猪血清中CCK、GLP-1和ghrelin的水平不同程度地高于对照组仔猪(图 2),其中ghrelin和GLP-1的水平达到显著水平(P < 0.05)。
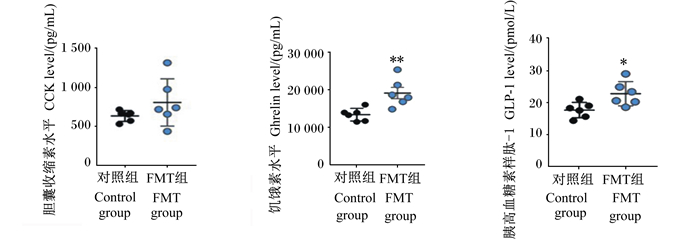
|
图 2 FTM对仔猪血清中3种肠道激素水平的影响 Fig. 2 Effects of FMT on three intestinal hormone levels in serum of piglets (n=6) |
与血清中CCK、GLP-1和ghrelin的水平整体升高不同的是,仔猪肠道组织中CCK、GLP-1和ghrelin的表达水平变化趋势并不完全一致。总体而言,仔猪回肠中CCK的表达水平明显高于结肠段,而ghrelin和GLP-1的表达水平则相反(图 3-A)。由图 3-B、图 3-C可知,与对照组仔猪相比,FMT组仔猪回肠中CCK的表达水平及其受体CCKAR和CCKBR的mRNA相对表达量均显著或极显著增加(P < 0.05或P < 0.01);FMT组仔猪回肠中ghrelin的表达水平同样显著增加(P < 0.05),但其受体GHSR的mRNA相对表达量无显著变化(P>0.05);此外,FMT组仔猪回肠中GLP-1的表达水平无显著变化(P>0.05),但其受体GLP-1R的mRNA相对表达量显著下调(P < 0.05)。与对照组仔猪相比,FMT组仔猪结肠中GLP-1的表达水平极显著增加(P < 0.01),其受体GLP-1R的mRNA相对表达量有升高趋势但差异不显著(P>0.05);FMT组仔猪结肠中ghrelin的表达水平及其受体GHSR的mRNA相对表达量显著减少(P < 0.05);FMT组仔猪结肠中CCK的表达水平及其受体CCKBR的mRNA相对表达量有升高趋势但差异不显著(P>0.05),而CCKAR的mRNA相对表达量则显著增加(P < 0.05)。这些结果表明,FMT促进了仔猪肠道激素的分泌和信号传递,但是不同肠道激素在不同肠段之间的表达水平存在明显区别。
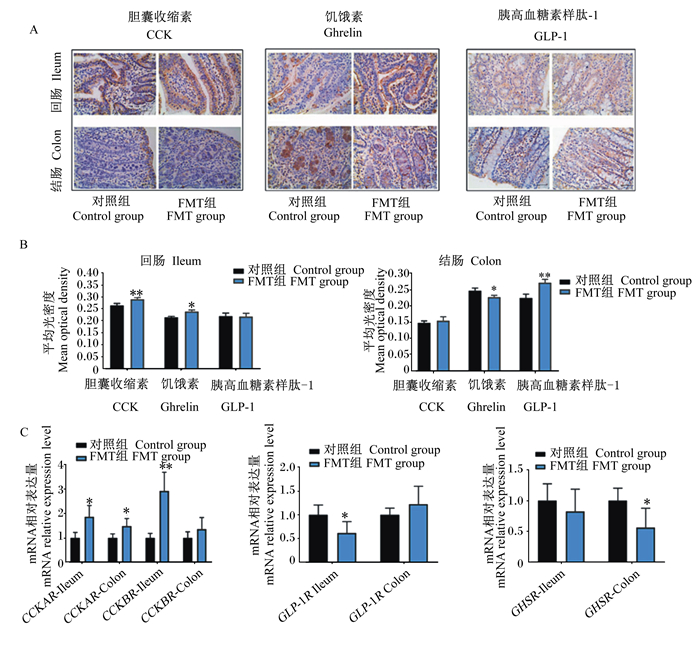
|
A:仔猪回肠和结肠中3种肠道激素的免疫组织化学染色结果;B:仔猪回肠和结肠中3种肠道激素的表达水平;C:仔猪回肠和结肠中肠道激素受体的mRNA相对表达量。Ileum:回肠;Colon:结肠;CCKAR:胆囊收缩素A受体cholecystokinin A receptor;CCKBR:胆囊收缩素B受体cholecystokinin B receptor;GLP-1R:胰高血糖素样肽-1受体glucagon-like peptide-1 receptor;GHSR:生长激素促分泌素受体growth hormone secretagogue receptor。 A: the results of three intestinal hormones in ileum and colon of piglets by immunohistochemical staining; B: the expression levels of three intestinal hormones in ileum and colon of piglets; C: the mRNA relative expression levels of intestinal hormone receptors in ileum and colon of piglets. 图 3 FTM对仔猪回肠和结肠中3种肠道激素及其受体表达的影响 Fig. 3 Effects of FMT on expression of three intestinal hormones and their receptors in ileum and colon of piglets (n=6) |
图 4显示了仔猪肠道菌群的alpha多样性和beta多样性。与对照组仔猪相比,FMT组仔猪回肠中菌群的ACE、Chao1、Shannon指数有一定程度提高,但差异没有达到显著水平(图 4-A,P>0.05);FMT组仔猪结肠中菌群的Chao1和Shannon指数显著高于对照组仔猪(图 4-B,P < 0.05),说明FMT介导的外源菌群移植提高了受体仔猪结肠菌群的alpha多样性。PCA结果反映了2组仔猪在肠道菌群组成结构上的区别,并且显示它们回肠中的菌群组成差异更大(图 4-C、图 4-D)。
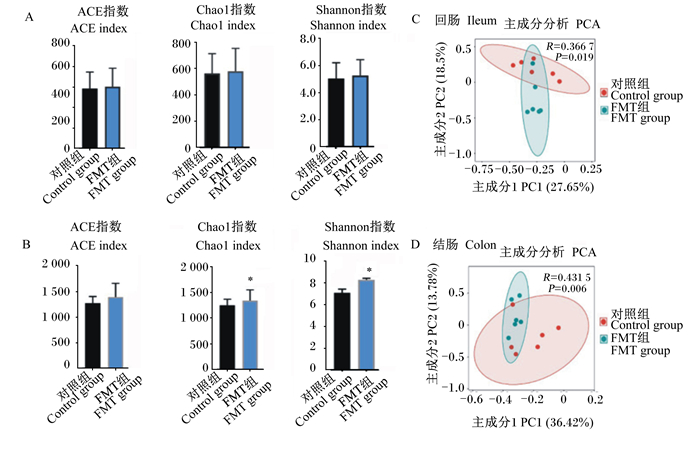
|
A:回肠菌群的alpha多样性指数;B:结肠菌群的alpha多样性指数;C:回肠菌群结构的主成分分析;D:结肠菌群的主成分分析。 A: the alpha diversity indexes of microbiota in ileum; B: the alpha diversity indexes of microbiota in colon; C: the PCA of microbial structure in ileum; D: PCA of microbial structure in colon. 图 4 FMT对仔猪肠道菌群多样性的影响 Fig. 4 Effects of FMT on intestinal microbiota diversity of piglets (n=6) |
图 5显示了2组仔猪肠道菌群组成在门水平上的差异。对照组仔猪回肠中的优势菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria);结肠中优势菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)。与对照组仔猪相比,FMT组仔猪回肠菌群中变形菌门的相对丰度降低,而厚壁菌门的相对丰度增加;FMT组仔猪结肠菌群中厚壁菌门的相对丰度略有减少,拟杆菌门的相对丰度略有增加,这能够保证仔猪更好地适应早期饲喂的植物性固体饲料。
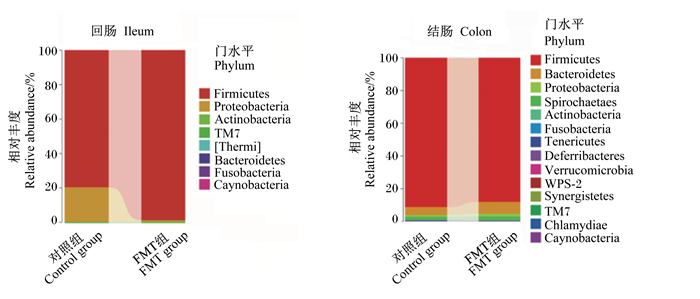
|
Firmicutes: 厚壁菌门; Proteobacteria: 变形菌门; Actinobacteria: 放线菌门; TM7:单糖菌门; [Thermi]: 栖热菌门; Bacteroidetes: 拟杆菌门; Fusobacteria: 梭杆菌门; Caynobacteria: 蓝藻门; Spirochaetaes: 螺旋菌门; Tenericutes: 软壁菌门; Deferribacteres: 脱铁杆菌门; Verrucomicrobia: 疣微菌门; Synergistetes: 互养菌门; Chlamydiae: 衣原体门。 图 5 FMT对仔猪肠道菌群组成的影响(门水平) Fig. 5 Effects of FMT on intestinal microbiota composition of piglets (phylum level) |
图 6显示了2组仔猪肠道菌群组成在属水平上的差异。对照组仔猪回肠中的优势菌属为乳杆菌属(Lactobacillus)、八联球菌属(Sarcina)和放线杆菌属(Actinobacillus);结肠中的优势菌属为乳杆菌属、韦荣球菌科下一属(p-75-a5)以及SMB53。与对照组仔猪相比,FMT组仔猪回肠菌群中乳杆菌属的相对丰度减少,SMB53、八联球菌属和棒状杆菌属(Corynebacterium)的相对丰度增加;FMT组仔猪结肠菌群中乳杆菌属的相对丰度略有增加。桑基图更直观地展示了2组仔猪回肠和结肠菌群组成结构的差异(图 7)。
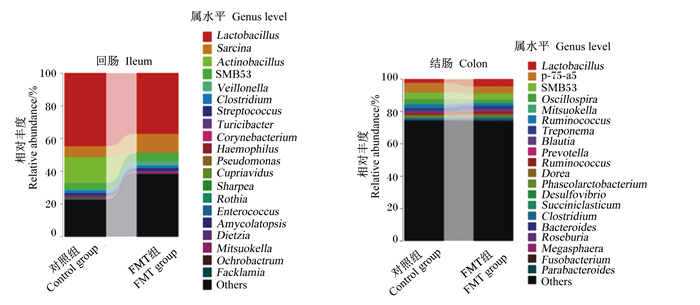
|
Lactobacillus: 乳杆菌属; Sarcina: 八联球菌属; Actinobacillus: 放线杆菌属; eillonella: 韦永氏球菌属; Clostridium: 梭菌属; Streptococcus: 链球菌属; Corynebacterium: 棒状杆菌属; Haemophilus: 嗜血杆菌属; Pseudomonas: 假单胞菌属; Cupriavidus: 贪铜菌属; Sharpea: 夏普氏菌属; Rothia: 罗氏菌属; Enterococcus: 肠球菌属; Amycolatopsis: 拟无枝酸菌属; Dietzia: 迪茨氏菌属; Mitsuokella: 光岗菌属; Ochrobactrum: 苍白杆菌属; Facklamia: 费克蓝姆氏菌属; p-75-a5:韦荣球菌科下一属; Oscillospira: 颤螺菌属; Ruminococcus: 瘤胃球菌属; Dorea: 多尔氏菌属; Phascolarctobacterium: 考拉杆菌属; Desulfovibrio: 脱硫弧菌属; Succiniclasticum: 解琥珀酸菌属; Bacteroides: 拟杆菌属; Roseburia: 罗氏菌属; Megasphaera: 巨球型菌属; Parabacteroides: 副杆菌属; Others: 其他未知菌属。 图 6 FMT对仔猪肠道菌群组成的影响(属水平) Fig. 6 Effects of FMT on intestinal microbiota composition of piglets (genus level) |
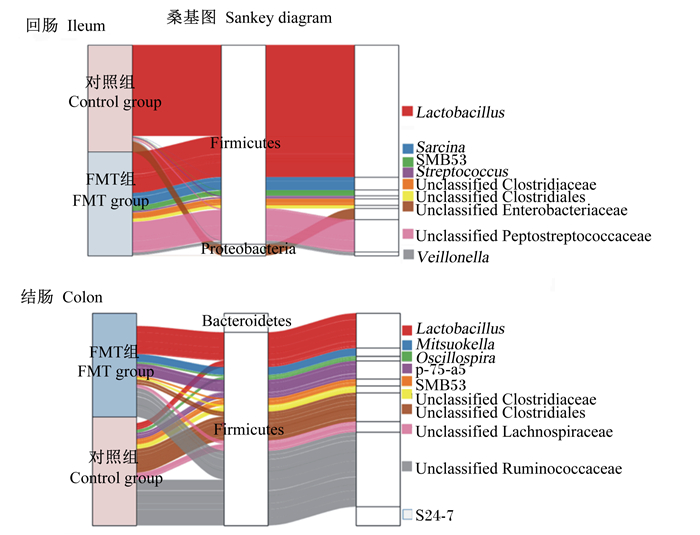
|
Firmicutes: 厚壁菌门; Proteobacteria: 变形菌门; Bacteroidetes: 拟杆菌门; Lactobacillus: 乳杆菌属; Sarcina: 八联球菌属; Streptococcus: 链球菌属; Mitsuokella: 光岗菌属; p-75-a5:韦荣球菌科下一属; Oscillospira: 颤螺菌属; Ruminococcus: 瘤胃球菌属; Veillonella: 韦永氏球菌属; Unclassified Clostridiaceae: 未分类的梭菌科; Unclassified Clostridiales: 未分类的梭菌目; Unclassified Enterobacteriaceae: 未分类的肠杆菌科; Unclassified Peptostreptococcaceae: 未分类的消化链球菌科; Unclassified Lachnospiraceae: 未分类的毛螺菌科; Unclassified Ruminococcaceae: 未分类的瘤胃球菌科。 图 7 肠道菌群组成桑基图 Fig. 7 Sankey diagram of intestinal microbiota composition |
将回肠和结肠中相对丰度较高的菌属(前30位)与肠道激素表达水平进行Spearman相关性分析,结果表明回肠中韦永氏球菌属(Veillonella)、嗜血杆菌属(Haemophilus)的相对丰度与GLP-1的表达水平呈显著负相关(图 8-A,P < 0.05);结肠中颤螺菌属(Oscillospira)的相对丰度与GLP-1的表达水平呈极显著正相关(图 8-B,P < 0.01),瘤胃球菌属(Ruminococcus)、拟杆菌属(Bacteroides)的相对丰度与CCK的表达水平呈显著负相关(P < 0.05),密螺旋体(Treponema)的相对丰度与CCK的表达水平呈显著正相关(P < 0.05)。

|
A:回肠中主要菌群相对丰度与肠道激素表达水平的相关性;B:结肠中主要菌群相对丰度与肠道激素表达水平的相关性。*表示相关性显著(P < 0.05),**表示相关性极显著(P < 0.01)。 Clostridia: 梭菌属; Lactobacillus: 乳杆菌属; Unclassified Streptococcaceae: 未分类的链球菌科; Cupriavidus: 贪铜菌属; Pseudomonas: 假单胞菌属; Agrobacterium: 土壤杆菌属; Unclassified Micrococcaceae: 未分类的微球菌科; Corynebacterium: 棒状杆菌属; Facklamia: 费克蓝姆氏菌属; Dietzia: 迪茨氏菌属; Mogibacteriaceae: 莫吉杆菌科; Unclassified Peptostreptococcaceae: 未分类的消化链球菌科; Unclassified Clostridiales: 未分类的梭菌目; Veillonella: 韦永氏球菌属; Unclassified Clostridiaceae: 未分类的梭菌科; Prevotella: 普氏菌属; Unclassified Bacteroidales: 未分类的拟杆菌目; Treponema: 密螺旋体属; Mitsuokella: 光岗菌属; Unclassified Coriobacteriaceae: 未分类的红蝽菌科; Unclassified S24-7:未知的S24-7菌科; Lactobacillus: 乳酸菌; Desulfovibrio: 脱硫弧菌属; Dorea: 多尔氏菌属; Ruminococcus: 瘤胃球菌属; Unclassified Enterobacteriaceae: 未分类的肠杆菌科; Phascolarctobacterium: 考拉杆菌属; Unclassified Lachnospiraceae: 未分类的毛螺菌科; p-75-a5:韦荣球菌科下一属; Fusobacterium: 梭杆菌属; Roseburia: 罗氏菌属; Succiniclasticum: 解琥珀酸菌属; Unclassified Ruminococcaceae: 未分类的瘤胃球菌科; Blautia: 布劳特氏菌属; Oscillospira: 颤螺菌属; Bacteroides: 拟杆菌属; Unclassified Christensenellaceae未分类的克里斯滕森菌科。 A: the correlation between the relative abundances of top intestinal microbiota and the expression levels of intestinal hormones in ileum; B: the correlation between the relative abundances of top intestinal microbiota and the expression levels of intestinal hormones in colon. * mean significant correlation (P < 0.05), and ** mean extremely significant correlation (P < 0.05). 图 8 肠道菌群与肠道激素的相关性 Fig. 8 Correlation between intestinal microbiota and intestinal hormones (n=6) |
早期干预和调控肠道菌群的定植能够改变仔猪的生长性状和健康水平。近年来,不同的试验表明在生长早期进行FMT能够促进仔猪的生长和肠道发育,优化肠道菌群,提高免疫力[18-20]。Cheng等[18]研究表明,将成年母猪粪便菌群移植给哺乳仔猪能够提高仔猪的生长性能,但降低了肠道的通透性。Diao等[19]报道,将藏猪粪便菌群移植到仔猪体内可以提高仔猪肠道中消化吸收酶的活性。Hu等[20]报道,将成年健康猪粪便菌群移植到仔猪体内可使仔猪体重明显增加。本试验也得到了相似的研究结果,FMT组仔猪的平均日增重较对照组仔猪显著增加,这说明将健康成年猪的“成熟”肠道菌群植入仔猪体内,能够加速或者推动仔猪的生长发育。
GLP-1等肠道激素能够到达并影响大脑和其他组织器官,具有控制食欲、调节血糖、调节能量稳态、维持肠道健康等诸多重要的生理功能[3]。目前关于肠道微生物对肠道激素影响的报道还较为匮乏。刘璐[21]的研究表明,通过对小鼠注射和灌胃乳源性复合益生菌乳,能够提高小鼠血清中GLP-1的水平并上调肠道内GLP-1R的mRNA相对表达量,提示GLP-1的分泌可能受到肠道菌群的影响。通过其他以啮齿类动物为模型的研究显示,ghrelin和CCK的分泌可能也与肠道菌群密切相关[22-23]。本研究首次揭示了FMT介导的肠道菌群的变化导致仔猪主要肠道激素(CCK、GLP-1和ghrelin)水平的波动,FMT整体提高了仔猪血清中肠道激素的水平,而在回肠和结肠中,这3种激素表现出不同的变化特征,这可能与FMT介导的不同肠道菌群的变化直接相关。
GLP-1和CCK由人和动物的十二指肠和空肠的L型EECs分泌,通过血液循环影响着中枢神经系统[24-25]。ghrelin由胃底的X/A细胞分泌,可刺激进食[5]。在动物生理代谢的调节中,不同激素存在协同或拮抗关系。Blanco等[26]以金鱼为研究模型,发现ghrelin抑制了CCK和GLP-1在肠道中的表达水平。在本试验中,FMT组仔猪血清中肠道激素的水平整体都呈现增加的趋势,反映了受体仔猪的生长更快速、代谢更旺盛。在仔猪肠道的不同部位,这3种激素的表达水平及其受体基因的mRNA相对表达量呈现了不完全相同的变化,CCK和GLP-1的表达模式更为接近,而ghrelin的表达模式与之相反,提示肠道中ghrelin的表达可能与CCK和GLP-1的表达存在一定程度的负相关,这与三者之间的生理调控功能也是较为一致的[6]。
一些研究认为肠道菌群影响和调控宿主EECs发育和肠道激素分泌主要是依靠细菌产生的功能性代谢物如SCFAs。SCFAs可以通过G蛋白偶联受体(G-protein-coupled receptors, GPR)锚定并作用于EECs。GPR43缺失小鼠体内GLP-1等肠道激素水平明显降低[27]。给动物补充一定的低聚果糖可以增加肠道微生物的种类和数量并提高血液中肠道激素的水平。此外,一些氨基酸的细菌代谢物如5-羟色胺(5-hydroxytryptamine,5-HT)也被认为能够刺激EECs的分泌功能[28]。在之前的一些试验报道中,早期FMT不但改变了肠道菌群组成,也显著增加了仔猪肠道内SCFAs、5-HT等代谢物的水平[15, 18]。
与之前的研究结果[29]相似,本试验中仔猪肠道内的菌群也是以厚壁菌门、变形菌门和拟杆菌门为主。乳酸菌属是哺乳仔猪肠道内的主要优势菌属[30]。FMT介导的外源微生物的植入明显增加了受体仔猪结肠菌群的多样性,但是对受体仔猪回肠菌群结构的影响更大,包含了很多条件性致病菌的变形菌门相对丰度的减少可能对仔猪的肠道健康更为有利,而厚壁菌门和拟杆菌门的比例变化能够让仔猪更好地适应固体饲料和植物性纤维[31-32]。更为重要的是,本试验通过相关性分析发现了仔猪肠道中几个主要菌属可能与3种肠道激素的分泌存在密切的联系,也提示了通过干预肠道菌群的变化能够影响肠道激素的分泌和传递。这些研究结果加深了我们对“微生物-肠-脑轴”对话机制的理解。
4 结论在生长早期通过FMT方法引入健康成年猪的肠道菌群能够加速受体仔猪的生长和肠道发育,改变肠道菌群结构,增加肠道菌群多样性。另外,FMT提高了仔猪血清中CCK、GLP-1和ghrelin等肠道激素的水平,可满足仔猪快速生长和旺盛代谢的需要。此外,这些肠道激素在肠道中的表达水平也因FMT引起的肠道菌群变化而发生波动。
| [1] |
BEUMER J, PUSCHHOF J, BAUZÁ-MARTINEZ J, et al. High-resolution mRNA and secretome atlas of human enteroendocrine cells[J]. Cell, 2020, 181(6): 1291-1306. DOI:10.1016/j.cell.2020.04.036 |
| [2] |
朱翠, 杨俊, 蒋宗勇, 等. 仔猪胃肠道内分泌细胞分布与化学感应作用[J]. 动物营养学报, 2018, 30(11): 4286-4294. ZHU C, YANG J, JIANG Z, et al. Distribution and chemosensing role of enteroendocrine cells in piglets[J]. Chinese Journal of Animal Nutrition, 2018, 30(11): 4286-4294 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.11.002 |
| [3] |
孙晓宇, 郭汝涛, 张洪涛, 等. 胃肠激素与肥胖关系的研究进展[J]. 现代生物医学进展, 2015, 15(14): 2786-2789. SUN X Y, GUO R T, ZHANG H T, et al. Research on correlations of gastrointestinal hormones and calorigenic nutrients for obesity[J]. Progress in Modern Biomedicine, 2015, 15(14): 2786-2789 (in Chinese). |
| [4] |
杜莉, 卢顺娇, 王英超, 等. 胰高血糖素样肽-1生物学功能的研究进展[J]. 生物化工, 2017, 3(6): 97-98, 104. DU L, LU S J, WANG Y C, et al. Research progress of glucagon like peptide-1 and its biological functions[J]. Biochemical Engineering, 2017, 3(6): 97-98, 104 (in Chinese). |
| [5] |
孙睿, 杨文艳. 胃饥饿素分泌调控机制的研究进展[J]. 动物营养学报, 2021, 33(1): 132-140. SUN R, YANG W Y. Advances on regulation mechanism of ghrelin secretion[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 132-140 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.015 |
| [6] |
SHEN J, OBIN M S, ZHAO L P. The gut microbiota, obesity and insulin resistance[J]. Molecular Aspects of Medicine, 2013, 34(1): 39-58. DOI:10.1016/j.mam.2012.11.001 |
| [7] |
王后福, 李鹏飞, 矣国, 等. 微生物营养物质代谢与微生物-肠-脑轴互作研究进展[J]. 动物营养学报, 2020, 32(1): 28-35. WANG H F, LI P F, YI G, et al. Progress in microbial nutrient metabolism and microbiota-gut-brain axis interaction[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 28-35 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.005 |
| [8] |
SAMPSON T R, MAZMANIAN S K. Control of brain development, function, and behavior by the microbiome[J]. Cell Host & Microbe, 2015, 17(5): 565-576. |
| [9] |
张亚南, 余凯凡, 朱伟云. 肠道微生物调控宿主食欲的研究进展[J]. 微生物学报, 2017, 57(7): 951-960. ZHANG Y N, YU K F, ZHU W Y. Role of gut microbiota in host appetite control[J]. Acta Microbiologica Sinica, 2017, 57(7): 951-960 (in Chinese). |
| [10] |
URIBE A, ALAM M, JOHANSSON O, et al. Microflora modulates endocrine cells in the gastrointestinal mucosa of the rat[J]. Gastroenterology, 1994, 107(5): 1259-1269. DOI:10.1016/0016-5085(94)90526-6 |
| [11] |
GENSOLLEN T, IYER S S, KASPER D L, et al. How colonization by microbiota in early life shapes the immune system[J]. Science, 2016, 352(6285): 539-544. DOI:10.1126/science.aad9378 |
| [12] |
NGUYEN Q N, HIMES J E, MARTINEZ D R, et al. The impact of the gut microbiota on humoral immunity to pathogens and vaccination in early infancy[J]. PLoS Pathogens, 2016, 12(12): e1005997. DOI:10.1371/journal.ppat.1005997 |
| [13] |
KORPELA K, DE VOS W M. Early life colonization of the human gut: microbes matter everywhere[J]. Current Opinion in Microbiology, 2018, 44: 70-78. DOI:10.1016/j.mib.2018.06.003 |
| [14] |
HO J T, CHAN G C, LI J C. Systemic effects of gut microbiota and its relationship with disease and modulation[J]. BMC Immunology, 2015, 16: 21. DOI:10.1186/s12865-015-0083-2 |
| [15] |
GENG S J, CHENG S S, LI Y, et al. Faecal microbiota transplantation reduces susceptibility to epithelial injury and modulates tryptophan metabolism of the microbial community in a piglet model[J]. Journal of Crohn's and Colitis, 2018, 12(11): 1359-1374. |
| [16] |
BRUNSE A, MARTIN L, RASMUSSEN T S, et al. Effect of fecal microbiota transplantation route of administration on gut colonization and host response in preterm pigs[J]. The ISME Journal, 2019, 13(3): 720-733. DOI:10.1038/s41396-018-0301-z |
| [17] |
NIEDERWERDER M C, CONSTANCE L A, ROWLAND R R R, et al. Fecal microbiota transplantation is associated with reduced morbidity and mortality in porcine circovirus associated disease[J]. Frontiers in Microbiology, 2018, 9: 1631. DOI:10.3389/fmicb.2018.01631 |
| [18] |
CHENG C S, WEI H K, WANG P, et al. Early intervention with faecal microbiota transplantation: an effective means to improve growth performance and the intestinal development of suckling piglets[J]. Animal, 2019, 13(3): 533-541. DOI:10.1017/S1751731118001611 |
| [19] |
DIAO H, YAN H L, XIAO Y, et al. Modulation of intestine development by fecal microbiota transplantation in suckling pigs[J]. RSC Advances, 2018, 8(16): 8709-8720. DOI:10.1039/C7RA11234C |
| [20] |
HU L S, GENG S J, LI Y, et al. Exogenous fecal microbiota transplantation from local adult pigs to crossbred newborn piglets[J]. Frontiers in Microbiology, 2018, 8: 2663. DOI:10.3389/fmicb.2017.02663 |
| [21] |
刘璐. 乳源性复合益生菌乳对db/db小鼠抗糖尿病作用及GLP-1的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆医科大学, 2018. LIU L. Effects of milk-borne composit probiotic on glucagon-like peptide-1 in db/db diabetic mice[D]. Master's Thesis. Urumchi: Xinjiang Medical University, 2018. (in Chinese) |
| [22] |
DUCA F A, SWARTZ T D, SAKAR Y, et al. Increased oral detection, but decreased intestinal signaling for fats in mice lacking gut microbiota[J]. PLoS One, 2012, 7(6): e39748. DOI:10.1371/journal.pone.0039748 |
| [23] |
PERRY R J, PENG L, BARRY N A, et al. Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome[J]. Nature, 2016, 534(7606): 213-217. DOI:10.1038/nature18309 |
| [24] |
WYNNE K, STANLEY S, MCGOWAN B, et al. Appetite control[J]. Journal of Endocrinology, 2005, 184(2): 291-318. DOI:10.1677/joe.1.05866 |
| [25] |
AHMED M, AHMED S. Functional, diagnostic and therapeutic aspects of gastrointestinal hormones[J]. Gastroenterology Research, 2019, 12(5): 233-244. DOI:10.14740/gr1219 |
| [26] |
BLANCO A M, BERTUCCI J I, VALENCIANO A I, et al. Ghrelin suppresses cholecystokinin (CCK), peptide YY (PYY) and glucagon-like peptide-1(GLP-1) in the intestine, and attenuates the anorectic effects of CCK, PYY and GLP-1 in goldfish (Carassius auratus)[J]. Hormones and Behavior, 2017, 93: 62-71. DOI:10.1016/j.yhbeh.2017.05.004 |
| [27] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [28] |
ZELKAS L, RAGHUPATHI R, LUMSDEN A L, et al. Serotonin-secreting enteroendocrine cells respond via diverse mechanisms to acute and chronic changes in glucose availability[J]. Nutrition & Metabolism, 2015, 12: 55. |
| [29] |
张贺, 徐荣莹, 苏勇, 等. 单胃动物肠道微生物研究进展[J]. 动物营养学报, 2020, 32(10): 4674-4685. ZHANG H, XU R Y, SU Y, et al. A review: gut microbiota in monogastric animals[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4674-4685 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.019 |
| [30] |
JIANG T T, SHAO T Y, ANG W X G, et al. Commensal fungi recapitulate the protective benefits of intestinal bacteria[J]. Cell Host & Microbe, 2017, 22(6): 809-816. |
| [31] |
KAOUTARI A E, ARMOUGOM F, GORDON J I, et al. The abundance and variety of carbohydrate-active enzymes in the human gut microbiota[J]. Nature Reviews Microbiology, 2013, 11(7): 497-504. DOI:10.1038/nrmicro3050 |
| [32] |
GOPHNA U, KONIKOFF T, NIELSEN H B. Oscillospira and related bacteria-from metagenomic species to metabolic features[J]. Environmental Microbiology Reports, 2017, 19(3): 835-841. DOI:10.1111/1462-2920.13658 |




