2. 中国科学院大学, 北京 100049;
3. 湖南农业大学动物科学技术学院, 长沙 410128
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China
氧化应激在畜牧生产中极其常见。仔猪出生过程和断奶、病毒细菌、饲料抗营养物质和霉变以及饲养密度过高等,都会在一定程度上引起机体氧化应激。氧化应激一般分为急性氧化应激和慢性氧化应激,其中慢性氧化应激刺激强度弱、刺激时间长、频率高,更加常见和多发[1-2]。D-半乳糖主要来源于动物乳汁中的乳糖,可引起慢性氧化应激和轻度炎症。例如,D-半乳糖易与体内、体外蛋白质和肽中的游离氨基酸反应,形成高级糖基化终产物[3],从而提高活性氧的产生量,降低线粒体呼吸复合的产生,最终导致慢性氧化应激损伤[4-5]。研究表明,D-半乳糖在小鼠中引起认知障碍、神经毒性、肝脏疾病以及慢性肾脏损伤[6-7]。鸟氨酸-α-酮戊二酸(ornithine-α-ketoglutarate,OKG)是一种营养盐,由2分子的鸟氨酸(ornithine,Orn)和1分子的α-酮戊二酸(alpha-ketoglutarate,AKG)组成,由于其具有治疗和合成代谢特性[8-9],已经使用了多个世纪,主要作用包括增加骨矿物质密度[10]、治愈烧伤和创伤[11]和抗骨骼应激[12]。OKG还是体内脯氨酸、精氨酸和谷氨酰胺前体[13]。研究表明,相较于鸟氨酸和α-酮戊二酸的单独添加,添加OKG能更有效地诱导胰岛素和生长激素分泌[14],并且还能提高能量代谢中丙酮酸的利用[15]。本课题组前期研究结果表明,饲粮中添加D-半乳糖显著抑制仔猪生长,增加血清丙二醛含量,降低血清超氧化物歧化酶活性,造成仔猪慢性氧化应激,添加的0.5%OKG可显著提高仔猪末重、平均日采食量与血清谷氨酸、脯氨酸、天冬氨酸、苏氨酸和支链氨基酸含量,改变肠道微生物区系,缓解D-半乳糖所造成的慢性氧化应激[16]。因此,本试验通过在断奶仔猪饲粮中添加D-半乳糖建立慢性氧化应激模型,在本课题组前期研究的基础上,进一步研究OKG对由D-半乳糖导致的慢性氧化应激仔猪生长性能、脏器指数、肠道形态以及血清生化指标的影响,旨在完善OKG缓解D-半乳糖刺激断奶仔猪产生慢性氧化应激的理论依据。
1 材料与方法 1.1 试验设计试验选取28日龄的健康“长×大”二元杂交断奶阉公猪40头,平均体重为(7.68±0.56) kg,按体重相近原则随机分为5组,分别为对照组(基础饲粮)、模型组(基础饲粮+5 g/kg BW D-半乳糖)、SOKG组(基础饲粮+5 g/kg BW D-半乳糖+0.5%OKG)、MOKG组(基础饲粮+5 g/kg BW D-半乳糖+1.0%OKG)和LOKG组(基础饲粮+5 g/kg BW D-半乳糖+2.0%OKG),每组8个重复,每个重复1头猪。试验期为28 d,试验结束后测定仔猪生长性能、脏器指数、肠道形态以及血清生化指标。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
饲养试验于湖南省永州市某猪场进行。试验期间猪舍为全封闭式,屋顶以排气扇通风,漏缝塑料材质底面,不锈钢可调式料槽,乳头式饮水器,不定期对猪舍进行卫生清洁以及消毒。试验猪按照试验设计分组饲养,自由饮水和采食,采用粉料饲喂。
1.3 指标测定及方法 1.3.1 生长性能在试验期间,记录每头仔猪每天的采食量。在试验期的第1天和第28天对仔猪进行空腹称重。根据记录的采食量和体重数据,计算每只仔猪的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。

|
仔猪饲养试验结束后,于猪舍内禁食12 h,运至屠宰地点,称取体重,人工解剖取出内脏,分别称取肝脏、脾脏和肾脏的重量,最后按照公式[脏器指数(%)=(器官重量/体重)×100]计算脏器指数。
1.3.3 肠道形态仔猪饲养试验结束后,取空肠、回肠肠段各约2 cm,于10%中性福尔马林溶液中固定,再经常规水洗、浸蜡、包埋、切片、苏木精-伊红(HE)染色后,在光学显微镜下观察,选取6个走向延伸良好的视野,用Magic Images Advanced 3.2软件测量绒毛高度(villi height,VH)、绒毛宽度(villi width,VW)和隐窝深度(crypt depth,CD),并计算出绒毛高度与隐窝深度的比值(V/C)。
1.3.4 血清生化指标仔猪饲养试验结束后,空腹采集前腔静脉血液10 mL,3 000 r/min、4 ℃下离心10 min,分离血清后于-20 ℃冻存。采用全自动血液生化分析仪测定血清总蛋白(total protein,TP)、白蛋白(albumin,ALB)、尿素氮(urea nitrogen,UN)、葡萄糖(glucose,GLU)、血氨(blood ammonia,NH3L)、免疫球蛋白G(immunoglobulin G,IgG)和免疫球蛋白M(immunoglobulin M,IgM)含量以及谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)活性。
1.4 数据统计与分析试验数据先于Excel 2016软件记录,同时进行归纳整理,接着采用统计软件SPSS 22.0进行单因素方差分析和Turkey多重比较检验组间的差异显著性,以P < 0.05为差异显著性标准,数值结果用平均值±标准误表示。
2 结果与分析 2.1 OKG对由D-半乳糖导致的慢性氧化应激仔猪生长性能的影响由表 2可知,模型组末重、ADG和ADFI与对照组相比显著降低(P < 0.05),F/G则显著增加(P < 0.05)。SOKG组末重、ADG与模型组相比显著增加,F/G则显著降低(P < 0.05);MOKG组F/G与模型组相比显著降低(P < 0.05);LOKG组各生长性能指标与模型组相比均没有显著变化(P>0.05)。
|
|
表 2 OKG对由D-半乳糖导致的慢性氧化应激仔猪生长性能的影响 Table 2 Effects of OKG on growth performance of piglets with chronic oxidative stress caused by D-galactose |
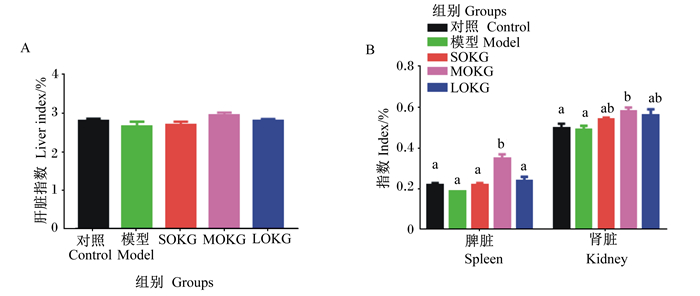
由图 1可知,各组肝脏指数无显著差异(P>0.05);对照组、模型组、SOKG组以及LOKG组间脾脏指数和肾脏指数无显著差异(P>0.05),但MOKG组脾脏指数和肾脏指数相较于对照组和模型组显著升高(P < 0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05),相同或无字母表示差异不显著(P>0.05)。 Value columns with different small letters mean significant difference (P < 0.05), while with the same or no letters mean no significant difference (P>0.05). 图 1 OKG对由D-半乳糖导致的慢性氧化应激仔猪脏器指数的影响 Fig. 1 Effects of OKG on organ indexes of piglets with chronic oxidative stress caused by D-galactose |
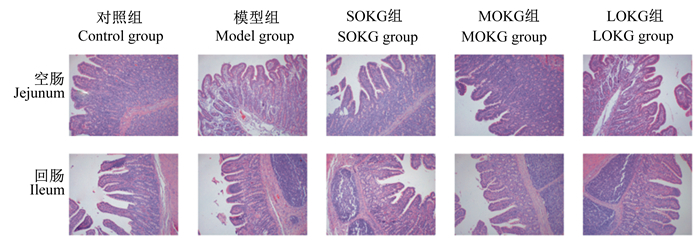
由图 2和表 3可知,对照组空肠绒毛高度与模型组以及3个OKG组均没有显著差异(P>0.05),但SOKG组空肠绒毛高度显著高于模型组(P < 0.05);模型组和SOKG组空肠隐窝深度较对照组显著降低(P < 0.05),MOKG组和LOKG组空肠隐窝深度则较对照组没有显著差异(P>0.05);对照组空肠绒毛高度与隐窝深度的比值与模型组以及3个OKG组均没有显著差异(P>0.05),但LOKG组空肠绒毛高度与隐窝深度的比值相较于MOKG组显著升高(P < 0.05);模型组空肠绒毛宽度较对照组显著降低(P < 0.05),3个OKG组的空肠绒毛宽度与对照组没有显著差异(P>0.05)。3个OKG组回肠绒毛高度显著低于对照组(P < 0.05);3个OKG组回肠隐窝深度与对照组和模型组均没有显著差异(P>0.05),但MOKG组和LOKG组回肠隐窝深度显著低于SOKG组(P < 0.05);SOKG组回肠空肠绒毛高度和隐窝深度的比值显著低于对照组(P < 0.05)。
|
图 2 仔猪肠道形态 Fig. 2 Intestinal morphology of piglets (100×) |
|
|
表 3 OKG对由D-半乳糖导致的慢性氧化应激仔猪肠道形态的影响 Table 3 Effects of OKG on intestinal morphology of piglets with chronic oxidative stress caused by D-galactose |
由表 4可知,MOKG组血清TP含量与对照组相比显著增加(P < 0.05);模型组血清ALP活性与对照组相比显著降低(P < 0.05),而SOKG组血清ALP活性与模型组相比显著增加(P < 0.05);MOKG组血清IgG含量与对照组相比显著增加(P < 0.05);MOKG组和LOKG组血清IgM含量与对照组和模型组相比显著增加(P < 0.05)。
|
|
表 4 OKG对由D-半乳糖导致的慢性氧化应激仔猪血清生化指标的影响 Table 4 Effects of OKG on serum biochemical indexes of piglets with chronic oxidative stress caused by D-galactose |
D-半乳糖是一种营养物质和还原单糖,它与蛋白质中的游离氨基酸反应生成活性氧簇(ROS),从而引起慢性氧化应激[5]。而越来越多的证据表明,OKG在氧化应激、烧伤、损伤和新陈代谢中具有正向的调节作用[9, 17-19]。从体重结果上来看,模型组添加D-半乳糖后末重显著降低,而在应激状态下添加0.5% OKG可以显著逆转末重的降低,这与我们之前的试验结果[16]一致,同时也与OKG对肿瘤大鼠[20]和D-半乳糖诱导的衰老小鼠的作用相似[21],说明OKG可以缓解仔猪因D-半乳糖造成的生长抑制。
3.2 OKG对由D-半乳糖导致的慢性氧化应激仔猪脏器指数的影响脏器指数是内脏器官的相对重量,是反映脏器是否中毒以及脏器功能强弱的重要指标[22]。有研究表明,D-半乳糖诱导的衰老型大鼠肝脏结构遭到破坏,肝功能减退[23];另外,D-半乳糖可导致小鼠慢性肾脏损伤[8]。本试验结果表明,正常仔猪和D-半乳糖应激仔猪肝脏指数、脾脏指数和肾脏指数无显著差异,说明D-半乳糖在仔猪上造成的应激还不至于显著损伤内脏。在D-半乳糖应激状态下,饲粮中添加0.5%、1.0%和2.0%OKG对仔猪肝脏指数均无显著影响,添加0.5%、2.0%OKG对仔猪脾脏指数和肾脏指数也无显著影响,但添加1.0%OKG使得仔猪脾脏指数以及肾脏指数显著升高,这与我们前期的研究得出的1.0%OKG可提高仔猪末重来缓解D-半乳糖所造成的慢性氧化应激的结果[16]相符,这在一定程度上说明1.0%OKG可以促进仔猪脾脏和肾脏的生长。
3.3 OKG对由D-半乳糖导致的慢性氧化应激仔猪肠道形态的影响营养物质经胃初步消化后,主要通过小肠消化吸收[24],所以小肠黏膜形态结构可以直接反映动物机体的健康状况以及对营养物质消化吸收能力的强弱。小肠绒毛越高,隐窝越浅,绒毛高度与隐窝深度的比值越大,说明吸收面积越大,功能越好。本试验结果表明,在D-半乳糖应激状态下,饲粮中添加0.5%OKG的仔猪空肠绒毛高度显著提升,饲粮中添加1.0%和2.0%OKG的仔猪回肠隐窝深度降低。这在一定程度上说明OKG能够改善应激仔猪的肠道黏膜损伤,从而提高仔猪肠道在应激状态下的吸收功能。但饲粮中添加0.5%OKG的仔猪回肠绒毛高度与隐窝深度的比值显著低于正常仔猪,加上在D-半乳糖应激下的仔猪回肠绒毛高度与隐窝深度的比值低于正常仔猪,可能是因为剂量不足以达到影响D-半乳糖导致慢性氧化应激下仔猪的回肠的吸收功能,建议进一步细化饲粮中OKG的添加量,研究其对D-半乳糖导致慢性氧化应激仔猪回肠形态结构的影响。
3.4 OKG对由D-半乳糖导致的慢性氧化应激仔猪血清生化指标的影响血清TP含量与猪的消化吸收以及免疫力有关;ALB是血浆中最主要的蛋白质,用于维持机体营养与渗透压;血清ALT活性可反映肝脏是否受到损害;血清AST活性可反映心脏和肝脏是否正常运行,高AST活性与心肌梗死、干细胞损伤、肌营养不良以及皮肌炎有关;ALP参与脂肪代谢,其活性可反映机体生长性能;血清UN含量升高主要在于肾脏功能出现故障;血清GLU是机体能量的重要来源,为各种组织、脏器的正常运作提供动力;血清IgG、IgM是机体抗感染免疫过程中重要物质基础;血清NH3L含量是反映机体肝脏功能的指标。
研究表明AKG可促进体内蛋白质的合成,诱导胰岛素和生长激素的分泌[25],而OKG相较于鸟氨酸和AKG的单独添加,其能更有效地诱导胰岛素和生长激素分泌[14]。另外,D-半乳糖诱导的衰老型小鼠血清IgG、IgM含量降低[26]。本试验结果表明,饲粮中添加1.0%OKG可使应激仔猪血清TP含量显著高于正常仔猪,原因可能在于OKG在体内分解为AKG,从而促进蛋白质的合成。饲粮中添加0.5%OKG可使应激仔猪血清ALP活性显著增加,而D-半乳糖刺激仔猪血清ALP活性降低,ALP活性高低与机体生长性能相关,说明OKG可能通过促进肝脏功能的发挥,进而提高仔猪在应激状态下的生长性能。饲粮中添加1.0%OKG可使应激仔猪血清IgG、IgM含量显著增加,添加2.0%OKG可使应激仔猪血清IgM含量显著增加,D-半乳糖刺激仔猪血清IgG、IgM含量相较于正常仔猪有一定程度上的提升,原因可能在于,仔猪受到D-半乳糖刺激,机体免疫系统迅速产生免疫应答,浆细胞分泌大量IgG和IgM进行防御抵抗,而OKG可能改善肠道应激损伤,促进肠道营养吸收,机体产生的能量也就更多,进而产生更多的IgG和IgM。建议开展后续试验,进一步细化饲粮中OKG的添加量,以确定缓解仔猪慢性氧化应激的最优值。
4 结论① 饲粮中添加D-半乳糖显著抑制仔猪生长,而添加0.5%OKG可以减轻D-半乳糖所造成的生长抑制。
② 饲粮中添加1.0%OKG可显著增加慢性氧化应激仔猪脾脏和肾脏的重量。
③ 饲粮中添加0.5%OKG可显著提升慢性氧化应激仔猪空肠绒毛高度,添加1.0%和2.0%OKG可降低回肠隐窝深度。
④ 饲粮中添加0.5%OKG可显著增加慢性氧化应激仔猪血清ALP活性,添加1.0%OKG可显著增加血清TP、IgG、IgM含量,添加2.0%OKG可显著增加血清IgM含量。
⑤ 综合上述结果可知,OKG可以减轻D-半乳糖导致的仔猪生长抑制,通过促进脾脏和肾脏生长,改善小肠黏膜形态结构,提高血清TP、IgG和IgM含量与ALP活性,从而缓解D-半乳糖造成的仔猪慢性氧化应激。同时,综合各项指标可以确定0.5%OKG对于缓解D-半乳糖导致的仔猪慢性氧化应激具有较好的效果。
| [1] |
BETTERIDGE D J. What is oxidative stress?[J]. Metabolism: Clinical and Experimental, 2000, 49(2): 3-8. DOI:10.1016/S0026-0495(00)80077-3 |
| [2] |
WANG W W, WU Z L, LIN G, et al. Glycine stimulates protein synthesis and inhibits oxidative stress in pig small intestinal epithelial cells[J]. The Journal of Nutrition, 2014, 144(10): 1540-1548. DOI:10.3945/jn.114.194001 |
| [3] |
PARK S, KIM C S, LEE J, et al. Effect of regular exercise on the histochemical changes of D-galactose-induced oxidative renal injury in high-fat diet-fed rats[J]. Acta Histochemica et Cytochemica, 2013, 46(4): 111-119. DOI:10.1267/ahc.13012 |
| [4] |
LIU C M, MA J Q, LOU Y. Chronic administration of troxerutin protects mouse kidney against D-galactose-induced oxidative DNA damage[J]. Food and Chemical Toxicology, 2010, 48(10): 2809-2817. DOI:10.1016/j.fct.2010.07.011 |
| [5] |
ZHONG J J, WANG F, WANG Z F, et al. Aloin attenuates cognitive impairment and inflammation induced by D-galactose via down-regulating ERK, p38 and NF-κB signaling pathway[J]. International Immunopharmacology, 2019, 72: 48-54. DOI:10.1016/j.intimp.2019.03.050 |
| [6] |
FENG Y, YU Y H, WANG S T, et al. Chlorogenic acid protects D-galactose-induced liver and kidney injury via antioxidation and anti-inflammation effects in mice[J]. Pharmaceutical Biology, 2016, 54(6): 1027-1034. DOI:10.3109/13880209.2015.1093510 |
| [7] |
ZHANG J M, LIN W W, WU R J, et al. Mechanisms of the active components from Korean pine nut preventing and treating D-galactose-induced aging rats[J]. Biomedicine and Pharmacotherapy, 2018, 103: 680-690. DOI:10.1016/j.biopha.2018.04.063 |
| [8] |
SEGAUD F, LARDEUX B, ALEXANDRE-GOUABAU M C, et al. Pretreatment of starved rats with ornithine α-ketoglutarate: effects on hepatic mRNA levels and plasma concentrations of three liver-secreted proteins[J]. Nutrition, 2005, 21(6): 732-739. DOI:10.1016/j.nut.2004.11.008 |
| [9] |
LOÏ C, HAMANI D, MOINARD C, et al. Does the ornithine-α-ketoglutarate ratio influence ornithine α-ketoglutarate metabolism in healthy rats?[J]. Metabolism: Clinical and Experimental, 2007, 56(1): 105-114. DOI:10.1016/j.metabol.2006.09.004 |
| [10] |
TATARA M R, ŚLIWA E, KRUPSKI W, et al. Ornithine alpha-ketoglutarate increases mineralization and mechanical properties of tibia in turkeys[J]. Bone, 2006, 39(1): 100-105. DOI:10.1016/j.bone.2005.12.016 |
| [11] |
JEEVANANDAM M, HOLADAY N J, PETERSEN S R. Ornithine-α-ketoglutarate (OKG) supplementation is more effective than its component salts in traumatized rats[J]. Journal of Nutrition, 1996, 126(9): 2141-2150. DOI:10.1093/jn/126.9.2141 |
| [12] |
SCHUSTER H, BLANC M C, GENTHON C, et al. Does dietary ornithine α-ketoglutarate supplementation protect the liver against ischemia-reperfusion injury?[J]. Clinical Nutrition, 2005, 24(3): 375-384. DOI:10.1016/j.clnu.2004.12.002 |
| [13] |
GONÇALVES E S G, RABELO C M, DO PRADO NETO A X, et al. Effect of short-term ornithine alpha-ketoglutarate pretreatment on intestinal ischemia-reperfusion in rats[J]. Acta Cirurgica Brasileira, 2011, 26(Suppl.1): 2-7. |
| [14] |
PERNET P, COUDRAY-LUCAS C, SCHNEID C, et al. Dose dependency of the effect of ornithine α-ketoglutarate on tissue glutamine concentrations and hypercatabolic response in endotoxaemic rats[J]. British Journal of Nutrition, 2004, 92(4): 627-634. DOI:10.1079/BJN20041254 |
| [15] |
SCHNEID C, DE BANDT J P, CYNOBER L, et al. In vivo induction of insulin secretion by ornithine α-ketoglutarate: involvement of nitric oxide and glutamine[J]. Metabolism: Clinical and Experimental, 2003, 52(3): 344-350. DOI:10.1053/meta.2003.50054 |
| [16] |
LI Y Y, WANG P, YIN J, et al. Effects of ornithine α-ketoglutarate on growth performance and gut microbiota in a chronic oxidative stress pig model induced by D-galactose[J]. Food & Function, 2020, 11(1): 472-482. |
| [17] |
MOINARD C, CALDEFIE F, WALRAND S, et al. Effects of ornithine 2-oxoglutarate on neutrophils in stressed rats: evidence for the involvement of nitric oxide and polyamines[J]. Clinical Science, 2002, 102(3): 287-295. DOI:10.1042/CS20010162 |
| [18] |
ALBAUGH V L, MUKHERJEE K, BARBUL A. Proline precursors and collagen synthesis: biochemical challenges of nutrient supplementation and wound healing[J]. Journal of Nutrition, 2017, 147(11): 2011-2017. |
| [19] |
LE BRICON T, COUDRAY-LUCAS C, LIORET N, et al. Ornithine α-ketoglutarate metabolism after enteral administration in burn patients: bolus compared with continuous infusion[J]. American Journal of Clinical Nutrition, 1997, 65(2): 512-518. DOI:10.1093/ajcn/65.2.512 |
| [20] |
LE BRICON T, CYNOBER L, BARACOS V E. Ornithine α-ketoglutarate limits muscle protein breakdown without stimulating tumor growth in rats bearing Yoshida ascites hepatoma[J]. Metabolism: Clinical and Experimental, 1994, 43(7): 899-905. DOI:10.1016/0026-0495(94)90274-7 |
| [21] |
ZHANG H Y, LI Y Y, CUI C X, et al. Modulation of gut microbiota by dietary supplementation with tuna oil and algae oil alleviates the effects of D-galactose-induced ageing[J]. Applied Microbiology and Biotechnology, 2018, 102(6): 2791-2801. DOI:10.1007/s00253-018-8775-1 |
| [22] |
王黎琦, 汪攀, 曹珺, 等. 约氏乳杆菌对断奶仔猪生产性能、血液学指标、脏器指数和组织病理学的影响[J]. 中国畜牧杂志, 2016, 52(21): 76-80. WANG L Q, WANG P, CAO J, et al. Effects of Lactobacillus johnsonii on growth performance, hematology indices, organ indices and tissues histopathology in weaned pigs[J]. Chinese Journal of Animal Science, 2016, 52(21): 76-80 (in Chinese). DOI:10.3969/j.issn.0258-7033.2016.21.017 |
| [23] |
RUAN Q W, LIU F, GAO Z J, et al. The anti-inflamm-aging and hepatoprotective effects of huperzine A in D-galactose-treated rats[J]. Mechanisms of Ageing and Development, 2013, 134(3/4): 89-97. |
| [24] |
WANG W W, QIAO S Y, LI D F. Amino acids and gut function[J]. Amino Acids, 2009, 37(1): 105-110. DOI:10.1007/s00726-008-0152-4 |
| [25] |
YAO K, YIN Y L, LI X L, et al. Alpha-ketoglutarate inhibits glutamine degradation and enhances protein synthesis in intestinal porcine epithelial cells[J]. Amino Acids, 2012, 42(6): 2491-2500. DOI:10.1007/s00726-011-1060-6 |
| [26] |
李梦云, 欧阳五庆, 吴小利, 等. 激动素对衰老大鼠免疫功能及其脾淋巴细胞体外增殖的影响[J]. 生理学报, 2014, 66(5): 605-611. LI M Y, OUYANG W Q, WU X L, et al. Effect of kinetin on immunity and splenic lymphocyte proliferation in vitro in D-galactose-induced aging rats[J]. Acta Physiologica Sinica, 2014, 66(5): 605-611 (in Chinese). |




