21世纪以来,我国生产力急剧升高,人民生活水平日益改善,人均肉蛋消费比例稳步上升。肉鸡养殖业在我国当今畜牧业生产中占有相当比重,年出栏量约为80亿只。特别是2018年以来非洲猪瘟肆虐,生猪供应急剧下降,导致猪肉价格飞涨,人们转而对鸡肉的需求日益增高。然而,在养殖过程中,企业为降低成本,采用高密度集约化的饲养方式使得肉鸡生理和环境压力骤升[1],病害频发。因此,企业常在饲粮中添加少量抗生素以预防常见疾病,提高生产效率,维持动物健康[2-3]。但随着抗生素的广泛应用,其弊端日益突显,例如长期使用抗生素会降低机体免疫力,并导致致病菌的耐药性越来越强[4];摄食含有抗生素的畜禽产品,最终通过食物链汇集于人体,威胁人类健康[5];此外,刘菲等[6]研究发现,集约化家禽饲养场是抗生素抗性基因(antibiotic resistance genes,ARGs)的重要来源。
自2020年7月1日起,我国已实行饲料全面禁抗,然而近几年各种病害频发,我国畜牧业发展面临着严峻的挑战。因此,迫切需要寻找一种或多种抗生素替代品,能起到增强动物自然防御功能的作用,而没有抗生素所带来的弊端,如耐药性、药物残留等问题。近年来,龙须菜(Gracilaria lemaneiformis)已成为我国四大经济栽培海藻之一,是一种传统的可食用海藻,从龙须菜中提取的多糖也越来越受到人们的重视。研究指出,龙须菜多糖(Gracilaria lemaneiformis polysaccharides,GLP)具有抗氧化[7-8]、抗肿瘤[9-10]、免疫调节[11]、降血糖[12]、改善肠道菌群等多种生物学功能[13]。然而,有关龙须菜多糖在肉鸡上的应用罕见报道。在其他海藻多糖的研究中,郭晓波等[14]研究发现,海藻多糖可改善仔猪小肠上皮细胞屏障功能,促进紧密连接蛋白的表达;而萨仁娜[15]研究发现,海藻多糖对肉鸡的生长无显著影响,但可提高其淋巴细胞转化率。
因此,伴随着我国畜牧行业集约化、规模化程度的不断提高,如何在提高畜产品产量的同时,提升产品品质、减少环境污染成为畜牧行业亟待解决的问题。基于龙须菜多糖在抗肿瘤、抗氧化、免疫调节等方面的最新研究成果,针对肉鸡集约化生产中所面临的高应激、环境差、免疫力低下、抗生素积累等问题,本研究拟从调节肉鸡的抗氧化能力、提高其免疫功能和改善其生长性能为切入点,为龙须菜多糖替代抗生素在实际生产中的应用以及研制复合新型抗生素替代品提供理论依据。
1 材料与方法 1.1 试验设计采用完全随机试验设计,选取1日龄、平均体重为(43.47±0.29) g的健康爱拔益加(AA)肉仔鸡288只,随机分成3个组,每组6个重复,每个重复16只鸡(公母各占1/2),各组体重无显著差异(P>0.05)。每个重复放入1个笼(0.9 m×1.0 m)中。基础饲粮采用玉米-豆粕型饲粮,参照《鸡饲养标准》(NY/T 33—2004)配制成粉状配合饲粮,其组成及营养水平见表 1。对照(CON)组饲喂基础饲粮,龙须菜多糖和抗生素(ANTI)组分别饲喂在基础饲粮中添加0.1%龙须菜多糖和10 mg/kg抗生素的试验饲粮。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验所用龙须菜多糖购自广州某生物科技有限公司,有效含量为50%,主要成分为琼二糖、琼胶糖前体、6-OCH3-琼二糖、6-OS03-琼二糖等;抗生素为美国某有限公司提供,含50%的维吉尼亚霉素。
1.3 饲养管理试验于河南省农业科学院畜牧兽医研究所尉氏养殖基地进行,试验饲粮为粉料,肉鸡采用双层笼养方式进行饲养。试验期间肉鸡自由采食和饮水,按正常免疫程序进行免疫接种。鸡舍内采用23 h人工光照,1 h黑暗处理,温度由1日龄时的34 ℃逐步降低至21日龄时的24 ℃,然后保持大致稳定。试验期42 d,分为1~21日龄和22~42日龄2个阶段。
1.4 样品采集及指标测定 1.4.1 生长性能指标试验开始时对1日龄肉仔鸡按组称取其初始体重,并记录。分别于21和42日龄时,空腹3 h后以每重复为单位测定肉仔鸡的体重,同时统计各组给料量、剩余料量及鸡只死亡数量,计算平均日采食量、平均日增重和料重比。
1.4.2 血清抗氧化和免疫指标分别于21和42日龄时,从每个重复随机选取2只体重相近的肉鸡,利用乙二胺四乙酸(EDTA)真空管由翅静脉采血2~3 mL,3 000 r/min离心15 min,-80 ℃分装保存。血清中总抗氧化能力(T-AOC),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量的测定均采用南京建成生物工程研究所试剂盒,按照试剂盒说明书要求进行操作,并用Biotech酶标仪进行检测。同时,采用酶联免疫吸附(ELISA)竞争法测定血清中免疫球蛋白及细胞因子含量,包括免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β),测定步骤参照试剂盒说明书进行(南京建成生物工程研究所)。
1.4.3 肠道黏膜采集和炎症因子指标用戊巴比妥钠稀释液(30 mg/mL)将上述取完血清的肉鸡麻醉致死。鸡处死后迅速剖开腹腔,取出肠道(十二指肠),置于冰上剖开肠段,用事先准备好的无菌生理盐水稍作冲洗,后用无菌载玻片刮取肠道黏膜至冻存管中,随后放入液氮保存。
肠道黏膜总RNA的提取采用TaKaRa(宝生物)试剂盒(TaKaRa MiniBEST Universal RNA Extraction Kit),具体步骤按说明书进行。RNA的浓度和纯度用Nano-drop 1000进行检测,采用反转录试剂盒PrimeScriptTM RT Master Mix(TaKaRa)将RNA反转录为cDNA,再进行实时荧光定量PCR检测(TB GreenⓇ Premix Ex TaqTM Ⅱ,TaKaRa)。实时荧光定量反应仪器为罗氏Light Cycler 96,内参基因为三磷酸甘油醛脱氢酶(GAPDH),目标基因为IL-1β和TNF-α,其引物序列见表 2。采用相对定量法(2-ΔΔCt)进行结果计算[16]。
|
|
表 2 荧光定量PCR引物序列 Table 2 Primer sequences of fluorescent qPCR |
将上述麻醉致死的肉鸡分别采摘脾脏、胸腺、法氏囊,并剔除附着组织,用滤纸吸干血水后称鲜重,计算其免疫器官指数。计算公式为:
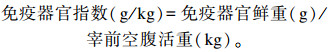
|
所有试验数据均采用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),组间出现显著差异时再用Duncan氏法进行多重比较。数据以“平均值±标准误”表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 龙须菜多糖对肉鸡生长性能的影响由表 3可知,1~21日龄时,各组肉鸡的末重、平均日增重和平均日采食量均无显著差异(P>0.05),对照组的料重比显著高于龙须菜多糖和抗生素组(P < 0.05)。22~42日龄时,龙须菜多糖和抗生素组肉鸡的末重和平均日增重显著高于对照组(P < 0.05),料重比显著低于对照组(P < 0.05);各组的平均日采食量无显著差异(P>0.05)。
|
|
表 3 龙须菜多糖对肉鸡生长性能的影响 Table 3 Effects of GLP on growth performance of broilers |
由表 4可知,21日龄时,龙须菜多糖组肉鸡的脾脏指数显著高于对照组和抗生素组(P < 0.05),抗生素组的法氏囊指数显著低于对照组和龙须菜多糖组(P < 0.05)。42日龄时,各组肉鸡的脾脏指数无显著差异(P>0.05);抗生素组的胸腺指数显著低于对照组(P < 0.05);龙须菜多糖组的法氏囊指数显著高于对照组(P < 0.05),但与抗生素组相比无显著差异(P>0.05)。
|
|
表 4 龙须菜多糖对肉鸡免疫器官指数的影响 Table 4 Effects of GLP on immune organ indexes of broilers |
由表 5可知,21日龄时,对照组肉鸡血清中MDA含量最高,且显著高于龙须菜多糖组(P < 0.05),抗生素组血清中MDA含量高于龙须菜多糖组,但差异不显著(P>0.05);龙须菜多糖组血清中GSH-Px活性显著高于对照组和抗生素组(P < 0.05)。42日龄时,龙须菜多糖组肉鸡血清中SOD和GSH-Px活性显著高于对照组和抗生素组(P < 0.05);血清中MDA含量以龙须菜多糖组最低,且显著低于其余2组(P < 0.05)。各组肉鸡血清中T-AOC和CAT活性均无显著差异(P>0.05)。
|
|
表 5 龙须菜多糖对肉鸡血清抗氧化指标的影响 Table 5 Effects of GLP on serum antioxidant indexes of broilers |
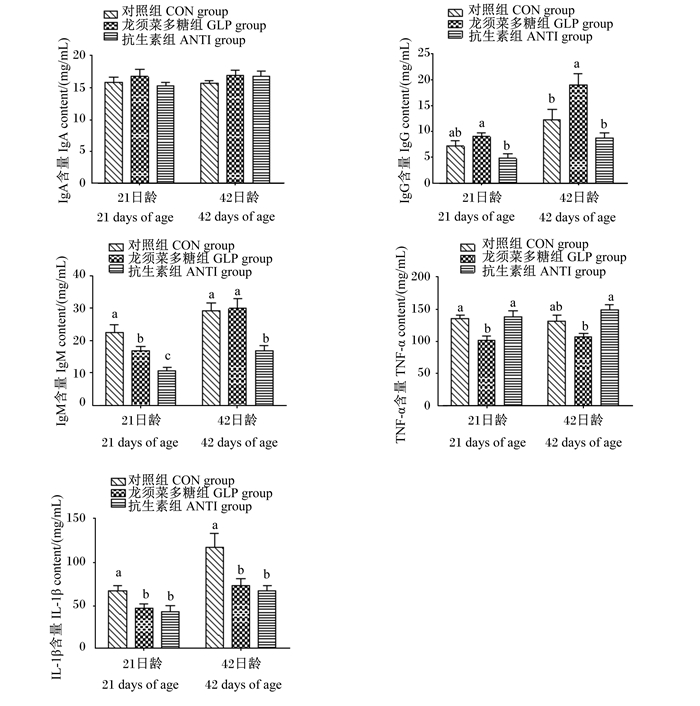
由图 1可知,在免疫球蛋白方面,各组肉鸡血清中IgA含量在21和42日龄时均无显著差异(P>0.05);龙须菜多糖组血清中IgG含量在21和42日龄时均为最高,且在42日龄时显著高于对照组和抗生素组(P < 0.05);抗生素组血清中IgM含量在21和42日龄时均为最低,且显著低于其他2组(P < 0.05)。在炎症因子方面,龙须菜多糖组肉鸡血清中TNF-α含量在21日龄时显著低于其他2组(P < 0.05),42日龄时显著低于抗生素组(P < 0.05);龙须菜多糖和抗生素组血清中IL-1β含量在21和42日龄时均显著低于对照组(P < 0.05),且2组间无显著差异(P>0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。图 2同。 Value columns with different small letters mean significant difference (P < 0.05). The same as Fig. 2. 图 1 龙须菜多糖对肉鸡血清免疫指标及炎性因子的影响 Fig. 1 Effects of GLP on serum immune indexes and inflammatory factors of broilers |
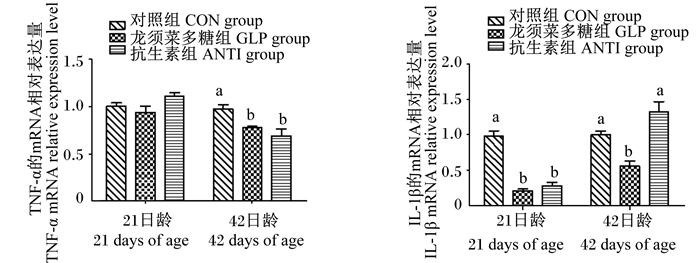
由图 2可知,21日龄时,龙须菜多糖和抗生素组肉鸡肠道黏膜IL-1β的mRNA相对表达量显著低于对照组(P < 0.05);各组肠道黏膜TNF-α的mRNA相对表达量无显著差异(P>0.05)。42日龄时,龙须菜多糖组肉鸡肠道黏膜IL-1β的mRNA相对表达量最低,且显著低于其他2组(P < 0.05);龙须菜多糖和抗生素组肠道黏膜TNF-α的mRNA相对表达量显著低于对照组(P < 0.05)。
|
图 2 龙须菜多糖对肉鸡肠道黏膜炎性因子mRNA相对表达量的影响 Fig. 2 Effects of GLP on mRNA relative expression level of inflammatory factors in intestinal mucosa of broilers |
畜产品安全是当今食品安全问题中的焦点。企业为追求生产效率和经济效益,在生产过程中通常采用高密度、集约化的饲养方式,使得肉鸡生理和环境压力骤升[1],病害频发。因此,在饲粮中添加低剂量的抗生素是解决上述问题的普遍做法,然而随着我国2020年在畜牧业中全面禁止抗生素的使用以及人们对养殖动物福利及食品安全的注重,如何实现畜牧业的绿色安全可持续发展是亟待解决的问题。本研究通过在饲粮中添加龙须菜多糖和抗生素观察其对肉鸡的影响,研究结果发现,龙须菜多糖和抗生素组肉鸡22~42日龄时的末重和平均日增重显著高于对照组,1~21日龄和22~42日龄时的料重比显著低于对照组。这说明龙须菜多糖的添加对肉鸡的生长有一定的促进作用。
关于龙须菜多糖对肉鸡生长等方面的研究罕有报道。胡庭俊等[17]对凤凰土鸡的研究中指出,饲粮中添加0.25 g/kg马尾藻多糖纳米脂质体能显著降低其料重比,提高饲料利用率。杨晋[18]研究发现,饲粮中添加400 mg/kg海藻多糖能显著提高仔猪的日增重,并且降低料重比和腹泻频率。另有研究报道,用海藻多糖替代仔猪饲粮中部分乳糖,海藻多糖添加组仔猪的平均日增重和料重比得到显著改善[19-20]。这可能是由于海藻多糖一方面可以提高饲养动物肠道乳酸菌的数量,如石莼聚糖可改善肠道微生物区系,使盲肠乳酸杆菌数显著增加,大肠杆菌数显著减少[21],而乳酸菌分泌产生的糖苷酶可以进一步促进饲料的消化吸收和利用[22];另一方面,海藻多糖可以增加肠绒毛高度,促进肠道中黏蛋白的分泌,提高动物的消化吸收能力,有研究表明,饲粮中添加海藻多糖对仔猪小肠绒毛高度提高具有促进作用[23-24]。
然而,有关海藻多糖对动物生长性能影响的报道不尽相同。万顺康等[25]研究发现,螺旋藻多糖对肉仔鸡的平均日采食量、平均日增质量和料重比无显著促进作用。阎桂玲等[26]研究发现,褐藻酸寡糖对肉鸡的生长性能无显著促进效果,但高剂量添加(2 000 mg/kg)在饲养前期有降低料重比和提高日增重的趋势。萨仁娜[15]研究发现,海带岩藻聚糖对肉鸡的生长性能无显著影响,但可以促进其淋巴细胞转化率。产生不同结论的原因可能是各个试验所用的藻类多糖的种类不同、肉鸡品种及所处的饲养环境也略有差异。
3.2 龙须菜多糖对肉鸡免疫器官指数的影响脾脏、胸腺和法氏囊是禽类的重要免疫器官,它们的正常发育和形态完整是机体健康状态的一种重要表现,同时也会直接影响机体的免疫状态。正常范围内免疫器官的相对重量增加,说明机体细胞的免疫功能增强。本试验结果表明,龙须菜多糖对肉鸡脾脏、胸腺和法氏囊指数均有显著影响,且龙须菜多糖组的免疫器官指数普遍高于对照组和抗生素组,说明龙须菜多糖对肉鸡免疫器官的发育有一定促进作用,特别是在肉鸡生长前期。从数据看出,前期龙须菜多糖组的脾脏指数上升显著,而抗生素组的免疫器官指数普遍较低。有研究指出,黄霉素作为饲料添加剂会降低鸡的免疫器官指数,抑制动物的免疫器官发育[17]。任颖朗等[27]研究发现,龙须菜多糖能提高光老化小鼠的胸腺指数和脾脏指数。Fan等[9]发现,龙须菜酸性多糖可以增强荷瘤小鼠免疫器官的免疫功能。在肉鸡试验中,萨仁娜[15]研究指出,高剂量海带岩藻聚糖可显著促进肉鸡脾脏和胸腺发育;万顺康等[25]在饲粮中添加1 g/kg螺旋藻多糖,发现肉鸡的免疫器官指数显著高于未添加组;王烨等[28]通过饮水方式每天补充20 mg/kg海藻多糖,发现可提高21~42日龄肉鸡免疫器官的免疫系数,尤其是脾脏免疫系数最为显著。
本试验中所设定的肉鸡饲养密度较高,本课题组前期研究发现,高饲养密度会导致肉鸡的应激加强,体内累积较多氧自由基,而氧自由基连锁反应会损害动物细胞的生物膜及其功能,造成神经、组织、器官等损伤,而龙须菜多糖可以通过清除体内的自由基改善动物自身的抗氧化功能,从而影响肉鸡免疫器官的生长发育[29]。宫春宇等[30]和杨文鸽等[31]研究认为,龙须菜多糖具有体外清除羟自由基、超氧自由基和过氧化氢的作用。
3.3 龙须菜多糖对肉鸡抗氧化能力的影响本研究结果显示,龙须菜多糖可显著提高肉鸡血清中SOD和GSH-Px活性,降低MDA含量,表明龙须菜多糖对肉鸡的抗氧化能力有一定提升作用。Guo等[32]将龙须菜多糖与草酸诱导的人近端肾小管上皮细胞共同孵育后,发现其细胞的SOD活性显著升高,MDA含量显著降低,表明龙须菜多糖能提高细胞内抗氧化酶活性,减少细胞损伤。陈美珍等[33]报道,龙须菜多糖能够提高荷瘤小鼠的抗氧化能力。王晓梅等[34]研究发现,龙须菜多糖具有优异的抗氧化活性。石达友等[35]研究发现,给粤黄鸡注射海藻多糖(40 g/L)能显著提高其血清中SOD活性。这可能是由于龙须菜多糖可以清除体内多余的自由基。于敬沂[36]研究发现,许多海藻多糖都具有清除体内或体外活性氧自由基、提高抗氧化酶活性及降低脂质过氧化物含量的作用。杨华等[37]研究发现,采用微波辅助法提取的龙须菜多糖能有效清除1, 1-二苯基-2-三硝基苯肼(DPPH)自由基,表明其有抗氧化活性作用。此外,Souza等[38]研究发现,龙须菜硫酸多糖能减缓自由基的形成。这可能是由于龙须菜多糖具有还原性的半缩醛羟基结构,可以还原/清除自由基[34],从而提高机体的抗氧化能力。
3.4 龙须菜多糖对肉鸡免疫指标及炎性因子的影响免疫球蛋白是参与体液免疫的主要抗体,其在血清中的含量是判断动物体液免疫功能的重要指标之一。本研究发现,龙须菜多糖组肉鸡血清中IgG和IgM含量显著上升,这说明龙须菜多糖对肉鸡的体液免疫有促进作用。类似的研究在龙须菜多糖灌胃荷瘤小鼠研究中发现,龙须菜多糖可显著増强B细胞活性,使机体分泌较高水平的肿瘤特异性IgG抗体,提高机体的体液免疫能力[39]。Okai等[40]和Choi等[41]对海带多糖的研究中进一步发现,热水提取的海带多糖能诱导小鼠脾淋巴细胞增殖,提高脾细胞的DNA合成能力,同时使B淋巴细胞数量增加,其所分泌的抗体IgM和IgG数量也随之增多。万顺康等[25]报道,饲粮中添加螺旋藻多糖可使肉鸡血清中IgG含量显著升高,高剂量添加组(1.0和1.5 g/kg)血清中IgA和IgM含量显著升高。Leonard等[23]在妊娠第107天到哺乳第26天母猪饲粮中添加海藻多糖,发现泌乳母猪初乳中IgA和IgG含量得到显著提高。
炎症反应是一个极其复杂的过程,适度的炎症反应有助于动物机体的恢复,然而过于强烈或持久的炎症反应则会对正常的细胞和组织造成一定的损伤。本试验研究发现,龙须菜多糖组肉鸡血清中TNF-α和IL-1β含量及肠道黏膜TNF-α和IL-1β的mRNA相对表达量与对照组相比显著降低。造成这种现象的原因可能是以下2个方面:一方面,由于对照组肉鸡受持久的高密度环境应激影响开始产生免疫应答,由此产生较多细胞因子,而过多的细胞因子对机体是有害的;另一方面,龙须菜多糖的添加可以降低炎症反应,使炎症因子含量及表达量下降。诸多研究指出海藻多糖具有免疫调节作用,例如在对猪的研究中发现,用海藻多糖治疗脂多糖(LPS)刺激后的断奶仔猪,可以显著降低其回肠TNF-α的mRNA相对表达量[23];在饲粮中添加400 mg/kg海藻多糖能显著上调仔猪空肠黏膜抗炎性因子白细胞介素-10(IL-10)的mRNA表达,并使促炎性因子IL-6和TNF-α的mRNA表达显著下调[18]。这可能是由于海藻多糖能够通过抑制核转录因子激活蛋白-1(AP-1)激活等机制下调诱导型一氧化氮合酶(iNOS)及环氧合酶(COX-2)的mRNA表达,从而抑制炎症介质一氧化氮及前列腺素E2(PGE2)的释放,发挥其抗炎作用[42-43]。在小鼠的研究中,同样也发现海藻多糖不仅能降低机体促炎性因子IL-6、TNF-α和IL-1β的分泌,还能提高抗炎性因子IL-10和转化生长因子-β(TGF-β)的mRNA相对表达量,从而恢复细胞因子的平衡,起到抗炎的作用[44, 29]。在相关肠胃炎症模型中,Choi等[45]发现,岩藻多糖能降低阿司匹林诱导的急性胃溃疡模型大鼠血清中IL-6含量,减轻胃黏膜损伤;Brito等[42]研究指出,在大鼠肠炎模型中,Gracilaria birdiae硫酸化多糖能够抑制促炎因子TNF-α和IL-1β的分泌,并减弱髓过氧化物酶(MPO)活性,从而减少肠道炎性细胞浸润,改善肠道组织损伤。
4 结论饲粮中添加0.1%龙须菜多糖能提高肉鸡的生长性能和饲料利用率,提升机体的抗氧化能力和免疫功能,并能在一定程度上缓解肉鸡的肠道炎性反应。
| [1] |
HONG P Y, LI X Z, YANG X F, et al. Monitoring airborne biotic contaminants in the indoor environment of pig and poultry confinement buildings[J]. Environmental Microbiology, 2012, 14(6): 1420-1431. DOI:10.1111/j.1462-2920.2012.02726.x |
| [2] |
BEN W W, WANG J, PAN X, et al. Dissemination of antibiotic resistance genes and their potential removal by on-farm treatment processes in nine swine feedlots in Shandong province, China[J]. Chemosphere, 2017, 167: 262-268. DOI:10.1016/j.chemosphere.2016.10.013 |
| [3] |
DIBAISE J K, ZHANG H S, CROWELL M D, et al. Gut microbiota and its possible relationship with obesity[J]. Mayo Clinic Proceedings, 2008, 83(4): 460-469. DOI:10.4065/83.4.460 |
| [4] |
WU N, QIAO M, ZHANG B, et al. Abundance and diversity of tetracycline resistance genes in soils adjacent to representative swine feedlots in China[J]. Environmental Science & Technology, 2010, 44(18): 6933-6939. |
| [5] |
PAL C, BENGTSSON-PALME J, KRISTIANSSON E, et al. The structure and diversity of human, animal and environmental resistomes[J]. Microbiome, 2016, 4(1): 54. DOI:10.1186/s40168-016-0199-5 |
| [6] |
刘菲, 许霞, 屠博文, 等. 某集约化肉鸡饲养场PM2.5中抗生素抗性基因的分布特征[J]. 环境科学, 2019, 40(2): 567-572. LIU F, XYV X, TU B W, et al. Distribution characteristics of antibiotic resistance genes in PM2.5 of a concentrated broiler feeding operation[J]. Environmental Science, 2019, 40(2): 567-572 (in Chinese). |
| [7] |
HE J Z, XU Y Y, CHEN H B, et al. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds[J]. International Journal of Molecular Sciences, 2016, 17(12): 1988. DOI:10.3390/ijms17121988 |
| [8] |
WU S J, LU M S, WANG S J. Amylase-assisted extraction and antioxidant activity of polysaccharides from Gracilaria lemaneiformis[J]. 3 Biotech, 2017, 7(1): 38. DOI:10.1007/s13205-017-0697-6 |
| [9] |
FAN Y L, WANG W H, SONG W, et al. Partial characterization and anti-tumor activity of an acidic polysaccharide from Gracilaria lemaneiformis[J]. Carbohydrate Polymers, 2012, 88(4): 1313-1318. DOI:10.1016/j.carbpol.2012.02.014 |
| [10] |
YAN J K, PEI J J, MA H L, et al. Advances in antitumor polysaccharides from Phellinus sensu lato: production, isolation, structure, antitumor activity, and mechanisms[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(6): 1256-1269. DOI:10.1080/10408398.2014.984802 |
| [11] |
REN Y L, ZHENG G Q, YOU L J, et al. Structural characterization and macrophage immunomodulatory activity of a polysaccharide isolated from Gracilaria lemaneiformis[J]. Journal of Functional Foods, 2017, 33: 286-296. DOI:10.1016/j.jff.2017.03.062 |
| [12] |
LIAO X B, YANG L W, CHEN M Z, et al. The hypoglycemic effect of a polysaccharide (GLP) from Gracilaria lemaneiformis and its degradation products in diabetic mice[J]. Food & Function, 2015, 6(8): 2542-2549. |
| [13] |
AI C Q, DUAN M M, MA N, et al. Sulfated polysaccharides from pacific abalone reduce diet-induced obesity by modulating the gut microbiota[J]. Journal of Functional Foods, 2018, 47: 211-219. DOI:10.1016/j.jff.2018.05.061 |
| [14] |
郭晓波, 邹田德, 杨晋, 等. 海藻多糖对仔猪小肠上皮细胞紧密连接蛋白及核转录因子-κB信号通路相关基因表达的影响[J]. 动物营养学报, 2020, 32(6): 2816-2823. GUO X B, ZHOU T D, YANG J, et al. Effects of seaweed polysaccharides on expression of tight junction protein and related genes in nuclear transcription factor-κB signaling pathway in porcine epithelial cells[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2816-2823 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.042 |
| [15] |
萨仁娜. 海带岩藻聚糖分级纯化及对肉仔鸡巨噬细胞免疫调节的研究[D]. 博士学位论文. 北京: 中国农业科学院, 2007. SA R N. Isolation and purification of fucoidan from laminaria japonica and its immunomodulatory activities on broiler macrophage[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2008. (in Chinese) |
| [16] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
胡庭俊, 刘姗姗, 韦现色, 等. 马尾藻多糖纳米脂质体对鸡生长发育及免疫功能的影响[J]. 饲料工业, 2012, 33(3): 32-35. HU J T, LIU S S, WEI X S, et al. Effects of Sargassum nano-polysaccharide liposome on growth and immune function of chickens[J]. Feed Industry, 2012, 33(3): 32-35 (in Chinese). DOI:10.3969/j.issn.1001-991X.2012.03.009 |
| [18] |
杨晋. 海藻多糖替代抗生素对断奶仔猪生长性能和肠道屏障功能的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2019. YANG J. Effects of seaweed polysaccharide substitute for antibiotics on growth performance and intestinal barrier function of weaned piglets[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2019. (in Chinese) |
| [19] |
HEIM G, WALSH A M, SWEENEY T, et al. Effect of seaweed-derived laminarin and fucoidan and zinc oxide on gut morphology, nutrient transporters, nutrient digestibility, growth performance and selected microbial populations in weaned pigs[J]. British Journal of Nutrition, 2014, 111(9): 1577-1585. DOI:10.1017/S0007114513004224 |
| [20] |
MCALPINE P, O'SHEA C J, VARLEY P F, et al. The effect of seaweed extract as an alternative to zinc oxide diets on growth performance, nutrient digestibility, and fecal score of weaned piglets[J]. Journal of Animal Science, 2012, 90(Suppl.4): 224-226. |
| [21] |
孙福昱, 南雪梅, 唐志文, 等. 海藻在畜牧生产中的应用研究进展[J]. 中国畜牧兽医, 2019, 46(1): 157-165. SUN F Y, NAN X M, TANG Z W, et al. Research progress on seaweed application in animal husbandry production[J]. China Animal Husbandry and Veterinary Medicine, 2019, 46(1): 157-165 (in Chinese). |
| [22] |
MACFARLANE G T, HAY S, MACFARLANE S, et al. Effect of different carbohydrates on growth, polysaccharidase and glycosidase production by Bacteroides ovatus, in batch and continuous culture[J]. Journal of Applied Bacteriology, 1990, 68(2): 179-187. DOI:10.1111/j.1365-2672.1990.tb02564.x |
| [23] |
LEONARD S C, SWEENEY T BAHAR B, et al. Effect of maternal seaweed extract supplementation on suckling piglet growth, humoral immunity, selected microflora, and immune response after an ex vivo lipopolysaccharide challenge[J]. Journal of Animal Science, 2012, 90(2): 505-514. DOI:10.2527/jas.2010-3243 |
| [24] |
WALTER J. Ecological role of lactobacilli in the gastrointestinal tract: implications for fundamental and biomedical research[J]. Applied and Environmental Microbiology, 2008, 74(16): 4985-4996. DOI:10.1128/AEM.00753-08 |
| [25] |
万顺康, 左绍远, 张翠香. 螺旋藻多糖对肉仔鸡生长性能、免疫功能及生化指标的影响[J]. 饲料研究, 2013(9): 70-73. WAN S K, ZUO S Y, ZHANG C X. Effects of Spirulina polysaccharide on growth performance, immune function and biochemical indexes of broilers[J]. Feed Research, 2013(9): 70-73 (in Chinese). |
| [26] |
阎桂玲, 呙于明. 褐藻酸寡糖对肉鸡生长及免疫机能的影响[C]//动物营养与饲料研究: 第六次全国饲料营养学术研讨会论文集. 杨凌: 中国畜牧兽医学会动物营养学分会, 2010: 1. YAN G L, GUO Y M. Effect of alginate-oligosaccharides on growth performance and immunity in broilers[C]//Animal nutrition and feed research: Proceedings of the sixth national symposium on feed nutrition. Yangling: Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary Medicine, 2010: 1. (in Chinese) |
| [27] |
任颖朗, 季德胜, 张云林, 等. 龙须菜多糖的提取及其免疫调节活性研究[J]. 现代食品科技, 2017, 33(10): 45-51. REN Y L, JI D S, ZHANG Y L, et al. Extraction of polysaccharides from Gracilaria lemaneiformis and their immunoregulatory activity[J]. Modern Food Science and Technology, 2017, 33(10): 45-51 (in Chinese). |
| [28] |
王烨, 胡中泽. 海藻多糖对肉杂鸡免疫功能的影响[J]. 安徽农学通报, 2010, 16(17): 59-62, 70. WANG Y, HU Z Z. Effects of algae polysaccharides on the immune function of crossing chickens[J]. Anhui Agricultural Science Bulletin, 2010, 16(17): 59-62 (in Chinese). DOI:10.3969/j.issn.1007-7731.2010.17.027 |
| [29] |
LI W J, WEI F X, XU B, et al. Effect of stocking density and alpha-lipoic acid on the growth performance, physiological and oxidative stress and immune response of broilers[J]. Asian-Australasian Journal of Animal Sciences, 2019, 32(12): 1914-1922. DOI:10.5713/ajas.18.0939 |
| [30] |
宫春宇, 张慧君, 余世峰, 等. 龙须菜超滤多糖体外抗氧化活性研究[J]. 食品工业, 2012, 33(7): 92-94. GONG C Y, ZHANG H J, YU S F, et al. Antioxidant activity in vitro of polysaccharides from Gracilaria lemaneiformis[J]. The Food Industry, 2012, 33(7): 92-94 (in Chinese). |
| [31] |
杨文鸽, 谢果凰, 徐大伦, 等. 龙须菜多糖的降解及其降解产物的抗氧化活性[J]. 水产学报, 2009, 33(2): 342-347. YANG W G, XIE G H, XV D L, et al. Degradation of Gracilaria lemaneiform is polysaccharide and antioxidation of its degraded products[J]. Journal of Fisheries of China, 2009, 33(2): 342-347 (in Chinese). |
| [32] |
GUO D, YU K, SUN X Y, et al. Structural characterization and repair mechanism of Gracilaria lemaneiformis sulfated polysaccharides of different molecular weights on damaged renal epithelial cells[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 1-15. |
| [33] |
陈美珍, 余杰, 廖灶辉, 等. 龙须菜多糖抑瘤活性及对荷瘤小鼠抗氧化作用的研究[J]. 中国海洋药物, 2008, 27(2): 46-49. CHEN M Z, YU J, LIAO Z H, et al. Study on the antitumor activity and antioxidation of polysaccharide from Gracilaria lemaneiformis in sarcoma180 bearing mice[J]. Chinese Journal of Marine Drugs, 2008, 27(2): 46-49 (in Chinese). DOI:10.3969/j.issn.1002-3461.2008.02.011 |
| [34] |
王晓梅, 张忠山, 周俊波, 等. 龙须菜多糖的提取纯化及生物活性研究进展[J]. 海洋渔业, 2020, 42(1): 120-128. WANG X M, ZHANG Z S, ZHOU J B, et al. Research progress on extraction, purification and physiological activity of polysaccharides from Gracilaria lemaneiformis[J]. Marine Fisheries, 2020, 42(1): 120-128 (in Chinese). DOI:10.3969/j.issn.1004-2490.2020.01.013 |
| [35] |
石达友, 刘汉儒, 卓曲, 等. 中药提取物对鸡免疫器官发育和新城疫抗体水平的影响[J]. 中兽医学杂志, 2004(2): 4-5. SHI D Y, LIU H R, ZHUO Q, et al. Effects of Chinese herbal extracts on the development of immune organs and the level of antibodies against Newcastle disease in chickens[J]. Chinese Journal of Traditional Veterinary Science, 2004(2): 4-5 (in Chinese). DOI:10.3969/j.issn.1003-8655.2004.02.001 |
| [36] |
于敬沂. 几种海藻多糖的提取及其抗氧化、抗病毒(TMV)活性研究[D]. 硕士学位论文. 福州: 福建农林大学, 2005. YU J Q. Studies on the extraction and the activities of antioxidation and anti-virus(TMV) of polysaccharides from several sea algaes[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2005. (in Chinese) |
| [37] |
杨华, 庄陈丰. 响应面法优化微波辅助提取龙须菜多糖工艺及其抗氧化活性研究[J]. 食品科学, 2011, 32(20): 79-83. YANG H, ZHUANG C F. Gracilaria lamaneiformis polysaccharides: optimization of microwave-assisted extraction by response surface methodology and antioxidant properties[J]. Food Science, 2011, 32(20): 79-83 (in Chinese). |
| [38] |
SOUZA B W S, CERQUEIRA M A, BOURBON A I, et al. Chemical characterization and antioxidant activity of sulfated polysaccharide from the red seaweed Gracilaria birdiae[J]. Food Hydrocolloids, 2012, 27(2): 287-292. DOI:10.1016/j.foodhyd.2011.10.005 |
| [39] |
贾贺威. 龙须菜多糖抗肿瘤活性研究[D]. 硕士学位论文. 天津: 天津科技大学, 2016. JIA H W. The research on antitumor activity of polysaccharides from Gracilaria Lemaneiformis[D]. Master's Thesis. Tianjin: Tianjin University of Science and Technology, 2016. (in Chinese) |
| [40] |
OKAI Y, HIGASHI-OKAI K, ISHIZAKA S, et al. Possible immunodulating activities in an extract of edible brown alga, Hijikia fusiforme (Hijiki)[J]. Journal of the Science of Food and Agriculture, 1998, 76(1): 56-62. DOI:10.1002/(SICI)1097-0010(199801)76:1<56::AID-JSFA927>3.0.CO;2-L |
| [41] |
CHOI J H, KIM D I, PARK S H, et al. Effects of Sen tangle (Laminaria japonica) extract and fucoidan components on lipid metabolism of stressed mouse[J]. Korean Journal of Fisheries and Aquatic Sciences, 2000, 33(2): 124-128. |
| [42] |
BRITO T V, NETO J P R P, PRUDÊNCIO R S, et al. Sulfated-polysaccharide fraction extracted from red algae Gracilaria birdiae ameliorates trinitrobenzenesulfonic acid-induced colitis in rats[J]. Journal of Pharmacy and Pharmacology, 2014, 66(8): 1161-1170. DOI:10.1111/jphp.12231 |
| [43] |
SANJEEWA K K A, FERNANDO I P S, KIM E A, et al. Anti-inflammatory activity of a sulfated polysaccharide isolated from an enzymatic digest of brown seaweed Sargassum horneri in RAW 264.7 cells[J]. Nutrition Research and Practice, 2017, 11(1): 3-10. DOI:10.4162/nrp.2017.11.1.3 |
| [44] |
JOSE G M, KURUP G M. The efficacy of sulfated polysaccharides from Padina tetrastromatica in modulating the immune functions of RAW 264.7 cells[J]. Biomedicine & Pharmacotherapy, 2017, 88: 677-683. |
| [45] |
CHOI J I, RAGHAVENDRAN H R B, SUNG N Y, et al. Effect of fucoidan on aspirin-induced stomach ulceration in rats[J]. Chemico-Biological Interactions, 2010, 183(1): 249-254. DOI:10.1016/j.cbi.2009.09.015 |




