2. 北京农学院, 奶牛营养学北京市重点实验室, 北京 102206;
3. 山东银香伟业集团有限公司, 菏泽 274400;
4. 昌平区崔村动物防疫站, 北京 102200
2. Beijing Key Laboratory of Dairy Cow Nutrition, Beijing University of Agriculture, Beijing 102206, China;
3. Shandong Yinxiang Weiye Group Co., Ltd., Heze 274400, China;
4. Animal Epidemic Prevention Station of Cui Village of Changping District, Beijing 102200, China
采食固体饲料是促进犊牛瘤胃发育和从“非反刍”到“反刍”的必备条件,所以应尽可能增加犊牛对固体饲料的干物质采食量(DMI)[1-3]。大量研究表明,给哺乳期犊牛补饲干草相比于只饲喂精料会提高DMI,促进瘤胃健康,改善犊牛行为福利[4-7]。全混合日粮(TMR)可以增加奶牛对饲料的DMI,提高采食时间并且降低挑食率[8]。因此,饲喂TMR可以保证犊牛和泌乳牛一样摄入更均衡的营养物质和产生更好的瘤胃内环境,从而有助于犊牛瘤胃的健康。最新研究表明,哺乳期犊牛饲喂TMR在产生较大的淀粉采食量的同时不会对DMI和生长性能产生影响[9]。此外,哺乳期犊牛饲喂TMR不仅会对行为产生直接影响,而且还可能在其断奶后产生长期的有利影响[10]。但是,饲喂TMR的后备奶牛和泌乳牛均存在喜欢吃细粒度饲料的挑食行为[10]。影响挑食的因素包括粗饲料来源、粗饲料物理形态、饲料粒度和饲料水分含量等[11-14]。已有大量研究表明,饲料的物理形态以及水分和中性洗涤纤维(NDF)含量可影响犊牛的挑食、健康[15-18],但目前对哺乳期犊牛TMR粒度上尚缺乏数据支撑。随着优质粗饲料价格的上涨,大豆皮作为非牧草纤维也逐渐成为替代苜蓿和燕麦草的NDF来源之一,并且在断奶犊牛中产生了非常优异的效果[19]。不同NDF来源和粒度TMR是否会带来不同的饲养效果,是否会对犊牛采食行为产生影响?基于此疑问,本研究在20% NDF水平的基础上通过探究不同NDF来源(燕麦草和大豆皮)与粒度的TMR对哺乳期犊牛生长性能、血清生化指标和采食行为的影响,以期为哺乳期犊牛营养供给模式提供有力的依据。
1 材料与方法 1.1 试验时间与地点本试验于2020年5—7月在山东省银香伟业第二牧场进行,当地温度为18~31 ℃。
1.2 试验动物和设计选取(4.2±2.3)日龄和体重[(39.2±3.6) kg]相近的荷斯坦犊牛45头(27公18母),随机分配到3个组,每组15头(9公6母)。各组分别饲喂不同的TMR:长燕麦草TMR(长燕麦草组,LO组)、燕麦草粉TMR(燕麦草粉组,SO组)和大豆皮粉TMR(大豆皮粉组,SS组)。TMR根据NRC(2001)[20]配制且营养水平基本保持一致。TMR组成及营养水平见表 1。TMR中所有精料原料、燕麦草粉和大豆皮粉都经过3 mm的粉碎筛粉碎,长燕麦草是原燕麦草经TMR机搅拌25 min取得,3种粗饲料在宾州筛(PSPS)上的分层情况见表 2。
|
|
表 1 TMR组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of TMR (DM basis) |
|
|
表 2 3种粗饲料在宾州筛上的分层情况 Table 2 Delaminating of 3 kinds of forage in PSPS |
犊牛岛单栏饲养(长×高×宽=4.0 m×1.1 m×1.8 m),以稻壳为垫料并在每天15:00—16:00更换,以保证犊牛岛的干燥卫生。犊牛出生2 h内饲喂4 L初乳,8 h后再饲喂2 L。2日龄开始饲喂巴氏灭菌鲜奶(每天2次:08:00和18:00),2~20日龄饲喂4 L/d,21~30日龄饲喂5 L/d,31~56日龄饲喂6 L/d,57~63日龄逐渐断奶并结束试验。整个试验期间犊牛自由饮水,自由采食TMR。
1.4 测定指标和方法 1.4.1 TMR营养成分的测定TMR粉碎后,取少量的样品在105 ℃的烘箱中干燥6 h,测定干物质(DM)含量;采用FOSS全自动凯氏定氮仪(Kjeltec 8400,FOSS公司,丹麦)测定粗蛋白质(CP)含量;采用索氏提取法测定粗脂肪(EE)含量;取少量样品在550 ℃的马弗炉中完全燃烧6 h,测定粗灰分(Ash)含量;采用纤维仪(Fiber Analyzer 200,ANKOM公司,美国)测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量;采用高锰酸钾滴定法测定钙(Ca)含量;采用钼钒酸盐比色法测定磷(P)含量。所有营养成分的测定均参考AOAC(2002)[21]。
1.4.2 生长性能7日龄开始,每7 d晨饲前称取犊牛体重(14日龄除外),每14 d量取犊牛的体尺(胸围、腹围、体高、十字部高、体斜长和腰角宽)。试验期间每日记录TMR投料量和剩余量,用于计算DMI,并计算平均日增重(ADG)和饲料转化率。
1.4.3 血清生化指标21、35和49日龄晨饲前,每组选取6头体重相近的公犊牛进行颈静脉采血于10 mL不含抗凝剂的真空采血管中,1 500×g离心30 min后收集血清-80 ℃保存,用于测定血清生化指标。比色法(KHB-1280全自动生化分析仪,上海科华生物工程股份有限公司)测定血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)和尿素氮(UN)含量;酶联免疫吸附测定法(ST-360全自动酶标仪,上海科华生物工程股份有限公司)测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性和免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、β-羟基丁酸(BHBA)含量。试剂盒均采购于南京建成生物工程研究所。
1.4.4 挑食指数燕麦草、大豆皮、投喂的TMR(每10 d收集1次)和剩余的TMR样品(30日龄开始每10 d收集1次)用宾州筛进行分层分析。宾州筛将饲料分为4部分:>19.00 mm、8.00~19.00 mm、1.18~8.00 mm和<1.18 mm。100 ℃干燥24 h,测量各分离层的DM含量。物理有效因子(pef)为宾州筛总筛上物的DM含量,物理有效中性洗涤纤维(peNDF)为总筛上物的NDF含量乘以pef。挑食指数计算公式[16]如下:

|
挑食指数=1表示没有挑食行为,< 1表示选择性排斥,>1表示偏爱采食。为了测试犊牛是否对TMR挑食,从试验第30天开始直到结束,每10 d每组犊牛测定1次挑食指数。
1.4.5 行为观察分析采用高清红外摄像机(海康威视数码科技有限公司,50 Hz,25 fps)安装在犊牛岛前方2 m高的位置对犊牛进行实时监控。所有视频存储在5个硬盘中用于试验结束后的观察和数据采集。15和30日龄,每组选取6头犊牛记录当天24 h内所有的采食、反刍、站立、饮水和非营养性口腔行为(non-nutritive oral behavior,NNOB),每次采食和反刍行为必须大于10 s记为有效行为,当行为停止后2 min内不再出现,则认为此次行为结束。行为记录标准见表 3,记录方法和标准均参照Kargar等[16]。
|
|
表 3 行为记录标准 Table 3 Standard of recorded behaviors[16] |
试验数据采用R 4.0.3和GraphPad Prism 8软件进行分析和作图。生长性能、DMI、ADG、饲料转化率和挑食指数采用t检验方法分别对粒度和NDF来源进行分析。血清生化指标和行为学数据首先进行log10(X)的转化进而保证其符合正态分布,血清生化指标用MIXED模型对粒度和NDF来源进行分析,而行为学数据用t检验方法进行分析。P<0.05表示差异显著,0.05≤P<0.10表示有差异显著趋势。
2 结果 2.1 TMR粒度大小分布由表 4可知,仅有LO组的TMR在宾州筛的第1层和第2层出现,且LO组的TMR的peNDF>8.00 mm和peNDF>1.18 mm均显著高于SO组的TMR(P < 0.05),而SO组的TMR和SS组的TMR的peNDF>8.00 mm和peNDF>1.18 mm差异不显著(P>0.05),这符合本试验设计。
|
|
表 4 TMR粒度大小分布 Table 4 Particle size distribution of TMR |
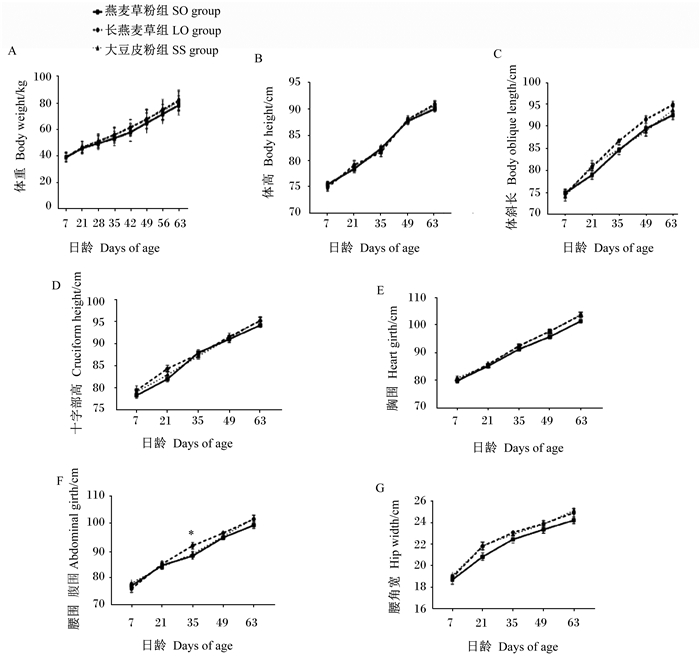
由图 1可知,不同NDF来源和粒度的TMR对犊牛体重无显著影响(P>0.05),不同NDF来源和粒度的TMR对犊牛体高、体斜长、十字部高、胸围和腰角宽均无显著影响(P>0.05)。35日龄时,LO组犊牛腹围有高于SO组的趋势(0.05≤P < 0.10)。
|
*表示有差异显著的趋势(0.05≤P < 0.10),无标注表示差异不显著(P>0.05)。图 2同。 *mean a significantly different trend (0.05≤P < 0.10), and no mark mean no significant difference (P>0.05). The same as Fig. 2. 图 1 不同NDF来源和粒度的TMR对犊牛体重和体尺的影响 Fig. 1 Effects of different NDF sources and particle sizes of TMR on body weight and body size of calves |
由表 5可知,LO组和SO组的各阶段饲料转化率无显著差异(P>0.05)。尽管SS组和SO组的断奶前和断奶中饲料转化率无显著差异(P>0.05),但是SS组全期饲料转化率显著高于SO组(P < 0.05)。不同NDF来源和粒度的TMR对犊牛DMI和ADG均无显著影响(P>0.05)。
|
|
表 5 不同NDF来源和粒度的TMR对犊牛生长性能的影响 Table 5 Effects of different NDF sources and particle sizes of TMR on growth performance of calves |
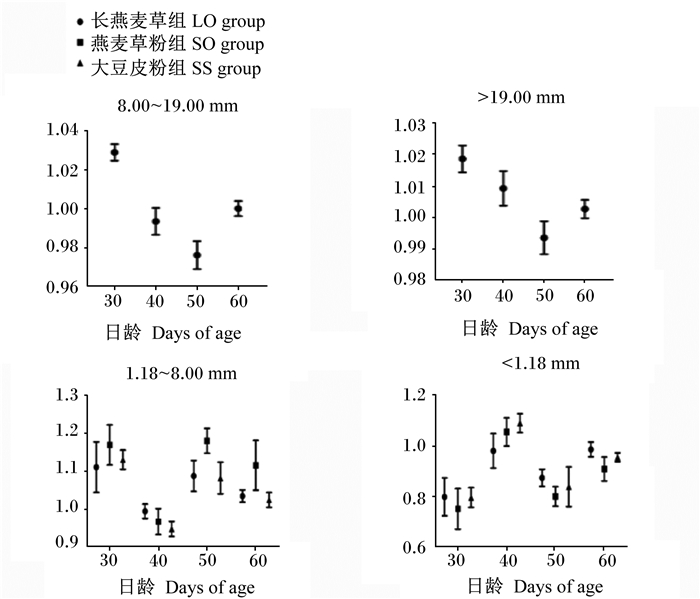
由图 2可知,不同NDF来源和粒度的TMR对犊牛挑食指数无显著影响(P>0.05)。随着犊牛日龄增长,各层挑食指数趋于1。
|
图 2 不同NDF来源和粒度的TMR对犊牛挑食指数的影响 Fig. 2 Effects of different NDF sources and particle sizes of TMR on sorting index of calves |
由表 6可知,从不同粒度的角度看,21日龄时,LO组的血清ALP活性显著高于SO组(P < 0.05),且血清AST活性有高于SO组的趋势(0.05≤P < 0.10);LO组和SO组的其他血清生化指标均无显著差异(P>0.05)。35日龄时,LO组和SO组的血清生化指标均无显著差异(P>0.05)。49日龄时,LO组的血清AST活性显著高于SO组(P < 0.05),且血清ALB活性有低于SO组的趋势(0.05≤P < 0.10);LO组和SO组的其他血清生化指标均无显著差异(P>0.05)。平均值来看,LO组的血清AST和ALP活性均显著高于SO组(P < 0.05),LO组和SO组的其他血清生化指标均无显著差异(P>0.05);不同粒度和日龄的交互作用不影响血清生化指标(P>0.05)。
|
|
表 6 不同NDF来源和粒度的TMR对犊牛血清生化指标的影响 Table 6 Effects of different NDF sources and particle sizes of TMR on serum biochemical indexes of calves |
从不同NDF来源的角度看,21和35日龄时,SO组和SS组的血清生化指标均无显著差异(P>0.05)。49日龄时,SO组的血清ALT活性显著高于SS组(P < 0.05),SO组和SS组的其他血清生化指标均无显著差异(P>0.05)。平均值来看,SS组的血清TP和GLB含量显著高于SO组(P < 0.05),SO组和SS组的其他血清生化指标均无显著差异(P>0.05);不同NDF来源和日龄的交互作用显著影响血清GLB含量(P < 0.05),有影响血清TP含量的趋势(0.05≤P < 0.10)。
2.5 不同NDF来源和粒度的TMR对犊牛行为指标的影响由表 7可知,15日龄时,LO组的NNOB时长有低于SO组的趋势(0.05≤P < 0.10),LO组的采食次数有高于SO组的趋势(0.05≤P < 0.10),而LO组和SO组的其他行为指标均无显著差异(P>0.05);SO组和SS组的行为指标均无显著差异(P>0.05)。30日龄时,SO组的饮水时长和NNOB时长均显著高于LO组(P < 0.05),而LO组和SO组的其他行为指标均无显著差异(P>0.05);SO组的反刍时长和饮水时长显著高于SS组(P < 0.05),SO组的反刍次数有高于SS组的趋势(0.05≤P < 0.10),SO组和SS组其他行为指标均无显著差异(P>0.05)。
|
|
表 7 不同NDF来源和粒度的TMR对犊牛行为指标的影响 Table 7 Effects of different NDF sources and particle sizes of TMR on behavior parameters of calves |
已有大量关于哺乳期犊牛补饲干草的研究[4, 7, 9],但以TMR形式饲喂哺乳期犊牛的研究甚少[9, 16]。本试验以任春燕等[18]和马满鹏等[19]的研究为基础,发现哺乳期犊牛饲喂不同NDF来源和粒度的TMR不会对生长性能造成显著的影响。35日龄时,饲喂长燕麦草TMR犊牛的腹围有高于饲喂燕麦草粉TMR犊牛的趋势,可能是由于35日龄犊牛的消化系统以及反刍行为发育不完全,长粒度的草在瘤胃中无法进一步磨碎消化导致堆积。相比于燕麦草粉TMR,长燕麦草TMR可导致犊牛腰角宽更高,这与Kargar等[22]发现的长粒度TMR会显著提高犊牛腰角宽的结果相同,但目前数据尚无法解释其原因,这也可能是未来需要关注的研究点。此外,本试验结果显示饲喂大豆皮粉TMR犊牛全期的饲料转化率相比饲喂燕麦草粉TMR犊牛显著升高,这可能是大豆皮和燕麦草相比含有更多的可消化纤维、可溶性的纤维,进而利于微生物进一步降解[19]。此外,Wang等[23]的研究表明,与燕麦草相比,饲喂大豆皮的断奶犊牛瘤胃会产生更多的总挥发性脂肪酸和丙酸,改变了瘤胃微生物区系以及代谢过程。大量的挥发性脂肪酸会刺激瘤胃的发育,提高饲粮的消化利用率。马满鹏等[19]的研究结果显示,相比于苜蓿草,断奶后犊牛饲粮中用大豆皮作为主要的NDF来源会显著地降低犊牛的料重比,这与本文研究结果有很好的衔接。哺乳期犊牛固体饲料的DMI低,但是断奶期间DMI有较大的提升,所以我们推测断奶后,随着犊牛对于TMR采食量的升高,大豆皮粉为主要NDF来源的TMR会有更高的饲料转化率。
3.2 不同NDF来源和粒度的TMR对犊牛挑食指数的影响挑食一直是奶牛科学界关注的问题,泌乳牛经常偏爱细颗粒饲料,导致瘤胃酸中毒的发生[24]。研究表明,生命早期的干预会对后期的行为产生巨大的影响[25]。幼龄时期是学习采食的关键时期,犊牛挑食现象在幼龄时期就已经形成[26]。Devries等[11]研究发现,断奶前饲喂干草突然改为饲喂TMR时,犊牛偏爱采食草颗粒,然而饲喂1个月后又开始偏爱精料,这可能与犊牛早期的“学习”有关。Kargar等[16]发现高湿度TMR会降低犊牛对中颗粒层的偏爱程度,这与本研究结果相似。本研究发现,犊牛对于长燕麦草TMR的高颗粒层和中颗粒层均存在不同程度的偏爱性。此外,犊牛对3种TMR均存在轻微的挑食现象,但均没有显著的差异,且随日龄的增长,挑食指数趋于1,这与Kargar等[16]研究结果相同。Costa等[27]认为幼龄犊牛学习的动力是由营养需要、瘤胃功能、咀嚼和反刍功能来进行驱动,且并通过反馈调节机制进行学习[28],所以本研究的结果也可能揭示了犊牛对平衡营养摄入和维持瘤胃内环境的自我学习过程。由于本研究没有进行断奶后犊牛试验,无法印证Devries等[11]的研究结果,这也需要通过进一步试验进行探究。
3.3 不同NDF来源和粒度的TMR对犊牛血清生化指标的影响ALT、AST和ALP是体现肝脏功能健康的重要指标。与成年反刍动物利用短链脂肪酸作为能量来源不同,哺乳期犊牛主要依赖于葡萄糖,犊牛可利用乳糖进行肝脏糖异生,此能力是成年牛的7~8倍[29-31]。肝脏糖异生的过程增加乳酸的消耗量,也可以保护犊牛免受瘤胃酸中毒的影响,同时,糖异生、脂肪酸β氧化和急性期反应均是相互关联的肝脏代谢过程,所以哺乳期犊牛肝脏的健康是至关重要的。本研究中,饲喂长燕麦草TMR犊牛的血清ALT、AST和ALP活性普遍高于饲喂燕麦草粉TMR犊牛,说明在正常饲喂的情况下,哺乳期犊牛饲喂长粒度饲料可能会对其肝脏造成一定的损伤。Chishti等[32]研究表明,与饲喂磨碎的燕麦草相比,长燕麦草会显著提高触珠蛋白(HPT)基因的表达。HPT是一种具有与血红蛋白结合能力的血浆蛋白,它是溶血的重要标志[33]。当红细胞被破坏后,HPT会大量产生以防止血管内溶血过程中的铁丢失和肾脏等损伤[33]。因此,哺乳期犊牛饲喂长粒度的TMR可能会造成肝脏红细胞的损伤,进而导致血清ALT、AST和ALP活性的升高。饲喂长燕麦草TMR犊牛在49日龄时血清ALB的含量显著低于饲喂燕麦草粉TMR犊牛,这与其他相关的研究结果[16]相似。ALB是由肝实质细胞合成,体现机体的免疫状态和肝脏健康[34]。血清ALB含量的显著降低可能与肝功能异常和蛋白质代谢有关。TP和GLB与机体的免疫力有很高的相关性。本研究中,饲喂大豆皮粉TMR犊牛的血清TP和GLB含量平均值显著高于饲喂燕麦草粉TMR犊牛。然而马满鹏等[19]认为大豆皮替代苜蓿不会影响断奶犊牛的血清GLB含量,这可能是由于哺乳期犊牛消化系统发育不完全,燕麦草的NDF比大豆皮难消化,进而导致肝脏的代谢障碍免疫力下降。总之,饲喂长燕麦草TMR犊牛的肝脏功能和免疫性能要劣于饲喂燕麦草粉TMR。
3.4 不同NDF来源和粒度的TMR对犊牛行为指标的影响犊牛行为是衡量其是否受到良好福利待遇的体现。NNOB是采食粗饲料受挫的补偿行为,是福利待遇差的表现[35]。本研究发现,饲喂长燕麦草TMR犊牛的NNOB显著低于饲喂燕麦草粉TMR犊牛。Castells等[4]发现补饲干草可以明显地减少犊牛的NNOB,也有研究表明补饲不同长度的干草以及不同湿度的TMR均会导致犊牛的NNOB显著变化[16],这也进一步说明粗饲料的粒度对减少犊牛的NNOB有重要作用。反刍是监控奶牛的良好指标,通常被认为是奶牛福利的标志行为,它与动物的生产性能和健康有很大的相关性[35-38]。研究表明,反刍行为时间长短与饲粮粒度的大小呈正相关,粒度越大奶牛的反刍时间越长[35]。然而本研究表明,饲喂燕麦草粉TMR犊牛的反刍次数和反刍时长均大于饲喂大豆皮粉TMR犊牛,且饲喂长燕麦草和饲喂燕麦草粉TMR的犊牛无显著差异。反刍行为是由瘤网胃壁的收缩而产生的,所以也可能受瘤胃发育和瘤胃微生物的调节[35]。本试验只对1月龄内的犊牛进行观察,目前关于大豆皮饲喂犊牛对行为的影响未见报道,但是可能由于大豆皮含有大量的可降解纤维,无法刺激瘤胃壁产生较多反刍行为,进而可能增加犊牛瘤胃酸中毒的风险。由于1月龄以内犊牛瘤胃发育和微生物定植不完全,导致瘤胃中小粒度的燕麦草滞留,反复刺激犊牛产生反刍行为。尽管在早期饲喂长燕麦草TMR犊牛的采食次数相对较多,但是其采食量与饲喂燕麦草粉TMR犊牛并无差异,这可能是由于饲喂长燕麦草TMR的犊牛进食速度减慢所致,说明饲喂短粒度的TMR比长粒度TMR犊牛进食更容易,这也与先前的研究结果[16]一致。本研究还发现,30日龄时饲喂燕麦草粉TMR犊牛的饮水时间最高,与Kargar等[16]的结果相反,可能是由于当天燕麦草粉TMR中含有较多的尘土;也有研究表明饲粮中的尘土会造成奶牛饮水量的上升[3]。总之,饲喂长粒度TMR会产生较少的NNOB,关于非饲草纤维作为主要NDF来源饲喂犊牛的行为学研究甚少,未来也是一个值得关注的研究点。
4 结论在本试验条件下,大豆皮粉替代燕麦草粉作为TMR的主要NDF来源对犊牛有着更好的饲料转化率,但是会减少反刍时长,增加瘤胃酸中毒的风险。从TMR粒度的角度看,长粒度TMR可减少犊牛NNOB,建议适当增加TMR粒度以保证犊牛的行为福利。
| [1] |
BEIRANVAND H, GHORBANI G R, KHORVASH M, et al. Interactions of alfalfa hay and sodium propionate on dairy calf performance and rumen development[J]. Journal of Dairy Science, 2014, 97(4): 2270-2280. DOI:10.3168/jds.2012-6332 |
| [2] |
PAZOKI A, GHORBANI G R, KARGAR S, et al. Growth performance, nutrient digestibility, ruminal fermentation, and rumen development of calves during transition from liquid to solid feed: effects of physical form of starter feed and forage provision[J]. Animal Feed Science and Technology, 2017, 234: 173-185. DOI:10.1016/j.anifeedsci.2017.06.004 |
| [3] |
ARZOLA-ÁLVAREZ C, BOCANEGRA-VIEZCA J A, MURPHY M R, et al. Particle size distribution and chemical composition of total mixed rations for dairy cattle: water addition and feed sampling effects[J]. Journal of Dairy Science, 2010, 93(9): 4180-4188. DOI:10.3168/jds.2009-2952 |
| [4] |
CASTELLS L, BACH A, ARAUJO G, et al. Effect of different forage sources on performance and feeding behavior of Holstein calves[J]. Journal of Dairy Science, 2012, 95(1): 286-293. DOI:10.3168/jds.2011-4405 |
| [5] |
OVERVEST M A, BERGERON R, HALEY D B, et al. Effect of feed type and method of presentation on feeding behavior, intake, and growth of dairy calves fed a high level of milk[J]. Journal of Dairy Science, 2016, 99(1): 317-327. DOI:10.3168/jds.2015-9997 |
| [6] |
HORVATH K C, MILLER-CUSHON E K. Evaluating effects of providing hay on behavioral development and performance of group-housed dairy calves[J]. Journal of Dairy Science, 102(11): 10411-10422. DOI:10.3168/jds.2019-16533 |
| [7] |
CASTELLS L, BACH A, ARIS A, et al. Effects of forage provision to young calves on rumen fermentation and development of the gastrointestinal tract[J]. Journal of Dairy Science, 2013, 96(8): 5226-5236. DOI:10.3168/jds.2012-6419 |
| [8] |
GRETER A M, LESLIE K E, MASON G J, et al. Effect of feed delivery method on the behavior and growth of dairy heifers[J]. Journal of Dairy Science, 2010, 93(4): 1668-1676. DOI:10.3168/jds.2009-2844 |
| [9] |
ENGELKING L E, MATSUBA T, INOUCHI K, et al. Effects of feeding hay and calf starter as a mixture or as separate components to Holstein calves on intake, growth, and blood metabolite and hormone concentrations[J]. Journal of Dairy Science, 2020, 103(5): 4423-4434. DOI:10.3168/jds.2019-17676 |
| [10] |
MILLER-CUSHON E K, DEVRIES T J. Effect of early feed type exposure on diet-selection behavior of dairy calves[J]. Journal of Dairy Science, 2011, 94(1): 342-350. DOI:10.3168/jds.2010-3382 |
| [11] |
DEVRIES T J, VON KEYSERLINGK M A G, BEAUCHEMIN K A. Frequency of feed delivery affects the behavior of lactating dairy cows[J]. Journal of Dairy Science, 2005, 88(10): 3553-3562. DOI:10.3168/jds.S0022-0302(05)73040-X |
| [12] |
LEONARDI C, GIANNICO F, ARMENTANO L E. Effect of water addition on selective consumption (sorting) of dry diets by dairy cattle[J]. Journal of Dairy Science, 2005, 88(3): 1043-1049. DOI:10.3168/jds.S0022-0302(05)72772-7 |
| [13] |
COSTA J H C, ADDERLEY N A, WEARY D M, et al. Short communication: effect of diet changes on sorting behavior of weaned dairy calves[J]. Journal of Dairy Science, 2016, 99(7): 5635-5639. DOI:10.3168/jds.2015-10052 |
| [14] |
MILLER-CUSHON E K, DEVRIES T J. Feeding amount affects the sorting behavior of lactating dairy cows[J]. Canadian Veterinary Journal, 2010, 90(1): 1-7. |
| [15] |
MONTORO C, MILLER-CUSHON E K, DEVRIES T J, et al. Effect of physical form of forage on performance, feeding behavior, and digestibility of Holstein calves[J]. Journal of Dairy Science, 2013, 96(2): 1117-1124. DOI:10.3168/jds.2012-5731 |
| [16] |
KARGAR S, KANANI M. Reconstituted versus dry alfalfa hay in starter feed diets of Holstein dairy calves: effects on feed intake, feeding and chewing behavior, feed preference, and health criteria[J]. Journal of Dairy Science, 2019, 102(5): 4061-4071. DOI:10.3168/jds.2018-15189 |
| [17] |
BACH A, GIMÉNEZ A, JUARISTI J L, et al. Effects of physical form of a starter for dairy replacement calves on feed intake and performance[J]. Journal of Dairy Science, 2007, 90(6): 3028-3033. DOI:10.3168/jds.2006-761 |
| [18] |
任春燕, 毕研亮, 郭艳丽, 等. 开食料中性洗涤纤维水平对犊牛生长性能、血清生化指标和抗氧化功能的影响[J]. 中国农业科学, 2020, 53(2): 440-450. REN C Y, BI Y L, GUO Y L., et al. Effects of NDF level of starter on growth performance, serum biochemical parameters and antioxidant[J]. Scientia Agricultura Sinica, 2020, 53(2): 440-450 (in Chinese). |
| [19] |
马满鹏, 王炳, 屠焰, 等. 不同中性洗涤纤维来源饲粮对荷斯坦公犊牛生长性能、消化代谢和血清生化指标的影响[J]. 动物营养学报, 2019, 31(6): 2682-2692. MA M P, WANG B, TU Y, et al. Effects of dietary different neutral detergent fiber sources on growth performance, digestion and metabolism and serum biochemical indexes of Holstein male calves[J]. Chinese Journal of Animal Nutrition, 2019, 31(6): 2682-2692 (in Chinese). |
| [20] |
NRC. Nutrient requirements of dairy cattle[S]. 7th rev. ed. Washington, D.C. : National Research Council, 2001.
|
| [21] |
AOAC International. Official methods of analysis[S]. 17th ed. Arlington, VA: AOAC International, 2002.
|
| [22] |
KARGAR S, KANANI M. Reconstituted versus dry alfalfa hay in starter feed diets of Holstein dairy calves: effects on growth performance, nutrient digestibility, and metabolic indications of rumen development[J]. Journal of Dairy Science, 2019, 102(5): 4051-4060. DOI:10.3168/jds.2018-15153 |
| [23] |
WANG B, MA M P, DIAO Q Y, et al. Saponin-induced shifts in the rumen microbiome and metabolome of young cattle[J]. Frontiers in Microbiology, 2019, 10: 356. DOI:10.3389/fmicb.2019.00356 |
| [24] |
LEONARDI C, ARMENTANO L E. Effect of quantity, quality, and length of alfalfa hay on selective consumption by dairy cows[J]. Journal of Dairy Science, 2003, 86(2): 557-564. DOI:10.3168/jds.S0022-0302(03)73634-0 |
| [25] |
ESTIMA C C P, BRUENING M, HANNAN P J, et al. A cross-cultural comparison of eating behaviors and home food environmental factors in adolescents from São Paulo (Brazil) and Saint Paul-Minneapolis (US)[J]. Journal of Nutrition Education and Behavior, 2014, 46(5): 370-375. DOI:10.1016/j.jneb.2014.01.007 |
| [26] |
MILLER-CUSHON E K, MONTORO C, BACH A, et al. Effect of early exposure to mixed rations differing in forage particle size on feed sorting of dairy calves[J]. Journal of Dairy Science, 2013, 96(5): 3257-3264. DOI:10.3168/jds.2012-6415 |
| [27] |
COSTA J H C, ADDERLEY N A, WEARY D M, et al. Short communication: effect of diet changes on sorting behavior of weaned dairy calves[J]. Journal of Dairy Science, 2016, 99(7): 5635-5639. DOI:10.3168/jds.2015-10052 |
| [28] |
PROVENZA F D. Postingestive feedback as an elementary determinant of food preference and intake in ruminants[J]. Journal of Range Management, 1995, 48(1): 2-17. DOI:10.2307/4002498 |
| [29] |
HAGA S, FUJIMOTO S, YONEZAWA T, et al. Changes in hepatic key enzymes of dairy calves in early weaning production systems[J]. Journal of Dairy Science, 2008, 91(8): 3156-3164. DOI:10.3168/jds.2007-0853 |
| [30] |
HAMMON H M, STEINHOFF-WAGNER J, SCHÖNHUSEN U, et al. Energy metabolism in the newborn farm animal with emphasis on the calf: endocrine changes and responses to milk-born and systemic hormones[J]. Domestic Animal Endocrinology, 2012, 43(2): 171-185. DOI:10.1016/j.domaniend.2012.02.005 |
| [31] |
DONKIN S S, ARMENTANO L E. Insulin and glucagon regulation of gluconeogenesis in preruminating and ruminating bovine[J]. Journal of Animal Science, 1995, 73(2): 546-551. DOI:10.2527/1995.732546x |
| [32] |
CHISHTI G A, SALFER I J, SUAREZ-MENA F X, et al. Short communication: relationships between physical form of oats in starter, rumen pH, and volatile fatty acids on hepatic expression of genes involved in metabolism and inflammation in dairy calves[J]. Journal of Dairy Science, 2020, 103(1): 439-446. DOI:10.3168/jds.2019-16296 |
| [33] |
VAN VLIERBERGHE H, LANGLOIS M, DELANGHE J. Haptoglobin polymorphisms and iron homeostasis in health and in disease[J]. Clinica Chimica Acta, 2004, 345(1/2): 35-42. |
| [34] |
QUINLAN G J, MARTIN G S, EVANS T W. Albumin: biochemical properties and therapeutic potential[J]. Hepatology, 2005, 41(6): 1211-1219. DOI:10.1002/hep.20720 |
| [35] |
王硕, 胡凤明, 刁其玉, 等. 奶牛反刍行为调控机制研究进展[J]. 动物营养学报, 2021, 33(4): 1869-1879. WANG S, HU F M, DIAO Q Y, et al. Research progress on regulation mechanism of ruminating behavior in dairy cows[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 1869-1879 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.008 |
| [36] |
JOHNSTON C, DEVRIES T J. Short communication: associations of feeding behavior and milk production in dairy cows[J]. Journal of Dairy Science, 2018, 101(4): 3367-3373. DOI:10.3168/jds.2017-13743 |
| [37] |
KAUFMAN E I, LEBLANC S J, MCBRIDE B W, et al. Association of rumination time with subclinical ketosis in transition dairy cows[J]. Journal of Dairy Science, 2016, 99(7): 5604-5618. DOI:10.3168/jds.2015-10509 |
| [38] |
KING M T M, DANCY K M, LEBLANC S J, et al. Deviations in behavior and productivity data before diagnosis of health disorders in cows milked with an automated system[J]. Journal of Dairy Science, 2017, 100(10): 8358-8371. DOI:10.3168/jds.2017-12723 |




