冷应激给北方或寒区的畜牧业带来了巨大损失,常导致畜禽幼仔免疫力及抗病能力下降,甚至死亡[1]。肠道是维持机体内环境稳态的先天性屏障。许多环境和生物应激源,包括辐射、热应激、脂多糖、各种药物和活性氧均可对肠上皮造成损害[2]。王雪洁等[3]研究发现,热应激可影响家禽的肠道结构,干扰肠道微微生态的平衡,抑制肠道免疫功能,破坏肠黏膜完整性,从而使家禽的生长和健康受到影响。研究表明,冷应激可引起鸡肠道免疫功能的改变,急性和慢性冷应激可导致肉鸡小肠中白细胞介素(IL)-2、γ-干扰素(IFN-γ)、IL-4、IL-17和转化生长因子-β4(TGF-β4)mRNA表达量随冷刺激时间的延长呈先升高后降低的趋势[4]。冷应激会促使体内许多生物活性分子参与到机体的调节中。核转录因子-κB(NF-κB)是一种快速诱导的转录因子,在炎症、细胞增殖和分化、免疫反应和基因诱导中有广泛的作用[5]。NF-κB家族中的转录因子在细胞的激活、生存和增殖中扮演着关键角色。它的异常活动可能导致癌症、免疫缺陷或自身免疫性疾病[6]。Ye等[7]研究表明小鼠NF-κB亚基p50缺失可改善冷应激诱导的肿瘤坏死因子-α(TNF-α)、巨噬细胞炎性蛋白-2(MIP-2)和细胞间黏附分子-1(ICAM-1)的表达,从而减少中性粒细胞的积聚和对胃黏膜的损伤。p65通过磷酸化、泛素化等作用对NF-κB进行转录激活,在炎症性疾病中发挥重要作用[8]。研究表明,TNF-α、p65表达量升高可导致结肠通透性增加,进而导致过度炎症免疫反应的发生[9]。肠道碱性磷酸酶(IAP)是一种经糖基磷脂酰肌醇键锚定于肠上皮细胞顶膜上的糖蛋白,在肠黏膜屏障的维护中发挥着重要作用,包括调节十二指肠表面pH、解除脂多糖和游离核苷酸的毒性、抑制肠道炎性反应、调节肠道菌群等[10]。Ferencz等[11]研究发现小肠组织中存在的垂体腺苷酸环化酶激活多肽-38(PACAP-38)在预防肠冷保存损伤中具有关键作用,冷应激会破坏PACAP-38缺陷小鼠的黏膜、黏膜下层和隐窝。近年来,冷刺激对肠道影响的研究较多,但急性冷刺激对断奶仔猪十二指肠NF-κB/IAP信号通路的研究鲜有报道。为了进一步探究冷刺激对断奶仔猪肠道的影响机制,本研究采用人工气候室,从肠道形态观察入手,研究不同冷刺激时间对断奶仔猪十二指肠形态结构的影响,并检测十二指肠NF-κB/IAP信号通路关键蛋白p65、核转录因子抑制蛋白(IκB)、磷酸化IκB(p-IκB)及IAP的表达情况,旨在从分子层面探讨急性冷刺激对断奶仔猪十二指肠损伤的机制,并探究急性冷刺激下NF-κB/IAP信号通路对十二指肠的保护作用,为早期检测和防治北方寒冷地区仔猪冷刺激肠道疾病提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试验动物选取16头体况相近、健康的30日龄“杜×长×大”三元杂交断奶仔猪,随机分成4组,每组4个重复,每个重复1头猪。按照《国家实验动物饲养管理条例》,在人工智能气候室内预饲7 d,常规饲养管理,正常饲喂,正常饮水。
1.1.2 主要试剂RIPA裂解液(强,P0013B)、BCA蛋白浓度测定试剂盒(P0010S)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒(P0012A)、SDS-PAGE 5X蛋白上样缓冲液(P0015)均购自碧云天公司。β-肌动蛋白(β-actin)免疫印迹所用的一抗鼠抗单克隆抗体(1 ∶ 15 000,60008-1-Ig)、NF-κB p65免疫印迹所用的一抗兔抗单克隆抗体(1 ∶ 2 000,10745-1-AP)以及IκB-α(1 ∶ 2 000,51066-1-AP)、辣根过氧化物酶标记的山羊抗鼠IgG(1 ∶ 10 000,SA00001-1),辣根过氧化物酶标记的山羊抗兔IgG(1 ∶ 10 000,SA00001-2)均购自武汉三鹰生物技术有限公司。p-IκBα(1 ∶ 1 000,#2859)购自CST(Cell Signaling Technology)公司。IAP(1 ∶ 3 000,ab97532)购自Abcam公司。
1.2 试验方法 1.2.1 冷刺激试验4组分别为对照组、急性冷刺激2 h组、急性冷刺激6 h组和急性冷刺激12 h组。采用人工气候室内模拟冬季寒冷气候,3个急性冷刺激组断奶仔猪在温度为(4±2) ℃的人工气候室中分别饲养2、6、12 h,而对照组断奶仔猪饲养于温度为(24±2) ℃的环境中,相对湿度维持在40%~50%。
1.2.2 切片制作及测定分别在冷刺激0(对照组)、2、6、12 h后将断奶仔猪在室温中屠宰,取十二指肠中段,生理盐水冲洗后,固定于4%甲醛固定液中,制作石蜡切片并进行苏木精-伊红(HE)染色,在光镜下观察肠组织病理变化,采用图像分析系统观测肠道绒毛高度和隐窝深度。
1.2.3 Western-blot法检测十二指肠NF-κB/IAP信号通路关键蛋白表达情况屠宰后取十二指肠,用冰生理盐水冲洗干净,并在十二指肠中段取5 cm样品装于1.5 mL离心管中,液氮冻存。液氮速冻后-80 ℃低温冰箱保存。将十二指肠组织解冻后,用裂解液提取总蛋白,用BCA蛋白浓度试剂盒测定蛋白质浓度,100 ℃煮10 min。SDS-PAGE分离后转印至聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭1 h,4 ℃一抗过夜,次日TBST冲洗膜3次,每次10 min,二抗(1 ∶ 10 000)室温孵育1 h,l×TBST冲洗膜3次,显色液显色。用ChemiDoc XRS(伯乐)成像系统成像,测定样品灰度值,Image Lab分析目标条带的灰度值,并计算目的蛋白的相对表达量。
1.3 数据处理与分析试验数据采用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),结果用平均值±标准差表示,以P < 0.05表示差异显著,P < 0.01表示差异极显著。
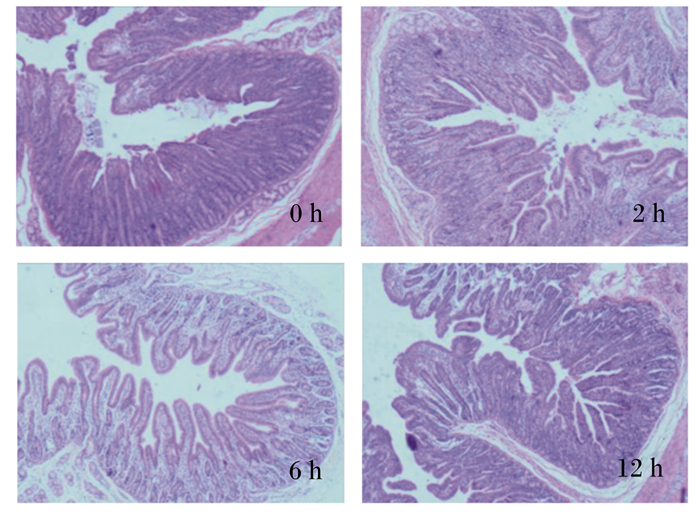
2 结果与分析 2.1 急性冷刺激对断奶仔猪十二指肠组织结构的影响从图 1可见,对照组仔猪十二指肠组织结构完整,绒毛排列紧密,急性冷刺激组肠绒毛出现断裂和少数上皮细胞变性脱落现象,肠绒毛排列稀疏。表 1显示,3个急性冷刺激组十二指肠绒毛高度、隐窝深度和绒毛高度/隐窝深度均发生了变化。与对照组相比,急性冷刺激2和6 h后,断奶仔猪十二指肠绒毛高度降低,差异不显著(P>0.05);急性冷刺激12 h后,断奶仔猪十二指肠绒毛高度显著降低(P < 0.05)。与对照组相比,急性冷刺激2、6和12 h后十二指肠隐窝深度及绒毛高度/隐窝深度均下降,但差异不显著(P>0.05)。
|
图 1 各组十二指肠组织结构 Fig. 1 Histology structure of duodenum of each group (40×) |
|
|
表 1 急性冷刺激对断奶仔猪十二指肠黏膜形态的影响 Table 1 Effects of acute cold stimulation on duodenal mucosal morphology of weaned piglets (n=4) |
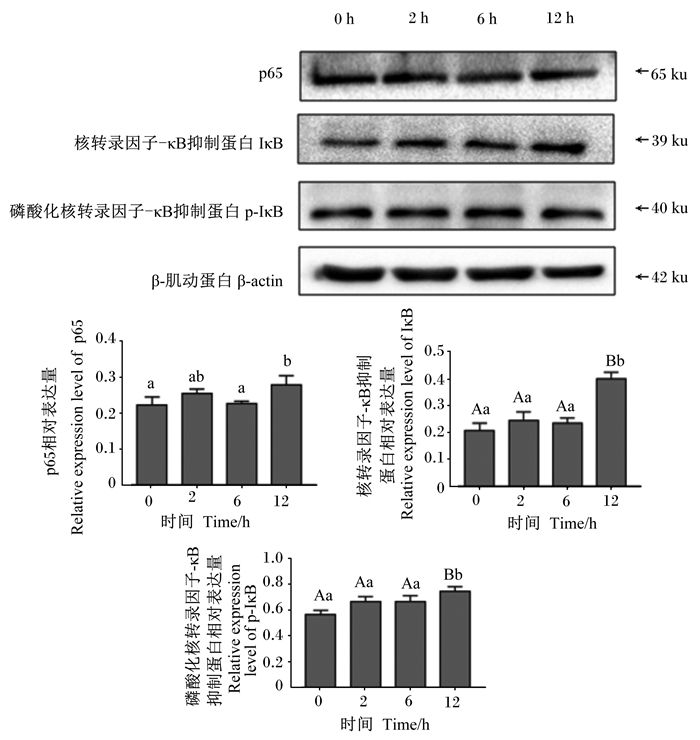
如图 2所示,与对照组相比,急性冷刺激2 h时十二指肠中p65相对表达量升高,但差异不显著(P>0.05);急性冷刺激6 h时十二指肠中p65相对表达量基本恢复到冷刺激前(对照组)水平。急性冷刺激12 h时,十二指肠中p65相对表达量与对照组和急性冷刺激6 h时相比显著升高(P < 0.05)。与对照组相比,急性冷刺激2和6 h时十二指肠中IκB相对表达量有增加的趋势,但差异不显著(P>0.05);急性冷刺激12 h时十二指肠中IκB相对表达量与对照组和急性冷刺激2和6 h时相比极显著增加(P < 0.01)。急性冷刺激2和6 h时十二指肠中p-IκB相对表达量与对照组相比略有增加,差异不显著(P>0.05);急性冷刺激12 h时十二指肠中p-IκB相对表达量与对照组相比极显著增加(P < 0.01)。上述结果表明急性冷刺激能够影响断奶仔猪十二指肠NF-κB信号通路的活化,促进通路蛋白的表达。
|
数据标注不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01),相同小写字母表示差异不显著(P>0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05), and with different capital letters mean extremely significant difference (P < 0.01), while with the same small letters mean no significant difference (P>0.05). The same as below. 图 2 急性冷刺激对断奶仔猪十二指肠中NF-κB信号通路关键蛋白表达的影响 Fig. 2 Effects of acute cold stimulation on expression of key proteins in NF-κB signaling pathway in duodenum of weaned piglets (n=4) |
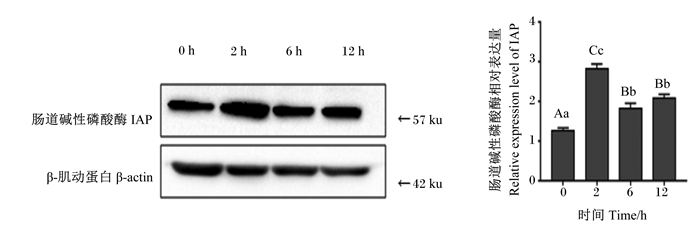
如图 3所示,与对照组相比,急性冷刺激2、6和12 h时,十二指肠中IAP相对表达量极显著升高(P < 0.01)。与急性冷刺激2 h时相比,急性冷刺激6和12 h时十二指肠中IAP相对表达量极显著降低(P < 0.01)。与急性冷刺激6 h时相比,急性冷刺激12 h时十二指肠中IAP相对表达量略有升高,差异不显著(P>0.05)。
|
图 3 急性冷刺激对断奶仔猪十二指肠IAP表达的影响 Fig. 3 Effects of acute cold stimulation on IAP expression in duodenum of weaned piglets (n=4) |
越来越多的流行病学证据表明,异常的环境温度可增加动物的死亡风险[12]。过强刺激会使机体产生免疫功能改变、胃肠溃疡等病理现象[13]。有研究表明,长期冷刺激会促使雏鸡的十二指肠和腺胃充血,同时经常遭受冷刺激也会导致胃肠道溃疡等病症[14]。在急性冷刺激对肠道组织结构影响的研究中,高静雯等[15]研究表明,冷应激可导致绵羊空肠、回肠和十二指肠的组织结构发生相应的变化,主要表现为回肠绒毛变短变粗。强冷应激会抑制绵羊机体抗炎症反应及免疫机能的调节。在本研究中发现断奶仔猪十二指肠绒毛高度、隐窝深度和绒毛高度/隐窝深度均受到了急性冷刺激不同程度的影响。与对照组相比,急性冷刺激6和12 h时,断奶仔猪十二指肠绒毛高度变短,隐窝深度变浅,且急性冷刺激12 h时断奶仔猪十二指肠绒毛高度显著降低,说明急性冷刺激对断奶仔猪十二指肠组织结构产生了一定的损伤。吕建伟等[16]将小鼠长期置于低温条件下,结果表明冷刺激会降低其十二指肠肠壁和肠道组织截面积,但显著增加了绒毛高度。计红等[17]研究表明,急性冷刺激12 h对大鼠肾脏、胃壁黏膜均有损伤,但十二指肠组织结构没有明显变化。上述研究与本试验研究结果不完全一致,可能是由于动物种属不同所致。
3.2 急性冷刺激对断奶仔猪十二指肠NF-κB信号通路的影响家畜应激与免疫调节之间的平衡对家畜健康和生产力具有重要影响[18]。NF-κB是细胞核内重要的转录调节因子,是细胞应激应答、炎症反应和免疫应答的重要调节者。NF-κB被激活后与IκB解离并易位入核,结合靶基因增强子/启动子上的κB位点,从而调控靶基因的表达[19]。Shi等[20]研究发现,当小鼠冷暴露2 h后,NF-κB被激活,p65的磷酸化也被激活。Lian等[21]研究表明,妊娠期冷应激可诱发胎盘细胞凋亡,并激活胎盘热休克蛋白70(HSP70)/Toll样受体4(TLR4)/NF-κB信号通路,进而影响胎儿胎盘的功能和发育。产前冷应激可促进妊娠母鼠肝脏中p65、HSP70的表达,进而产生炎症反应[22]。Fu等[23]研究表明,急性和慢性冷应激均可引起鹌鹑十二指肠、空肠和回肠的炎症反应,在急性和慢性冷应激下空肠、回肠和十二指肠的NF-κB mRNA表达量升高,TNF-α mRNA表达量降低。本试验结果显示,在断奶仔猪十二指肠中,急性冷刺激2 h时,p65、IκB及p-IκB相对表达量与对照组相比略有升高,说明急性冷刺激2 h对断奶仔猪十二指肠造成了一定损伤,十二指肠产生了炎症;急性冷刺激6 h时,p65相对表达量基本恢复到冷刺激前水平,说明急性冷刺激使仔猪肠道产生炎症反应后,机体通过激活全身炎症反应和内部的抗炎效应来防止过度的炎症反应,机体通过自身免疫调节使炎症反应有所恢复;与对照组和急性冷刺激6 h时相比,急性冷刺激12 h时p65、IκB及p-IκB相对表达量均显著升高。由此可以推断,急性冷刺激激活NF-κB信号通路,并通过调节NF-κB信号通路对肠道造成一定损伤,之后机体通过自身免疫调节使炎症反应有所恢复,继续延长冷刺激时间,则急性冷刺激又重新对十二指肠产生损伤,表明在急性冷刺激时,断奶仔猪的免疫机能调节及抗炎症反应等功能均受到抑制。据报道,冷应激与免疫系统及补体系统有关,可导致局部和全身的损伤[24]。
3.3 急性冷刺激对断奶仔猪十二指肠IAP信号通路的影响IAP在调节十二指肠表面pH、肠道内细菌脂多糖(LPS)解毒、减少体内LPS毒性、控制肠道炎症、防止体内细菌跨黏膜通道等方面均具有关键作用[25]。研究表明坏死性小肠结肠炎与IAP的表达和活性降低有关。IAP是一种内源性蛋白,已被证明能灭活LPS,最近已成功地作为一种辅助治疗成人脓毒症的药物[26]。Rentea等[27]研究表明,早期肠内补充IAP可减轻坏死性小肠结肠炎相关性肠道损伤,有助于维持肠上皮屏障功能。早期断奶仔猪肠道容易受到感染,发生腹泻,造成生长迟缓,部分原因可能是空肠黏膜IAP的保护作用和功能减弱所致[28]。本试验结果显示,急性冷刺激能够极显著提高十二指肠中IAP的表达,并且,与急性冷刺激2 h时相比,急性冷刺激6和12 h时十二指肠中IAP相对表达量极显著降低。IAP是断奶仔猪肠道健康的促进因子,机体会通过提高IAP的表达进行自身的炎症调节。与急性冷刺激6 h时相比,急性冷刺激12 h时十二指肠中IAP相对表达量略有升高。由此可以推断急性冷刺激6 h时机体自身对损伤进行了一定的调节,急性冷刺激12 h时又重新对十二指肠产生了损伤。
4 结论急性冷刺激造成了断奶仔猪十二指肠黏膜结构的损伤,使绒毛高度变短,隐窝深度变浅,这是引起断奶仔猪消化吸收功能障碍的形态学基础;急性冷刺激使断奶仔猪十二指肠中NF-κB/IAP信号通路被激活,上调了p65、IκB、p-IκB和IAP的表达,进而导致断奶仔猪十二指肠产生一定的炎症反应。
| [1] |
张冬杰, 刘娣, 别墅, 等. 利用Affymetrix芯片分析民猪冷应激后肌肉组织的基因表达谱[J]. 畜牧兽医学报, 2011, 42(12): 1661-1665. ZHANG D J, LIU D, BIE S, et al. Gene expression analysis upon cold induced by affymetrix pig chip[J]. Chinese Journal of Animal and Veterinary Sciences, 2011, 42(12): 1661-1665 (in Chinese). |
| [2] |
冯燕海, 黄亚兰, 王裴, 等. 短链脂肪酸对内毒素/脂多糖引起的人肠上皮细胞屏障功能损害的作用及相关机制[J]. 中华烧伤杂志, 2018, 34(4): 214-218. FENG Y H, HUANG Y L, WANG P, et al. Effects of short-chain fatty acids on endotoxin/lipopolysaccharide induced barrier function impairment in human intestinal epithelial cells and related mechanisms[J]. Chinese Journal of Burns, 2018, 34(4): 214-218 (in Chinese). DOI:10.3760/cma.j.issn.1009-2587.2018.04.005 |
| [3] |
王雪洁, 冯京海. 热应激对家禽肠道黏膜结构的影响及可能原因[J]. 动物营养学报, 2018, 30(4): 1224-1229. WANG X J, FENG J H. Effects of heat stress on intestinal mucosal structure and function of poultry and its possible reasons[J]. Chinese Journal of Animal Nutrition, 2018, 30(4): 1224-1229 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.04.003 |
| [4] |
ZHAO F Q, ZHANG Z W, YAO H D, et al. Effects of cold stress on mRNA expression of immunoglobulin and cytokine in the small intestine of broilers[J]. Research in Veterinary Science, 2013, 95(1): 146-155. DOI:10.1016/j.rvsc.2013.01.021 |
| [5] |
ZHANG Q, LENARDO M J, BALTIMORE D. 30 years of NF-κB: a blossoming of relevance to human pathobiology[J]. Cell, 2017, 168(1/2): 37-57. |
| [6] |
BLONSKA M, LIN X. NF-κB signaling pathways regulated by CARMA family of scaffold proteins[J]. Cell Research, 2011, 21(1): 55-70. DOI:10.1038/cr.2010.182 |
| [7] |
YE B, ZHOU P Y, JIA M, et al. Absence of NF-κB subunit p50 ameliorates cold immobilization stress-induced gastric ulcers[J]. Biochemical and Biophysical Research Communications, 2013, 434(3): 547-551. DOI:10.1016/j.bbrc.2013.03.112 |
| [8] |
李毅斌, 蔡军伟, 刘靖华. RelA/p65的翻译后修饰及其对NF-κB转录活性的影响[J]. 中国生物化学与分子生物学报, 2012, 28(11): 977-983. LI Y B, CAI J W, LIU J H. Post-translational modification of RelA/p65 in regulating NF-κB transcriptional activities[J]. Chinese Journal of Biochemistry and Molecular Biology, 2012, 28(11): 977-983 (in Chinese). |
| [9] |
李士泽, 袁学军, 杨玉英, 等. 冷暴露对健康雏鸡某些血液生化指标及胃肠道黏膜充血的影响[J]. 中国应用生理学杂志, 2002, 18(2): 148, 198. LI S Z, YUAN X J, YANG Y Y, et al. Effects of cold exposure on some blood biochemical indexes and gastrointestinal mucosal congestion in healthy chicks[J]. Chinese Journal of Applied Physiology, 2002, 18(2): 148, 198 (in Chinese). |
| [10] |
毕景成, 王新颖, 黎介寿. 肠碱性磷酸酶在肠屏障中作用的研究进展[J]. 肠外与肠内营养, 2015, 24(4): 244-247. BI J C, WANG X Y, LI J S. Research progresses of intestinal alkaline phosphatase in intestinal barrier maintenance[J]. Parenteral & Enteral Nutrition, 2015, 24(4): 244-247 (in Chinese). |
| [11] |
FERENCZ A, WEBER G, HELYES Z, et al. Presence of endogenous PACAP-38 ameliorated intestinal cold preservation tissue injury[J]. Journal of Molecular Neuroscience, 2010, 42(3): 428-434. DOI:10.1007/s12031-010-9352-y |
| [12] |
SONG X P, WANG S G, HU Y L, et al. Impact of ambient temperature on morbidity and mortality: an overview of reviews[J]. Science of the Total Environment, 2017, 586: 241-254. DOI:10.1016/j.scitotenv.2017.01.212 |
| [13] |
李士泽, 袁学军, 杨玉英, 等. 浸水冷应激对雏鸡某些酶活性及消化道黏膜充血的影响[J]. 应用与环境生物学报, 2001, 7(3): 267-270. LI S Z, YUAN X J, YANG Y Y, et al. Effect of cold stress by immersing in water on some enzyme activities and digestive tract mucosal hyperemia in chicken[J]. Chinese Journal of Applied and Environmental Biology, 2001, 7(3): 267-270 (in Chinese). DOI:10.3321/j.issn:1006-687X.2001.03.016 |
| [14] |
黄循铷, 王承党, 王瑞幸, 等. 溃疡性结肠炎小鼠肠道通透性改变与TNF-α及NF-κBp65的关系[J]. 中国应用生理学杂志, 2016, 32(2): 112-115. HUANG X R, WANG C D, WANG R X, et al. Changes of colonic permeability and its correlation with TNF-α, NF-κBp65 in ulceration colitis mice[J]. Chinese Journal of Applied Physiology, 2016, 32(2): 112-115 (in Chinese). |
| [15] |
高静雯, 汪骁轩, 魏殿华, 等. 强冷应激对阿勒泰羔羊血清IgG、皮质醇及小肠免疫相关细胞的影响[J]. 中国兽医学报, 2019, 39(5): 967-974. GAO J W, WANG X X, WEI D H, et al. Effect of severe cold stress on serum IgG, cortisol concentration and intestinal immune-related cells in Altay lambs[J]. Chinese Journal of Veterinary Science, 2019, 39(5): 967-974 (in Chinese). |
| [16] |
吕建伟, 李小鹏, 谢振丽, 等. 小鼠肠道组织结构在低温环境下的适应性调整[J]. 生态学报, 2018, 38(23): 8660-8665. LU J W, LI X P, XIE Z L, et al. Morphological and histological plasticity in digestive tracts of cold-acclimated Kunming laboratory mice[J]. Acta Ecologica Sinica, 2018, 38(23): 8660-8665 (in Chinese). |
| [17] |
计红, 詹雪龙, 薛琳琳, 等. 急性冷刺激对大鼠骨骼肌和7个内脏器官的组织结构影响[J]. 中国兽医学报, 2019, 39(1): 105-112. JI H, ZHAN X L, XUE L L, et al. Effects of cold stimulus on the histology structure of skel-etal muscle and seven visceral organs in rats[J]. Chinese Journal of Veterinary Science, 2019, 39(01): 105-112 (in Chinese). |
| [18] |
CARROLL J A, BURDICK N C, CHASE C C, Jr, et al. Influence of environmental temperature on the physiological, endocrine, and immune responses in livestock exposed to a provocative immune challenge[J]. Domestic Animal Endocrinology, 2012, 43(2): 146-153. DOI:10.1016/j.domaniend.2011.12.008 |
| [19] |
姜一弘, 张丹, 张天择, 等. 核因子κB(NF-κB)信号通路在炎症与肿瘤中作用的研究进展[J]. 细胞与分子免疫学杂志, 2018, 34(12): 78-83. JIANG Y H, ZHANG D, ZHANG T Z, et al. Research progress of nuclear factor-κB (NF-κB) signaling pathway in inflammation and tumor[J]. Chinese Journal of Cellular and Molecular Immunology, 2018, 34(12): 78-83 (in Chinese). |
| [20] |
SHI H Z, YAO R Z, LIAN S, et al. Regulating glycolysis, the TLR4 signal pathway and expression of RBM3 in mouse liver in response to acute cold exposure[J]. Stress, 2019, 22(3): 366-376. DOI:10.1080/10253890.2019.1568987 |
| [21] |
LIAN S, GUO J R, WANG L P, et al. Impact of prenatal cold stress on placental physiology, inflammatory response, and apoptosis in rats[J]. Oncotarget, 2017, 8(70): 115304-115314. DOI:10.18632/oncotarget.23257 |
| [22] |
李文杰, 连帅, 李悦, 等. 产前冷应激对妊娠母鼠肝脏HSP70和P65的影响[J]. 中国兽医学报, 2018, 38(10): 1952-1955. LI W J, LIAN S, LI Y, et al. Effects of prenatal cold stress on HSP70 and P65 in rat liver[J]. Chinese Journal of Veterinary Science, 2018, 38(10): 1952-1955 (in Chinese). |
| [23] |
FU J, LIU C P, ZHANG Z W. Influence of inflammatory pathway markers on oxidative stress induced by cold stress in intestine of quails[J]. Research in Veterinary Science, 2013, 95(2): 495-501. DOI:10.1016/j.rvsc.2013.05.006 |
| [24] |
CAI J Y, ZHAO C Y, DU Y J, et al. Amentoflavone ameliorates cold stress-induced inflammation in lung by suppression of C3/BCR/NF-κB pathways[J]. BMC Immunology, 2019, 20(1): 49. DOI:10.1186/s12865-019-0331-y |
| [25] |
LALLōS J P. Intestinal alkaline phosphatase: multiple biological roles in maintenance of intestinal homeostasis and modulation by diet[J]. Nutrition Reviews, 2010, 68(6): 323-332. DOI:10.1111/j.1753-4887.2010.00292.x |
| [26] |
RIGGLE K M, RENTEA R M, WELAK S R, et al. Intestinal alkaline phosphatase prevents the systemic inflammatory response associated with necrotizing enterocolitis[J]. Journal of Surgical Research, 2013, 180(1): 21-26. DOI:10.1016/j.jss.2012.10.042 |
| [27] |
RENTEA R M, LIEDEL J L, WELAK S R, et al. Intestinal alkaline phosphatase administration in newborns is protective of gut barrier function in a neonatal necrotizing enterocolitis rat model[J]. Journal of Pediatric Surgery, 2012, 47(6): 1135-1142. DOI:10.1016/j.jpedsurg.2012.03.018 |
| [28] |
LACKEYRAM D, YANG C, ARCHBOLD T, et al. Early weaning reduces small intestinal alkaline phosphatase expression in pigs[J]. The Journal of Nutrition, 2010, 140(3): 461-468. DOI:10.3945/jn.109.117267 |




