畜禽的健康极易受到外界各种病原体或非病原体的侵害,促使机体通过一系列代谢行为和神经内分泌的改变来适应新的环境以达到新的动态平衡。在此过程中,畜禽往往会出现精神萎靡、嗜睡、食欲不振,使饲粮中部分用于生长发育的营养物质转而用于维持动物机体的免疫反应,进而导致畜禽的生长发育缓慢,引起免疫应激[1]。此外,过度的应激反应会产生一些有害代谢产物残留在肉类及肉制品中,导致肉品质严重下降[2]。由此可见,免疫应激不仅影响肉仔鸡生长发育,对消费者的健康也有一定的影响。因此,通过绿色无污染的营养调控措施来缓解免疫应激引起的肉仔鸡的机体损伤,从而发挥治疗和缓解作用是较为理想的选择。
黑沙蒿广泛分布于我国内蒙古和陕西等西北地区,是一种较为常见的可防风固沙的菊科蒿属植物。黑沙蒿在医药领域的应用有着悠久的历史,具有消炎散肿、宽胸利气和止血的作用,在农业方面还具有杀虫等功效[3]。研究表明,在饲粮中添加750 mg/kg黑沙蒿多糖(AOP)可显著改善肉仔鸡的生长性能,而这可能与其促进营养物质代谢、改善肠黏膜形态、提高消化酶活性有关[4]。在反刍动物上的研究发现,添加3% AOP可改善反刍动物瘤胃的发酵,提高对营养物质的有效降解,从而改善其生长性能[5]。在啮齿类动物上也有类似发现,在大鼠饲粮中添加300 mg/kg AOP可提高大鼠平均日增重[6]。有研究者以小鼠腹腔巨噬细胞为载体评价了沙蒿多糖的免疫调节活性,结果发现,沙蒿多糖可激活巨噬细胞,提高巨噬细胞中氧自由基和一氧化氮(NO)的含量,并提高促炎因子肿瘤坏死因子-α(TNF-α)和白细胞介素(IL)-6的含量,其具体调控机制为沙蒿多糖被巨噬细胞膜表面的Toll样受体4(TLR4)识别后,将其信号转到胞内,随后激活丝裂原活化蛋白激酶(MAPK)/磷酸肌醇3-激酶(PI3K)/蛋白激酶B(AKT)和核转录因子-κB(NF-κB)p65信号通路,进而发挥其免疫调节活性[7]。
畜禽生长(尤其是早期生长)由于受环境和营养应激等因素的影响,极易损伤肠道屏障,降低免疫机能,造成生长阻滞,甚至导致死亡。研究表明,肉仔鸡注射脂多糖(LPS)后激活了TLR4/NF-κB信号通路,并导致IL-1β、IL-6和TNF-α的过度产生[8],而AOP是否可通过TLR4/NF-κB信号通路缓解由LPS引起的免疫应激,还有待进一步研究。因此,本研究从TLR4/NF-κB信号通路探究AOP对免疫应激状态下肉仔鸡十二指肠中炎症因子含量的影响,旨在为AOP在肉仔鸡饲粮中的科学应用提供理论依据。
1 材料与方法 1.1 试验动物与设计本课题组前期综合生长性能、血清免疫和抗氧化指标确定AOP在肉仔鸡饲粮中的适宜添加量为750 mg/kg[4],以此作为本研究试验饲粮中AOP的添加量。通过腹腔注射LPS构建肉仔鸡的免疫应激模型。采用2×2双因子试验设计,选取192只1日龄爱拔益加(AA)肉仔鸡,随机分为4个处理,每个处理6个重复,每个重复8只鸡。试验期为42 d,分为预试期(第1~14天)、应激Ⅰ期(第15~28天,包括7 d的LPS注射期和7 d的恢复期)和应激Ⅱ期(第29~42天,包括7 d的LPS注射期和7 d的恢复期)。处理1和2饲喂基础饲粮,处理3和4饲喂试验饲粮(在基础饲粮中添加750 mg/kg AOP)。分别在应激Ⅰ期(试验第15、17、19、21天)和应激Ⅱ期(试验第29、31、33、35天)给处理1和3的肉仔鸡腹腔注射5 mL/kg BW的LPS溶液(LPS溶液浓度为100 μg/mL生理盐水),处理2和4的肉仔鸡腹腔注射等量的生理盐水。在应激Ⅰ期(第21天)和应激Ⅱ期(第35天)每个重复随机选取1只鸡,进行屠宰、剖腹,迅速取十二指肠组织样品,用于测定组织中免疫指标及其相关基因和蛋白的表达。
1.2 饲养管理试验期内人工控制舍内光照和温度,并自然通风。试验第1周的舍内温度设定在32~34 ℃,然后每周降低3 ℃,直至21 ℃。试验第1~3天每天保持23 h光照,第4~21天每天保持10 h光照,第22~42天每天保持23 h光照。舍内相对湿度保持在50%~60%,氨气浓度为5.1~6.2 mg/m3,风速约为0.5 m/s。根据我国农业行业标准《鸡饲养标准》(NY/T 33—2004)配制玉米-豆粕型粉状基础饲粮(表 1),饲养过程中肉仔鸡自由采食和饮水。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在试验第1天记录1日龄肉仔鸡的初始体重,于第14、21、28、35和42天对各处理肉仔鸡进行称重、结料,计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.3.2 十二指肠中免疫指标称取0.5 g十二指肠组织,按1 ∶ 9(质量体积比)的比例在冰冷的0.9%生理盐水中用手持式匀浆器匀浆,随后离心(4 000×g)15 min,取上清保存于-80 ℃。采用考马斯亮蓝法测定匀浆液上清的蛋白浓度,免疫球蛋白(Ig)G、IgM和IgA及IL-1β、IL-2、IL-4和IL-6含量采用泉州市睿信生物科技有限公司研发的酶联免疫吸附试验(ELISA)试剂盒进行测定,严格按照试剂盒内说明书要求进行。
1.3.3 十二指肠中NF-κB信号通路相关因子的基因表达十二指肠组织中总RNA的提取使用RNAiso Plus试剂(TaKaRa),参照说明书的方法进行。将提取后的总RNA用核酸定量仪分别在260和280 nm处进行定量和定性测定,并通过1.5%琼脂糖凝胶电泳测定RNA的完整性。用Prime ScriptTM RT试剂盒,按照说明书合成cDNA,程序为:37 ℃,15 min;85 ℃,5 s。用Illumina实时荧光定量PCR仪和TB® Premix Ex TaqTM试剂盒(TaKaRa)进行实时荧光定量PCR,程序如下:95 ℃,30 s,循环1次(预热);95 ℃,5 s;60 ℃,30 s;72 ℃,20 s,循环40次(扩增);95 ℃,15 s;60 ℃,1 min;95 ℃,15 s,循环1次(熔解曲线)。本试验以β-肌动蛋白(β-actin)为内参基因,根据2-ΔΔCt方法计算各处理十二指肠中TLR4、髓样分化因子88(MyD88)、NF-κB p65、IL-1β和IL-6基因的相对表达量。相关基因的引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
采用组织或细胞总蛋白提取试剂盒[生工生物工程(上海)股份有限公司]按照说明书提取全细胞蛋白。随后采用BCA蛋白测定试剂盒(北京Beyotime生物技术研究所),以牛血清白蛋白为标准品测定蛋白浓度。以β-actin作为内参蛋白,采用Western Blot法测定十二指肠中的TLR4、NF-κB激酶抑制因子复合体β(IKKβ)、NF-κB的抑制物α(IκBα)、NF-κB p65、IL-1β、IL-6的蛋白表达水平。主要操作步骤如下:将蛋白样品加入5×蛋白上样缓冲液中(V ∶ V=4 ∶ 1),煮沸10 min,使蛋白变性,待冷却后离心收集上清。在各胶孔中加入等量的蛋白质(100 μg)后在十二烷基硫酸钠聚丙烯酰胺凝胶中电泳分离[依次经浓缩胶(80 V,30 min)和分离胶(120 V,90 min)],然后转移到聚乙二烯二氟化物(PVDF)膜上(100 V,50 min)。转膜完成后,用1×TBST洗涤膜,随后使用封闭液于室温下避光封闭1 h。封闭完成后再次洗膜。将膜分别在4 ℃条件下过夜进行一抗孵育:兔抗β-actin多克隆抗体(1 ∶ 1 000稀释)、兔抗TLR4多克隆抗体(1 ∶ 100稀释)、兔抗IKKβ多克隆抗体(1 ∶ 100稀释)、兔抗IκBα单克隆抗体(1 ∶ 200稀释)、兔抗NF-κB p65多克隆抗体(1 ∶ 100稀释)、兔抗IL-1β多克隆抗体(1 ∶ 10稀释)和兔抗IL-6多克隆抗体(1 ∶ 10稀释)。次日进行相应的二抗孵育,将山羊抗兔辣根过氧化物酶(HPR)(1 ∶ 1 000稀释)室温摇床孵育1 h。用ECL超敏发光试剂盒进行显色,然后利用凝胶成像系统(VILBER FUSION FX7 Spectra,法国)拍照并对条带强度进行定量分析,计算目的蛋白相对表达量。

|
试验数据采用SAS 9.2分析软件系统的GLM模型进行单因素方差分析,并采用Duncan氏法进行多重比较,此外,所有数据进行2×2双因素方差分析,模型中的因素包括LPS(应激与不应激)和AOP(0和750 mg/kg)以及两者之间的交互效应。P<0.05为差异显著。
2 结果与分析 2.1 AOP对LPS刺激的免疫应激肉仔鸡生长性能的影响AOP对LPS刺激的免疫应激肉仔鸡生长性能的影响见表 3。在应激前(第1~14天),饲粮中添加AOP对肉仔鸡的生长性能没有显著影响(P>0.05)。由双因素方差分析统计结果可知:在应激Ⅰ期(第15~21天)和应激Ⅱ期(第29~35天),以AOP为主效应分析,饲粮中添加AOP显著增加了肉仔鸡的ADG(P<0.05),并显著降低了F/G(应激Ⅰ期,P<0.05);以LPS为主效应分析,注射LPS显著降低了肉仔鸡ADG(应激Ⅰ期)和ADFI(P<0.05);AOP和LPS对肉仔鸡的生长性能无显著的互作效应(P>0.05)。多重比较结果显示:在应激Ⅰ期和应激Ⅱ期,非应激状态下,AOP有增加肉仔鸡ADG和ADFI的趋势,而应激状态下,AOP显著缓解了由LPS导致的肉仔鸡ADG的下降(P<0.05)。
|
|
表 3 AOP对LPS刺激的免疫应激肉仔鸡生长性能的影响 Table 3 Effects of AOP on growth performance of immune-stressed broilers challenged with LPS |
由双因素方差分析统计结果可知:在恢复Ⅰ期(第22~28天)和恢复Ⅱ期(第36~42天),以AOP为主效应分析,饲粮中添加AOP显著增加了肉仔鸡的ADG和ADFI(P<0.05);LPS作为主效应单独作用及LPS与AOP的互作效应对肉仔鸡生长性能的影响均不显著(P>0.05)。多重比较结果显示:恢复Ⅰ期和恢复Ⅱ期,非应激状态下,AOP显著增加肉仔鸡ADG和ADFI(恢复Ⅰ期)(P<0.05),应激状态下,AOP有增加肉仔鸡ADG的趋势。
2.2 AOP对LPS刺激的免疫应激肉仔鸡十二指肠中免疫指标的影响AOP对LPS刺激的免疫应激肉仔鸡十二指肠中免疫指标的影响见表 4。由双因素方差分析统计结果可知:以AOP作为主效应,饲粮中添加AOP显著降低了肉仔鸡十二指肠中IL-1β(第35天)、IL-6(第21和35天)和IL-4(第21天)的含量(P<0.05),但却显著增加了肉仔鸡十二指肠中sIgA(第21天)和IgM(第35天)的含量(P<0.05);以LPS为主效应,注射LPS显著增加了肉仔鸡十二指肠中IL-1β(第21和35天)、IL-6(第21和35天)和IL-4(第21天)的含量(P<0.05),却显著降低了十二指肠中sIgA(第21天)的含量(P<0.05);LPS与AOP的互作效应对肉仔鸡十二指肠中IL-1β(第35天)、IL-6(第21和35天)、IL-2(第21天)、IL-4(第21和35天)、sIgA(第21天)和IgM(第21和35天)的含量有显著影响(P<0.05)。多重比较结果显示:非应激状态下,饲粮中添加AOP有提高肉仔鸡十二指肠中IL-1β(第35天)和IL-6(第35天)的含量的趋势,同时显著升高了十二指肠中sIgA(第21天)和IgM(第35天)的含量,而在应激状态下,饲粮中添加AOP显著缓解了由LPS导致的肉仔鸡十二指肠中IL-1β(第21和35天)、IL-6(第21和35天)和IL-4(第21天)的过度产生,且显著缓解了IgM(第21天)含量的过度下降(P<0.05)。
|
|
表 4 AOP对LPS刺激的免疫应激肉仔鸡十二指肠中免疫指标的影响 Table 4 Effects of AOP on immune indexes in duodenum of immune-stressed broilers challenged by LPS |
AOP对LPS刺激的免疫应激肉仔鸡十二指肠中NF-κB信号通路相关因子基因表达的影响见表 5。由双因素方差分析统计结果可知:以AOP为主效应,饲粮中添加AOP显著降低了肉仔鸡十二指肠中IL-1β(第21天)的基因表达量(P<0.05);以LPS为主效应,注射LPS显著促进了肉仔鸡十二指肠中TLR4(第35天)、NF-κB p65(第21和35天)和IL-1β(第21和35天)的基因表达量(P<0.05);LPS与AOP的互作效应显著影响肉仔鸡十二指肠中NF-κB p65(第35天)及IL-1β(第21天)的基因表达量(P<0.05)。多重比较结果显示:非应激状态下,饲粮中添加AOP有提高肉仔鸡十二指肠中NF-κB p65(第21天)和IL-1β(第35天)的基因表达量的趋势,而在应激状态下,饲粮中添加AOP显著缓解了由LPS导致的肉仔鸡十二指肠中NF-κB p65(第35天)和IL-1β(第21天)基因的过表达(P<0.05)。
|
|
表 5 AOP对LPS刺激的免疫应激肉仔鸡十二指肠中NF-κB信号通路相关因子基因表达的影响 Table 5 Effects of AOP on gene expression of NF-κB signal pathway related factors in duodenum of immune-stressed broilers challenged by LPS |
AOP对LPS刺激的免疫应激肉仔鸡十二指肠中NF-κB信号通路相关因子蛋白表达的影响见图 1和表 6。由双因素方差分析统计结果可知:以AOP为主效应,饲粮中添加AOP显著降低了肉仔鸡十二指肠中IKKβ(第21和35天)、NF-κB p65(第35天)、IL-1β(第21和35天)和IL-6(第35天)的蛋白表达量,显著升高了十二指肠中IκBα(第21和35天)的蛋白表达量(P<0.05);以LPS为主效应,注射LPS显著上调了肉仔鸡十二指肠中TLR4(第35天)、IKKβ(第21和35天)、NF-κB p65(第21和35天)、IL-1β(第21和35天)、IL-6(第21和35天)的蛋白表达量(P<0.05),显著降低了十二指肠中IκBα(第21和35天)的蛋白表达量(P<0.05);LPS与AOP的互作效应显著影响除TLR4(第21天)和IκBα(第35天)外的肉仔鸡十二指肠中NF-κB信号通路相关因子的蛋白表达量(P<0.05)。多重比较结果显示:非应激状态下,饲粮中添加AOP显著促进了NF-κB信号通路相关因子[TLR4(第35天)、IKKβ(第21和35天)、NF-κB p65(第21天)、IL-1β(第21和35天)和IL-6(第35天)]的蛋白表达(P<0.05),而在应激状态下,饲粮中添加AOP显著缓解了由LPS导致的肉仔鸡十二指肠中NF-κB信号通路相关蛋白(NF-κB p65、IL-1β和IL-6,第21和35天)的过表达(P<0.05),且显著促进了IκBα(第21和35天)的蛋白表达(P<0.05)。
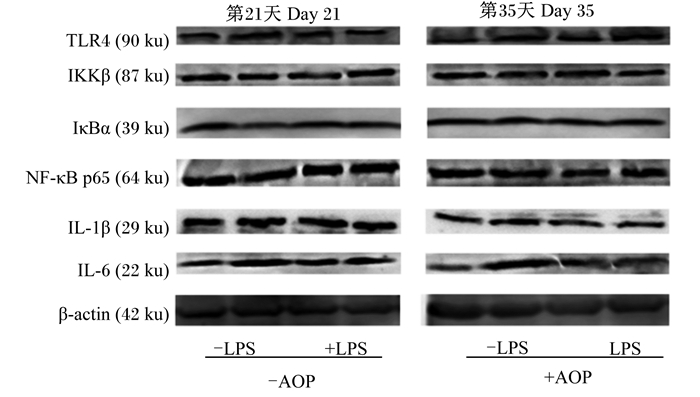
|
-:不添加或不注射;+:添加或注射;AOP:黑沙蒿多糖;LPS:脂多糖。-: no addition or no injection; +: addition or injection; AOP: Artemisia ordosica polysaccharide; LPS: lipopolysaccharide. TLR4:Toll样受体4 Toll-like receptor 4;IKKβ:核转录因子-κB激酶抑制因子复合体β nuclear factor-κB kinase inhibitor complex β;IκBα:核转录因子-κB的抑制物α nuclear factor-κB inhibitor α;NF-κB p65:核转录因子-κB p65 nuclear factor-κB p65;IL-1β:白细胞介素-1 interleukin-1;IL-6:白细胞介素-6 interleukin-6。 图 1 AOP对LPS刺激的免疫应激肉仔鸡十二指肠中NF-κB信号通路相关因子蛋白表达的影响 Fig. 1 Effects of AOP on protein expression of NF-κB signal pathway related factors in duodenum of immune-stressed broilers challenged by LPS |
|
|
表 6 AOP对LPS刺激的免疫应激肉仔鸡十二指肠中NF-κB信号通路相关因子蛋白表达的影响 Table 6 Effects of AOP on protein expression of NF-κB signal pathway related factors in duodenum of immune-stressed broilers challenged by LPS |
经腹腔或者肌肉注射LPS能够建立肉仔鸡免疫应激模型,处于免疫应激状态下的肉仔鸡生长发育缓慢[1],而相关研究表明添加植物多糖可以提高动物的生长性能[9-10]。然而针对AOP对LPS刺激的免疫应激肉鸡生长性能影响的研究却鲜见报道。在本研究中,AOP对LPS刺激前肉仔鸡的生长性能并没有显著影响。在应激期,非应激状态下,饲粮中添加AOP促进了肉仔鸡的生长。此外,饲粮中添加AOP可缓解由LPS导致的肉仔鸡生长的阻滞。在恢复期,饲粮中添加AOP更有助于肉仔鸡从免疫应激中恢复。研究表明,植物提取物可通过缓解由LPS导致的小肠消化酶活性降低、肠道形态损伤和肠道菌群改变等途径来提高营养物质消化率[11],进而促进肉仔鸡的生长发育,而这也可能是AOP缓解LPS导致的肉仔鸡生长阻滞的主要原因,其具体机制还有待进一步研究。
研究表明,LPS是最常用的研究免疫应激的细菌毒素之一,它会引起全身炎症和败血症[12]。LPS又称内毒素,是革兰氏阴性杆菌细胞壁的主要组分,当其进入宿主后,会刺激单核细胞、巨噬细胞和中性粒细胞等免疫细胞,通过细胞膜及细胞内的一系列级联反应,最终活化NF-κB信号通路。而NF-κB信号通路的主要功能之一是调控免疫炎症反应相关基因的表达,进而调节促炎因子(IL-1β、IL-6和TNF-α等)的过度产生与释放,这些生物活性分子通过“神经-内分泌-免疫”网络,诱导动物在短时间内产生细菌感染症状,引发动物免疫应激。本研究表明,饲粮中添加AOP可缓解由LPS导致的肉仔鸡十二指肠中IL-1β、IL-6和IL-4的过度产生,且可缓解IgM的过度下降,这说明AOP可缓解LPS对肉仔鸡十二指肠的免疫应激。
如前所述,LPS会导致TLR4/NF-κB信号通路的过度激活,而植物多糖可通过TLR4/NF-κB信号通路调控免疫细胞因子的表达[13],进而缓解由LPS导致的免疫应激。其中,肠上皮细胞TLR4是植物多糖的特异性受体,可通过调节TLR4的转录水平激活NF-κB的表达,进而改善LPS引起的机体损伤[14]。此外,NF-κB作为动物免疫应答中细胞因子的调控通路,既能够直接调节与免疫相关细胞因子的表达,还能够抵抗细胞凋亡因子的表达,维持细胞正常的生理功能,此外,它对维持动物肠道上皮细胞屏障的完整性也有一定的作用[15]。研究发现,黄芪多糖可通过抑制TLR4的基因转录和NF-κB的抑制物(IκB)的降解,来减弱NF-κB的激活,进而下调促炎因子表达,抑制由LPS诱导的免疫应激反应[16]。据报道,人参多糖和黑莓多糖也可降低由LPS刺激导致巨噬细胞中TLR4、MyD88和NF-κB的mRNA表达量的提高,从而降低促炎因子IL-1β和TNF-α的分泌及表达,减少机体免疫应激反应[17-18]。本研究也得出相似的结论,饲粮中添加AOP缓解了由LPS导致的肉仔鸡十二指肠中NF-κB p65(第21天)和IL-1β(第35天)基因的过表达,以及NF-κB信号通路相关蛋白(NF-κB p65、IL-1β和IL-6)的过表达,且促进了IκBα的蛋白表达。这提示AOP可通过抑制NF-κB信号通路的过度激活来抑制LPS导致的促炎因子的过度释放,从而缓解肉仔鸡的免疫应激。
此外,本研究表明,非应激状态下,饲粮中添加AOP有提高肉仔鸡十二指肠中IL-1β、IL-6和IL-4含量的趋势,同时显著升高了十二指肠中IgA(第21天)和IgM(第35天)的含量,这可能与AOP有提高NF-κB p65(第21天)和IL-1β(第35天)基因表达的趋势,且增加了NF-κB信号通路相关基因及其下游靶基因的蛋白表达有关,这也揭示了AOP对NF-κB信号通路的调控是双向的,即AOP能激活正常静息状态的免疫系统,可轻微刺激肉仔鸡十二指肠中促炎因子的表达。但当机体免疫系统处在过度激活状态时,AOP又能下调LPS诱导产生的大量促炎因子的表达,抑制NF-κB信号通路的过度激活,这和前人对云芝糖肽的免疫调节作用的研究结果[19]相一致。据此推断,AOP对不同状态下(应激与不应激)动物机体NF-κB信号通路的调控之所以呈现出看似矛盾的结果,一方面与其双向调控作用有关,另一方面与其和其他信号通路的相互作用有关,故此AOP对不同信号通路究竟是发挥协同作用、抑制作用还是拮抗作用仍需大量的研究。
4 结论综上可知,饲粮中添加750 mg/kg AOP可缓解由LPS导致的肉仔鸡生长性能的下降,并通过抑制NF-κB信号通路的过度激活来抑制LPS导致的十二指肠中促炎因子的过度释放。
| [1] |
JOHNSON R W. Inhibition of growth by pro-inflammatory cytokines: an integrated view[J]. Journal of Animal Science, 1997, 75(5): 1244-1255. DOI:10.2527/1997.7551244x |
| [2] |
FALOWO A B, FAYEMI P O, MUCHENJIE V. Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products: a review[J]. Food Research International, 2014, 64: 171-181. DOI:10.1016/j.foodres.2014.06.022 |
| [3] |
邢媛媛, 史彬林, 金晓, 等. 黑沙蒿对动物免疫和抗氧化功能的影响及其机制[J]. 动物营养学报, 2018, 30(10): 3805-3809. XING Y Y, SHI B L, JIN X, et al. Artemisia ordosica affects immune and antioxidative function of animals and its mechanism[J]. Chinese Journal of Animal Nutrition, 2018, 30(10): 3805-3809 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.10.002 |
| [4] |
王俊丽. 黑沙蒿多糖对肉仔鸡生长性能、肠道指标及肉品质的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. WANG J L. Effects of Artemisia ordosica polysaccharide on growth performance, intestinal index and meat quality of broilers[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [5] |
马国强. 黑沙蒿及其多糖对绒山羊瘤胃发酵参数、营养物质消化、血液抗氧化与免疫指标的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. MA G Q. Effects of Artemisia ordosica and its polysaccharides on ruminal fermentation, nutrient digestibility, serum antioxidant and immune parameters of cashmere goats[D]. Master's Thesis. Hohhot: Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [6] |
邢媛媛, 郭世伟, 石璐璐, 等. 黑沙蒿多糖对大鼠生长性能及抗氧化功能的影响[J]. 动物营养学报, 2019, 31(10): 4701-4709. XING Y Y, GUO S W, DAN L L, et al. Effects of artemisia ordosica polysaccharide on growth performance and antioxidant function of rats[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4701-4709 (in Chinese). |
| [7] |
任道远. 沙蒿多糖的肝损伤保护、免疫调节及其载运姜黄素的稳态化递送[D]. 博士学位论文. 西安: 陕西师范大学, 2018. REN D Y. Hepatic injury protection and immunomodulation of A. sphaerocephala Krasch polysaccharide and its application on curcu[D]. Ph. D. Thesis. Xi'an: Shaanxi Normal University, 2018. (in Chinese) |
| [8] |
REIMUND J M, HIRTH C, KOEHL C, et al. Antioxidant and immune status in active Crohn's disease.A possible relationship[J]. Clinical Nutrition, 2000, 19(1): 43-48. DOI:10.1054/clnu.1999.0073 |
| [9] |
XIE J H, JIN M L, MORRIS G A, et al. Advances on bioactive polysaccharides from medicinal plants[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(Suppl.1): S60-S84. |
| [10] |
HAN J, BIAN L, LIU X, et al. Effects of Acanthopanax senticosus polysaccharide supplementation on growth performance, immunity, blood parameters and expression of pro-inflammatory cytokines genes in challenged weaned piglets[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(7): 1035-1043. DOI:10.5713/ajas.2013.13659 |
| [11] |
YANG L, LIU G, ZHU X, et al. The anti-inflammatory and antioxidant effects of leonurine hydrochloride after lipopolysaccharide challenge in broiler chicks[J]. Poultry Science, 2019, 98(4): 1648-1657. DOI:10.3382/ps/pey532 |
| [12] |
BEUTLER B, RIETSCHEL E T. Innate immune sensing and its roots: the story of endotoxin[J]. Nature Reviews Immunology, 2003, 3(2): 169-176. DOI:10.1038/nri1004 |
| [13] |
WEI W, XIAO H T, BAO W R, et al. TLR-4 may mediate signaling pathways of Astragalus polysaccharide RAP induced cytokine expression of RAW264.7 cells[J]. Journal of Ethnopharmacology, 2016, 179: 243-252. DOI:10.1016/j.jep.2015.12.060 |
| [14] |
张猛猛. 玛咖根部多糖的结构鉴定及免疫调节活性的研究[D]. 博士学位论文. 广州: 华南理工大学, 2019. ZHANG M M. Structural identification and the immunological activity of polysaccharides from maca root (Lepidium meyenii Walp)[D]. Ph. D. Thesis. Guangzhou: South China University of Technology, 2019. (in Chinese) |
| [15] |
MORGAN M J, LIU Z G. Crosstalk of reactive oxygen species and NF-κB signaling[J]. Cell Research, 2011, 21(1): 103-115. DOI:10.1038/cr.2010.178 |
| [16] |
刘磊. 黄芪多糖调控肉鸡免疫应激反应研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2015. LIU L. Study on the regulation of astragalus polysaccharide on immunological stress responses in broliers[D]. Master's Thesis. Yangling: Northwest Agriculture&Forestry University, 2015. (in Chinese) |
| [17] |
陈广勇, 韩乾杰, 张玲玲, 等. 人参多糖对脂多糖刺激小鼠巨噬细胞的免疫调控作用[J]. 中国畜牧杂志, 2021, 57(2): 182-187. CHEN G Y, HAN Q J, ZHANG L L, et al. Immune regulation of ginseng polysaccharide on lipopolysaccharide-stimulated mouse macrophages[J]. Chinese Journal of Animal Science, 2021, 57(2): 182-187 (in Chinese). |
| [18] |
CAILLOT A R C, BEZERRA I D L, PALHARES L C G F, et al. Structural characterization of blackberry wine polysaccharides and immunomodulatory effects on LPS-activated RAW 264.7 macrophages[J]. Food Chemistry, 2018, 257: 143-149. DOI:10.1016/j.foodchem.2018.02.122 |
| [19] |
任文智. 云芝糖肽(PSP)对小鼠巨噬细胞的双向免疫调节及NF-κB信号通路的调控研究[D]. 硕士学位论文. 上海: 上海师范大学, 2010: 1-3. REN W Z. A study of the bidirectional immunomodulatory effects of Trametes versicolor polysaccharopeptide (PSP) on mouse macrophage and its regulation on NF-κB signal pathway[D]. Master's Thesis. Shanghai: Shanghai Normal University, 2010: 1-3. (in Chinese) |




