2. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193;
3. 温氏食品集团股份有限公司, 新兴 527439
2. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Wen's Food Group Co., Ltd., Xinxing 527439, China
在家禽饲料氨基酸消化率的测定中,消化后食糜样品的来源直接影响氨基酸的消化率及结果的变异。因此,比较不同方法获得的回肠末端食糜的差异及其变异对氨基酸消化率的准确测定非常关键。目前,在家禽回肠食糜的获取上,主要通过屠宰法收集回肠食糜[1-4],或采用去盲肠手术后获得大量的排泄物样品[5-6];也有少量研究通过回肠套管收集鸡的食糜[7-8]。屠宰法获得回肠食糜测定的氨基酸消化率受取样位置、取样方式及指示剂的影响[9-10];此外,从每只鸡获取的样品量很少(干食糜0.6~3.9 g),指示剂回收率低[9, 11],因此,其代表性存在质疑。去盲肠法受手术操作复杂,存在术后恢复期等因素的限制,因此,用于测定氨基酸消化率的试验鸡重复数通常不大,且多用于成年公鸡。回肠套管法可以多次收集回肠食糜,但仍然受指示剂类型及指示剂在食糜固液相分布的影响。Rezvani等[6]比较了屠宰法与去盲肠法测定鸡饲料原料氨基酸消化率的差异,得出去盲肠法的变异系数约为屠宰法的1/3。然而,鲜见关于去盲肠法、屠宰法和套管法采集的回肠食糜在处理重复内的变异及其对氨基酸消化率测定变异的影响。为此,本研究对试验鸡进行去盲肠或回肠套管手术,并观察术后恢复状况,在确保试验鸡术后生长正常的基础上,比较去盲肠法、套管法和屠宰法采集的回肠食糜在氨基酸和指示剂含量的差异与变异及其对氨基酸消化率测定变异的影响,为筛选准确地测定氨基酸消化率的方法提供参考。
1 材料与方法 1.1 试验设计本试验分为2部分。第1部分考察去盲肠和回肠套管手术的过程及术后恢复情况,对186只雄性黄羽肉鸡实施去盲肠手术(第1批39只,55日龄,平均体重1.52 kg;第2批147只,65日龄,平均体重1.40 kg),47只55日龄的雄性黄羽肉鸡(平均体重1.51 kg)实施回肠末套管手术,观察其术后恢复状况。第2部分考察黄羽肉鸡消化后样品来源对饲粮氨基酸消化率的影响,采用单因素完全随机设计,饲粮经黄羽肉鸡消化后的样品来源设3个处理,即去盲肠法排泄物、套管法回肠食糜及屠宰法回肠食糜。选择42只76日龄雄性黄羽肉鸡,其中12只去盲肠鸡(平均体重2.327 kg)从第1部分第1批去盲肠鸡中选择;12只回肠套管鸡(平均体重2.282 kg)从第1部分回肠套管鸡中选择;术后恢复期均达到21 d以上。18只未做手术的试验鸡(平均体重2.253 kg)从50只鸡中选择。通过去盲肠鸡和回肠套管鸡获得样品每个处理6个重复,每个重复2只鸡。通过屠宰获得的鸡回肠食糜每个处理6个重复,每个重复3只鸡。参考Zuber等[12]关于采用去盲肠鸡测定饲料原料的氨基酸消化率中,试验鸡对饲粮的适应期为4 d、排泄物样品收集期4 d以及欧洲测定肉鸡代谢能参考方法的程序[13]。本试验中试验鸡术后恢复21 d以上进入正式试验期,其中试验期第1~4天为适应期,去盲肠鸡在试验期第5~9天(第5天09:00开始,第9天09:00结束)收集全部排泄物。参考Van Leeuwen等[14]的方法在试验期第5~7天通过回肠套管收集回肠食糜。在试验期的第5~9天屠宰完整鸡获取回肠食糜。每次样品收集后,同一个重复内的样品合并,放入冰箱冷冻。
1.2 试验饲粮根据黄羽肉鸡(温氏广西土2公鸡)的营养需要及生产实际配制玉米-豆粕型饲粮。将玉米过3.5 mm筛片粉碎,豆粕、棉籽粕过2.5 mm筛粉碎,预混料与豆粕逐级稀释后将所有原料混合冷制粒成试验饲粮。
|
|
表 1 玉米-豆粕型饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of corn-soybean type diet (air-dry basis) |
试验在温氏食品集团股份有限公司养禽事业部肉鸡代谢室进行。雄性黄羽公鸡单笼饲养于代谢笼(0.42 m×0.42 m×0.52 m)中,代谢室的温度维持在23~25 ℃,自由采食和饮水,每日光照16 h。饲养管理按动物营养学国家重点实验室常规程序进行。日常消毒及免疫等管理工作按照温氏食品集团鸡场的正常程序进行。
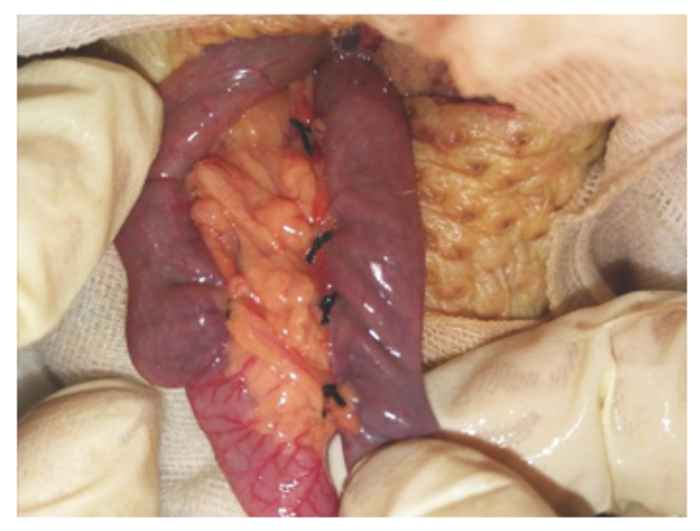
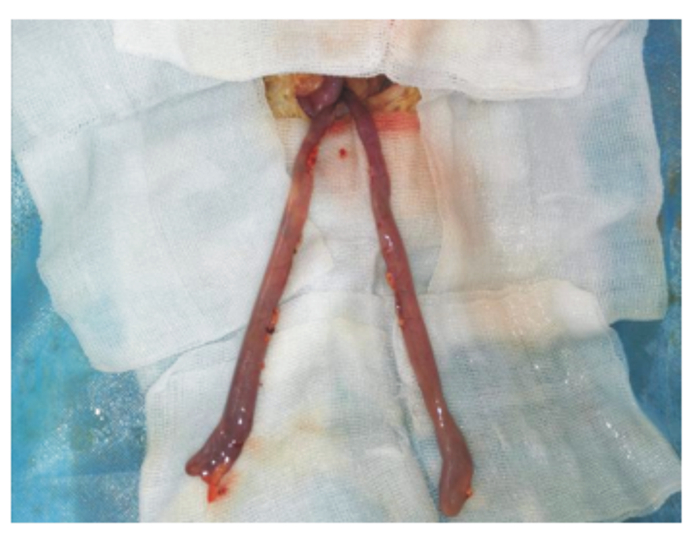
1.4 肉鸡去盲肠手术及回肠套管安装过程根据Payne等[15]描述的关于成年公鸡去盲肠的外科手术方法进行去盲肠手术,其过程描述如下:首先去除试验鸡腹部泄殖腔以上5 cm×5 cm的羽毛,然后用自制保定架将试验鸡保定后,用手术刀小心打开腹腔,术口打开约4 cm左右。用钝性镊子小心勾出试验鸡盲肠端(盲肠部位在试验鸡中部偏左的位置)。结扎所有通向盲肠的血管(注意结扎时要看清血管通路,不要造成其他肠段血液供应中断)(图 1)。结扎完成后再剪开连接的系膜。盲肠在结扎过程中会遇到难以拉出的现象,观察牵连部位血管分布,切断韧带后再将盲肠轻轻拉出(图 2)。分离完盲肠后在距离回盲连接处1 cm处结扎并剪下盲肠。取出盲肠后,用甲硝唑溶液清洗腹腔,取出残留的血块。然后分别缝合腹膜、腹脂层、肌肉层和皮肤。腹脂层采用连续缝合法,肌肉层和皮肤采用锁边缝合。皮肤伤口处用碘酒消毒并涂抹青霉素。术后绝食12 h,补饲30 g/dL的葡萄糖溶液50 mL,每日2次,连服3 d。术后第3天开始饲喂饲粮,术后第3~5天分别以30%、60%、100%自由采食的方式喂饲粮。手术当天及术后3 d内每日肌肉注射青链霉素100 000 IU/只。术后7 d内每日进行术部消毒,第7天拆除皮肤处手术缝合线。
|
图 1 结扎盲肠与系膜连接的毛细血管 Fig. 1 Ligate capillary vessel connecting cecum and mesenterium |
|
图 2 游离出2根盲肠 Fig. 2 Separate two ceca |
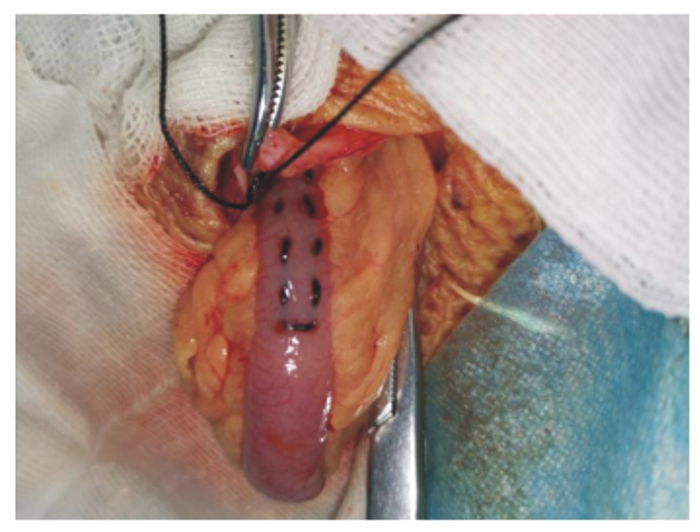
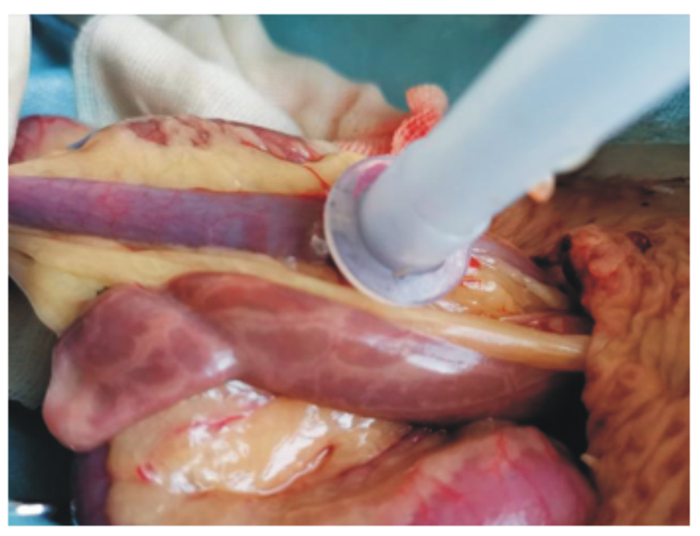
根据赵峰等[16]描述的关于安装家禽肠道套管的外科手术方法在回肠末端安装套管。其过程简述如下:术部除毛、消毒及术口位置与去盲肠手术类似,找到盲肠后牵出回肠,在距离回盲结合处3~5 cm处的回肠部位作约1 cm左右切口,插入套管后荷包缝合(图 3、图 4)。腹腔及皮肤缝合和术后护理同去盲肠手术。
|
图 3 距回盲结合处5~8 cm的回肠作荷包缝合 Fig. 3 Purse string suture on ileum near to ileo-cecal junction about 5 to 8 cm |
|
图 4 肠壁作1 cm左右小切口,插入套管 Fig. 4 Cut of about 1 cm on intestinal wall and cannula was inserted into bowel |
去盲肠法排泄物和套管法回肠食糜的收集采用在皮肤缝合采样盖,采样袋拧到采样盖上后收集。屠宰法回肠食糜的收集参考Poureslami等[17]和Osho等[18]的过程进行,取从距离回盲结合处1 cm往卵黄囊憩室方向2/3的肠道,分成2段后用去离子水冲洗到培养皿中。然后转入-20 ℃冰柜冷冻保存。试验结束后所有排泄物或食糜样品转入原位冻干机(SCIENTZ-50ND,宁波新芝生物科技股份有限公司)冷冻干燥。
1.6 测定指标 1.6.1 手术及术后恢复评价指标分别在术前及术后第7天、第14天和第21天,空腹8 h后称重。记录切除盲肠的长度、重量。记录术后死淘试验鸡只数,计算术后死亡及淘汰率。
1.6.2 化学成分分析水分含量参考GB/T 6435—2014进行测定,粗蛋白质含量采用GB/T 6432—1994以凯氏定氮法测定。饲粮及食糜或排泄物中二氧化钛(TiO2)含量参考Myers等[19]和Wang等[20]的方法进行测定。样品氨基酸含量参考AOAC(1997,方法994.12)进行测定,其过程为:样品先在过氧甲酸溶液中0 ℃氧化16 h,将蛋氨酸和半胱氨酸氧化成蛋氨酸砜和磺基丙氨酸,反应结束后加入焦亚硫酸钠分解过量的过氧甲酸,再用6 mol/L盐酸溶液(含苯酚)在110 ℃下水解23 h;水解液用氨基酸分析仪(biochrom 30,英国)进行色谱分离;分离后的氨基酸与茚三酮混合并且在加热的反应线圈中生成特定的显色物质(柱后衍生),通过紫外570 nm波长或者440 nm波长检测,使用OPENLAB软件对色谱图积分。
1.7 数据处理与统计分析

|
采用SAS 9.0软件Means模块计算基本统计量,并计算每个处理下重复数据的75%(Q3)和25%(Q1)分位数。四分位距(IQR)=Q3-Q1;Q1-1.5×IQR~Q3+1.5×IQR以外的数据为异常数据予以剔除。采用t test模块对第1、2批去除盲肠的长度进行t检验,其他处理采用GLM模块进行方差分析,并以Duncan氏法进行多重比较。P<0.05为差异显著。
2 结果与分析 2.1 肉鸡去盲肠和回肠套管手术过程及术后恢复状况如表 2所示,在去盲肠手术中,第2批去盲肠手术切除的短盲肠长度和长盲肠长度显著长于第1批(P<0.05),手术时长显著短于第1批(P<0.05)。回肠套管手术时长显著短于去盲肠手术(P<0.05)。第2批去盲肠手术肉鸡的术前及术后第7天、第21天体重显著低于第1批去盲肠手术和回肠套管手术(P<0.05)。而3组肉鸡的术后第7天、第14天和第21天增重均无显著差异(P>0.05)。第1批、第2批去盲肠手术和回肠套管手术肉鸡术后3个月的合计术后死亡及淘汰率分别为23.1%、20.4%和33.9%。
|
|
表 2 肉鸡去盲肠和回肠套管手术过程其术后恢复状况 Table 2 Procedure of cecectomy and ileal cannula surgeries and its recovery of rooster |
如表 3所示,去盲肠法排泄物中TiO2含量显著高于套管法回肠食糜(P<0.05),但显著低于屠宰法回肠食糜(P<0.05);套管法回肠食糜中TiO2含量显著低于屠宰法回肠食糜(P<0.05)。去盲肠法排泄物中半胱氨酸、苏氨酸和脯氨酸含量显著低于套管法回肠食糜(P<0.05),组氨酸、赖氨酸、甘氨酸、苯丙氨酸含量显著高于套管法回肠食糜和屠宰法回肠食糜(P<0.05)。套管法回肠食糜中半胱氨酸、苏氨酸和脯氨酸含量显著高于屠宰法回肠食糜(P<0.05)。
|
|
表 3 去盲肠法排泄物、套管法回肠食糜和屠宰法回肠食糜中氨基酸含量(干物质基础) Table 3 Contents of amino acid in excreta in cecectomy, ileal digesta in cannulation method and ileal digesta in slaughter method (DM basis) |
如表 4所示,去盲肠全收粪法和去盲肠指示剂法测定的饲粮氨酸表观消化率无显著差异(P>0.05)。去盲肠全收粪法测定的饲粮半胱氨酸、苏氨酸、缬氨酸、天冬氨酸和脯氨酸表观消化率均显著高于套管法(P<0.05),而甘氨酸表观消化率显著低于套管法(P<0.05)。去盲肠全收粪法测定的饲粮组氨酸、赖氨酸、甘氨酸和苯丙氨酸表观消化率显著低于屠宰法(P<0.05)。套管法测定的饲粮半胱氨酸、组氨酸、赖氨酸、苏氨酸、缬氨酸、天冬氨酸、甘氨酸、苯丙氨酸、脯氨酸和总氨基酸表观消化率均显著低于屠宰法(P<0.05)。
|
|
表 4 去盲肠全收粪法、去盲肠指示剂法、套管法和屠宰法对饲粮氨基酸表观消化率的影响 Table 4 Effects of cecectomy total collection method, cecectomy indicator method, cannulation method and slaughter method on amino acid apparent digestibilities of diets |
如表 5所示,去盲肠法排泄物与屠宰法回肠食糜中TiO2含量的变异系数接近,而套管法回肠食糜中TiO2含量的变异系数是去盲肠法排泄物和屠宰法回肠食糜中TiO2含量的变异系数的2.35倍。在氨基酸含量的变异上,去盲肠法排泄物中5种氨基酸含量、套管法回肠食糜中10种氨基酸含量、屠宰法回肠食糜中8种氨基酸含量的变异系数超过10%。去盲肠法排泄物、屠宰法回肠食糜和套管法回肠食糜中氨基酸含量的变异系数依次增加。在氨基酸表观消化率的变异上,去盲肠全收粪法测定的8种氨基酸表观消化率、去盲肠指示剂法测定的3种氨基酸表观消化率、套管法测定的12种氨基酸表观消化率、屠宰法测定的1种氨基酸表观消化率的变异系数超过3%。
|
|
表 5 氨基酸含量和氨基酸表观消化率的变异系数 Table 5 CV of amino acid contents and amino acid apparent digestibilities |
饲粮蛋白质在畜禽体内水解成氨基酸或小肽后主要在回肠末端前被吸收,未消化的蛋白质进入后肠后,微生物对蛋白质的降解会影响排泄物氨基酸的组成及含量[21],导致氨基酸消化率与动物体内实际可利用的氨基酸不相符。在成年公鸡(体重约2.0 kg)中,流经回盲结合处进入盲肠的干物质约占排泄物的18%,水分约占17%[22],由此导致鸡粪末端的氨基酸消化率比回肠末端的氨基酸消化率高[23-25]。因此,在饲粮氨基酸表观消化率的测定中,需要获得排除微生物参与降解的消化后样品。目前,主要通过3种手段获取样品。1)去盲肠手术切除盲肠后获得排泄物样品,该方法在德国使用较多[5-6, 26]。其优点是可以收集全部消化后的样品,代表性好。缺点是去盲肠手术耗时长,盲肠肠系膜的毛细血管不通过结扎止血容易发生感染而导致死亡。因此,测定1个样品氨基酸表观消化率的去盲肠鸡数量一般在10只以下[12, 27]。在1个试验中测定多个样品的氨基酸消化率时,为了满足重复数要求,可能需要采用拉丁方设计[27]。在本试验中,去盲肠手术在1 h以上,术后增重恢复符合预期,术后3个月以上仍正常健康的肉鸡为77%~80%。在2个批次的去盲肠手术中,第2批去盲肠手术时间更短,切除盲肠的长度比第1批次长约1 cm;在术后1个月内死亡及淘汰率远高于第1批,而在术后1~2个月内死亡及淘汰率远低于第1批。这主要是第2批手术前试验鸡从笼养中移入代谢笼中2~3 d开始进行手术,应激过大而导致术后1周内术后死亡及淘汰率较高。上述结果也表明,随着外科手术人员去除盲肠操作的娴熟,手术耗时更少,去除盲肠的根部更加彻底,成活率更高。因此,本试验的手术可以获得大批量去盲肠试验鸡。2)在鸡的回肠末端安装套管,收集食糜。该方法在20世纪80~90年代有很少量的文献报道[7-8]。其优点是类似于猪回肠末端氨基酸表观消化率的测定,可以多次收集流经回肠末端的部分食糜样品,样品量可以满足要求。其缺点是禽用套管的内径小,容易出现回肠食糜固液分离。本试验中套管法回肠食糜中TiO2含量显著低于去盲肠法排泄物和屠宰法回肠食糜中,而其中7个氨基酸含量与去盲肠法排泄物有显著差异,且氨基酸含量的变异系数高于去盲肠法排泄物和屠宰法回肠食糜。这可能与套管法收集的食糜出现固液分离(液体更多)有关,由此也说明,套管法收集回肠食糜虽然可以多次采集样品,但样品的代表性并不满意。3)屠宰后收集后段回肠食糜是目前文献报道最多的方法[1-4]。其缺点是回肠食糜的氨基酸含量受取样位置、取样方式的影响[9, 17]。其次,每只鸡获取的样品量较少,每个重复需要屠宰较多的试验鸡才能获得足够的样品用于分析。为了尽可能采集到每只鸡的回肠食糜,需要严格规定屠宰前试验鸡集中采食的时间[28]。再次,该方法所采集的回肠食糜占每天流经回肠食糜总量的比例较少,其代表性存在质疑。本研究中,屠宰法回肠食糜中有4个氨基酸(赖氨酸、组氨酸、苯丙氨酸和甘氨酸)含量与去盲肠法排泄物有差异,且重复变异系数仅稍高于去盲肠法排泄物(9.96% vs. 9.01%),这表明屠宰获得的回肠食糜的代表性与去盲肠法收集的排泄物是接近的。
3.2 去盲肠全收粪法、去盲肠指示剂法、套管法和屠宰法对饲粮氨基酸表观消化率的影响套管法或屠宰法收集回肠食糜均需要通过外源指示剂估测流经回肠的食糜总量,因此,指示剂的测定精度将直接影响氨基酸表观消化率的计算值。本试验中,去盲肠全收粪法与去盲肠指示剂法测定的饲粮氨基酸表观消化率非常接近,且无显著差异,这表明本试验测定TiO2含量准确度高。因此,套管法或屠宰法收集回肠食糜测定氨基酸表观消化率与去盲肠全收粪测定氨基酸表观消化率的比较上可以排除因指示剂的引入而导致的差异。Rezvan等[6]报道,屠宰法收集回肠食糜测定15种氨基酸的表观消化率比去盲肠全收粪法平均低4.7个百分点,而标准误约为去盲肠全收粪法的3.3倍。在本研究中,回肠食糜来自于卵黄囊憩室至回盲结合处前2 cm的肠道内容物。Kluth等[9]的试验结果表明,沿Ross肉鸡卵黄囊憩室至回盲结合处纵向分布的前1/3段、中间1/3段和后1/3段食糜作为消化后样品计算氨基酸表观消化率的差异中,前1/3段食糜样品比中间1/3段和后1/3段食糜样品计算的氨基酸表观消化率低3%~10%。而Poureslami等[17]报道,肉鸡回肠末端食糜样品测定的氨基酸表观消化率与全回肠食糜(卵黄囊憩室至回盲结合处)样品测定的氨基酸表观消化率无显著差异。Kim等[29]比较去盲肠全收粪法与屠宰法测定的氨基酸表观消化率总体上相一致,但不同的原料间有所差异。本试验中,屠宰收集回肠中后段(2/3)食糜,其氨基酸表观消化率与去盲肠收集排泄物测定的氨基酸表观消化率,除3个氨基酸外,其他氨基酸的消化率均无显著差异。在变异系数上,屠宰法甚至低于去盲肠全收粪法(2.22% vs 3.82%)。这表明去盲肠全收粪法与屠宰法在测定饲粮氨基酸表观消化率上具有可比性。Johns等[7]报道套管收集回肠末端食糜测定的氨基酸表观消化率显著低于屠宰收集回肠食糜。本研究也呈现类似的规律,且套管法测定的氨基酸表观消化率的变异系数明显高于屠宰法和去盲肠全收粪法。从套管法回肠食糜中TiO2含量偏低,变异系数为去盲肠法排泄物和屠宰法回肠食糜的2倍以上,可以推断套管法收集回肠末端食糜很可能出现所采集的样品不能代表流经回肠末端的全部食糜,从而导致氨基酸表观消化率测定不准确。
4 结论去盲肠法收集排泄物与屠宰法收集回肠食糜在TiO2、氨基酸含量、氨基酸表观消化率及其变异系数比较接近,且与套管法收集回肠食糜法有较大差异。因此,去盲肠法收集排泄物与屠宰法收集回肠食糜在测定氨基酸的消化率上具有可比性,而套管法收集回肠食糜法不适合用于测定氨基酸表观消化率。
致谢:
感谢北京农学院动物科技学院张华老师在鸡去盲肠手术方面给予的悉心指导!
| [1] |
SHEIKHHASAN B S, MORAVEJ H, SHIVAZAD Mr, et al. Prediction of the total and standardized ileal digestible amino acid contents from the chemical composition of soybean meals of different origin in broilers[J]. Poultry Science, 2020, 99(10): 4947-4957. DOI:10.1016/j.psj.2020.06.033 |
| [2] |
SHEIKHHASAN B S, MORAVEJ H, GHAZIANI F, et al. Relationship between chemical composition and standardized ileal digestible amino acid contents of corn grain in broiler chickens[J]. Poultry Science, 2020, 99(9): 4496-4504. DOI:10.1016/j.psj.2020.06.013 |
| [3] |
LU P Y, WANG J, WU S G, et al. Standardized ileal digestible amino acid and metabolizable energy content of wheat from different origins and the effect of exogenous xylanase on their determination in broilers[J]. Poultry Science, 2020, 99(2): 992-1000. DOI:10.1016/j.psj.2019.10.013 |
| [4] |
WOYENGO T A, KIARIE E, NYACHOTI C M. Metabolizable energy and standardized ileal digestible amino acid contents of expeller-extracted canola meal fed to broiler chicks[J]. Poultry Science, 2010, 89(6): 1182-1189. DOI:10.3382/ps.2009-00595 |
| [5] |
REZVANI M R. Standardisation of precaecal and total tract amino acid digestibility measurement in laying hens[D]. Ph. D. Thesis. Halle-Wittenberg, Germany: Martin Luther University, 2007.
|
| [6] |
REZVANI M, KLUTH H, RODEHUTSCORD M. Comparison of amino acid digestibility determined prececally or based on total excretion of cecectomized laying hens[J]. Poultry Science, 2008, 87(11): 2311-2319. DOI:10.3382/ps.2008-00144 |
| [7] |
JOHNS D C, LOW C K, JAMES K A C. Comparison of amino acid digestibility using the ileal digesta from growing chickens and cannulated adult cockerels[J]. British Poultry Science, 1986, 27(4): 679-685. DOI:10.1080/00071668608416927 |
| [8] |
WARREN B E, FARRELL D J. The nutritive value of full-fat and defatted Australian rice bran.Ⅴ.The apparent retention of minerals and apparent digestibility of amino acids in chickens and adult cockerels fitted with ileal cannulae[J]. Animal Feed Science and Technology, 1991, 34: 323-342. DOI:10.1016/0377-8401(91)90120-H |
| [9] |
KLUTH H, MEHLHORN K, RODEHUTSCORD M. Studies on the intestine section to be sampled in broiler studies on precaecal amino acid digestibility[J]. Archives of Animal Nutrition, 2005, 59(4): 271-279. DOI:10.1080/17450390500217058 |
| [10] |
OLUKOSI O A, BOLARINWA O A, COWIESON A J, et al. Marker type but not concentration influenced apparent ileal amino acid digestibility in phytase-supplemented diets for broiler chickens and pigs[J]. Journal of Animal Science, 2012, 90(12): 4414-4420. DOI:10.2527/jas.2011-4801 |
| [11] |
KADIM I T, MOUGHAN P J. Development of an heal amino acid digestibility assay for the growing chicken-effects of time after feeding and site of sampling[J]. British Poultry Science, 1997, 38(1): 89-95. DOI:10.1080/00071669708417946 |
| [12] |
ZUBER T, SIEGERT W, SALEHI H, et al. Variability of amino acid digestibility of lupin and pea grains in caecectomised laying hens[J]. British Poultry Science, 2019, 60(3): 229-240. DOI:10.1080/00071668.2018.1556389 |
| [13] |
BOURDILLON A, CARRÉ B, CONAN L, et al. European reference method for the in vivo determination of metabolisable energy with adult cockerels: reproducibility, effect of food intake and comparison with individual laboratory methods[J]. British Poultry Science, 1990, 31(3): 557-565. DOI:10.1080/00071669008417287 |
| [14] |
VAN LEEUWEN P, BABINSZKY L, VERSTEGEN M W A, et al. A procedure for ileostomisation of adult roosters to determine apparent ileal digestibility of protein and amino acids of diets: comparison of six diets in roosters and growing pigs[J]. Livestock Production Science, 2000, 67(1/2): 101-111. |
| [15] |
PAYNE W L, KIFER R R, SNYDER D G, et al. Studies of protein digestion in the chicken.1.Investigation of apparent amino acid digestibility of fish meal protein using cecectomized, adult male chickens[J]. Poultry Science, 1971, 50(1): 143-150. DOI:10.3382/ps.0500143 |
| [16] |
赵峰, 张子仪, 侯水生. 鸭的空肠食糜连续采集方法及其空肠套管的设计[J]. 畜牧兽医学报, 2006, 37(7): 672-675. ZHAO F, ZHANG Z Y, HOU S S. Method for continous collection of jejunum digesta and jejunal cannula design for duck[J]. Acta Veterinaria et Zootechnica Sinica, 2006, 37(7): 672-675 (in Chinese). DOI:10.3321/j.issn:0366-6964.2006.07.009 |
| [17] |
POURESLAMI R, BATAL A B, JUNG B. Effect of ileal sub-section and the method of collection of digesta on the determination of apparent ileal digestibility of amino acids in broilers[J]. Animal Feed Science and Technology, 2012, 177(1/2): 130-133. |
| [18] |
OSHO S O, BABATUNDE O O, ADEOLA O. Additivity of apparent and standardized ileal digestibility of amino acids in wheat, canola meal, and sorghum distillers dried grains with solubles in mixed diets fed to broiler chickens[J]. Poultry Science, 2019, 98(3): 1333-1340. DOI:10.3382/ps/pey457 |
| [19] |
MYERS W D, LUDDEN P A, NAYIGIHUGU V, et al. Technical note: a procedure for the preparation and quantitative analysis of samples for titanium dioxide[J]. Journal of Animal Science, 2004, 82(1): 179-183. DOI:10.2527/2004.821179x |
| [20] |
WANG T T, ADEOLA O. Digestibility index marker type, but not inclusion level affects apparent digestibility of energy and nitrogen and marker recovery in growing pigs regardless of added oat bran[J]. Journal of Animal Science, 2018, 96(7): 2817-2825. DOI:10.1093/jas/sky153 |
| [21] |
KONG C, ADEOLA O. Evaluation of amino acid and energy utilization in feedstuff for swine and poultry diets[J]. Asian-Australasian Journal of Animal Science, 2014, 27(7): 917-925. DOI:10.5713/ajas.2014.r.02 |
| [22] |
SON J H, RAGLAND D, ADEOLA O. Quantification of digesta flow into the caeca[J]. British Poultry Science, 2002, 43(2): 322-324. DOI:10.1080/00071660120121562 |
| [23] |
BLOK M C, DEKKER R A. Table 'standardized ileal digestibility of amino acids in feedstuffs for poultry'[R]. Wageningen: Wageningen Livestock Research, 2017.
|
| [24] |
PARSONS C M. Influence of caecectomy on digestibility of amino acids by roosters fed distillers' dried grains with solubles[J]. The Journal of Agricultural Science, 1985, 104(2): 469-472. DOI:10.1017/S0021859600044178 |
| [25] |
WANG Z Y, SHI S R, ZHOU Q Y, et al. The influence of caecectomy on amino acid availability of three feedstuffs for ganders[J]. British Poultry Science, 2008, 49(2): 181-185. DOI:10.1080/00071660801968715 |
| [26] |
ZUBER T. Variability of amino acid digestibility of cereal grains in laying hens[D]. Ph. D. Thesis. Stuttgart, Germany: University of Hohenheim, 2017.
|
| [27] |
ZUBER T, RODEHUTSCORD M. Variability in amino acid digestibility and metabolizable energy of corn studied in cecectomized laying hens[J]. Poultry Science, 2017, 96(6): 1696-1706. DOI:10.3382/ps/pew429 |
| [28] |
SIEGERT W, GANZER C, KLUTH H, et al. Influence of feed provisioning prior to digesta sampling on precaecal amino acid digestibility in broiler chickens[J]. Archives of Animal Nutrition, 2018, 72(3): 190-204. DOI:10.1080/1745039X.2018.1446810 |
| [29] |
KIM E J, UTTERBACK P L, PARSONS C M. Comparison of amino acid digestibility coefficients for soybean meal, canola meal, fish meal, and meat and bone meal among 3 different bioassays[J]. Poultry Science, 2012, 91(6): 1350-1355. DOI:10.3382/ps.2011-01861 |




