动物养殖过程中,受环境、营养、心理等因素影响,易发生肠道炎症,肠道炎症发生的同时往往伴随肝脏疾病,因此,开发新型饲料添加剂缓解肠道和肝脏损伤具有重要意义。Uko等[1]观察到肠道炎症会诱发肝脏并发症,并且大多数治疗炎症性肠病(inflammatory bowel disease,IBD)的药物对肠道和肝脏有不良影响[2]。IBD是一种非特异性肠道炎症疾病,以葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的小鼠结肠炎是最常见的研究模型[3],之前的研究大多集中于利用DSS溃疡性结肠炎模型研究IBD。Kitajima等[4]发现利用DSS处理小鼠后,DSS会分布在肝脏枯否氏细胞、肠系膜淋巴结巨噬细胞和大肠固有层细胞,但目前未见关于DSS处理是否会对肝脏造成损伤的报道。研究发现,活性氧自由基(ROS)参与调控结肠炎的发展[5],抗氧化剂如维生素C、维生素E等具有清除自由基、缓解氧化应激和炎症的作用[6-7]。课题组前期研究发现,微生物源性抗氧化剂(microbe-derived antioxidants,MA)可以缓解敌草快引起的小鼠肝脏和肠道氧化应激,提高空肠养分转运能力[8],缓解肝脏内质网应激[9]。因此,本试验旨在探究DSS处理小鼠是否会发生肝脏损伤以及MA的缓解作用,为肠道炎症疾病及其肝脏损伤的治疗提供新的治疗思路。
1 材料与方法 1.1 试验设计选择48只6周龄C57BL/6J雄性小鼠,预饲养1周后,随机分为4组,每组12只。对照组和DSS组每天每只小鼠灌胃0.020 mL/g BW的生理盐水,低剂量MA组(LMA组)每天每只小鼠灌胃0.002 mL/g BW的MA,高剂量MA组(HMA组)每天每只小鼠灌胃0.003 mL/g BW的MA。对照组每天饮用双蒸水;其余各组1~7 d饮用双蒸水,8~14 d饮用含3% DSS的双蒸水。试验期14 d。小鼠饲养于25 cm×40 cm加不锈钢盖的塑料笼盒中,温度控制在20~25 ℃,相对湿度为50%~60%,光照和黑暗各占12 h,自由饮水,自由采食。试验期结束后1 d将小鼠脱颈处死,解剖后取出肝脏,去除结缔组织,用预冷生理盐水冲洗后装入冻存管,在液氮中速冻之后置于-80 ℃冰箱保存。
1.2 试验材料6周龄C57BL/6J雄性小鼠(18~22 g)购于常州卡文斯实验动物有限公司,生产许可证号:SCXK(苏)2016-0010。小鼠基础饲粮购于江苏协同生物有限公司,其营养水平见表 1。DSS购自美国MP Biomedicals公司;MA(商品名KB-120)由上海江翰生物科技有限公司提供,是以沙棘、刺梨果实为原料,经枯草芽孢杆菌、乳酸杆菌、酵母菌等益菌发酵,经提取、浓缩、灭活、冻干等固液复合发酵处理而成,含有微生素C、维生素E、异黄酮、谷胱甘肽(GSH,glutathione)、超氧化物歧化酶(SOD)和多种微量元素的金属衍生物,MA可清除组织过量ROS,提高小鼠血清中免疫球蛋白A(IgA)含量,提高脾脏淋巴细胞转化率,促进脾脏和胸腺发育。过氧化氢(H2O2)、丙二醛(malondialdehyde,MDA)、GSH含量和总抗氧化能力(total antioxidant capacity,T-AOC)及总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)活性检测试剂盒均购于南京建成生物工程研究所。Trizol购于美国Invitrogen公司。反转录试剂盒PrimeScript RT reagent Kit(Perfect Real Time)和荧光定量PCR试剂盒SYBR Premix Ex TaqTM(Perfect Real Time)购自日本TaKaRa公司。线粒体提取试剂盒购自北京索莱宝科技有限公司。线粒体膜电位检测试剂盒(JC-1法)购自北京雷根生物技术有限公司。
|
|
表 1 基础饲粮营养水平(饲喂基础) Table 1 Nutrient levels of the basal diet (as-fed basis) |
取新鲜肝脏组织转移到4%的多聚甲醛中,通过脱水、石蜡包埋、苏木精-伊红(HE)染色并封片之后,光学显微镜下观察组织形态。
1.4 氧化应激指标及AST、ALT活性测定取冻存的肝脏组织称重后,按1 ∶ 9比例加入生理盐水,冰上匀浆,4 000 r/min离心20 min,取上清液进行相关指标测定。依据试剂盒说明书测定H2O2、MDA、GSH含量T-AOC及T-SOD、GSH-Px、AST和ALT活性。
1.5 线粒体膜电位测定取冻存的肝脏组织200 mg,加入预冷裂解缓冲液(lysis buffer)冰上匀浆,按照试剂盒步骤提取出线粒体。取100 μL纯化的线粒体与900 μL JC-1染色工作液混合,取200 μL转移到96孔板于荧光酶标仪下读数,检测JC-1单体激发光设置为490 nm,发射光设置为590 nm;检测JC-1聚合体激发光设置为525 nm,发射光设置为590 nm,2次读数比值为线粒体膜电位。取20 μL转移至玻板于荧光显微镜下观察,设置绿色荧光蛋白(GFP,标记绿色荧光)观察JC-1单体,设置Cy5(标记红色荧光)观察JC-1聚合物。
1.6 实时荧光定量PCR检测肝脏组织相关基因[含pyrin结构域NOD样受体家族蛋白3(NLRP3)、白细胞介素-18(IL-18)、凋亡相关斑点样蛋白(ASC)、半胱天冬蛋白酶-1(Caspase-1)、白细胞介素-1β(IL-1β)、端粒酶逆转录酶(Tert)、肿瘤坏死因子-α(TNF-α)、细胞外调节蛋白激酶(PERK)、活化转录因子6 (ATF6)、肌醇依赖性激酶1(IRE1)和葡萄糖调节蛋白78(GRP78)]表达:将肝脏组织在液氮中研磨后使用Trizol法提取RNA,并用Nanodrop测定RNA浓度,按照PrimeScript RT reagent Kit(Perfect Real Time)说明书进行,首先去除基因组DNA,反应条件为42 ℃ 2 min,4 ℃ 30 s。将RNA逆转录为cDNA,反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 30 s。设计引物序列并委托Invitrogen公司合成。引物序列见表 2。以cDNA为模板,根据SYBR Premix Ex TaqTM (Perfect Real Time)试剂盒进行实时荧光定量PCR反应,反应条件:预变性,95 ℃ 30 s;PCR反应,95 ℃ 3 s,60 ℃ 30 s;熔解曲线,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,循环40次。实时荧光定量PCR结果以β-肌动蛋白(β-actin)作为内参基因,采用2-ΔΔCt法计算待测样品的相对表达量。
|
|
表 2 引物序列 Table 2 Primer sequence |
采用SPSS 20.0软件进行统计分析,采用单因素方差分析(one-way ANOVA)和LSD法统计组间差异,结果以均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
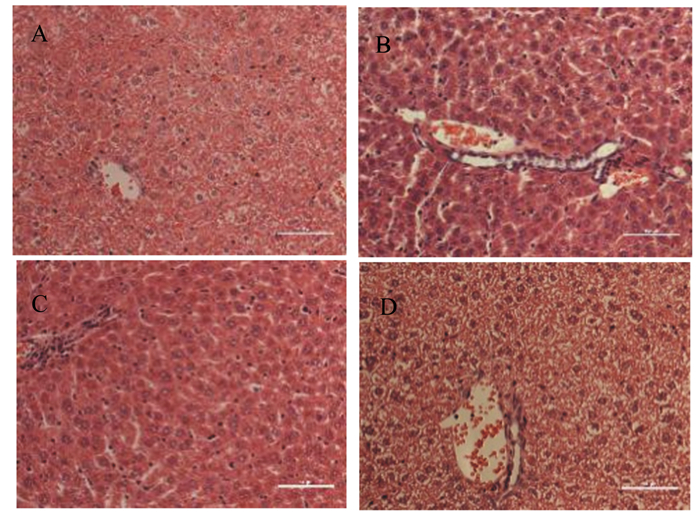
2 结果与分析 2.1 肝脏组织切片HE染色如图 1所示,DSS组小鼠的肝小叶中央汇管区炎性细胞浸润,肝细胞发生脂肪变性;HMA组的DSS诱导结肠炎发生的肝脏病理变化明显改善。这表明MA缓解了DSS引起的肝脏组织损伤。
|
图 1 对照组(A)、DSS组(B)、LMA组(C)和HMA组(D)的肝脏组织形态 Fig. 1 Liver histomorphology of control group (A), DSS group (B), LMA group (C) and HMA group (D) (200×) |
如表 3所示,与对照组相比,DSS组H2O2、MDA含量极显著升高(P<0.01),T-SOD、GSH-Px活性和GSH含量及T-AOC显著或极显著降低(P<0.05或P<0.01)。与DSS组相比,LMA组H2O2含量显著降低(P<0.05),T-AOC和GSH-Px活性显著升高(P<0.05);HMA组H2O2、MDA含量显著降低(P<0.05),T-SOD、GSH-Px活性和GSH含量及T-AOC显著升高(P<0.05)。这表明DSS诱导肝脏组织发生氧化应激,MA清除肝脏组织过量ROS,提高肝脏组织抗氧化能力。
|
|
表 3 肝脏组织氧化应激指标 Table 3 Liver tissue oxidative stress indexes |
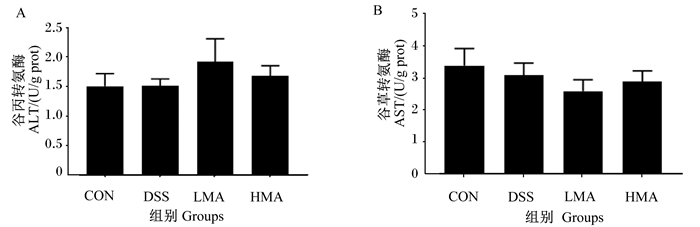
如图 2所示,与对照组相比,DSS组AST和ALT活性降低,但差异不显著(P>0.05)。与DSS组相比,LMA组和HMA组AST和ALT活性没有显著差异(P>0.05)。这表明DSS未造成肝脏AST和ALT活性下降。
|
数据柱标*表示与对照组相比差异显著(P<0.05),标#表示与DSS组相比差异显著(P<0.05)。下图同。 Value columns with * mean significant difference compared with the control group (P < 0.05), and with # mean significant difference compared with the DSS group (P < 0.05). The same as below. 图 2 肝脏ALT活性(A)和AST活性(B) Fig. 2 Activities of ALT (A) and AST (B) in liver |
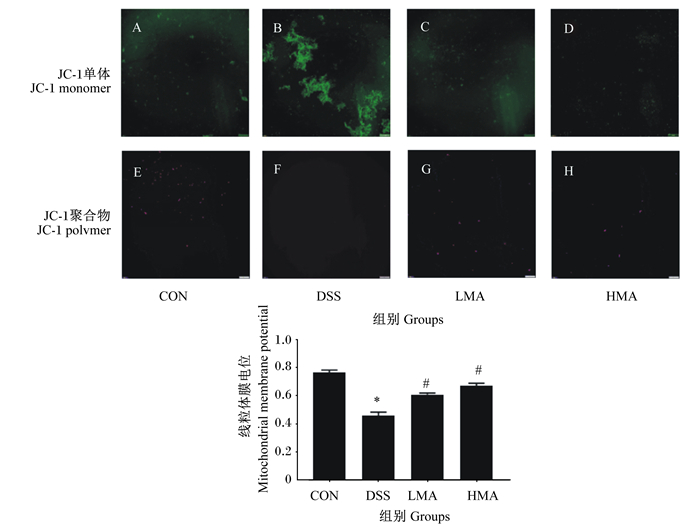
如图 3所示,与对照组相比,DSS组绿色荧光强度明显增强,且观察不到红色荧光;MA处理后绿色荧光强度明显减弱,红色荧光强度明显增强。与对照组相比,DSS组线粒体膜电位显著降低(P<0.05);与DSS组相比,LMA组和HMA组线粒体膜电位显著升高(P<0.05)。这表明MA缓解DSS引起的肝脏线粒体膜电位下降。
|
A、B、C、D:GFP荧光图;E、F、G、H:Cy5荧光图。 A, B, C and D: GFP fluorescence image; E, F, G and H: Cy5 fluorescence image. 图 3 肝脏线粒体膜电位 Fig. 3 Liver mitochondrial membrane potential |
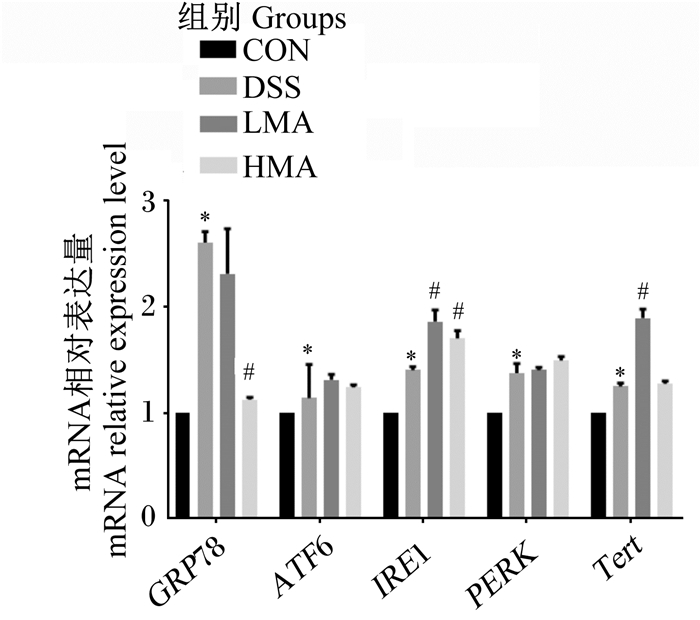
如图 4所示,与对照组相比,DSS组GRP78、ATF6、IRE1、PERK、Tert mRNA相对表达量显著升高(P<0.05)。与DSS组相比,LMA组IRE1、Tert mRNA相对表达量显著升高(P<0.05),GRP78、ATF6、PERK mRNA相对表达量没有显著差异(P>0.05);HMA组GRP78 mRNA相对表达量显著降低(P<0.05),IRE1 mRNA相对表达量显著升高(P<0.05),ATF6、PERK mRNA相对表达量没有显著差异(P>0.05)。这表明MA缓解DSS引起的肝脏内质网应激。
|
GRP78:葡萄糖调节蛋白78 glucose regulated protein 78;ATF6:活化转录因子6 activating transcription factor 6;IRE1:肌醇依赖性激酶1 inositol requiring enzyme 1;PERK:细胞外调节蛋白激酶extracellular regulated protein kinases;Tert:端粒酶逆转录酶telomerase reverse transcriptase。 图 4 肝脏GRP78、ATF6、IRE1、PERK和Tert mRNA表达 Fig. 4 Liver GRP78, ATF6, IRE1, PERK and Tert mRNA expression |
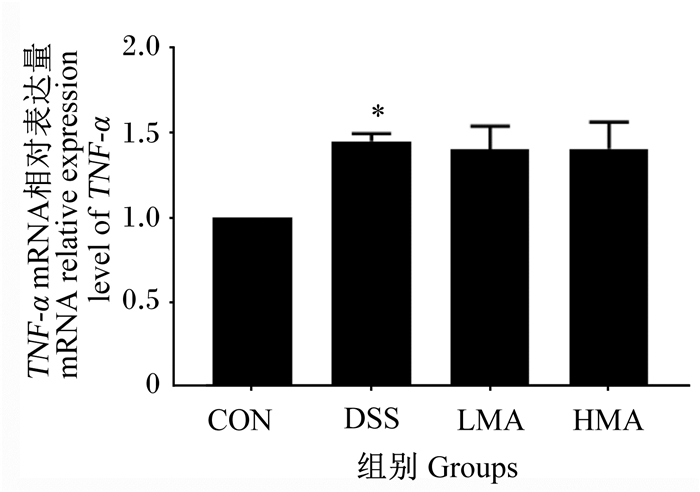
如图 5所示,与对照组相比,DSS组TNF-α mRNA相对表达量显著升高(P<0.05)。与DSS组相比,LMA组和HMA组TNF-α mRNA相对表达量没有显著差异(P>0.05)。这表明DSS诱发肝脏发生炎症,MA对DSS处理后肝脏TNF-α mRNA表达没有显著影响。
|
图 5 肝脏TNF-α mRNA表达 Fig. 5 Liver TNF-α mRNA expression |
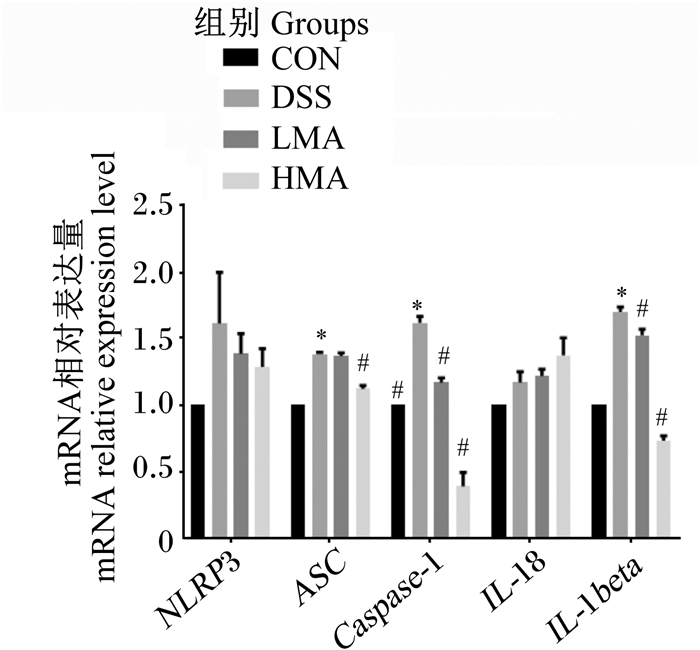
如图 6所示,与对照组相比,DSS组ASC、Caspase-1、IL-1β mRNA相对表达量显著升高(P<0.05),NLRP3、IL-18 mRNA相对表达量没有显著差异(P>0.05)。与DSS组相比,LMA组Caspase-1、IL-1β mRNA相对表达量显著降低(P<0.05),HMA组ASC、Caspase-1、IL-1β mRNA相对表达量显著降低(P<0.05)。这表明NLRP3相关基因参与调控MA缓解DSS引起的肝脏炎症。
|
NLRP3:Nod样受体家族含pyrin结构域蛋白3 Nod-like receptor family pyrin domain-containing protein 3;ASC:凋亡相关斑点样蛋白apoptosis-associated speck-like protein containing a CARD;Caspase-1:半胱天冬蛋白酶-1 cysteine aspartatespecific proteinase-1;IL-18:白细胞介素-18 interleukin-18;IL-1β:白细胞介素-1β interleukin-1β。 图 6 肝脏NLRP3、ASC、Caspase-1、IL-18、IL-1β mRNA表达 Fig. 6 Liver NLRP3, ASC, Caspase-1, IL-18 and IL-1β mRNA expression |
本研究发现,DSS处理后小鼠肝脏H2O2和MDA含量极显著升高,肝脏T-SOD、GSH-Px活性和GSH含量及T-AOC显著或极显著降低,表明肝脏产生过量自由基发生氧化应激,组织抗氧化能力下降。线粒体功能是细胞健康的重要指标,是评估线粒体功能的指标之一,线粒体膜电位越高,促进细胞能量转换越强[10],在各种凋亡信号的诱导下,线粒体会发生显著的结构与功能性的变化,比如线粒体膜电位的丢失、电子传递链的变化以及细胞内氧化还原状态的变化[11]。本试验中,DSS处理后,肝脏线粒体膜电位显著降低,表明肝脏细胞处于凋亡早期。氧化应激是导致肝功能异常变化的原因之一[12],当肝细胞受损,会释放AST、ALT进入血液循环[13],AST主要存在于线粒体中,肝细胞坏死严重时,AST活性才会明显变化,ALT绝大多数存在于细胞质中[14]。本试验结果发现,DSS处理后,肝脏AST和ALT活性虽然有下降趋势但差异不显著,仍说明肝脏有部分AST和ALT释放。GPR78是发生内质网应激的标志性蛋白,当内质网处于应激状态时,大量未折叠或错误折叠蛋白堆积于内质网腔中,GRP78与ATF-6和PERK感应蛋白解离,转而与未折叠蛋白结合[15],IRE1可被未折叠蛋白直接激活[16],导致其相对表达量升高;Tert表达是检测肝脏组织内端粒酶活性的重要指标,端粒酶活性及Tert mRNA相对表达量与细胞坏死凋亡具有相关性[17]。在本试验中,DSS处理后,GRP78、ATF6、IRE1、PERK、Tert mRNA相对表达量显著升高,肝脏组织出现炎性细胞浸润和脂肪变性,炎性因子IL-1β和TNF-α mRNA表达量显著上升,表明肝脏发生内质网应激并有早期凋亡、炎症和组织损伤。
本研究发现,MA处理后,LMA组和HMA组肝脏H2O2含量显著下降,HMA组肝脏MDA含量显著下降,LMA组和HMA组肝脏T-AOC和GSH-Px活性显著升高,HMA组肝脏T-SOD活性和GSH含量也显著升高,这一结果与报道中花青素等抗氧化剂可以有效降低肝脏中H2O2和MDA含量的结果[18-19]一致。MA处理后,LMA组和HMA组肝脏线粒体膜电位显著升高,表明MA能够有效改善细胞凋亡。HMA处理后,HMA组肝脏GRP78 mRNA相对表达量显著降低,LMA组和HMA组肝脏IRE1 mRNA相对表达量显著升高,可能是在内质网应激时短期活化IRE1可剪切X盒结合蛋白-1(X-box binding protein 1,XBP-1)mRNA来促进细胞生存[20],小鼠肝脏炎性细胞浸润和脂肪变性有明显改善;LMA组和HMA组肝脏IL-1β mRNA相对表达量显著下降,表明MA可以缓解肝脏内质网应激、炎症反应和组织损伤,出现一定的剂量依赖性。
本研究发现,DSS处理后,小鼠肝脏ASC、Caspase-1、IL-1β mRNA相对表达量显著升高,表明NLRP3炎性小体参与了肝脏炎症调控。MA处理后,LMA组和HMA组肝脏Caspase-1、IL-1β mRNA相对表达量显著降低,HMA组肝脏ASC mRNA相对表达量显著降低。有报道发现,NLRP3基因表达后小鼠IBD的病死率显著提高[21],当肠道屏障受损肠肝轴[22]会放大肠道与肝脏Toll样受体(Toll like receptors,TLRs)之间的关联信号[23],导致肝脏损伤,白细胞介素受体相关激酶(interleukin receptor associated kinase,IRAK)会绕过引发过程,并将TLRs快速连接到NLRP3炎性小体使其被激活[24],DSS在肝脏枯否氏细胞分布,DSS可以通过巨噬细胞上的TLRs诱导炎症[25],从而进一步促进肝病的发展。
4 结论综上所述,DSS诱发了小鼠肝脏组织损伤、氧化应激、内质网应激、膜电位下降和炎症反应,MA对此有明显的缓解作用,其中高剂量MA的缓解作用更强,并且NLRP3炎性小体参与调控炎症。
| [1] |
UKO V, THANGADA S, RADHAKRISHNAN K. Liver disorders in inflammatory bowel disease[J]. Gastroenterology Research and Practice, 2012, 2012: 642923. |
| [2] |
ROGLER G. Gastrointestinal and liver adverse effects of drugs used for treating IBD[J]. Best Practice & Research Clinical Gastroenterology, 2010, 24(2): 157-165. |
| [3] |
CHOI J H, MOON C M, SHIN T S, et al. Lactobacillus paracasei-derived extracellular vesicles attenuate the intestinal inflammatory response by augmenting the endoplasmic reticulum stress pathway[J]. Experimental & Molecular Medicine, 2020, 52(12): 423-437. |
| [4] |
KITAJIMA S, TAKUMA S, MORIMOTO M. Tissue distribution of dextran sulfate sodium (DSS) in the acute phase of murine DSS-induced colitis[J]. Journal of Veterinary Medical Science, 1999, 61(1): 67-70. DOI:10.1292/jvms.61.67 |
| [5] |
LI B, ALLI R, VOGEL P, et al. IL-10 modulates DSS-induced colitis through a macrophage-ROS-NO axis[J]. Mucosal Immunology, 2014, 7(4): 869-878. DOI:10.1038/mi.2013.103 |
| [6] |
RIGHI N C, SCHUCH F B, DE NARDI A T, et al. Effects of vitamin C on oxidative stress, inflammation, muscle soreness, and strength following acute exercise: meta-analyses of randomized clinical trials[J]. European Journal of Nutrition, 2020, 59(7): 2827-2839. DOI:10.1007/s00394-020-02215-2 |
| [7] |
PIRHADI-TAVANDASHTI N, IMANI H, EBRAHIMPOUR-KOUJAN S, et al. The effect of vitamin E supplementation on biomarkers of endothelial function and inflammation among hemodialysis patients: a double-blinded randomized clinical trial[J]. Complementary Therapies in Medicine, 2020, 49: 102357. DOI:10.1016/j.ctim.2020.102357 |
| [8] |
CHEN X D, SHO T K M, XU W N, et al. Microbe-derived antioxidants promote the expression of nutrient transporters through regulating apoptosis and autophagy in mice challenged with diquat[J]. International Journal of Agriculture And Biology, 2019, 22(5): 1155-1160. |
| [9] |
徐雪, TAKAMI S, 张京, 等. 微生物源性抗氧化剂对diquat诱导的小鼠肝脏氧化应激、内质网应激和功能的影响[J]. 中华肝脏病杂志, 2020, 28(5): 441-445. XU X, TAKAMI S, ZHANG J, et al. Effects of microbial-derived antioxidants on diquat-induced oxidative stress, endoplasmic reticulum stress and function in mice liver[J]. Chinese Journal of Hepatology, 2020, 28(5): 441-445 (in Chinese). DOI:10.3760/cma.j.cn501113-20200316-00116 |
| [10] |
SAKAMURU S, ATTENE-RAMOS, XIA M H. Mitochondrial membrane potential assay[M]//ZHU H, XIA M. High-throughput screening assays in toxicology. New York, NY: Humana Press, 2016.
|
| [11] |
SHIMIZU S, NARITA M, TSUJIMOTO Y. Correction: Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel VDAC[J]. Nature, 2000, 399(6735): 483-487. |
| [12] |
GIANNINI E, BOTTA F, FASOLI A, et al. Progressive liver functional impairment is associated with an increase in AST/ALT ratio[J]. Digestive Diseases and Sciences, 1999, 44(6): 1249-1253. DOI:10.1023/A:1026609231094 |
| [13] |
苗启翔, 谢彦娇, 唐湘方, 等. 氧化应激的产生及其对畜禽肝脏功能的影响与机制[J]. 动物营养学报, 2019, 31(8): 3496-3504. MIAO Q X, XIE Y J, TANG X F, et al. The production of oxidative stress and its effect on liver function of livestock and poultry and its mechanism[J]. Chinese Journal of Animal Nutrition, 2019, 31(8): 3496-3504 (in Chinese). |
| [14] |
代俊合, 谷德权, 王超强, 等. AST/ALT比值测定在肝炎及肝硬化中的临床意义[J]. 临床荟萃, 2001, 16(24): 1131. DAI J H, GU D Q, WANG C Q, et al. The clinical significance of AST/ALT ratio determination in hepatitis and liver cirrhosis[J]. Clinical Focus, 2001, 16(24): 1131 (in Chinese). DOI:10.3969/j.issn.1004-583X.2001.24.023 |
| [15] |
WALTER P, RON D. The unfolded protein response: from stress pathway to homeostatic regulation[J]. Science, 2011, 334(6059): 1081-1086. DOI:10.1126/science.1209038 |
| [16] |
HETZ C, MARTINON F, RODRIGUEZ D, et al. The unfolded protein response: integrating stress signals through the stress sensor IRE1α[J]. Physiological Reviews, 2011, 91(4): 1219-1243. DOI:10.1152/physrev.00001.2011 |
| [17] |
MIURA N, OSAKI Y, NAGASHIMA M, et al. A novel biomarker TERT mRNA is applicable for early detection of hepatoma[J]. BMC Gastroenterology, 2010, 10: 46. DOI:10.1186/1471-230X-10-46 |
| [18] |
张艳梅. 沙葱黄酮对氧化应激小尾寒羊肝脏的保护作用及其机制研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019: 49-50. ZHANG Y M. Protective effect and mechanism of flavonoids from Allium spp. on the liver of oxidative stress small-tailed Han sheep[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University 2019: 49-50. (in Chinese) |
| [19] |
宓伟, 练武, 尹淑英, 等. 山楂原花青素及维生素C对胰岛素抵抗大鼠肝脏氧化应激的影响[J]. 中草药, 2016, 47(4): 625-629. MI W, LIAN W, YIN S Y, et al. Effects of hawthorn proanthocyanidins and vitamin C on oxidative stress in the liver of insulin-resistant rats[J]. Chinese Herbal Medicine, 2016, 47(4): 625-629 (in Chinese). |
| [20] |
BAREZ S R, ATAR A M, AGHAEI M. Mechanism of inositol-requiring enzyme 1-alpha inhibition in endoplasmic reticulum stress and apoptosis in ovarian cancer cells[J]. Journal of Cell Communication and Signaling, 2020, 14(4): 403-415. DOI:10.1007/s12079-020-00562-7 |
| [21] |
BAUER C, DUEWELL P, LEHR H A, et al. Protective and aggravating effects of NLRP3 inflammasome activation in IBD models: influence of genetic and environmental factors[J]. Digestive Diseases, 2012, 30(Suppl.1): 82-90. |
| [22] |
TRIPATHI A, DEBELIUS J, BRENNER D A, et al. Publisher correction: the gut-liver axis and the intersection with the microbiome[J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(12): 785. |
| [23] |
PAOLELLA G, MANDATO C, PIERRI L, et al. Gut-liver axis and probiotics: their role in non-alcoholic fatty liver disease[J]. World Journal of Gastroenterology, 2014, 20(42): 15518-15531. DOI:10.3748/wjg.v20.i42.15518 |
| [24] |
LIN K M, HU W, TROUTMAN T D, et al. IRAK-1 bypasses priming and directly links TLRs to rapid NLRP3 inflammasome activation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(2): 775-780. DOI:10.1073/pnas.1320294111 |
| [25] |
KOZICKY L K, MENZIES S C, HOTTE N, et al. Intravenous immunoglobulin (IVIg) or IVIg-treated macrophages reduce DSS-induced colitis by inducing macrophage IL-10 production[J]. European Journal of Immunology, 2019, 49(8): 1251-1268. |




