全球范围内,每年约有25%的谷物受到霉菌毒素污染,给畜牧业造成了巨大的经济损失[1]。目前已发现的霉菌毒素有200多种,其中黄曲霉毒素(aflatoxins,AFs)、玉米赤霉烯酮(zearalenone,ZEA)及呕吐毒素(deoxynivalenol,DON)是饲料中最常见的3类霉菌毒素[2]。黄曲霉毒素是一类主要由黄曲霉和寄生曲霉产生的次级代谢产物,常见的有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2),其中以AFB1毒性最强,具有致癌性[3]。ZEA主要由镰刀菌产生,具有高毒性,广泛存在于玉米、小麦等饲料原料中,是一种雌激素类似物,可导致畜禽性激素机能紊乱,还具有一定程度的肝脏毒性、遗传毒性及免疫毒性[4-5]。DON又称脱氧雪腐镰刀菌烯醇,是由镰刀菌属产生的低分子质量次级代谢产物,可导致畜禽胃肠功能紊乱、皮肤黏膜损伤及免疫性能低下[6-7]。
我国《饲料卫生标准》(GB 13078—2017)[8]中规定了霉菌毒素的限量,如AFB1在玉米加工产品中的限量为≤50 μg/kg,在仔猪配合饲料中的限量为≤10 μg/kg;ZEA在玉米等饲料原料中的限量为≤0.5 mg/kg;DON在植物性饲料原料中的限量为≤5 mg/kg,在猪配合饲料中的限量为≤1 mg/kg。建立饲料中霉菌毒素的检测方法对于筛选合格饲料、保障畜禽机体健康及畜禽产品安全具有重要的意义。目前,霉菌毒素的检测方法主要有薄层色谱法[9-11]、免疫层析法[12-13]、酶联免疫吸附法[14-16]、高效液相色谱(HPLC)法[17-19]以及液相色谱-串联质谱法[20-22],其中薄层色谱法、免疫层析法和酶联免疫吸附法主要用于霉菌毒素的快速筛检,而HPLC法和液相色谱-串联质谱法则主要用于霉菌毒素的定量分析。HPLC法对仪器设备要求低,但通常只能用于单种霉菌毒素的检测;液相色谱-串联质谱法可用于多种霉菌毒素的同步检测,但仪器设备昂贵且维护成本高,不适于基层实验室对霉菌毒素的定量分析。目前可同步检测多种霉菌毒素的HPLC法相关文献报道较少。因此,本试验旨在建立一种对饲料中AFB1、ZEA及DON含量同步检测的HPLC法,为基层实验室中饲料霉菌毒素的快速定量检测提供方法参考。
1 材料与方法 1.1 仪器与试剂高效液相色谱仪:Agilent Technologies 1200系列,美国Agilent Technologies公司;超纯水仪:Millipore Milli-Q纯化系统,美国Merck Millipore公司;电子分析天平:BSA124S,德国赛多利斯科学仪器有限公司;旋涡混合器:HQ-60-Ⅱ,北京同方股份有限公司;高速冷冻离心机:3-30K型,德国Sigma公司;Clover光化学衍生器,IAC-SEP黄曲霉毒素-呕吐毒素-玉米赤霉烯酮(ADZ)三合一免疫亲和柱,北京中检维康生物技术有限公司;SymmetryShield RP18色谱柱(4.6 mm×150 mm,5 μm),沃特世科技(上海)有限公司;HSC-24B水浴氮吹仪,天津恒奥科技发展有限公司。
甲醇、乙腈,色谱纯,德国Merck公司;AFB1、ZEA、DON标准品溶液(1 mg/mL),美国Sigma公司;吐温-20(tween-20),分析纯,上海阿拉丁生化科技股份有限公司;氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾,分析纯,北京化工厂有限责任公司,用于配制pH 7.0的磷酸盐缓冲液(PBS,称取8.0 g氯化钠、1.44 g磷酸氢二钠、0.24 g磷酸二氢钾、0.2 g氯化钾,用990 mL纯水溶解,然后用浓盐酸调节pH至7.0,最后用纯水稀释至1 000 mL)。
1.2 色谱条件色谱柱:SymmetryShield RP18色谱柱(4.6 mm×150 mm,5 μm)。流动相组成为水/甲醇,荧光检测器激发波长为360 nm,发射波长为440 nm,紫外检测器设置双波长为218 nm/265 nm。柱温30 ℃,进样量40 μL,流速0.8 mL/min,洗脱时间为20 min,洗脱程序为:有机相(甲醇)在0~7 min时质量分数为30%,7~8 min时质量分数由30%变为75%并保持至第15 min,15~16 min时质量分数由75%变为30%并保持至第20 min。
1.3 标准溶液配制本实验室购买的AFB1、ZEA、DON标准品溶液浓度均为1 mg/mL。准确移取一定体积的AFB1、ZEA、DON标准品溶液,用50%甲醇-水稀释,最终配成AFB1浓度分别为1.0、2.5、5.0、10.0、20.0、50.0 ng/mL,ZEA浓度分别为50、125、250、500、1 000、2 500 ng/mL,DON浓度分别为100、250、500、1 000、2 000、5 000 ng/mL的三合一霉菌毒素标准工作溶液。在所设定的液相色谱条件下,按照低浓度至高浓度进行进样,采用外标法定量,作峰面积-浓度标准曲线,得到3种霉菌毒素的标准曲线回归方程。
1.4 样品处理方法准确称取试样2.0 g于50 mL离心管中,准确加入20 mL乙腈-水(体积比6 ∶ 4)溶液,振荡30 min,以6 010×g高速离心10 min。准确移取2.0 mL上清液并加入28.0 mL含1%吐温-20的PBS(pH 7.0)稀释,备用。将上述30 mL滤液以1~2滴/s的流速全部通过ADZ三合一免疫亲和柱,直至空气进入亲和柱。将10 mL纯水以1~2滴/s的流速通过亲和柱,直至空气进入亲和柱。将2 mL色谱级甲醇以1滴/s的流速淋洗亲和柱,将淋洗液收集于玻璃试管中。50 ℃下浓缩氮气吹干后,用50%甲醇-水定容至0.5 mL,供HPLC分析。
1.5 结果计算按照以下公式计算饲料样品中各种霉菌毒素的含量:
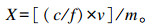
|
式中:X为试样中霉菌毒素(AFB1、ZEA、DON)的含量(μg/kg);c为由标准曲线得到试液中霉菌毒素的浓度(ng/mL);v为饲料样品加入乙腈-水定容体积(mL);f为浓缩倍数;m为所称取的样品质量(g)。
2 结果与分析 2.1 标准曲线的制备按选定的色谱条件对已配制的三合一霉菌毒素标准工作溶液进行上样检测,以各霉菌毒素标准品溶液浓度为横坐标(X,ng/mL),色谱峰面积为纵坐标(Y),绘制标准曲线。由表 1可知,AFB1标准品溶液浓度在2.5~50.0 ng/mL、ZEA标准品溶液浓度在50~2 500 ng/mL、DON标准品溶液浓度在250~5 000 ng/mL时线性关系良好,相关系数均大于0.99。
|
|
表 1 3种霉菌毒素的线性范围、回归方程及相关系数 Table 1 Linear ranges, linear regression equations and correlation coefficients of three mycotoxins |
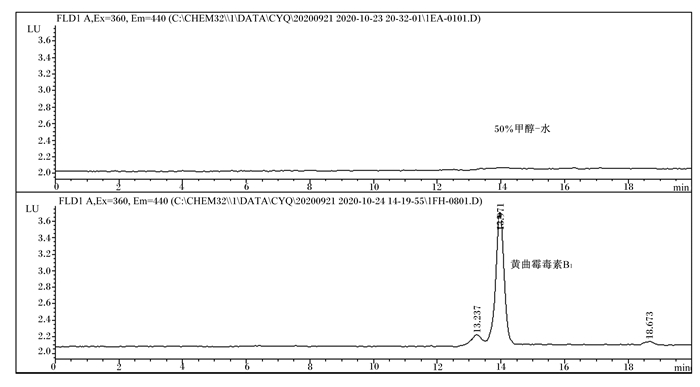
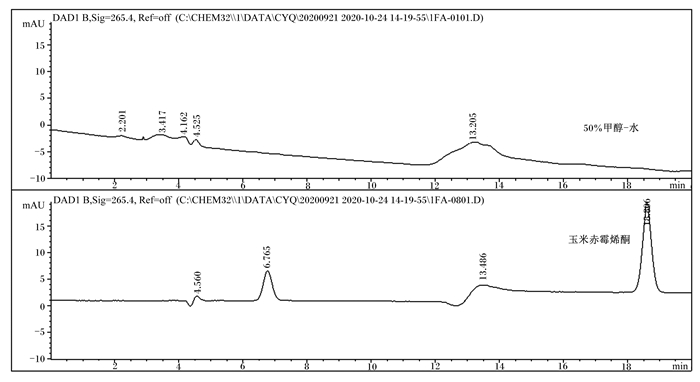
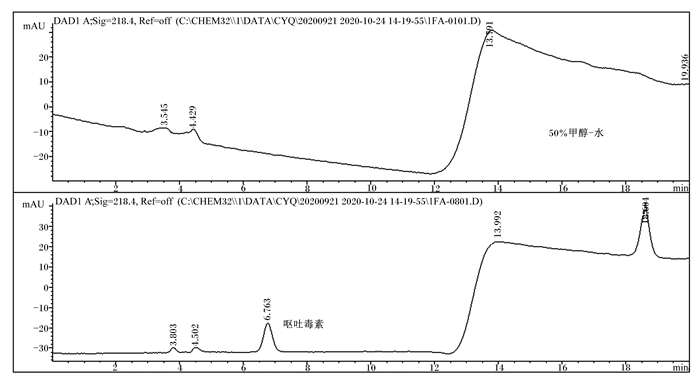
空白溶剂(50%甲醇-水)及霉菌毒素标准品溶液(AFB1:50.0 ng/mL,ZEA:2 500 ng/mL,DON:5 000 ng/mL)的色谱图分别见图 1~图 3。由图可知,在本研究所建HPLC法下,3种霉菌毒素的峰型较稳定,周围杂质峰干扰少,分离效果良好,可准确定量检测霉菌毒素含量。以信噪比(S/N)为3和10作为最低检出限和定量限,确定AFB1、ZEA、DON的检出限分别为0.5、7.5和37.5 ng/mL,定量限分别为1.5、25.0和125.0 ng/mL,均能满足国家及行业有关霉菌毒素限量标准要求。
|
图 1 空白溶剂和AFB1标准溶液色谱图 Fig. 1 Chromatograms of blank solvent and AFB1 standard solution |
|
图 2 空白溶剂和ZEA标准溶液色谱图 Fig. 2 Chromatograms of blank solvent and ZEA standard solution |
|
图 3 空白溶剂和DON标准溶液色谱图 Fig. 3 Chromatograms of blank solvent and DON standard solution |
称取空白肉鸡饲料做回收试验,每种霉菌毒素设置3个添加浓度,每个添加浓度进行3次平行测定,按1.4方法进行处理,上样检测,测定的3种霉菌毒素回收率见表 2。由表可知,用所建HPLC法进行霉菌毒素的添加回收试验,3种霉菌毒素均可达到较稳定的回收率,在81.2%~92.3%,相对标准偏差(RSD)在4.3%~9.5%。
|
|
表 2 3种霉菌毒素的回收率 Table 2 Recoveries of three mycotoxins |
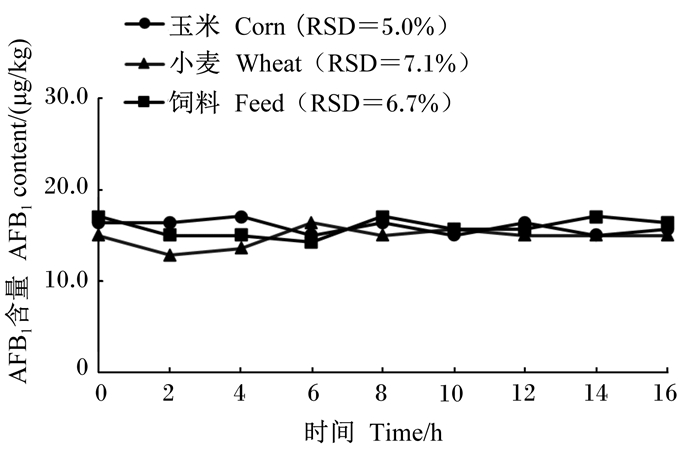
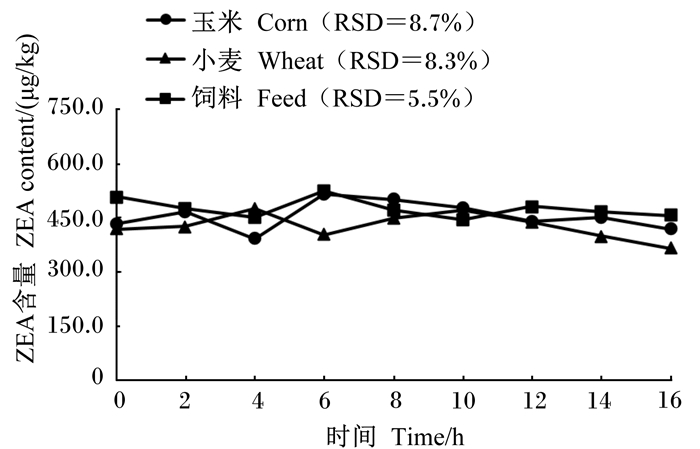
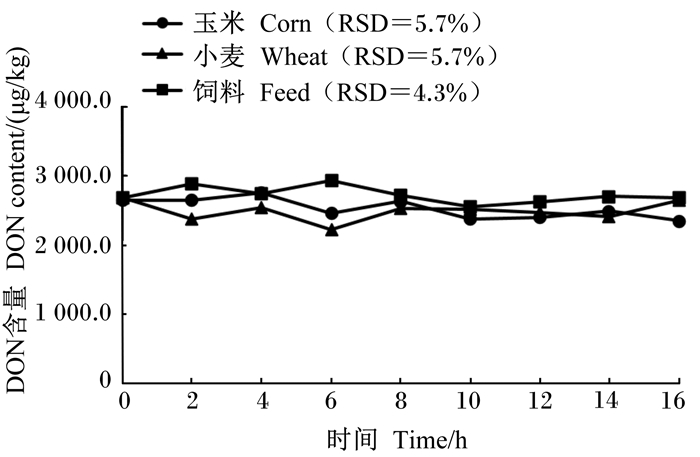
为了进一步验证所建HPLC法对不同饲料样品的适用性以及同一样品标准溶液在不同时间段测定结果的稳定性,称取空白玉米原料、小麦原料及猪配合饲料,参照我国《饲料卫生标准》(GB 13078—2017)[8]的限定值添加霉菌毒素,3种空白饲料加标样品中AFB1、ZEA、DON标准溶液的添加浓度分别为20、500和3 000 μg/kg,按1.4方法进行处理,每间隔2 h进行上样检测,共检测9次,不同加标样品溶液中AFB1、ZEA和DON含量随时间变化结果见图 4至图 6,在玉米原料、小麦原料及猪配合饲料加标样品溶液中,不同时间段AFB1、ZEA和DON检测值间的RSD均小于9.0%。
|
图 4 不同加标样品溶液中AFB1检测含量随时间的变化 Fig. 4 Changes of AFB1 detection content in different spiked sample solutions with time |
|
图 5 不同加标样品溶液中ZEA检测含量随时间的变化 Fig. 5 Changes of ZEA detection content in different spiked sample solutions with time |
|
图 6 不同加标样品溶液中DON检测含量随时间的变化 Fig. 6 Changes of DON detection content in different spiked sample solutions with time |
采集送检肉鸭配合饲料、玉米芯粉、玉米、小麦饲料样品共计41份,采用所建HPLC法检测每份饲料样品中的AFB1、ZEA及DON总含量。由表 3可知,所有饲料样品均检测出1种以上霉菌毒素,肉鸭配合饲料中AFB1检出率100%,超标率达81.8%;玉米芯粉中ZEA含量严重超标,检出率及超标率均达100.0%;4种饲料样品中DON含量未有超标,检出率为27.3%~100.0%。
|
|
表 3 4种饲料样品中霉菌毒素的检测含量 Table 3 Mycotoxin detection contents in 4 kinds of feed samples |
试验首先针对色谱条件的选择与优化2个方面进行了重点研究。对于霉菌毒素检测波长的选择,不同文献报道的不尽相同。Gell等[23]在激发波长365 nm,发射波长455 nm色谱荧光检测条件下定量检测真菌培养物中的AFB1含量,取得良好效果;Kim等[24]所建立的同时检测黄曲霉毒素(AFB1、AFB2、AFG1、AFG2)和赭曲霉毒素A(ochratoxin A,OTA)含量的HPLC法,可准确用于动物饲料中霉菌毒素定量分析,其中黄曲霉毒素荧光检测条件为激发波长360 nm,发射波长450 nm。班晓敏[25]和何苗等[26]的试验均采用218 nm紫外检测波长检测饲料中DON含量,具有较高的准确度。而ZEA既可通过荧光检测器进行测定,对于紫外检测器也有较好的响应效果,其检测波长不同报道有所差异[27-29]。参照前人研究文献及免疫亲和柱产品说明书,以霉菌毒素峰形和分离效果为指标,本研究对检测波长进行了筛选优化,最终采用荧光检测器-柱后衍生的方法在激发波长、发射波长分别为360、440 nm时对AFB1含量进行检测,采用紫外检测器在检测波长分别为265、218 nm时分别对ZEA和DON含量进行检测。
对于流动相的选择,液相色谱检测多以乙腈与水或甲醇与水体系为主[30-31]。本研究通过对AFB1、ZEA、DON单标采用这2种流动相体系进行上样分析,结果发现:甲醇与水流动相体系下,霉菌毒素峰对称性好、分离效果最佳,故将其作为同步检测3种霉菌毒素的流动相体系。通过对AFB1、ZEA、DON标准溶液在不同比例的甲醇∶水(1 ∶ 1、2 ∶ 8、3 ∶ 7、4 ∶ 6)条件下进样分析,发现DON最早出峰,且当甲醇: 水比例为3 ∶ 7时,DON峰形最佳,故洗脱程序起始设置为30%有机相保持7 min使DON得以洗脱出来。通过数次更换不同时间段的流动相比例及洗脱时间对三合一霉菌毒素标准品进行上样分析,观察出峰时间、峰面积及分离效果,以优化洗脱程序,最终确定了1.2色谱条件中所述的洗脱程序。该洗脱程序洗脱时间仅为20 min,可同步检测饲料中AFB1、ZEA及DON含量,而研究表明,这3种霉菌毒素单独检测时其上样分析时间均在10 min以上[26, 32-33]。因此,本研究所建方法检测时长相对较短,可大大提高检测效率。
3.2 回收率和精密度添加回收试验是验证霉菌毒素检测方法的重要组成部分,对于同步检测多种霉菌毒素含量的液相色谱方法研究,因前处理方法、所检测霉菌毒素种类以及样品种类等的不同,其加标回收率和精密度也显示出较大差异。Irakli等[34]建立了同步检测麦麸中黄曲霉毒素、ZEA、DON及OTA的HPLC法,其中ZEA和DON的平均回收率为84.5%~100.8%,而AFB1的平均回收率则不太稳定,为70.3%~101.4%,RSD为2.7%~12.0%。在李克等[35]的研究中,加标玉米样品ZEA和OTA的回收率为83.1%~91.9%,RSD为3.1%~9.3%,该方法可用于准确检测玉米、小麦和稻米中ZEA和OTA含量。Chen等[28]所建立的同步检测花生中霉菌毒素HPLC法,6霉菌种毒素(AFB1、AFB2、AFG1、AFG2、ZEA和OTA)均具有良好的加标回收率,为83.1%~99.3%,且RSD均小于10.0%,精密度较好,但该方法部分毒素的保留时间较为接近,实际样品检测时分离效果可能不太理想。本研究添加回收试验结果显示,加标空白肉鸡饲料样品中,不同添加浓度的AFB1、ZEA及DON的平均回收率为81.2%~92.3%,RSD为4.3%~9.5%,这说明本研究所建HPLC法具有较高的准确度与精密度。此外,本研究还考察了不同加标样品溶液中霉菌毒素检测含量随时间变化情况,结果显示,AFB1、ZEA及DON检测值在不同加标样品溶液中随时间波动不大,相对标准偏差均小于9.0%,这表明该方法具有较强的稳定性,可实际应用于基层实验室不同饲料品种中霉菌毒素的定量检测,有利于保障饲料质量安全。
3.3 饲料样品的检测饲料原料在生产、贮存、运输等过程中,受气候、季节、加工不当等因素影响,极易发生霉变而产生霉菌毒素[36]。玉米、小麦是世界上产量最大的粮食作物,在我国作为饲料原料被大量用于畜禽配合饲料中。在本试验所检测的8份玉米样品中,AFB1检出率高达100%,ZEA和DON检出率为50%;而16份小麦样品均检出ZEA和DON,说明这2类饲料原料易受霉菌毒素污染,且霉菌毒素共存现象较为普遍,这与龚阿琼等[37]和史海涛等[38]研究结果相一致。在玉米芯粉样品中,ZEA含量严重超标,最高含量达3 676.8 μg/kg,远高于《饲料卫生标准》(GB 13078—2017)[8]限定值1 000 μg/kg,畜禽采食后可能会造成严重的器官损伤、免疫抑制,甚至引起畜禽死亡。配合饲料中的霉菌毒素污染问题同样严峻,研究表明,AFB1、ZEA、DON等毒素在部分猪全价料、肉鸡配合饲料以及宠物饲料中有着极高的检出率及超标率[39-41]。本次所检11份肉鸭配合饲料中,AFB1和ZEA检出率均达100%,其中AFB1超标率达81.8%,生产中此类高AFB1含量的饲料极易引发畜禽急性中毒现象,危害畜禽机体健康。
此外,霉菌毒素间的协同效应同样不容忽视。Levkut等[42]报道,ZEA、DON混合毒素能严重抑制肉鸡白细胞的吞噬能力,降低肉鸡免疫力。杨云斌[43]研究表明,ZEA与AFB1联合添加能显著降低人肝癌HepG2细胞活力,诱导细胞凋亡,两者表现为协同效应。Sun等[44]试验发现,AFB1与DON协同作用会加剧大鼠肝脏细胞毒性。本试验所检小麦样品,其ZEA、DON含量虽均未超标,但最高含量分别达到了987.5和4 876.9 μg/kg,接近《饲料卫生标准》(GB 13078—2017)[8]限定值,且2种毒素存在协同增效可能,若畜禽长期采食,易降低机体免疫力,增加疾病易感性。从以上检测结果可以看出,常见植物性饲料原料以及配合饲料中的AFB1、ZEA及DON污染问题不容乐观。因此,在生产和养殖过程中,应严格把控饲料生产加工、存储、运输等环节,减少饲料霉菌毒素污染;同时,做好饲料原料及配合饲料的霉菌毒素检测工作,最大程度地避免畜禽采食霉变饲料,保障畜禽机体健康。
4 结论本研究所建立的HPLC法能够同步检测饲料样品中的AFB1、ZEA及DON含量。该方法准确度和精密度高,稳定性好,样品前处理操作简单,检测时间较短,能大大提高生产中霉菌毒素检测效率。采用该方法实际检测了4种饲料样品中AFB1、ZEA及DON含量,说明该方法适用性强,可用于不同饲料样品的霉菌毒素检测,作为饲料中常见霉菌毒素含量的检测分析方法。
| [1] |
许玲涵. 饲料中常见霉菌毒素及防控措施[J]. 畜牧业环境, 2020(3): 73. XU L H. Common mycotoxins in feed and their prevention and control measures[J]. Animal Industry and Environment, 2020(3): 73 (in Chinese). |
| [2] |
刘冬梅. 霉菌毒素的危害及防治[J]. 吉林畜牧兽医, 2018, 39(4): 8, 11. LIU D M. The harm and prevention of mycotoxins[J]. Jilin Animal Husbandry and Veterinary Medicine, 2018, 39(4): 8, 11 (in Chinese). |
| [3] |
DAI Y Q, HUANG K L, ZHANG B Y, et al. Aflatoxin B1-induced epigenetic alterations: an overview[J]. Food and Chemical Toxicology, 2017, 109: 683-689. DOI:10.1016/j.fct.2017.06.034 |
| [4] |
ZHOU C, ZHANG Y, YIN S, et al. Biochemical changes and oxidative stress induced by zearalenone in the liver of pregnant rats[J]. Human & Experimental Toxicology, 2015, 34(1): 65-73. |
| [5] |
LIU X L, WU R Y, SUN X F, et al. Mycotoxin zearalenone exposure impairs genomic stability of swine follicular granulosa cells in vitro[J]. International Journal of Biological Sciences, 2018, 14(3): 294-305. DOI:10.7150/ijbs.23898 |
| [6] |
BARNES J A, DEROUCHEY J M, TOKACH M D, et al. Effects of vomitoxin concentration in nursery pig diets and the effectiveness of commercial products to mitigate its effects[J]. Kansas Agricultural Experiment Station Research Reports, 2010(10): 79-85. DOI:10.4148/2378-5977.3439 |
| [7] |
FROBOSE H L, TOKACH M D, SOLTWEDEL K T, et al. The effects of Biomin product A and vomitoxin on growth performance of nursery pigs[J]. Kansas Agricultural Experiment Station Research Reports, 2010(10): 86-94. DOI:10.4148/2378-5977.3438 |
| [8] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 13078-2017饲料卫生标准[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. GB 13078-2017 Hygienical standard for feeds[S]. Beijing: Standards Press of China, 2017. (in Chinese) |
| [9] |
SOKOLOVIĆ M, ŠIMPRAGA B. Survey of trichothecene mycotoxins in grains and animal feed in Croatia by thin layer chromatography[J]. Food Control, 2006, 17(9): 733-740. DOI:10.1016/j.foodcont.2005.05.001 |
| [10] |
QU L L, JIA Q, LIU C Y, et al. Thin layer chromatography combined with surface-enhanced raman spectroscopy for rapid sensing aflatoxins[J]. Journal of Chromatography A, 2018, 1579: 115-120. DOI:10.1016/j.chroma.2018.10.024 |
| [11] |
VEGA-HERRERA M, MADARIAGA R, ARANDA M, et al. Confirmation of deoxyniv alenol presence in chilean wheat by high-performance thin-layer chromatography-mass spectrometry[J]. Journal of the Chilean Chemical Society, 2017, 62(2): 3435-3437. DOI:10.4067/S0717-97072017000200003 |
| [12] |
杜兵耀, 马晨, 余雄. 胶体金免疫层析法检测谷物中的黄曲霉毒素B1[J]. 饲料工业, 2016, 37(9): 58-60. DU B Y, MA C, YU X. Study on aflatoxin B1 detecting in grain by colloidal gold immunochromatographic assay[J]. Feed Industry, 2016, 37(9): 58-60 (in Chinese). |
| [13] |
张文静, 吴雨豪, 熊勇华. 饲料及原料中霉菌毒素的免疫层析快速检测技术[J]. 中国猪业, 2017, 12(9): 74-77. ZHANG W J, WU Y H, XIONG Y H. Rapid immunochromatography detection of mycotoxins in feed and feed materials[J]. China Swine Industry, 2017, 12(9): 74-77 (in Chinese). DOI:10.3969/j.issn.1673-4645.2017.09.030 |
| [14] |
REITER E, ZENTEK J, RAZZAZI E. Review on sample preparation strategies and methods used for the analysis of aflatoxins in food and feed[J]. Molecular Nutrition and Food Research, 2009, 53(4): 508-524. DOI:10.1002/mnfr.200800145 |
| [15] |
LI P W, ZHOU Q, WANG T, et al. Development of an enzyme-linked immunosorbent assay method specific for the detection of G-group aflatoxins[J]. Toxins, 2016, 8(1): 5. |
| [16] |
杨艳, 吴鑫, 朱应飞, 等. 酶联免疫吸附法测定植物油中黄曲霉毒素B1[J]. 食品安全质量检测学报, 2018, 9(12): 3166-3170. YANG Y, WU X, ZHU Y F, et al. Detection of aflatoxin B1 in vegetable oils by enzyme-linked immunosorbent assay[J]. Journal of Food Safety and Quality, 2018, 9(12): 3166-3170 (in Chinese). DOI:10.3969/j.issn.2095-0381.2018.12.049 |
| [17] |
SKENDI A, IRAKLI M N, PAPAGEORGIOU M D. Optimized and validated high-performance liquid chromatography method for the determination of deoxynivalenol and aflatoxins in cereals[J]. Journal of Separation Science, 2016, 39(8): 1425-1432. DOI:10.1002/jssc.201501217 |
| [18] |
LUCI G, INTORRE L, FERRUZZI G, et al. Determination of ochratoxin A in tissues of wild boar (Sus scrofa L.) by enzymatic digestion (ED) coupled to high-performance liquid chromatography with a fluorescence detector (HPLC-FLD)[J]. Mycotoxin Research, 2018, 34(1): 1-8. DOI:10.1007/s12550-017-0292-z |
| [19] |
赵贞, 万鹏, 李翠枝, 等. 高效液相色谱法测定饲料中黄曲霉毒素含量的研究[J]. 畜牧与饲料科学, 2019, 40(3): 27-29, 49. ZHAO Z, WAN P, LI C Z, et al. Determination of aflatoxin in feed by high-performance liquid chromatography[J]. Animal Husbandry and Feed Science, 2019, 40(3): 27-29, 49 (in Chinese). |
| [20] |
魏云计, 冯民, 朱臻怡, 等. 高效液相色谱-串联质谱法同时测定饲料中11种霉菌毒素[J]. 色谱, 2017, 35(8): 891-896. WEI Y J, FENG M, ZHU Z Y, et al. Simultaneous determination of 11 mycotoxins in feeds by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2017, 35(8): 891-896 (in Chinese). |
| [21] |
DE SANTIS B, DEBEGNACH F, GREGORI E, et al. Development of a LC-MS/MS method for the multi-mycotoxin determination in composite cereal-based samples[J]. Toxins, 2017, 9(5): 169. DOI:10.3390/toxins9050169 |
| [22] |
PARK J, KIM D H, MOON J Y, et al. Distribution analysis of twelve mycotoxins in corn and corn-derived products by LC-MS/MS to evaluate the carry-over ratio during wet-milling[J]. Toxins, 2018, 10(8): 319. DOI:10.3390/toxins10080319 |
| [23] |
GELL R M, CARBONE I. HPLC quantitation of aflatoxin B1 from fungal mycelium culture[J]. Journal of Microbiological Methods, 2019, 158: 14-17. DOI:10.1016/j.mimet.2019.01.008 |
| [24] |
KIM H J, LEE M J, KIM H J, et al. Analytical method development and monitoring of aflatoxin B1, B2, G1, G2 and ochratoxin A in animal feed using HPLC with fluorescence detector and photochemical reaction device[J]. Cogent Food & Agriculture, 2017, 3(1): 1419788. |
| [25] |
班晓敏. AFB1、OTA、DON高效液相色谱检测方法的优化和应用[D]. 硕士学位论文. 南京: 南京农业大学, 2012. BAN X M. Optimization and Application of high performance liquid chromatography detection methods for AFB1, OTA, DON[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2012. (in Chinese) |
| [26] |
何苗, 李鑫. 高效液相色谱法测定浮小麦中的呕吐毒素[J]. 海峡药学, 2020, 32(2): 36-38. HE M, LI X. Determination of vomitoxin in light wheat by high performance liquid chromatography[J]. Strait Pharmaceutical Journal, 2020, 32(2): 36-38 (in Chinese). DOI:10.3969/j.issn.1006-3765.2020.02.011 |
| [27] |
LEE M, SEO D J, JEON S B, et al. Detection of foodborne pathogens and mycotoxins in eggs and chicken feeds from farms to retail markets[J]. Korean Journal for Food Science of Animal Resources, 2016, 36(4): 463-468. DOI:10.5851/kosfa.2016.36.4.463 |
| [28] |
CHEN F F, LUAN C L, WANG L, et al. Simultaneous determination of six mycotoxins in peanut by high-performance liquid chromatography with a fluorescence detector[J]. Journal of the Science of Food and Agriculture, 2017, 97(6): 1805-1810. DOI:10.1002/jsfa.7978 |
| [29] |
张婷, 向仲朝. 啤酒中玉米赤霉烯酮的高效液相色谱紫外检测法[J]. 现代预防医学, 2016, 43(19): 3590-3592. ZHANG T, XIANG Z C. Determination of zearalenone in beer by high-performance liquid chromatography with UV detection[J]. Modern Preventive Medicine, 2016, 43(19): 3590-3592 (in Chinese). |
| [30] |
董颖超, 李俊, 李军国, 等. 免疫亲和柱-高效液相色谱法检测青贮饲料中的呕吐毒素[J]. 中国饲料, 2010(10): 38-39. DONG Y C, LI J, LI J G, et al. Determination of deoxynivalenol in silage feed by immunoaffinity column-high performance liquid chromatography[J]. China Feed, 2010(10): 38-39 (in Chinese). DOI:10.3969/j.issn.1004-3314.2010.10.015 |
| [31] |
关嘉成, 苗力, 卢杰, 等. 高效液相色谱法用于小麦中脱氧雪腐镰刀菌烯醇检测与去除的研究[J]. 广州化工, 2020, 48(17): 68-70. GUAN J C, MIAO L, LU J, et al. Study on the detection and removal of deoxynivalenol in wheat by HPLC[J]. Guangzhou Chemical Industry, 2020, 48(17): 68-70 (in Chinese). DOI:10.3969/j.issn.1001-9677.2020.17.024 |
| [32] |
王艳红, 胡丹丹, 潘雪静. 高效液相色谱法测定小麦中黄曲霉毒素B1含量[J]. 山东化工, 2019, 48(12): 74-75, 80. WANG Y H, HU D D, PAN X J. Determination of aflatoxin B1 in wheat by high performance liquid chromatography[J]. Shandong Chemical Industry, 2019, 48(12): 74-75, 80 (in Chinese). DOI:10.3969/j.issn.1008-021X.2019.12.034 |
| [33] |
WU J W, ZHAO R H, CHEN B, et al. Determination of zearalenone in barley by high-performance liquid chromatography coupled with evaporative light scattering detection and natural occurrence of zearalenone in functional food[J]. Food Chemistry, 2011, 126(3): 1508-1511. DOI:10.1016/j.foodchem.2010.11.159 |
| [34] |
IRAKLI M N, SKENDI A, PAPAGEORGIOU M D. HPLC-DAD-FLD method for simultaneous determination of mycotoxins in wheat bran[J]. Journal of Chromatographic Science, 2017, 55(7): 690-696. DOI:10.1093/chromsci/bmx022 |
| [35] |
李克, 潘丽红, 罗小虎, 等. 高效液相法同时检测谷物中玉米赤霉烯酮和赭曲霉毒素A[J]. 食品研究与开发, 2020, 41(6): 118-123. LI K, PAN L H, LUO X H, et al. Simultaneous determination of ochratoxin A and zearalenone in cereals by HPLC[J]. Food Research and Development, 2020, 41(6): 118-123 (in Chinese). |
| [36] |
李劲秋. 饲料霉变的原因、危害及预防措施[J]. 畜禽业, 2016(12): 26-27. LI J Q. Causes, harms and preventive measures of feed mildew[J]. Livestock and Poultry Industry, 2016(12): 26-27 (in Chinese). DOI:10.3969/j.issn.1008-0414.2016.12.023 |
| [37] |
龚阿琼, 陈晖, 全明旭, 等. 2017年我国饲料原料及饲料毒素检测分析[J]. 中国饲料, 2018(5): 91-93. GONG A Q, CHEN H, QUAN M X, et al. Analysis of raw materials and feed toxins in 2017[J]. China Feed, 2018(5): 91-93 (in Chinese). |
| [38] |
史海涛, 曹志军, 李键, 等. 中国饲料霉菌毒素污染现状及研究进展[J]. 西南民族大学学报(自然科学版), 2019, 45(4): 354-366. SHI H T, CAO Z J, LI J, et al. Mycotoxin contamination of feed in China: current status and research advances[J]. Journal of Southwest Minzu University (Natural Science Edition), 2019, 45(4): 354-366 (in Chinese). |
| [39] |
MA R, ZHANG L, LIU M, et al. Individual and combined occurrence of mycotoxins in feed ingredients and complete feeds in China[J]. Toxins, 2018, 10(3): 113. DOI:10.3390/toxins10030113 |
| [40] |
张瑞星. 饲料中霉菌毒素污染状况调查及霉变饲料对肉鸡氧化损伤和免疫功能的影响[D]. 硕士学位论文. 青岛: 青岛农业大学, 2016. ZHANG R X. Investigation on contamination of mycotoxin in feed and effect of moldy feed on oxidative damage and immune function of broilers[D]. Master's Thesis. Qingdao: Qingdao Agricultural University, 2016. (in Chinese) |
| [41] |
SHAO M Y, LI L, GU Z L, et al. Mycotoxins in commercial dry pet food in China[J]. Food Additives & Contaminants Part B: Surveillance, 2018, 11(4): 237-245. |
| [42] |
LEVKUT M, REVAJOVA V, SLAMINKOVA Z, et al. Lymphocyte subpopulations in blood and duodenal epithelium of broilers fed diets contaminated with deoxynivalenol and zearalenone[J]. Animal Feed Science and Technology, 2011, 165(3/4): 210-217. |
| [43] |
杨云斌. 玉米赤霉烯酮与黄曲霉毒素B1对HepG2细胞的联合毒性研究[J]. 食品工业科技, 2019, 40(18): 91-96. YANG Y B. Joint toxicity of zearalenone and aflatoxin B1 on HepG2 cells[J]. Science and Technology of Food Industry, 2019, 40(18): 91-96 (in Chinese). |
| [44] |
SUN L H, LEI M Y, ZHANG N Y, et al. Individual and combined cytotoxic effects of aflatoxin B1, zearalenone, deoxynivalenol and fumonisin B1 on BRL 3A rat liver cells[J]. Toxicon, 2015, 95: 6-12. DOI:10.1016/j.toxicon.2014.12.010 |




