2. 中国科学院亚热带农业生态研究所, 畜禽养殖污染控制与资源化技术国家工程实验室, 动物营养生理与代谢过程湖南省重点实验室, 长沙 410125;
3. 中国科学院大学, 北京 100049;
4. 黑龙江省农业科学院, 哈尔滨 150086;
5. 广东旺大集团股份有限公司, 广州 510663
2. Hunan Provincial Key Laboratory of Animal Nutrition Physiology and Metabolic Processes, National Engineering Laboratory of Poultry Breeding Pollution Control and Resource Technology, Institute of Subtropical Agricultural Ecology, Chinese Academy of Sciences, Changsha 410125, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China;
5. Guangdong Wangda Group Co., Ltd., Guangzhou 510663, China
溃疡性结肠炎(ulcerative colitis,UC)是一种在全球范围内流行的严重胃肠道疾病,发病率极高,严重影响国民的生活质量和健康水平[1]。结肠炎的病因普遍认为与感染细菌或病毒、应激、免疫系统失常、菌群失调等有关,这些因素往往会引发肠黏膜坏死、通透性增加以及肠道黏膜屏障功能损伤等,从而影响动物的生长发育和机体健康[2]。目前在医学领域治疗UC的方法主要集中于使用抗炎类药物和免疫抑制剂来减轻肠道炎症反应[3],这将导致抗药性及其他副作用,而通过食疗方法治疗UC则成为安全且有效的方法之一。
氨基酸是哺乳动物饮食中重要的营养组成成分,其消化吸收代谢不仅关系着动物整体健康和生产水平,也是维护肠道健康的关键营养物质。其中,天冬氨酸(Asp)是机体必不可少的一种功能性氨基酸,处于多个重要代谢过程的中间枢纽位置,在维持肠道生长发育、黏膜完整及其屏障功能中发挥重要的生物学作用[4]。但是近年来关于Asp的功能研究大多针对L-天冬氨酸(L-Asp)进行,对于不同旋光度的D-天冬氨酸(D-Asp)的功能研究则甚少。D-Asp是一种存在于脊椎动物和无脊椎动物中的内源性氨基酸,在动物体内由L-Asp经D-Asp氧化酶和Asp消旋酶转化或者合成形成,具有调节动物神经、调控激素分泌、改变肠道微生物菌群区系等生理功能,对维持动物正常的生理功能发挥关键作用。研究表明,饲粮添加适量D-Asp可通过下调仔猪空肠中Toll样受体4(Toll-like receptor 4,TLR4)和胞浆内模式识别受体1(NOD1)信号通路的表达来提高肠道免疫功能[5]。与L-Asp不同,D-Asp很少作为内源性蛋白酶的底物,导致D-Asp对相关蛋白酶的水解具有抗性,故可利用这种立体化学优势来提高生物活性分子的体内蛋白质水解稳定性,在抗癌物质中加入D-Asp可增加抗癌药物的半衰期[6]。D-Asp经D-氨基酸氧化酶(D-amino acid oxidase,DAO)的氧化脱氨作用产生了抗微生物物质过氧化氢(H2O2),参与机体的先天免疫防御[7]。因此,D-Asp在选择性抗炎或抗癌治疗中具有多种治疗潜力。本研究通过葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠结肠炎模型,探讨了直肠灌注不同浓度D-Asp对结肠炎小鼠肠道抗氧化和免疫功能的影响,为治疗结肠炎疾病提供理论依据和寻找新靶点。
1 材料与方法 1.1 试验材料与试验设计 1.1.1 试验材料DSS相对分子质量为36 000~50 000,购于合肥博美生物科技有限公司。C57BL/6J雄性小鼠购于湖南斯莱克景达实验动物有限公司。D-Asp(纯度≥99.0%)购自张家港市思普生化有限公司。
1.1.2 试验设计选取40只体重相近、健康状况良好的70日龄C57BL/6J雄性小鼠,初始平均体重为20.98 g,经过3 d的适应期后,随机分为5组,即对照组、0 mmol/L D-Asp组、0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组,每组8个重复,单笼饲养。试验第1~7天,对照组小鼠正常饮用蒸馏水外,其他各组小鼠均饮用含3.5% DSS的蒸馏水,诱导小鼠结肠炎。研究表明,动物体内99%的D-Asp被小肠消化吸收[8],而直肠灌注可将D-Asp直接输送到病变部位,避免胃肠道消化吸收造成D-Asp损失,使D-Asp在结肠内达到较高浓度,且作用效果更迅速[9]。因此,从试验第8天开始,对照组和0 mmol/L D-Asp组小鼠直肠灌注0.1 mL生理盐水,其他各组分别直肠灌注0.1 mL浓度为0.15、2.30和7.70 mmol/L的D-Asp溶液,每隔1 d灌注1次,共灌注5次,于第16天灌注后6 h内将小鼠致死,并采集相关样本。
1.2 样品采集试验结束后,采用眼眶取血的方法,收集小鼠血液样本,血液样本在4 ℃和3 500×g条件下离心10 min,分离获得血清,在-80 ℃保存待测。血液采集完毕后,采用颈椎脱臼的方法将小鼠致死,迅速剪开腹腔,取出整段结肠,测定长度,并截取相同部位用4%多聚甲醛固定,做病理组织学分析,采集结肠食糜,并将剩余肠段液氮速冻,转存-80 ℃冰箱待用。
1.3 测定指标与方法 1.3.1 小鼠体重和采食量整个试验过程中,每天称量记录小鼠体重,并每2 d记录1次小鼠采食量。
1.3.2 血清髓过氧化物酶(myeloperoxidase,MPO)、嗜酸性粒细胞过氧化物酶(eosinophil peroxidase,EPO)活性和炎症细胞因子含量血清MPO和EPO活性采用酶联免疫吸附测定(ELISA)试剂盒检测,试剂盒购自江苏雨桐生物有限公司,具体操作方法根据说明书进行。血清肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)含量采用ELISA试剂盒检测,试剂盒购自江苏雨桐生物有限公司,具体操作方法根据说明书进行。
1.3.3 结肠肠道组织学观察结肠经4%多聚甲醛固定、脱水透明、石蜡包埋后,切片、脱蜡和苏木精-伊红(HE)染色,透明并封片,镜检观察。根据组织学评分系统进行评分[1]。组织学评分系统见表 1。
|
|
表 1 组织学评分系统 Table 1 Histological scoring system |
使用Trizol试剂从结肠组织中分离出总RNA。分离的总RNA用Nano Drop 2000c分光光度计(Thermo公司,美国)测定RNA浓度和稳定性。利用逆转录试剂盒(Thermo公司,美国)合成第1条cDNA链。每个样本用SYBR-Green实时PCR系统进行3次评估。PCR程序如下:95 ℃ 5 min,在95 ℃下扩增45个周期10 s,60 ℃ 10 s,72 ℃ 15 s,扩增检测白细胞介素-6(IL-6)、铜锌超氧化物歧化酶(ZnCuSOD)、谷胱甘肽过氧化物酶4(GPX4)、谷胱甘肽过氧化物酶1(GPX1)、乙酰辅酶A羧化酶(ACC)、天冬氨酸/谷氨酸载体1(SLC25A12)、天冬氨酸/谷氨酸载体2(SLC25A13)和内参基因磷酸甘油醛脱氢酶(GAPDH)的表达。使用2-ΔΔCt方法计算相对表达量。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Pirmer sequences |
采用SPSS 22.0的一般线性模型(general linear model)分析主效应和互作效应,再利用ANOVA程序以及Duncan氏法对数据进行差异显著性分析,组间差异采用Student-t检验分析。数据用平均值±标准误表示,P>0.05为差异不显著,P<0.05为差异显著。
2 结果 2.1 D-Asp对UC小鼠生长状况的影响在试验第1~8天,对照组小鼠精神状况、饮食及活动均正常,毛发光泽,无便血。与对照组相比较,其他各组小鼠在试验第2天开始精神萎靡,活动迟缓,且第8天出现便血现象。如表 3所示,各组之间小鼠的初始体重无显著差异(P>0.05)。与对照组相比较,其他各组小鼠第5~9天体重显著低于对照组(P < 0.05),第8天体重达到最低。第12~14天,与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组的小鼠体重均显著提高(P < 0.05),其中7.70 mmol/L D-Asp组的小鼠体重最高。第16天时,由于小鼠自身调节恢复,各组的小鼠体重均有不同程度地增加,且各组之间无显著差异(P>0.05)。
|
|
表 3 D-Asp对UC小鼠体重的影响 Table 3 Effects of D-Asp on body weight of UC mice |
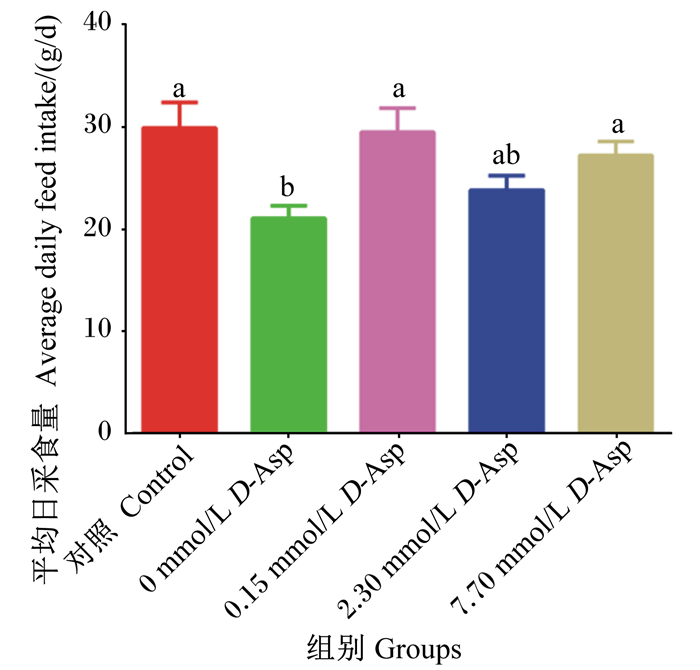
如图 1所示,与对照组相比,0 mmol/L D-Asp组的小鼠平均日采食量显著降低(P < 0.05),而0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组小鼠的平均日采食量与对照组无显著差异(P>0.05)。
|
数据柱形标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。图 2同。 Data values with the same letter superscripts mean no significant difference (P > 0.05), while with different superscripts mean significant difference (P < 0.05). The same as Fig. 2. 图 1 D-Asp对UC小鼠平均日采食量的影响 Fig. 1 Effects of D-Asp on average daily feed intake of UC mice |
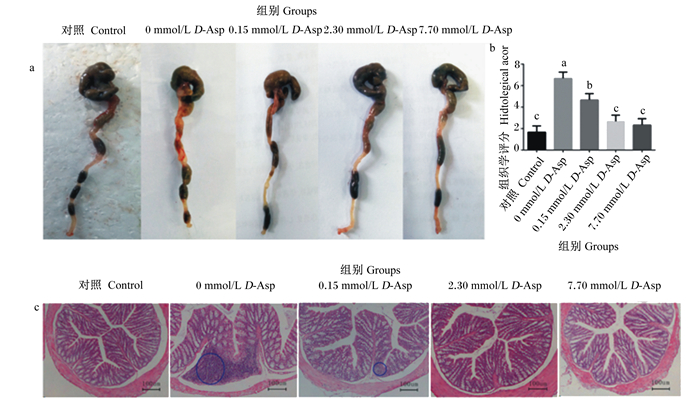
如图 2-a所示,与对照组相比,0 mmol/L D-Asp组小鼠结肠变短、变小,并出现浸血现象,而0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组小鼠结肠出血情况消失,其外观形态与对照组相似。
|
蓝圈表示出现炎症细胞浸润。 Blue circles indicate inflammatory cell infiltration. 图 2 D-Asp对UC小鼠结肠组织形态的影响 Fig. 2 Effects of D-Asp on colonic morphology of UC mice |
如图 2-b示,0 mmol/L D-Asp组组织学评分显著高于其他各组(P < 0.05)。
如图 2-c示,HE染色结果显示,对照组小鼠结肠组织结构清楚,各层清晰可见,黏膜层和黏膜上皮细胞完整,未见脱落,固有层内未见炎症细胞浸润,未见溃疡;0 mmol/L D-Asp组结肠组织结构尚存,但固有层内可见大量炎症细胞浸润,腺体被破坏;0.15 mmol/L D-Asp组结肠组织结构清晰,黏膜层和黏膜上皮细胞完整,仅见固有层内少量炎症细胞浸润;2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组结肠组织未见炎症细胞浸润,腺体排列整齐,绒毛和隐窝结构完整。
2.3 D-Asp对UC小鼠血清炎性细胞因子含量和抗氧化酶活性的影响如表 4所示,与对照组相比,0 mmol/L D-Asp组血清中IL-1β和TNF-α含量显著升高(P < 0.05),分别提高了40.51%和45.55%。与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组血清IL-1β和TNF-α含量不同程度地降低,且呈剂量效应;其中7.70 mmol/L D-Asp组血清中IL-1β和TNF-α含量显著降低(P < 0.05),分别下降了43.81%和38.44%,且与对照组无显著差异(P>0.05)。
|
|
表 4 D-Asp对UC小鼠血清炎症细胞因子含量和抗氧化酶活性的影响 Table 4 Effects of D-Asp on serum inflammatory cytokines content and antioxidant enzyme activities of UC mice |
与对照组相比,0 mmol/L D-Asp组血清中MPO活性上升了4.64%(P>0.05)。与0 mmol/L D-Asp组相比,7.70 mmol/L D-Asp组血清MPO活性下降了32.13%(P>0.05)。与对照组相比,0 mmol/L D-Asp组血清EPO活性显著升高(P < 0.05),提高了61.45%。与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组血清EPO活性均不同程度地降低,且呈剂量效应;其中,7.70 mmol/L D-Asp组血清EPO活性显著降低了50.00%(P < 0.05),且与对照组无显著差异(P>0.05)。
2.4 D-Asp对UC小鼠结肠中抗氧化酶和Asp转运载体mRNA相对表达量的影响由表 5可知,各组结肠中GPX4、GPX1和ZnCuSOD的mRNA相对表达量无显著差异(P>0.05)。0 mmol/L D-Asp组结肠中ACC mRNA相对表达量显著高于其他各组(P < 0.05),而其他各组之间无显著差异(P>0.05)。与对照组相比,0 mmol/L D-Asp组结肠中IL-6 mRNA相对表达量显著升高(P < 0.05),提高了55.16%;与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组结肠中IL-6 mRNA相对表达量均不同程度地降低,其中7.70 mmol/L D-Asp组显著下降了50.22%(P < 0.05),且与对照组无显著差异(P>0.05)。与对照组相比,0 mmol/L D-Asp组结肠中SLC25A12 mRNA相对表达量显著增加(P < 0.05);与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组结肠中SLC25A12 mRNA相对表达量均不同程度地降低,且与对照组无显著差异(P>0.05)。与对照组相比,0 mmol/L D-Asp组结肠中SLC25A13 mRNA相对表达量无显著差异(P>0.05);与0 mmol/L D-Asp组相比,0.15 mmol/L D-Asp组、2.30 mmol/L D-Asp组和7.70 mmol/L D-Asp组结肠中SLC25A13 mRNA相对表达量显著升高(P < 0.05),且显著高于对照组(P < 0.05)。
|
|
表 5 D-Asp对UC小鼠结肠中抗氧化酶和Asp转运载体mRNA相对表达量的影响 Table 5 Effects of D-Asp on mRNA relative expression level of antioxidase and Asp transporter in colon of UC mice |
D-Asp是神经递质/神经调节剂,可调节激素合成和释放[10]。研究表明,将D-Asp注射到大鼠体内会导致大鼠血清黄体生成素、睾酮、孕酮、生长激素和催乳素含量升高,引起大鼠促性腺激素释放激素的释放,从而调节大鼠性腺功能发育及大鼠的生长发育[11]。口服D-Asp可线性降低雏鸡的直肠温度来缓解热应激,即使在高环境温度条件下,口服适量D-Asp也能显著降低雏鸡的体温[12]。本试验结果也进一步证实了这一点,本试验发现,直肠灌注7.70 mmol/L D-Asp可提高UC小鼠的体重和平均日采食量,恢复结肠炎引起的生长受限,加快小鼠的康复。同时还发现,直肠灌注2.30和7.70 mmol/L D-Asp可有效修复结肠形态结构的损伤和改善细胞的形态和数量,从而促进小鼠结肠损伤恢复。这可能是因为D-Asp在机体代谢中可转化为鸟氨酸和谷氨酰胺,可调节肠上皮细胞的生长和增殖,为肠道正常生理提供充足的能量,从而促进动物生长发育和改善动物肠道功能[13]。但具体的研究机制还需要进一步研究。
3.2 D-Asp提高UC小鼠肠道免疫功能炎性细胞因子(促炎因子和抗炎因子)的异常分泌或表达被认为是导致结肠炎发生和发展的一个重要发病机制[14]。当肠道上皮细胞损伤后,巨噬细胞会被激活,巨噬细胞将释放出包括IL-1β、IL-6和TNF-α在内的大量炎性细胞因子,引起肠上皮细胞损伤,长此以往就会引发结肠炎、结肠癌等肠道疾病[15]。在UC患者的结肠组织中发现IL-6和TNF-α的mRNA相对表达量显著增加,证明IL-6和TNF-α是介导结肠炎的关键细胞因子[16]。TNF-α能够通过与肿瘤坏死因子受体-1结合破坏肠道屏障,诱导UC发生,还能够诱导巨噬细胞和血管内皮细胞产生IL-6等细胞因子和趋化因子,诱导免疫细胞趋化、浸润至肠道病灶部位,加剧肠道炎症,促进UC发展[17]。在小鼠自身免疫性脑脊髓炎模型试验中,D-Asp可通过降低血清IL-6含量和提高总抗氧化能力来缓解自身免疫性脑脊髓炎,并减少自身免疫性脑脊髓炎的发病[18]。本研究发现,直肠灌注7.70 mmol/L D-Asp可有效降低UC小鼠血清IL-1β和TNF-α含量以及降低结肠中IL-6 mRNA相对表达量,减少中性粒细胞等免疫细胞浸润,抑制炎性细胞因子产生,减少结肠病灶形成,修复UC小鼠肠道形态,有效改善结肠炎症状况。在断奶仔猪饲粮中添加适量D-Asp可降低肠道放线菌和拟杆菌的相对丰度,增加厚壁菌门的相对丰度,同时调控肠道Toll样受体(TLRs)、胞浆内模式识别受体1(NOD1)和髓样分化因子(MyD88)mRNA的表达水平,从而改善肠道免疫功能[19]。由此推测,直肠灌注D-Asp或许也可以通过改变小鼠结肠肠道菌群区系来促进UC小鼠肠道损伤恢复,但具体机制仍需进一步研究。
3.3 D-Asp提高UC小鼠抗氧化能力当动物机体受到应激时,机体会产生过量的自由基,破坏机体的抗氧化防御系统,从而引发氧化应激反应致使肠道功能损伤[20]。有研究表明,D-Asp可通过提高公猪血清和睾丸中抗氧化酶的活性及炎性细胞因子的分泌来缓解公猪生殖器官的损伤[21]。在鸡的早期发育时期,静脉注射D-Asp可以剂量依赖性地减少新生雏鸡痛苦发声的次数和主动清醒的时间,从而调节鸡的行为应激反应[18]。Erwan等[18]研究表明,口服D-Asp可降低三酰甘油和尿酸含量,增加葡萄糖和氯水平并降低雏鸡的直肠温度,从而缓解家禽的热应激。也有研究表明,在公牛精子培养基中添加D-Asp,可保护精子在体外处理过程中免受氧化应激损伤[22]。ACC是脂肪酸合成过程中的限速酶,抑制ACC活性可减少脂肪的生成,有利于脂质氧化,从而防止过量脂质在肌肉、心脏和肝脏等组织中的积累[23]。ACC还参与调节免疫细胞的分化和增殖,ACC可能通过调控免疫细胞的功能而参与哮喘气道炎症的发生[24]。MPO是一种亚铁血红素酶,利用过氧化氢和氯离子产生次氯酸和氯离子,次氯酸是一种导致组织氧化损伤的活性氧物质,具有强大的杀灭病原微生物、细胞毒和解毒作用[25]。因此,正常生理情况下,MPO能杀灭入侵体内病原微生物,参与机体先天性免疫反应的一部分。但当机体处于氧化应激或炎症状态时,MPO催化产生的氧化物质超过机体抗氧化能力,破坏机体氧化-抗氧化系统平衡,从而引发多种病理现象和组织损伤[25]。直肠灌注7.70 mmol/L D-Asp可下调机体MPO的活性,使其维持正常生理水平,从而维持机体氧化-抗氧化系统平衡。而嗜酸性粒细胞(EO)是一种炎症细胞,可刺激碱性蛋白的释放,产生炎性介质,引发炎症反应。EO释放的蛋白酶EPO参与活性氧的细胞损伤,EPO在体内可与过氧化氢和卤化物反应,生成氧化剂[26]。机体产生过量的EPO会促进机体炎症反应,并诱发机体的氧化应激反应。本试验结果表明,DSS诱导小鼠发生结肠炎时,血清中EPO和MPO活性增加,且结肠中ACC mRNA相对表达量也显著增加,而直肠灌注7.70 mmol/L D-Asp时降低UC小鼠血清EPO和MPO活性以及结肠中ACC mRNA相对表达量,这意味着D-Asp可以通过下调血清EPO和MPO活性以及结肠中ACC mRNA相对表达量,从而减少结肠炎小鼠脂肪的合成,并调节结肠炎小鼠的炎症反应,减少小鼠体内氧化剂的生成,维持UC小鼠机体的氧化和抗氧化平衡,从而减轻UC小鼠的氧化应激反应。
3.4 D-Asp改善UC小鼠氨基酸转载体的表达SLC25A12和SLC25A13是线粒体Asp-谷氨酸载体的神经元亚型,是将氧化还原当量从糖酵解转移到线粒体基质所必需的苹果酸-Asp穿梭的组成部分,其在细胞代谢中起着重要作用,且在炎症或肿瘤组织中显著上调[27]。而SLC25A13是从线粒体基质中输出Asp,以换取细胞溶质谷氨酸和氢离子(H+),SLC25A13在苹果酸-Asp穿梭中起关键作用[28],其表达的升高可加速机体能量代谢,产生更多的ATP。本试验结果也进一步验证了上述理论,本试验发现,0 mmol/L D-Asp组小鼠结肠中SLC25A12 mRNA相对表达量较对照组显著升高,而经7.70 mmol/L D-Asp处理后,其结肠中SLC25A12 mRNA相对表达量下降,但SLC25A13 mRNA相对表达量却显著提高,说明直肠灌注D-Asp可有效刺激线粒体基质中输出L-Asp进入三羧酸循环,为机体提供更多的能量,促进肠道损伤修复。这也进一步证实,当小鼠受到应激损伤时,机体所需能量增加,同时对D-Asp的需求量也随之增加,灌注D-Asp可以增加体内D-Asp的含量,补充因应激造成的D-Asp或L-Asp不足。此外,动物神经组织中D-Asp的含量与SLC25A12和SLC25A13 mRNA相对表达量密切相关,从而调节小鼠体内D-Asp的转运。因D-Asp被证明是一种重要的神经递质,可有效缓解小鼠机械性异常性疼痛、抑郁及焦虑行为[29],同时直肠灌注D-Asp也显著降低了SLC25A12 mRNA相对表达量,从而可能会降低小鼠结肠炎发生癌变的风险。
4 结论直肠灌注D-Asp可调节UC小鼠血清和结肠中炎症细胞因子的分泌和表达,调控抗氧化酶的活性和ACC信号分子,提高UC小鼠肠道抗氧化和免疫功能,从而促进肠道组织损伤的恢复和改善UC小鼠生长性能,其中以灌注7.70 mmol/L D-Asp效果最好。
| [1] |
ZHANG Q, XU N N, HU X J, et al. Anti-colitic effects of physalin B on dextran sodium sulfate-induced balb/c mice by suppressing multiple inflammatory signaling pathways[J]. Journal of Ethnopharmacology, 2020, 259: 112956. DOI:10.1016/j.jep.2020.112956 |
| [2] |
SHENG K L, ZHANG G H, SUN M, et al. Grape seed proanthocyanidin extract ameliorates dextran sulfate sodium-induced colitis through intestinal barrier improvement, oxidative stress reduction, and inflammatory cytokines and gut microbiota modulation[J]. Food & Function, 2020, 11(9): 7817-7829. |
| [3] |
韩伟, 刘宇琼, 孙雷. 丹参、黄芪注射液治疗溃疡性结肠炎的临床研究[J]. 长春中医学院学报, 2005, 21(4): 7. HAN W, LIU Y Q, SUN L. Clinical study of Danshen and Huangqi injection in the treatment of ulcerative colitis[J]. Journal of Changchun College of Traditional Chinese Medicine, 2005, 21(4): 7 (in Chinese). DOI:10.3969/j.issn.1007-4813.2005.04.006 |
| [4] |
蔡彬, 周敏红, 李春伟. 氨基酸在炎症性肠病治疗中的研究进展[J]. 中国医药导报, 2020, 17(9): 37-40. CAI B, ZHOU M H, LI C W. Research progress of amino acids in the treatment of inflammatory bowel disease[J]. China Medical Herald, 2020, 17(9): 37-40 (in Chinese). |
| [5] |
夏嗣廷, 胡睿智, 贺建华, 等. D-天冬氨酸生理功能及其在畜禽生产中的应用[J]. 动物营养学报, 2019, 31(10): 4481-4487. XIA S T, HU R Z, HE J H, et al. Physiological function of D-aspartic acid and its application in livestock and poultry production[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4481-4487 (in Chinese). |
| [6] |
FENG Z Q Q, XU B. Inspiration from the mirror: D-amino acid containing peptides in biomedical approaches[J]. Biomolecular Concepts, 2016, 7(3): 179-187. DOI:10.1515/bmc-2015-0035 |
| [7] |
SASABE J, SUZUKI M. Emerging role of D-amino acid metabolism in the innate defense[J]. Frontiers in Microbiology, 2018, 9: 933. DOI:10.3389/fmicb.2018.00933 |
| [8] |
WU G Y. Intestinal mucosal amino acid catabolism[J]. The Journal of Nutrition, 1998, 128(8): 1249-1252. DOI:10.1093/jn/128.8.1249 |
| [9] |
ZHANG H W, HUA R, ZHANG B X, et al. Serine alleviates dextran sulfate sodium-induced colitis and regulates the gut microbiota in mice[J]. Frontiers in Microbiology, 2018, 9: 3062. DOI:10.3389/fmicb.2018.03062 |
| [10] |
BOCCELLA S, VACCA V, ERRICO F, et al. D-aspartate modulates nociceptive-specific neuron activity and pain threshold in inflammatory and neuropathic pain condition in mice[J]. BioMed Research International, 2015, 2015: 905906. |
| [11] |
D'ANIELLO A. D-aspartic acid: an endogenous amino acid with an important neuroendocrine role[J]. Brain Research Reviews, 2007, 53(2): 215-234. DOI:10.1016/j.brainresrev.2006.08.005 |
| [12] |
ERWAN E, CHOWDHURY V S, NAGASAWA M, et al. Oral administration of D-aspartate, but not L-aspartate, depresses rectal temperature and alters plasma metabolites in chicks[J]. Life Sciences, 2014, 109(1): 65-71. DOI:10.1016/j.lfs.2014.05.015 |
| [13] |
段杰林. 酸性氨基酸缓解过氧化氢介导仔猪肠道氧化损伤机制研究[D]. 硕士学位论文. 北京: 中国科学院大学, 2016. DUAN J L. Study on the mechanism of acidic amino acids alleviating hydrogen peroxide-mediated intestinal oxidative damage in piglets[D]. Master's Thesis. Beijing: University of Chinese Academy of Sciences, 2016. (in Chinese) |
| [14] |
YOUSEF M, PICHYANGKURA R, SOODVILAI S, et al. Chitosan oligosaccharide as potential therapy of inflammatory bowel disease: therapeutic efficacy and possible mechanisms of action[J]. Pharmacological Research, 2012, 66(1): 66-79. DOI:10.1016/j.phrs.2012.03.013 |
| [15] |
CHAO L, ZHENG P Y, XIA L, et al. Calycosin attenuates dextran sulfate sodium (DSS)-induced experimental colitis[J]. Journal of Basic Medical Sciences, 2017, 20(9): 1056-1062. |
| [16] |
LIN X C, YI Z Y, DIAO J X, et al. Shaoyao decoction ameliorates colitis-associated colorectal cancer by downregulating proinflammatory cytokines and promoting epithelial-mesenchymal transition[J]. Journal of Translational Medicine, 2014, 12: 105. DOI:10.1186/1479-5876-12-105 |
| [17] |
POPIVANOVA B K, KITAMURA K, WU Y, et al. Blocking TNF-alpha in mice reduces colorectal carcinogenesis associated with chronic colitis[J]. Journal of Clinical Investigation, 2008, 118(2): 560-570. |
| [18] |
ERWAN E, TOMONAGA S, YOSHIDA J, et al. Central administration of L- and D-aspartate attenuates stress behaviors by social isolation and crf in neonatal chicks[J]. Amino Acids, 2012, 43(5): 1969-1976. DOI:10.1007/s00726-012-1272-4 |
| [19] |
LI Y Y, HAN H, YIN J, et al. D- and L-aspartate regulates growth performance, inflammation and intestinal microbial community in young pigs[J]. Food & Function, 2019, 10(2): 1028-1037. |
| [20] |
CABISCOL E, TAMARIT J, ROS J. Oxidative stress in bacteria and protein damage by reactive oxygen species[J]. International Microbiology, 2000, 3(1): 3-8. |
| [21] |
TANG W J, WU J, JIN S S, et al. Glutamate and aspartate alleviate testicular/epididymal oxidative stress by supporting antioxidant enzymes and immune defense systems in boars[J]. Science China Life Sciences, 2020, 63(1): 116-124. DOI:10.1007/s11427-018-9492-8 |
| [22] |
BARBATO V, TALEVI R, BRAUN S, et al. Supplementation of sperm media with zinc, D-aspartate and co-enzyme q10 protects bull sperm against exogenous oxidative stress and improves their ability to support embryo development[J]. Zygote, 2017, 25(2): 168-175. DOI:10.1017/S0967199416000459 |
| [23] |
郑贵花, 夏广军, 尹宝珍. 乙酰辅酶A羧化酶在动物中的研究进展[J]. 现代农业研究, 2019(10): 109-112, 120. ZHENG G H, XIA G J, YIN B Z. Research progress of acetyl-coenzyme A carboxylase in animals[J]. Modern Agricultural Research, 2019(10): 109-112, 120 (in Chinese). DOI:10.3969/j.issn.1674-0653.2019.10.046 |
| [24] |
谢宝娟, 向霖丽, 许文娟, 等. 乙酰辅酶A羧化酶激动剂柠檬酸钠对慢性哮喘小鼠气道炎症和气道重塑的作用[J]. 武汉大学学报(医学版), 2021, 42(2): 267-271. XIE B J, XIANG L L, XU W J, et al. Effects of acetyl-coenzyme A carboxylase agonist sodium citrate on airway inflammation and airway remodeling in mice with chronic asthma[J]. Journal of Wuhan University (Medical Edition), 2021, 42(2): 267-271 (in Chinese). |
| [25] |
黄伟聪. 髓过氧化物酶、氧化应激与多囊卵巢综合征相关性研究进展[J]. 现代医药生物, 2020, 36(5): 82-85. HUANG W C. Research progress on the correlation between myeloperoxidase, oxidative stress and polycystic ovary syndrome[J]. Modern Medical Biology, 2020, 36(5): 82-85 (in Chinese). |
| [26] |
刘顺爱, 杨忠贞. 嗜酸性粒细胞与组织免疫损伤[J]. 国外医学(免疫学分册), 1993, 16(5): 235-239. LIU S A, YANG Z Z. Eosinophils and tissue immune damage[J]. Foreign Medicine (Immunology), 1993, 16(5): 235-239 (in Chinese). |
| [27] |
AMOEDO N D, PUNZI G, OBRE E, et al. Agc1/2, the mitochondrial aspartate-glutamate carriers[J]. Biochimica et Biophysica Acta: Molecular Cell Research, 2016, 1863(10): 2394-2412. DOI:10.1016/j.bbamcr.2016.04.011 |
| [28] |
PUERTAS-FRIAS G, DEL ARCO A, PARDO B, et al. Mitochondrial movement in aralar/Slc25a12/AGC1 deficient cortical neurons[J]. Neurochemistry International, 2019, 131: 104541. DOI:10.1016/j.neuint.2019.104541 |
| [29] |
PALAZZO E, LUONGO L, GUIDA F, et al. D-aspartate drinking solution alleviates pain and cognitive impairment in neuropathic mice[J]. Amino Acids, 2016, 48(7): 1553-1567. DOI:10.1007/s00726-016-2205-4 |




