2. 华南农业大学, 广东省动物营养调控重点实验室, 广州 510642
2. Guangdong Province Key Laboratory of Animal Nutritional Regulation, South China Agricultural University, Guangzhou 510642, China
细胞外囊泡(extracellular vesicles, EVs)是细胞分泌至胞外的膜性囊泡[1]。近年来,关于它作为细胞间新“细胞信使”的研究越来越多,且受到广泛的重视[2-3]。在各种原核和真核微生物中,许多细胞因子与EVs有关,EVs运输是一种普遍现象[3-4]。EVs由真核生物、古细菌和细菌产生,由脂质双分子层组成,形成直径从20~500 nm不等的含腔球体[5]。研究显示,EVs参与肿瘤进展、免疫调节、新陈代谢、肠道微生物区系的塑造等过程[6-10]。细菌来源的EVs于1965年首次在大肠杆菌中被发现[11]。细菌来源的EVs携带多种物质,包括毒力因子、黏附素、DNA、RNA、毒素、免疫调节因子和营养清除因子,与细胞毒性、宿主细胞入侵、膜融合、生物膜的产生、病毒入侵、DNA传递、受体响应和抗生素耐药蛋白的转移过程相关[12-13]。
葡萄球菌是一种圆形或卵圆形的革兰氏阳性球菌,呈葡萄状,无鞭毛,无荚膜,不产生芽孢[14]。临床上,葡萄球菌病主要是由金黄色葡萄球菌(Staphylococcus aureus)引起的。金黄色葡萄球菌是一种常见的人兽共患病原菌,在自然界分布广泛,可引起人和动物感染,也可引起细菌性食物中毒或饲料中毒[15],肠毒素是导致金黄色葡萄球菌食物中毒的主要毒力因子[16]。相比金黄色葡萄球菌,关于溶血性葡萄球菌(Staphylococcus haemolyticus)的研究鲜有报道。溶血性葡萄球菌是一种凝固酶阴性葡萄球菌,以共生菌的形式存在于皮肤中[17],是重要的医院感染病原菌[18]。酚可溶性调节肽(phenol-soluble modulins, PSM)是溶血性葡萄球菌的主要毒力因子,是一类具有广泛的细胞溶解活性的两亲性肽毒素,包含一种α型PSM和3种β型PSM,4种PSM均具有较强的促炎活性,可促进中性粒细胞趋化[19]。溶血性葡萄球菌来源的细胞外囊泡(SH-EVs)是否携带PSM,是否通过PSM产生促炎活性尚不明确。本试验拟研究SH-EVs对小鼠生长、免疫功能、肠道结构及微生物区系的影响,以期为细菌EVs的深入研究提供参考。
1 材料与方法 1.1 菌株及其培养溶血性葡萄球菌为本实验室保存菌种,由生工生物工程(上海)股份有限公司通过16S rRNA基因测序进行菌种鉴定,采用YPD液体培养基(含1.0%酵母提取物、2.0%蛋白胨、2.0%葡萄糖)于30 ℃下在转速为200 r/min的水平摇床上振荡培养14~16 h至OD600 nm达到1.0~1.5。
1.2 SH-EVs的分离、纯化与鉴定将保存的溶血性葡萄球菌菌种复苏,在新鲜LB液体培养基中于30 ℃下在转速为200 r/min的水平摇床上扩大培养,使OD600 nm达到1.0~1.5;然后将培养物于4 ℃、2 000×g离心10 min;收集上清于4 ℃、10 000×g离心30 min;取上清经过超速离心机于4 ℃、120 000×g离心90 min,得到SH-EVs沉淀,将获得SH-EVs沉淀经过磷酸盐缓冲液(PBS)重悬后再一次经超速离心机于4℃、120 000×g离心90 min,富集得到的沉淀即为纯化的SH-EVs,纯化后的SH-EVs用PBS重悬,放入-80 ℃保存备用。
将10 μL SH-EVs的PBS悬液滴加于铜网上沉淀20 min,用滤纸吸去浮液,接着再用蒸馏水漂洗1~3次。吸取2%的醋酸双氧铀10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液后常温干燥15 min,通过JEM-2000EX透射电子显微镜(transmission electron microscopy, TEM)来观察SH-EVs的外部形态特征[20]。利用纳米颗粒跟踪分析仪(Zetasizer Nano ZS)来测定EVs的粒径[21]。利用二奎啉甲酸(BCA)蛋白定量试剂盒测定SH-EVs的蛋白质浓度。
1.3 试验动物及饲养管理试验动物为无特定病原体(SPF)级的健康雄性C57BL/6小鼠,14~17 g,28~30日龄,购自广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002。饲养环境温度保持在(22±2) ℃,相对湿度保持在(50±10)%,光照周期为12 h光照/12 h黑暗。动物试验开始前先使小鼠习惯动物设施1周,动物试验按照《实验动物管理条例》(2017年修订)执行。
1.4 试验设计选取20只小鼠,采用完全随机试验设计分为2个组,每组10个重复,每个重复1只小鼠。参照Teng等[9]的方法,每隔1 d给试验组小鼠灌服150 μL SH-EVs悬液(含500 μg SH-EVs),给对照组小鼠灌服150 μL PBS,共灌服3次。试验期为5 d。试验期内自由饮水、自由采食。试验饲粮为购自广东省医学实验动物中心的小鼠标准饲粮。
1.5 样品采集 1.5.1 小鼠生长性能数据采集在试验始末清晨对每只小鼠进行空腹称重,记录个体重;试验过程中记录每只小鼠每天的采食量。
1.5.2 小鼠粪便采集试验结束当天采集小鼠的新鲜粪样,置于2 mL无菌PE管中,于-80 ℃条件下储存待测。
1.5.3 小鼠血液采集试验结束后利用蘸有异氟烷的棉球将小鼠麻醉,然后对小鼠进行眼球采血,血液静置1 h后,3 000 r/min离心20 min,分离血清。小心吸取血清分装于1.5 mL的试管中,于-80 ℃条件下储存待测。
1.5.4 小鼠回肠组织采集采血后,断颈处死小鼠,剖开腹腔,于回肠中段采集2 cm左右的组织样品,灭菌生理盐水冲洗干净,置于4%甲醛缓冲溶液中固定,以备制作切片。
1.6 检测指标与方法 1.6.1 小鼠生长性能指标测定根据试验始末小鼠体重计算平均日增重(ADG);根据每只小鼠每日的采食量计算平均日采食量(ADFI);根据平均日增重及平均日采食量计算料重比(F/G)。
1.6.2 小鼠血清免疫指标测定血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-10(interleukin-10, IL-10)、免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白G(immunoglobulin G, IgG)含量均采用上海酶联生物科技有限公司生产的试剂盒测定,测定方法按照说明书进行。
1.6.3 小鼠肠道形态观察将固定的回肠标本经脱水、透明、浸蜡、包埋、修块、切片、展片、常规苏木精-伊红(HE)染色等处理后,制成石蜡切片。之后用显微镜在40倍下随机选择多个非连续性视野观察切片,并挑选典型视野拍摄成图片。
1.6.4 小鼠肠道微生物区系测定从小鼠粪便样本中提取基因组DNA后,利用琼脂糖凝胶电泳检测DNA的纯度和浓度。用带有barcode的特异引物扩增16S rDNA的V3+V4区,引物序列为: 341F,5′-CCTACGGGNGGCWGCAG-3′;806R,5′-GGACTACHVGGGTATCTAAT-3′。然后PCR扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,使用HiSeq2500的PE250模式上机测序。
测序得到raw reads之后,对低质量reads进行过滤,再进行序列拼接、序列过滤、序列去嵌合体等处理,得到优化序列(tags)。用Uparse软件以97%的一致性(identity)对所有样品的优化序列聚类成为操作分类单元(OTU),获得OTU后,根据分析流程,使用QIIME(version 1.9.1)依次进行OTU分析、Alpha多样性分析、菌群结构分析[22]。
1.7 数据处理试验数据经Excel 2019初步整理后,采用SPSS 19.0统计软件的独立样本t检验法进行组间差异显著性比较,以P<0.05为差异显著,0.05≤P<0.10为差异有显著趋势,结果以平均值±标准差表示。
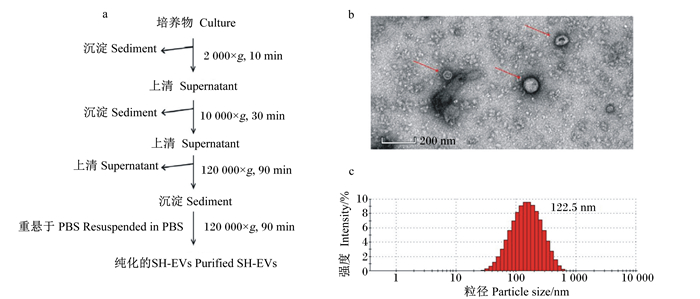
2 结果与分析 2.1 SH-EVs的生物学特性采用差速离心法从溶血性葡萄球菌培养液上清中得到较多的纯化SH-EVs(图 1-a)。对纯化SH-EVs进行TEM观察(图 1-b),发现SH-EVs大小不一,外形呈现圆形或椭圆形,直径100 nm左右,在20~500 nm范围之内,符合细菌EVs颗粒粒径的要求。随后采用纳米颗粒跟踪分析仪检测纯化SH-EVs的粒径分布(图 1-c),结果显示模式曲线线条平缓流畅,说明含有的杂质较少,纯度较好;检测得到的粒子分布系数(PDI)为0.271,介于0.08~0.70,证明体系分散度适中,检测结果置信度高;平均粒径为122.5 nm,粒径主峰为162.3 nm,粒径20~200 nm百分比为69.9%,与细菌EVs的理论颗粒粒径大小基本吻合。
|
a:分离纯化SH-EVs的主要步骤示意图;b:TEM观察SH-EVs的形态;c:Zetasizer Nano ZS检测SH-EVs的粒径分布。 a: schematic diagram of the main steps for the isolation and purification of SH-EVs; b: morphology of SH-EVs observed by transmission electron microscopy; c: particle size distribution of SH-EVs determined by Zetasizer Nano ZS. 图 1 SH-EVs的分离和表征 Fig. 1 Isolation and characterization of SH-EVs |
由表 1可知,与对照组相比,小鼠灌服SH-EVs显著降低了平均日采食量和平均日增重(P<0.05),有提高料重比的趋势(P=0.052),其中平均日采食量降低了4.80%,平均日增重降低了12.87%,料重比提高了9.20%。
|
|
表 1 SH-EVs对小鼠生长性能的影响 Table 1 Effects of SH-EVs on growth performance of mice |
由表 2可知,与对照组相比,小鼠灌服SH-EVs显著提高了血清TNF-α和IL-10含量(P<0.05),显著降低了血清IgA含量(P<0.05),有降低血清IgG含量的趋势(P=0.067),其中TNF-α和IL-10含量分别提高了16.26%和4.54%,IgA和IgG含量分别降低了9.15%和6.03%。
|
|
表 2 SH-EVs对小鼠血清免疫指标的影响 Table 2 Effects of SH-EVs on serum immune indicators of mice |
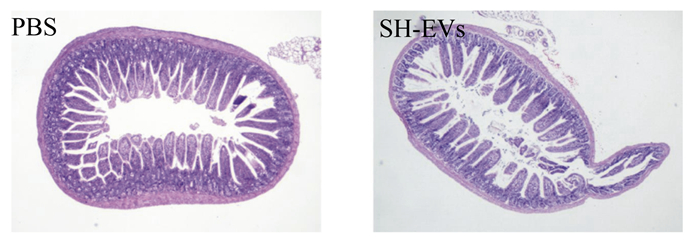
由图 2可知,对照组小鼠的回肠绒毛生长状态良好,完整性好,数量较多,密度较大;而试验组小鼠的回肠绒毛密度降低,有一定程度的损伤。
|
PBS代表对照组,SH-EVs代表试验组。下图同。 PBS represented control group and SH-EVs represented test group. The same as below. 图 2 小鼠回肠黏膜组织形态 Fig. 2 Ileum mucosa tissue morphology of mice |
由表 2可知,对照组和试验组检测到的物种数量均较高,在1 934~2 010个;覆盖度也均在99.6%以上,说明测序结果已基本覆盖样本的多样性。对照组和试验组的Chao1指数、ACE指数、Shannon指数和Simpson指数均差异不显著(P>0.05)。
|
|
表 3 Alpha多样性指数 Table 3 Alpha diversity indexes |
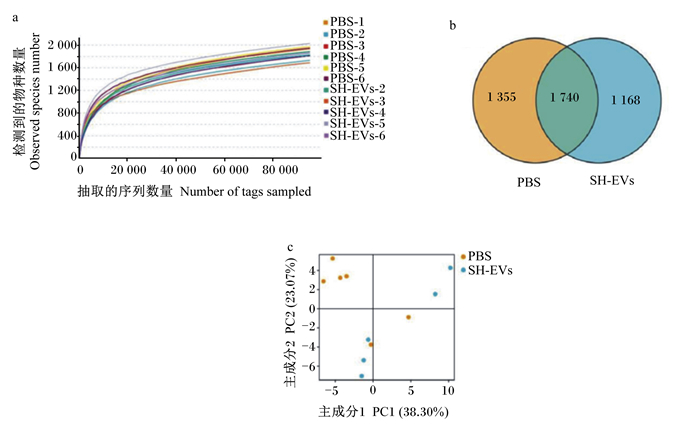
通过绘制稀释曲线可评价测序量是否足够,并能间接反映样本中物种的丰富程度。由图 3-a可见,各样本的稀释曲线趋于平缓或者达到平台期,可以认为继续增加测序深度已经不影响物种多样性,说明测序量足够。
|
图 3 稀释曲线(a)、韦恩图(b)和PCA图(c) Fig. 3 Rarefaction curves (a), Venn diagram (b) and PCA diagram (c) |
韦恩图可用于统计多个样本中所独有与共有的OTU数目,能够比较直观地表现样本的OTU数目组成相似性及重叠情况。由图 3-b可知,对照组和试验组共有1 740个OTU,对照组独有1 355个OTU,试验组独有1 168个OTU。
2.5.4 基于OTU的主成分分析(PCA)通过分析不同样本OTU(97%相似性)组成能够反映样本之间的差异和距离,PCA运用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映方差值的2个特征值。由图 3-c可知,对照组与试验组样本分散较远,相似性有较大差异。
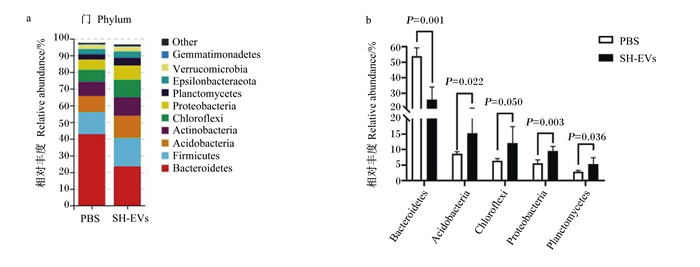
2.5.5 小鼠肠道菌群结构灌服SH-EVs对小鼠肠道菌群门水平相对丰度的影响如图 4所示。从样本中获得的主要菌群分别属于拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),在对照组中分别占42.84%和13.19%,在试验组中分别占23.56%和16.99%(图 4-a)。与对照组相比,灌服SH-EVs显著降低了小鼠肠道Bacteroidetes的相对丰度(P<0.05),显著提高了酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)的相对丰度(P<0.05)(图 4-b)。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Acidobacteria:酸杆菌门;Actinobacteria:放线菌门;Chloroflexi:绿弯菌门;Proteobacteria:变形菌门;Planctomycetes:浮霉菌门;Verrucomicrobia:疣微菌门;Gemmatimonadetes:芽单胞菌门;Other:其他。 图 4 在门水平上的肠道菌群结构(a)以及有显著差异的菌门(b) Fig. 4 Intestinal bacterial community structure at phylum level (a) and significantly changed phyla (b) |
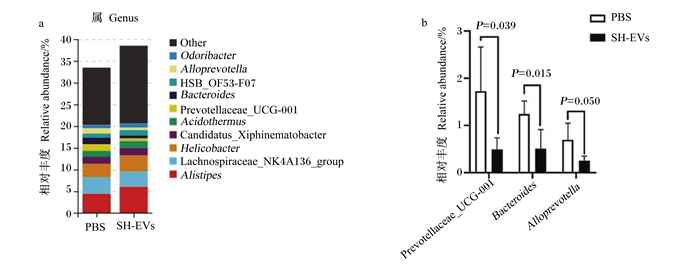
灌服SH-EVs对小鼠肠道菌群属水平相对丰度的影响如图 5所示。从样本中获得的主要菌群分别属于阿里叶柄菌属(Alistipes)、毛螺菌科NK4A136组(Lachnospiraceae_NK4A136_group)、螺杆菌属(Helicobacter),在对照组中分别占4.44%、3.79%、3.07%,在试验组中分别占6.05%、3.48%、3.70%(图 5-a)。与对照组相比,灌服SH-EVs显著降低了小鼠肠道普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)、拟杆菌属(Bacteroides)、拟普雷沃菌属(Alloprevotella)的相对丰度(P<0.05)(图 5-b)。
|
Alistipes:阿里叶柄菌属;Lachnospiraceae_NK4A136_group:毛螺菌科NK4A136组;Helicobacter:螺杆菌属;Acidothermus:热酸菌属;Prevotellaceae_UCG-001:普雷沃氏菌科UCG-001;Bacteroides:拟杆菌属;Alloprevotella:拟普雷沃菌属;Odoribacter:臭味杆菌属;Other:其他。 图 5 在属水平上的肠道菌群结构(a)以及有显著差异的菌属(b) Fig. 5 Intestinal bacterial community structure at genus level (a) and significantly changed bacterial genera (b) |
灌服SH-EVs对小鼠肠道菌群种水平相对丰度的影响如图 6所示。从对照组样本中获得的主要菌群为产酸拟杆菌(Bacteroides acidifaciens)、Helicobacter mastomyrinus、马赛拟杆菌dnLKV3(Bacteroides massiliensis dnLKV3),分别占0.85%、0.77%、0.59%;从试验组样本中获得的主要菌群为毛螺菌科细菌28-4(Lachnospiraceae_bacterium_28-4)、Bacteroides massiliensis dnLKV3、嗜酸细小链孢菌DSM44928(Catenulispora acidiphila DSM44928),分别占0.73%、0.44%、0.43%(图 6-a)。与对照组相比,灌服SH-EVs显著降低了小鼠肠道Bacteroides acidifaciens的相对丰度(P<0.05),显著提高了毛螺菌科细菌COE1(Lachnospiraceae_bacterium_COE1)的相对丰度(P<0.05)(图 6-b)。

|
Bacteroides acidifaciens:产酸拟杆菌;Bacteroides massiliensis dnLKV3:马赛拟杆菌dnLKV3;Catenulispora acidiphila DSM44928:嗜酸细小链孢菌DSM44928;Lachnospiraceae_bacterium_28-4:毛螺菌科细菌28-4;Lachnospiraceae_bacterium_COE1:毛螺菌科细菌COE1;Pseudomonas geniculate:弯曲假单胞菌;Clostridiales_bacterium_CIEAF_020:梭菌目细菌CIEAF020;Brevibacillus formosus:美丽短芽胞杆菌;Other:其他。 图 6 在种水平上的肠道菌群结构(a)以及有显著差异的菌种(b) Fig. 6 Intestinal bacterial community structure at species level (a) and significantly changed bacterial species (b) |
本试验采用TEM和Zetasizer Nano ZS从形态学和颗粒大小对SH-EVs进行了系统分析。结果显示,大部分SH-EVs粒径在20~500 nm,外形呈现圆形或椭圆形,符合文献报道的关于细菌EVs的形态特征[5]。
本试验研究了SH-EVs对小鼠生长性能、血清免疫指标的影响,结果显示小鼠灌服SH-EVs后平均日采食量和平均日增重以及血清IgA、IgG含量降低,血清TNF-α和IL-10含量升高。血清免疫球蛋白含量是反映动物机体免疫性能的重要指标之一,血清中IgA、IgG含量的降低表明动物体免疫机能减弱;TNF-α和IL-10参与炎性反应和免疫反应,是炎症因子[23-25]。溶血性葡萄球菌的典型毒力途径是:形成生物膜[26],产生PSM[19],由于大量的插入序列导致频繁的表型重排[27]。溶血性葡萄球菌感染主要由血液和器械相关感染引起,对免疫功能低下患者的影响尤为明显[28]。溶血性葡萄球菌产生的PSM具有较强的促炎活性[29],引起发烧、发冷、心动过速和呼吸急促等症状。过激的免疫反应以败血症为特征[19]。溶血性葡萄球菌通过产生抑制剂作用于淋球菌细胞的生长和休眠[30]。炎症反应导致采食量减少,进而影响动物的生长[31]。本试验中,试验组小鼠生长性能的下降可能与灌喂SH-EVs引起的炎症反应有关。由此可见,SH-EVs的作用与其来源菌(溶血性葡萄球菌)较为相似,提示SH-EVs中可能含有来自于溶血性葡萄球菌的毒力因子PSM。
有些肠道炎症局限于结肠和直肠,有些则遍布全肠段[32]。小肠是吸收营养物质的主要场所[33],小肠炎症直接影响到营养物质的吸收利用率。因此,本试验选择回肠作为观察点,研究SH-EVs对小鼠肠道形态的影响,结果显示,灌服SH-EVs后小鼠的回肠绒毛密度下降,出现一定程度的损伤。研究显示溶血性葡萄球菌的毒力因子PSM具有广泛的细胞溶解活性[19]。上述结果再次提示,SH-EVs中可能携带了来自于溶血性葡萄球菌的毒力因子PSM,PSM感染肠道上皮细胞,诱发了炎症反应和细胞损伤。
哺乳动物的肠道中有数万亿微生物,被视为是一个额外的器官。肠道微生物在维持肠道环境稳定和宿主健康方面起着重要作用[34-35]。肠道微生物在宿主免疫系统发育[36]、肠上皮细胞分化[35]、肠道黏膜屏障维持[37]中发挥了重要作用。肠道微生物的组成受多种环境因素的影响,包括抗生素、生活方式、饮食和卫生条件[35]。研究显示,动植物来源的EVs可改变动物肠道菌群结构[7-9]。本试验研究了SH-EVs对小鼠肠道菌群结构的影响,结果显示,从样本中获得的最主要菌门是Bacteroidetes,与文献报道[38]中关于小鼠肠道菌群的研究结果一致。在门水平上,灌服SH-EVs显著降低了小鼠肠道拟杆菌门的相对丰度,下降幅度高达52.25%,可见灌服SH-EVs对小鼠肠道菌群产生了较大的影响。在属水平上,灌服SH-EVs显著降低了小鼠肠道Prevotellaceae_UCG-001、Bacteroides、Alloprevotella的相对丰度,三者均属于Bacteroidetes,拟杆菌纲(Bacteroidia),拟杆菌目(Bacteroidales)。发生这种变化主要可能是基于Bacteroidales的共同特征,而这种共同特征可能是SH-EVs的作用靶点。Bacteroidales的细菌可能通过摄取SH-EVs而摄入了PSM,进而诱发了细胞损伤。
SH-EVs含有哪些主要成分?是否携带了PSM,本研究没有直接的证据。引起小鼠炎症反应、免疫力下降、肠道菌群紊乱的物质基础及作用机制是什么?还需要更为深入地研究。
4 结论① 灌服SH-EVs降低了小鼠的平均日采食量和平均日增重,进而降低了小鼠的生长性能。
② 灌服SH-EVs提高了小鼠血清TNF-α和IL-10含量,降低了血清IgA含量,进而降低了小鼠的免疫力。
③ 灌服SH-EVs降低了小鼠回肠绒毛密度,损伤了回肠形态结构。
④ 灌服SH-EVs,在门水平降低了小鼠肠道Bacteroidetes的相对丰度,提高了Acidobacteria、Chloroflexi、Proteobacteria、Planctomycetes的相对丰度;在属水平降低了小鼠肠道Prevotellaceae_UCG-001、Bacteroides、Alloprevotella的相对丰度;在种水平降低了小鼠肠道Bacteroides acidifaciens的相对丰度,提高了Lachnospiraceae_bacterium_COE1的相对丰度。
| [1] |
边素艳, 刘宏斌. 细胞外囊泡的分离及鉴定方法[J]. 新医学, 2019, 50(9): 658-662. BIAN S Y, LIU H B. Isolation and identification methods of extracellular vesicles[J]. New Medicine, 2019, 50(9): 658-662 (in Chinese). DOI:10.3969/j.issn.0253-9802.2019.09.003 |
| [2] |
BELL B M, KIRK I D, HILTBRUNNER S, et al. Designer exosomes as next-generation cancer immunotherapy[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2016, 12(1): 163-169. DOI:10.1016/j.nano.2015.09.011 |
| [3] |
BANG C, THUM T. Exosomes: new players in cell-cell communication[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(11): 2060-2064. |
| [4] |
RODRIGUES M L, NAKAYASU E S, OLIVEIRA D L, et al. Extracellular vesicles produced by Cryptococcus neoformans contain protein components associated with virulence[J]. Eukaryotic Cell, 2008, 7(1): 58-67. DOI:10.1128/EC.00370-07 |
| [5] |
DEATHERAGE B L, COOKSON B T. Membrane vesicle release in bacteria, eukaryotes, and archaea: a conserved yet underappreciated aspect of microbial life[J]. Infection and Immunity, 2012, 80(6): 1948-1957. DOI:10.1128/IAI.06014-11 |
| [6] |
FONG M Y, ZHOU W Y, LIU L, et al. Breast-cancer-secreted miR-122 reprograms glucose metabolism in premetastatic niche to promote metastasis[J]. Nature Cell Biology, 2015, 17(2): 183-194. DOI:10.1038/ncb3094 |
| [7] |
TONG L J, HAO H N, ZHANG X Y, et al. Oral administration of bovine milk-derived extracellular vesicles alters the gut microbiota and enhances intestinal immunity in mice[J]. Molecular Nutrition & Food Research, 2020, 64(8): e1901251. |
| [8] |
ZEMPLENI J, SUKREET S, ZHOU F, et al. Milk-derived exosomes and metabolic regulation[J]. Annual Review of Animal Biosciences, 2019, 7: 245-262. DOI:10.1146/annurev-animal-020518-115300 |
| [9] |
TENG Y, REN Y, SAYED M, et al. Plant-derived exosomal microRNAs shape the gut microbiota[J]. Cell Host & Microbe, 2018, 24(5): 637-652. |
| [10] |
ZHOU F, PAZ H A, SADRI M, et al. Dietary bovine milk exosomes elicit changes in bacterial communities in C57BL/6 mice[J]. American Journal of Physiology: Gastrointestinal and Liver Physiology, 2019, 317(5): G618-G624. DOI:10.1152/ajpgi.00160.2019 |
| [11] |
BISHOP D G, WORK E. An extracellular glycolipid produced by Escherichia coli grown under lysine-limiting conditions[J]. The Biochemical Journal, 1965, 96(2): 567-576. DOI:10.1042/bj0960567 |
| [12] |
SCHOOLING S R, BEVERIDGE T J. Membrane vesicles: an overlooked component of the matrices of biofilms[J]. Journal of Bacteriology, 2006, 188(16): 5945-5957. DOI:10.1128/JB.00257-06 |
| [13] |
BROWN L, WOLF J M, PRADOS-ROSALES R, et al. Through the wall: extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi[J]. Nature Reviews Microbiology, 2015, 13(10): 620-630. DOI:10.1038/nrmicro3480 |
| [14] |
黄婧文, 李欢, 万振鹏, 等. 仔猪溶血性葡萄球菌的分离鉴定及体外抑菌试验分析[J]. 江西畜牧兽医杂志, 2021(1): 13-16. HUANG J W, LI H, WAN Z P, et al. Isolation and identification of hemolytic Staphylococcus from piglets and analysis of antibacterial test in vitro[J]. Jiangxi Journal of Animal Husbandry & Veterinary Medicine, 2021(1): 13-16 (in Chinese). DOI:10.3969/j.issn.1004-2342.2021.01.007 |
| [15] |
刘保光, 谢苗, 董颖, 等. 金黄色葡萄球菌研究现状[J]. 动物医学进展, 2021, 42(4): 128-130. LIU B G, XIE M, DONG Y, et al. Research status of Staphylococcus aureus[J]. Progress in Veterinary Medicine, 2021, 42(4): 128-130 (in Chinese). DOI:10.3969/j.issn.1007-5038.2021.04.026 |
| [16] |
刘杰, 叶海梅, 刘秀峰, 等. 一起金黄色葡萄球菌食物中毒病原学检测及耐药分析[J]. 中国卫生检验杂志, 2020, 30(4): 484-486, 489. LIU J, YE H M, LIU X F, et al. Pathogenic detection and drug resistance analysis of Staphylococcus aureus from a food poisoning sample[J]. Chinese Journal of Health Laboratory Technology, 2020, 30(4): 484-486, 489 (in Chinese). |
| [17] |
ELTWISY H O, ABDEL-FATTAH M, ELSISI A M, et al. Pathogenesis of Staphylococcus haemolyticus on primary human skin fibroblast cells[J]. Virulence, 2020, 11(1): 1142-1157. DOI:10.1080/21505594.2020.1809962 |
| [18] |
连双庆, 陈愉生, 许能銮, 等. 重症监护室溶血性葡萄球菌医院感染危险因素病例对照研究[J]. 中国感染控制杂志, 2011, 10(5): 357-360. LIAN S Q, CHEN Y S, XU N L, et al. A case-control study on risk factors for nosocomial Staphylococcus haemolyticus infections in intensive care units[J]. Chinese Journal of Infection Control, 2011, 10(5): 357-360 (in Chinese). DOI:10.3969/j.issn.1671-9638.2011.05.010 |
| [19] |
DA F, JOO H S, CHEUNG G Y C, et al. Phenol-soluble modulin toxins of Staphylococcus haemolyticus[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 206. DOI:10.3389/fcimb.2017.00206 |
| [20] |
XIE M Y, HOU L J, SUN J J, et al. Porcine milk exosome miRNAs attenuate LPS-induced apoptosis through inhibiting TLR4/NF-κB and p53 pathways in intestinal epithelial cells[J]. Journal of Agricultural and Food Chemistry, 2019, 67(34): 9477-9491. DOI:10.1021/acs.jafc.9b02925 |
| [21] |
CHEN P F, ZHENG L, WANG Y Y, et al. Desktop-stereolithography 3D printing of a radially oriented extracellular matrix/mesenchymal stem cell exosome bioink for osteochondral defect regeneration[J]. Theranostics, 2019, 9(9): 2439-2459. DOI:10.7150/thno.31017 |
| [22] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [23] |
FERNÁNDEZ-CRUZ E, ALECSANDRU D, SÁNCHEZ RAMÓN S. Mechanisms of action of immune globulin[J]. Clinical and Experimental Immunology, 2009, 157(S1): 1-2. |
| [24] |
AKDIS C A, BLASER K. Mechanisms of interleukin-10-mediated immune suppression[J]. Immunology, 2001, 103(2): 131-136. DOI:10.1046/j.1365-2567.2001.01235.x |
| [25] |
SUN W P, YANG J. Functional mechanisms for human tumor suppressors[J]. Journal of Cancer, 2010, 1: 136-140. |
| [26] |
FREDHEIM E G A, KLINGENBERG C, ROHDE H, et al. Biofilm formation by Staphylococcus haemolyticus[J]. Journal of Clinical Microbiology, 2009, 47(4): 1172-1180. DOI:10.1128/JCM.01891-08 |
| [27] |
TAKEUCHI F, WATANABE S, BABA T, et al. Whole-genome sequencing of Staphylococcus haemolyticus uncovers the extreme plasticity of its genome and the evolution of human-colonizing staphylococcal species[J]. Journal of Bacteriology, 2005, 187(21): 7292-7308. DOI:10.1128/JB.187.21.7292-7308.2005 |
| [28] |
PAIN M, HJERDE E, KLINGENBERG C, et al. Comparative genomic analysis of Staphylococcus haemolyticus reveals key to hospital adaptation and pathogenicity[J]. Frontiers in Microbiology, 2019, 10: 2096. DOI:10.3389/fmicb.2019.02096 |
| [29] |
FOURNIER B, PHILPOTT D J. Recognition of Staphylococcus aureus by the innate immune system[J]. Clinical Microbiology Reviews, 2005, 18(3): 521-540. DOI:10.1128/CMR.18.3.521-540.2005 |
| [30] |
FRENETTE M, BEAUDET R, BISAILLON J G, et al. Site of action of a gonococcal growth inhibitor produced by Staphylococcus haemolyticus[J]. Journal of Medical Microbiology, 1988, 26(3): 199-204. DOI:10.1099/00222615-26-3-199 |
| [31] |
LIU Y L. Fatty acids, inflammation and intestinal health in pigs[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 41. DOI:10.1186/s40104-015-0040-1 |
| [32] |
HE F, WU C L, LI P, et al. Functions and signaling pathways of amino acids in intestinal inflammation[J]. BioMed Research International, 2018, 2018: 9171905. |
| [33] |
PARSONS S P, HUIZINGA J D. Nitric oxide is essential for generating the minute rhythm contraction pattern in the small intestine, likely via ICC-DMP[J]. Frontiers in Neuroscience, 2020, 14: 592664. |
| [34] |
HU J, CHEN L L, TANG Y M, et al. Standardized preparation for fecal microbiota transplantation in pigs[J]. Frontiers in Microbiology, 2018, 9: 1328. DOI:10.3389/fmicb.2018.01328 |
| [35] |
SOMMER F, BÄCKHED F. The gut microbiota-masters of host development and physiology[J]. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
| [36] |
IVANOV I I, ATARASHI K, MANEL N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria[J]. Cell, 2009, 139(3): 485-498. DOI:10.1016/j.cell.2009.09.033 |
| [37] |
GARRETT W S, GORDON J I, GLIMCHER L H. Homeostasis and inflammation in the intestine[J]. Cell, 2010, 140(6): 859-870. DOI:10.1016/j.cell.2010.01.023 |
| [38] |
孙东方, 王晨, 刘颖, 等. 双乙酸钠对小鼠肠道菌群结构和功能的影响[J]. 微生物学杂志, 2020, 40(2): 57-65. SUN D F, WANG C, LIU Y, et al. Effects of sodium diacetate on the structure and function of mice intestines microbial community[J]. Journal of Microbiology, 2020, 40(2): 57-65 (in Chinese). |




