2. 合肥正大有限公司, 合肥 230601;
3. 河北农业大学食品科技学院, 保定 071001
2. Hefei Zhengda Co., Ltd., Hefei 230601, China;
3. College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, China
蛋种鸡的饲养周期相对较长,产蛋后期种鸡生理机能逐渐退化,同时由于集约化养殖环境中各种应激因素的影响,鸡群常处于氧化应激状态,对疾病的抵抗力减弱,产蛋性能和孵化性能大幅降低,利用年限缩短,提高了养殖难度和养殖成本。因此,研究高效绿色饲料添加剂对产蛋后期蛋种鸡繁殖性能和抗氧化能力的影响对于提高蛋种鸡的利用率、延迟蛋种鸡下架时间和提高种禽饲养的经济效益有重要意义。葡萄糖氧化酶(glucose oxidase,GOD)作为一种功能性饲料添加剂,具有无残留、无抗药性、绿色安全等优点,在动物生产中的应用越来越广泛。已有研究表明,GOD可降低动物肠道pH,改善肠道健康,促进营养物质吸收利用,提高畜禽生产性能,增强机体抗氧化能力和免疫功能[1-7]。然而目前有关GOD在种禽上的研究甚少,其对产蛋后期海兰褐蛋种鸡产蛋性能、孵化性能和抗氧化能力方面的研究还未见报道。因此,本试验通过在产蛋后期蛋种鸡饲粮中添加不同水平的GOD,探究其对蛋种鸡产蛋性能、孵化性能、抗氧化能力及相关基因表达的影响,以期为GOD的抗氧化作用机制研究及其在种鸡生产中的合理应用提供科学依据。
1 材料与方法 1.1 试验材料GOD购自宁夏某有限公司,活性为1 200 U/g。
1.2 试验设计采用单因素随机试验设计,选用480只55周龄、体重和产蛋率基本一致的海兰褐蛋种母鸡,随机分为4组,每组6个重复,每个重复20只鸡。对照组饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加200、350和500 mg/kg GOD的试验饲粮。预试期1周,正试期12周。
1.3 基础饲粮及饲养管理参照NRC(1994)蛋种鸡营养标准和企业生产情况配制玉米-豆粕型基础饲粮,其组成及营养水平见表 1。各组试验鸡于半机械通风舍内使用3层阶梯笼养,自由采食和饮水,每隔5 d人工授精1次,每天人工光照16 h,光照强度为20 lx。试验期间各组试验鸡均保持相同的环境条件,并按常规饲养管理规程及免疫程序进行饲养和免疫。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
产蛋性能:试验期间每天15:00收集种蛋,记录各重复产蛋数、总蛋重和采食量,并记录破损蛋、软壳蛋、沙壳蛋、双黄蛋和畸形蛋等不合格蛋数。试验结束后对各组产蛋率、平均蛋重、平均日采食量、料蛋比和合格蛋率进行统计。

|
孵化性能:试验最后1周,每个重复收集50枚合格种蛋进行孵化指标的测定,并于孵化第18天进行照蛋,识别并捡出未受精种蛋,孵化过程中记录各重复入孵蛋数、受精蛋数和出雏数,计算受精率、孵化率和出雏率。

|
试验第12周末,每重复随机挑选5枚合格种蛋进行蛋品质测定。蛋形指数使用蛋形指数测量仪(NFN-385,以色列)进行测定,蛋壳强度、蛋白高度和哈氏单位使用多功能蛋品质测定仪(EMT-5200)进行测定,蛋壳厚度使用蛋壳厚度测量仪(ETG-1061型)测定。
1.4.3 血清及肝脏抗氧化指标试验结束后,各组以重复为单位随机选取2只接近平均体重的健康种鸡,翅静脉采血,3 000 r/min离心15 min后将血清分装于离心管,置于-20 ℃保存。采血完成后将试验鸡屠宰并解剖,取适量相同部位的肝脏组织,生理盐水冲洗后将分装于5 mL离心管中,置于液氮中,随后转移到-80 ℃冰箱保存。使用试剂盒测定血清及肝脏丙二醛(MDA)含量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和总抗氧化能力(T-AOC)。所用试剂盒均购于南京建成生物工程研究所,并严格按照试剂盒说明书进行操作。
1.4.4 肝脏抗氧化相关基因的mRNA表达样品采集:在进行1.4.3步骤的同时,额外取试验鸡2块筋膜较少的相同部位的肝脏组织,分装于1.5 mL冻存管后,迅速投入液氮,最后置于-80 ℃保存。
肝脏抗氧化相关基因mRNA相对表达量的测定步骤:1)使用超纯RNA提取试剂盒(Cat#CW0581,CWbio. Co., Ltd., )进行总RNA提取;取5 μL RNA,1%琼脂糖凝胶进行电泳,检测RNA的完整性。2)使用HiFi-MMLV cDNA第一链合成试剂盒(Cat#CW0744,CWbio. Co., Ltd., )进行反转录。3)应用Line Gene 9 600 Plus型PCR仪进行荧光定量,以β-肌动蛋白(β-actin)作为内参基因,采用2-ΔΔCt法计算目的基因的相对表达量。引物序列(表 2)由北京基谱生物科技有限公司设计并合成。
|
|
表 2 实时定量PCR引物序列 Table 2 Primer sequences used for quantitative real-time PCR |
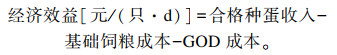
|
采用SPSS 22.0统计软件中的单因素方差分析(one-way ANOVA)程序对数据进行统计分析,并利用Duncan氏法进行多重比较,试验结果均以“平均值±标准差”表示,P < 0.05表示差异显著。
2 结果与分析 2.1 GOD对产蛋后期蛋种鸡产蛋性能和孵化性能的影响由表 3可知,与对照组相比,350和500 mg/kg GOD组产蛋后期蛋种鸡的产蛋率显著增加(P < 0.05),料蛋比显著降低(P < 0.05);200、350和500 mg/kg GOD组总产蛋数分别较对照组增加1.92、3.12和3.85枚/只,总合格蛋数较对照组分别增加1.97、3.74和3.86枚/只;与对照组相比,200、350和500 mg/kg GOD组的种蛋受精率显著增加(P < 0.05),但不同水平GOD添加组之间差异不显著(P>0.05);饲粮中添加不同水平GOD对平均日采食量、平均蛋重、合格蛋率、种蛋孵化率和出雏率均无显著影响(P>0.05)。
|
|
表 3 GOD对产蛋后期蛋种鸡产蛋性能和孵化性能的影响 Table 3 Effects of GOD on laying performance and hatching performance of laying breeders during later laying period |
由表 4可知,与对照组相比,350和500 mg/kg GOD组产蛋后期蛋种鸡的种蛋蛋壳厚度及哈氏单位显著增加(P < 0.05);饲粮中添加不同水平GOD对种蛋的蛋壳强度、蛋白高度和蛋形指数均无显著影响(P>0.05)。
|
|
表 4 GOD对产蛋后期蛋种鸡蛋品质的影响 Table 4 Effects of GOD on egg quality of laying breeders during later laying period |
由表 5可知,500 mg/kg GOD组产蛋后期蛋种鸡的血清MDA含量显著低于对照组、200和350 mg/kg GOD组(P < 0.05);与对照组相比,200、350和500 mg/kg GOD组的血清SOD活性和T-AOC显著增加(P < 0.05),但不同水平GOD添加组之间无显著差异(P>0.05);与对照组相比,350和500 mg/kg GOD组的血清GSH-Px活性显著增加(P < 0.05)。
|
|
表 5 GOD对产蛋后期蛋种鸡血清抗氧化指标的影响 Table 5 Effects of GOD on antioxidant indexes in serum of laying breeders during later laying period |
由表 6可知,与对照组相比,200、350和500 mg/kg GOD组产蛋后期蛋种鸡的肝脏MDA含量显著降低(P < 0.05),肝脏SOD活性显著增加(P < 0.05),但不同水平GOD添加组之间肝脏MDA含量和SOD活性无显著差异(P>0.05);350和500 mg/kg GOD组的肝脏GSH-Px活性显著高于对照组和200 mg/kg GOD组(P < 0.05);饲粮中添加GOD对肝脏T-AOC无显著影响(P>0.05)。
|
|
表 6 GOD对产蛋后期蛋种鸡肝脏抗氧化指标的影响 Table 6 Effects of GOD on antioxidant indexes in liver of laying breeders during later laying period |
由表 7可知,饲粮中添加不同水平的GOD显著上调了产蛋后期蛋种鸡肝脏核因子E2相关因子(Nrf2)、铜锌超氧化物歧化酶(Cu/Zn-SOD)和锰超氧化物歧化酶(Mn-SOD)的mRNA相对表达量(P < 0.05);GOD添加组的肝脏Nrf2的mRNA相对表达量均显著高于对照组(P < 0.05),但不同水平GOD添加组之间无显著差异(P>0.05);500 mg/kg GOD组的肝脏Cu/Zn-SOD的mRNA相对表达量显著高于对照组和200 mg/kg GOD组(P < 0.05),但500与350 mg/kg GOD组之间无显著差异(P>0.05);GOD添加组的肝脏的Mn-SOD的mRNA相对表达量显著高于对照组(P < 0.05),350与500 mg/kg GOD组之间无显著差异(P>0.05)。
|
|
表 7 GOD对产蛋后期蛋种鸡肝脏抗氧化相关基因mRNA相对表达量的影响 Table 7 Effects of GOD on mRNA relative expression levels of antioxidant related genes in liver of laying breeders during later laying period |
由表 8可知,饲粮中添加不同水平的GOD均能不同程度提高产蛋后期蛋种鸡的经济效益。在仅考虑饲粮成本的前提下,当GOD的添加水平为500 mg/kg时利润最高,每只鸡每日盈利1.030元,与对照组相比增加8.42%。
|
|
表 8 GOD对产蛋后期蛋种鸡经济效益的影响 Table 8 Effects of GOD on economic benefit of laying breeders during later laying period |
处于产蛋后期的蛋鸡,其本身生殖机能和抗氧化能力均有不同程度地减弱,而现代种鸡养殖多采用高密度笼养,鸡群常处于应激状态,进而导致产蛋性能和种蛋质量下降,孵化性能也显著降低[8-9]。研究表明,活性氧引起的氧化应激是机体衰老和卵巢功能衰退的主要机制之一[10-11]。因此,在饲粮中添加功能性添加剂可以缓解产蛋后期蛋种鸡的氧化应激状态,从而改善其生产性能。赵必迁等[12]在产蛋后期罗曼粉壳蛋鸡饲粮中添加300 mg/kg的GOD,发现显著提高了产蛋率和饲料转化率。曲浩杰等[13]在产蛋后期海兰褐蛋鸡饲粮中添加博落回提取物和GOD,发现产蛋率和料蛋比均有显著改善。本研究结果与上述报道一致,饲粮中添加350和500 mg/kg的GOD使产蛋后期海兰褐蛋种鸡的产蛋率和料蛋比得到显著改善。目前有关GOD对种用畜禽繁殖性能影响的报道有限。在猪上的研究表明,妊娠期和哺乳期母猪饲粮中添加60 U/kg的GOD能够改善母猪和仔猪的氧化还原状态,提高母猪的繁殖性能[7]。另据报道,在34周龄蛋种鸡饲粮中添加100 mg/kg的GOD对产蛋率、种蛋孵化率、受精率和健雏率等指标均无显著影响[14]。本研究中,饲粮中添加不同水平(200、350和500 mg/kg)GOD均显著改善了种蛋受精率。试验结果的差异可能归因于试验动物的种类、周龄、GOD的活性或添加水平不同。
3.2 GOD对产蛋后期蛋种鸡蛋品质的影响蛋壳厚度、蛋壳强度、蛋白高度、哈氏单位和蛋形指数是衡量蛋品质的重要指标。赵国先等[15]研究表明,在26周龄海兰褐蛋鸡饲粮中添加0.3%的GOD可显著提高鸡蛋的蛋壳厚度和哈氏单位。曲浩杰等[13]将GOD和博落回提取物联合使用,发现对55周龄产蛋后期海兰褐蛋鸡的蛋壳厚度无显著影响,但显著提高了蛋白高度。本试验中,饲粮中添加350和500 mg/kg的GOD显著提高了种蛋的蛋壳厚度和哈氏单位,蛋壳强度也有所增加,但未达到显著水平。研究结果的不同,可能与试验动物的种类、产蛋阶段、饲粮组成及养殖环境等因素有关。蛋壳质量不仅影响种蛋的运输安全,还会影响种蛋的孵化率[16]。哈氏单位是表示鸡蛋新鲜程度和蛋白质量的重要指标,其与种蛋孵化率也密切相关[17]。研究表明,氧化应激可抑制钙离子在肠道内的吸收,也会阻碍其在输卵管壳腺部的转运,影响蛋壳品质[18-19]。本试验结果显示,饲粮中添加350和500 mg/kg的GOD显著改善了产蛋后期蛋种鸡的氧化应激状态,这与种蛋的蛋壳质量和哈氏单位得到显著改善的结果相一致。此外,本课题组前期研究结果表明,饲粮中添加300和400 mg/kg的GOD可显著提高蛋鸡对钙、总磷和粗蛋白质等的消化率[5]。因此推测,GOD可能通过减轻产蛋后期蛋种鸡的氧化应激状态,改善机体钙、磷和蛋白质代谢来提高种蛋的蛋壳厚度和哈氏单位,其具体机制还有待进一步研究。
3.3 GOD对产蛋后期蛋种鸡抗氧化能力的影响血清及肝脏中GSH-Px、SOD活性和T-AOC、MDA含量都是反映机体抗氧化能力的重要指标。GSH-Px和SOD作为机体酶促抗氧化系统的第1道防线,可消除自由基,维持细胞内氧化还原平衡[20]。MDA为细胞膜脂质过氧化的终产物,可参照其含量来间接估计机体所受氧化损伤的程度。T-AOC是体现机体抗氧化能力的综合指标[21]。宋海彬[22]研究发现,饲粮中添加GOD可使肉鸡血清SOD活性不同程度增加,MDA含量下降。Wang等[2]研究证实,GOD可显著提高岭南黄羽肉鸡肝脏GSH-Px活性和T-AOC,显著降低MDA含量,增强机体抗氧化能力。另有研究表明,饲粮中添加30 mg/kg的GOD(活性为10 000 U/g)显著降低了临武鸭血清MDA含量,添加水平为40 mg/kg时血清GSH-Px活性显著增加,证实了GOD具有增强机体抗氧化能力的作用[23]。本研究中,饲粮中添加350和500 mg/kg GOD均可使蛋种鸡血清和肝脏GSH-Px、SOD活性显著增加,MDA含量显著降低,血清T-AOC显著升高,与上述结果基本一致。由此可见,饲粮中添加350和500 mg/kg GOD能够提高产蛋后期蛋种鸡机体的抗氧化酶活性,减轻脂质过氧化水平,缓解其氧化应激状态,从而改善种鸡的产蛋性能、孵化性能和蛋品质。
3.4 GOD对产蛋后期蛋种鸡抗氧化相关基因表达的影响Kelch样环氧氯丙烷相关蛋白1(Keap1)/Nrf2/抗氧化反应元件(ARE)信号通路是机体抵御氧化应激损伤的重要信号通路[24],该通路中起关键作用的是Nrf2,可调控下游多种抗氧化酶的基因表达[25]。Keap1是Nrf2的抑制因子,当细胞受到应激源刺激时,处于细胞质中的Nrf2与Keap1发生解偶联,并转移到细胞核与ARE结合,激活ARE相关二相酶的基因表达,降低细胞氧化损伤[26-27]。
Zhang等[28]研究表明,饲粮中添加含有GOD的益生菌后,仔猪肝脏Nrf2的mRNA和蛋白相对表达量显著增加。本研究中,饲粮中添加GOD显著提高了产蛋后期蛋种鸡肝脏Nrf2的mRNA相对表达量,同时Mn-SOD和Cu/Zn-SOD的mRNA相对表达量也显著增加,且血清和肝脏SOD活性表现出与肝脏抗氧化相关基因mRNA相对表达量一致的规律性。这说明GOD可诱导肝脏细胞中Nrf2/ARE信号通路关键基因Nrf2的表达,以调节下游SOD等相关抗氧化基因的转录和高效表达,使得机体抗氧化酶活性增加,最终提高机体抗氧化能力。然而,GOD是否可通过激活Keap1感应元件,调控Nrf2与Keap1解偶联来调控下游抗氧化基因表达以及GOD抗氧化作用的具体分子机制还有待进一步研究。
4 结论① 饲粮中添加350和500 mg/kg GOD可显著改善产蛋后期蛋种鸡的产蛋率和料蛋比,添加200、350和500 mg/kg GOD可显著改善种蛋受精率。
② 饲粮中添加350和500 mg/kg GOD可显著提高产蛋后期蛋种鸡种蛋的蛋壳厚度和哈氏单位。
③ 饲粮中添加GOD可提高产蛋后期蛋种鸡的血清和肝脏的抗氧化能力,激活肝脏细胞Nrf2/ARE信号通路相关基因的表达。
④ 综合经济效益分析,本试验条件下,产蛋后期蛋种鸡饲粮中GOD的适宜添加水平为500 mg/kg。
| [1] |
LIU J, LIU G H, CHEN Z M, et al. Effects of glucose oxidase on growth performance, immune function, and intestinal barrier of ducks infected with Escherichia coli O88[J]. Poultry Science, 2020, 99(12): 6549-6558. DOI:10.1016/j.psj.2020.09.038 |
| [2] |
WANG Y Y, WANG Y, XU H, et al. Direct-fed glucose oxidase and its combination with B.amyloliquefaciens SC06 on growth performance, meat quality, intestinal barrier, antioxidative status, and immunity of yellow-feathered broilers[J]. Poultry Science, 2018, 97(10): 3540-3549. DOI:10.3382/ps/pey216 |
| [3] |
WU S R, LI T H, NIU H F, et al. Effects of glucose oxidase on growth performance, gut function, and cecal microbiota of broiler chickens[J]. Poultry Science, 2019, 98(2): 828-841. DOI:10.3382/ps/pey393 |
| [4] |
QU W, LIU J. Effects of glucose oxidase supplementation on the growth performance, antioxidative and inflammatory status, gut gunction, and microbiota composition of broilers fed moldy corn[J]. Frontiers in Physiology, 2021, 12: 646393. DOI:10.3389/fphys.2021.646393 |
| [5] |
赵国先, 张晓云, 左晓磊, 等. 葡萄糖氧化酶对蛋鸡日粮主要营养物质表观消化率及肠道微生物的调控作用(英文)[J]. 动物营养学报, 2008, 20(6): 679-685. ZHAO G X, ZHANG X Y, ZUO X L, et al. Regulation of glucose oxidase on digestibility of main nutrients and cecum microorganism of laying hens[J]. Chinese Journal of Animal Nutrition, 2008, 20(6): 679-685 (in Chinese). DOI:10.3969/j.issn.1006-267X.2008.06.012 |
| [6] |
杨久仙, 张荣飞, 马秋刚, 等. 葡萄糖氧化酶对断奶仔猪生长性能及肠道健康的影响[J]. 中国畜牧兽医, 2011, 38(6): 18-21. YANG J X, ZHANG R F, MA Q G, et al. Effects of glucose oxides on productive performances of weanling piglets, and gastrointestinal tract health[J]. China Animal Husbandry & Veterinary Medicine, 2011, 38(6): 18-21 (in Chinese). |
| [7] |
SUN X J, PIAO L G, JIN H F, et al. Effects of dietary glucose oxidase, catalase, or both supplementation on reproductive performance, oxidative stress, fecal microflora and apoptosis in multiparous sows[J/OL]. Animal Bioscience, 2021, doi: https://doi.org/10.5713/ab.20.0839
|
| [8] |
周建民, 武书庚, 王晶, 等. 产蛋后期蛋鸡生理特点与营养调控[J]. 中国家禽, 2021, 43(3): 74-82. ZHOU J M, WU S G, WANG J, et al. Physiological characteristics and nutritional regulation of aged laying hens[J]. China Poultry, 2021, 43(3): 74-82 (in Chinese). |
| [9] |
朱飞, 刘艳妍, 韩月, 等. L-茶氨酸对产蛋后期岭南黄肉种鸡免疫及抗氧化性能的影响[J]. 饲料研究, 2017(12): 13-17, 31. ZHU F, LIU Y Y, HAN Y, et al. Effect of L-theanine on immune and antioxidant properties of Lingnan yellow broilers during later laying period[J]. Feed Research, 2017(12): 13-17, 31 (in Chinese). |
| [10] |
CHHUNCHHA B, KUBO E, SINGH P, et al. Sumoylation-deficient Prdx6 repairs aberrant sumoylation-mediated Sp1 dysregulation-dependent Prdx6 repression and cell injury in aging and oxidative stress[J]. Aging, 2018, 10(9): 2284-2315. DOI:10.18632/aging.101547 |
| [11] |
LUDERER U. Ovarian toxicity from reactive oxygen species[J]. Vitamins & Hormones, 2014, 94: 99-127. |
| [12] |
赵必迁, 李学海. 葡萄糖氧化酶对产蛋后期蛋鸡生产性能的影响[J]. 广东畜牧兽医科技, 2016, 41(5): 22-24. ZHAO B Q, LI X H. Effects of glucose oxidase on performance of laying hens during late laying period[J]. Guangdong Journal of Animal and Veterinary Science, 2016, 41(5): 22-24 (in Chinese). DOI:10.3969/j.issn.1005-8567.2016.05.008 |
| [13] |
曲浩杰, 孙广超, 朱应波, 等. 博落回提取物和葡萄糖氧化酶联合使用对蛋鸡产蛋后期生产性能、抗氧化性能和经济效益的影响[J]. 饲料工业, 2020, 41(14): 7-11. QU H J, SUN G C, ZHU Y B, et al. Effects of macleaya cordata extract combined with glucose oxidase enzyme on production performance, antioxidant capacity and economic benefits of laying hens during late period of laying[J]. Feed Industry, 2020, 41(14): 7-11 (in Chinese). |
| [14] |
徐海燕. 葡萄糖氧化酶在种鸡产蛋期的应用研究[J]. 当代畜牧, 2013(9): 41-42. XU H Y. Application of glucose oxidase in laying period of breeder hens[J]. Contemporary Animal Husbandry, 2013(9): 41-42 (in Chinese). |
| [15] |
赵国先, 张小云, 计成, 等. 葡萄糖氧化酶对鸡蛋品质的影响[J]. 中国家禽, 2006, 28(24): 66-68. ZHAO G X, ZHANG X Y, JI C, et al. Effects of glucose oxidase on egg quality[J]. China Poultry, 2006, 28(24): 66-68 (in Chinese). DOI:10.3969/j.issn.1004-6364.2006.24.027 |
| [16] |
WOLC A, ARANGO J, SETTAR P, et al. Genetic parameters of egg defects and egg quality in layer chickens[J]. Poultry Science, 2012, 91(6): 1292-1298. DOI:10.3382/ps.2011-02130 |
| [17] |
乔利敏, 关文怡, 马建民. 葡萄籽粕替代玉米对种鸡产蛋高峰后期生产性能、鸡蛋品质及新城疫抗体水平的影响[J]. 中国畜牧兽医, 2019, 46(12): 3538-3546. QIAO L M, GUAN W Y, MA J M. Effects of replacing corn with grape seed meal on performance, egg quality and Newcastle disease antibody level of breeder chickens at late egg production peak[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(12): 3538-3546 (in Chinese). |
| [18] |
DE BARBOZA G D, GUIZZARDI S, MOINE L, et al. Oxidative stress, antioxidants and intestinal calcium absorption[J]. World Journal of Gastroenterology, 2017, 23(16): 2841-2853. DOI:10.3748/wjg.v23.i16.2841 |
| [19] |
BAR A, VAX E, STRIEM S. Relationships between calbindin (Mr 28, 000) and calcium transport by the eggshell gland[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1992, 101(4): 845-848. DOI:10.1016/0300-9629(92)90367-Y |
| [20] |
CHUEH C C, LIN L J, LIN W C, et al. Antioxidant capacity of banana peel and its modulation of Nrf2-ARE associated gene expression in broiler chickens[J]. Italian Journal of Animal Science, 2019, 18(1): 1394-1403. DOI:10.1080/1828051X.2019.1667884 |
| [21] |
胡锴, 任常宝, 颜城, 等. 高铜日粮对肉鸡肝脏抗氧化功能的影响[J]. 中国家禽, 2011, 33(12): 26-29. HU K, REN C B, YAN C, et al. Effect of different levels of dietary copper sulfate on liver antioxidantal index in broilers[J]. China Poultry, 2011, 33(12): 26-29 (in Chinese). |
| [22] |
宋海彬. 葡萄糖氧化酶对肉鸡生长的营养调控作用及机理研究[D]. 硕士学位论文. 保定: 河北农业大学, 2008: 19-20. SONG H B. Study on nutrition regulation effect of glucose on broilers growth and their function mechanism[D]. Master's Thesis. Baoding: Agricultural University of Hebei, 2008: 19-20. (in Chinese) |
| [23] |
王前光, 李闯, 黄璇, 等. 葡萄糖氧化酶对1~6周龄临武鸭生长性能、血清生化和抗氧化指标、肠道形态结构和微生物多样性的影响[J]. 动物营养学报, 2020, 32(8): 3605-3614. WANG Q G, LI C, HUANG X, et al. Effects of glucose oxidase on growth performance, serum biochemical and antioxidant indexes, intestinal morphology and microbial diversity of 1 to 6-week-old linwu ducks[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3605-3614 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.08.019 |
| [24] |
陈刚耀, 唐志刚, 乔丽红, 等. 载锌沸石对肉鸡生产性能、抗氧化功能及其相关基因表达的影响[J]. 中国粮油学报, 2015, 30(2): 74-79. CHEN G Y, TANG Z G, QIAO L H, et al. Effects of zinc-bearing clinoptilolite on growth performance, antioxidant function and genes expression of broiler chickens[J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(2): 74-79 (in Chinese). |
| [25] |
CHO H Y, REDDY S P, KLEEBERGER S R. Nrf2 defends the lung from oxidative stress[J]. Antioxidants & Redox Signaling, 2006, 8(1/2): 76-87. |
| [26] |
赵雅丽, 张心壮, 格日乐其木格, 等. 氧化应激对畜禽组织器官的损伤及核因子E2相关因子2-抗氧化反应元件信号通路抗氧化应激的机理研究进展[J]. 动物营养学报, 2020, 32(05): 2052-2059. ZHAO Y L, ZHANG X Z, GERELCHIMEG, et al. Research progress of oxidative stress damage on livestock tissues and organs associated with antioxidative stress mechanism of nuclear factor E2 related factor 2-antioxidant response element signaling pathway[J]. Chinese Journal of Animal Nutrition, 2020, 32(05): 2052-2059 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.05.013 |
| [27] |
RUBIOLO J A, MITHIEUX G, VEGA F V. Resveratrol protects primary rat hepatocytes against oxidative stress damage: activation of the Nrf2 transcription factor and augmented activities of antioxidant enzymes[J]. European Journal of Pharmacology, 2008, 591(1/2/3): 66-72. |
| [28] |
ZHANG J, LIU Y J, YANG Z B, et al. Illicium verum extracts and probiotics with added glucose oxidase promote antioxidant capacity through upregulating hepatic and jejunal Nrf2/Keap1 of weaned piglets[J]. Journal of Animal Science, 2020, 98(3): skaa077. DOI:10.1093/jas/skaa077 |




