2. 北京首农畜牧发展有限公司, 北京 100076
2. Beijing Sunlon Livestock Development Company Limited, Beijing 100076, China
近年来,围产期奶牛生理变化及其营养调控一直是奶牛营养和生理学的研究重点和热点[1-2]。国内外对围产期奶牛能量平衡及其调控的研究已经取得较大的进展,这些研究为围产期奶牛的营养调控提供了坚实的理论基础,但仍然有很多争论和需要完善的地方,特别是干奶期奶牛能量需求方面。根据NRC(2001)推荐标准,从干奶到产前21 d的奶牛饲粮产奶净能(NEL)水平为5.23 MJ/kg DM,分娩前最后3周NEL水平为6.44~6.78 MJ/kg DM。我国的奶牛饲养标准(2000)把整个干奶期奶牛饲粮NEL水平定为5.36 MJ/kg DM,并没有突出产前最后几周的能量需求,而2004年修订版对干奶期奶牛的营养需求更加细化,干奶期的营养需求不再一刀切,而是根据体重、胎次和妊娠天数给出不同的需求量。例如,对于体重600 kg的奶牛,妊娠最后1个月,干物质采食量(DMI)预测值为11.2 kg/d,每头牛能量需求为64 MJ/d,即饲粮能量水平要求提高到5.73 MJ/d,远低于NRC(2001)的推荐值。Mc Namara等[3]认为,产前饲喂高精料饲粮可以使产前最后几周奶牛能量满足需求,改善奶牛能量平衡以减少代谢病的发生,产前饲喂高精料饲粮除了最大程度满足机体需要外,还可以促进围产期奶牛瘤胃微生物的生长和瘤胃乳头上皮的发育,从而使奶牛更好地适应产后高精料饲粮。但Dann等[4]认为在干奶期饲喂高能量水平饲粮实际上会对奶牛在泌乳早期阶段造成持续有害的影响。近年来大量的试验证实产前饲喂低能量水平饲粮更有利于减少围产期奶牛脂质的动员或提高产后的生产性能[5-7]。Huang[8]等、Dancy等[9]的研究结果表明,干奶期饲喂低能量水平饲粮虽然降低了产后产奶量,但可以有效缓解能量负平衡。因此,干奶期奶牛的适宜饲粮能量水平仍有较大争议。本试验的目的是探讨干奶期奶牛饲粮能量水平对瘤胃发酵、消化代谢及血液指标的影响,以便建立适合我国的荷斯坦奶牛干奶期饲养管理模式,同时也为我国奶牛饲养标准的进一步修订提供理论依据。
1 材料与方法 1.1 试验动物和饲粮选择体重[(641±31) kg]、体况评分(BCS,3.31±0.19)、预产期相近并装有永久性瘤胃瘘管的干奶期健康奶牛4头(产前70 d干奶),采用4×4拉丁方设计,分别饲喂4种不同能量水平的饲粮,即NEL水平分别为5.46、5.78、6.11和6.43 MJ/kg DM。试验饲粮组成及营养水平见表 1。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
从产前60 d开始试验,分为4期,每期13 d,其中包括调整适应期10 d,采样期3 d。试验期内每周采集1次饲料样品。采样期内每天于采食后0、4、8、12、16、20和24 h采集瘤胃液,连续3 d全收粪尿,并于最后1天晨饲后4 h,通过尾静脉采集血液。试验牛为栓系饲养,手工配制全混合日粮(TMR),分别于每天05:30和17:30各饲喂1次,全天自由饮水。记录每天的采食量,剩料量控制在饲喂量的5%~10%。
1.3 样品采集与分析 1.3.1 饲料样品的采集与分析试验期内每周采集1次饲料样品,包括青贮、羊草、精料混合料、TMR以及剩料,于60 ℃烘箱内烘干48 h制备风干样,粉碎后保存待测。干物质(DM)含量测定采用105 ℃烘干方法(method 950.15,AOAC)[10],粗蛋白质(CP)含量测定采用凯氏定氮法,粗灰分(Ash)含量测定采用550 ℃灼烧法(method 924.05,AOAC)[10],粗脂肪(EE)含量测定采用索氏提取法(method 920, 39,AOAC)[10],钙(Ca)和磷(P)含量测定参考AOAC方法(method 965.09和method 965.17)[10],酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)含量根据Van Soest等[11]的方法测定。
1.3.2 瘤胃液的采集与分析采样期内每天于采食后0、4、8、12、16、20和24 h采集瘤胃液,用4层纱布过滤后,立即测定pH;然后再以1 510×g的速度离心,收集上清液,并分装于2个塑料瓶中,-20 ℃冷冻保存。其中一瓶根据Broderick等[12]描述的方法,用分光光度计测定氨态氮(NH3-N)含量。另一瓶用25%偏磷酸酸化后,用Agilent 6890N气相色谱仪测定挥发性脂肪酸(VFA)含量[13]。
1.3.3 粪样、尿样的收集与分析在每个试验期的采样期内,采用Cao等[14]描述的方法,连续3 d全收粪尿。将每天所收集的粪样混合均匀后,准确称取总粪量的2%,加入1/4粪重的10%酒石酸,混合均匀并于60 ℃烘干回潮,粉碎后保存待测,粪样中的各种营养成分的分析指标和方法同饲料样品。为防止尿样的腐败分解,在集尿桶中预加入200 mL 10%的稀硫酸以使pH < 3.0,每天取总尿量的2%,用4层纱布过滤后,分装于2个塑料瓶,于-20 ℃冷冻保存。其中一瓶按照凯氏定氮法测定总氮含量[10],另一瓶采用试剂盒的方法测定尿素氮(UN)含量[15]。相关指标计算公式如下:

|
在每个采样期内于最后1天晨饲后4 h,使用肝素抗凝一次性真空采血管,通过尾静脉采集血样10 mL,1 398×g离心分离血浆,分装于1.5 mL冻存管中,于-20 ℃保存待检。血浆葡萄糖(GLU)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、非酯化脂肪酸(NEFA)、β-羟基丁酸(BHBA)、UN含量及谷丙转氨酶(GPT)、谷草转氨酶(GOT)活性使用全自动生化分析仪(Technicon Instruments Corp.,美国)测定;血浆瘦素(Leptin)、胰岛素(Ins)、胰高血糖素(GLN)含量使用放射性免疫试剂盒测定(Linco Research,Inc.,美国)。
1.4 数据统计分析本试验按照拉丁方设计,用SAS 9.1的GLM过程进行分析。瘤胃发酵参数采用以下数学模型:
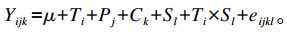
|
式中:Yijk为试验牛在不同饲粮处理下的因变量值;μ为均值;Ti为饲粮处理效应;Pj为试验期效应;Ck为试验牛的随机影响(k=1~4);Sl为采样时间(l=0、4、8、12、16、20、24 h);Ti×Sl为处理与采样时间的互作;eijkl为误差项。
其他数据采用SAS 9.1的GLM程序进行分析,均值采用Tukey检验进行多重比较。试验数据统计结果以平均值和均值标准误(SEM)表示,P < 0.05表示差异显著,0.05<P < 0.10表示有差异趋势,P>0.10表示差异不显著。
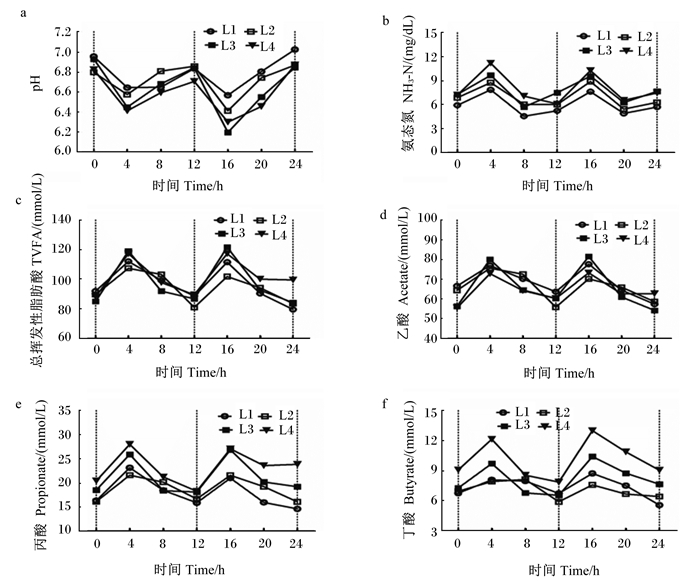
2 结果 2.1 饲粮能量水平对干奶期奶牛瘤胃发酵的影响从表 2和图 1可以看出,随着饲粮能量水平的提高,干奶期奶牛瘤胃液pH有降低的趋势(P=0.076),NH3-N含量有增加的趋势(P=0.086),丙酸含量显著增加(P < 0.05),乙酸/丙酸显著降低(P < 0.05)。NEL为6.43 MJ/kg组的瘤胃液丁酸和异戊酸含量显著高于其他各组(P < 0.05)。饲粮能量水平对干奶期奶牛瘤胃液总挥发性脂肪酸(TVFA)、乙酸和戊酸含量没有显著影响(P>0.10)。
|
|
表 2 饲粮能量水平对干奶期奶牛瘤胃发酵的影响 Table 2 Effects of dietary energy level on rumen fermentation of dairy cows during dry period |
|
L1、L2、L3和L4分别代表干奶期奶牛饲粮4个能量水平(L1,NEL=5.46 MJ/kg DM;L2,NEL=5.78 MJ/kg DM;L3,NEL=6.11 MJ/kg DM;L4,NEL=6.43 MJ/kg DM);垂直虚线代表饲喂时间。 L1, L2, L3 and L4 represent the four energy levels (L1, NEL=5.46 MJ/kg DM; L2, NEL=5.78 MJ/kg DM; L3, NEL=6.11 MJ /kg DM; L4, NEL=6.43 MJ/kg DM) of dairy cows during dry period, respectively; the vertical dotted line represents feeding time. 图 1 饲粮能量水平对干奶期奶牛瘤胃发酵的影响 Fig. 1 Effects of dietary energy level on rumen fermentation of dairy cows during dry period |
从表 3可以看出,随着饲粮能量水平的提高,干奶期奶牛DM、CP和EE摄入量显著增加(P < 0.05);粪中CP和ADF排出量显著增加(P < 0.05),DM和NDF排出量有增加的趋势(P=0.074和P=0.063);DM的表观消化率显著提高(P < 0.05),而NDF和ADF的表观消化率有下降的趋势(P=0.087和P=0.068)。
|
|
表 3 饲粮能量水平对干奶期奶牛消化代谢的影响 Table 3 Effects of dietary energy level on digestion and metabolism of dairy cows during dry period |
从表 4可以看出,随着饲粮能量水平的提高,干奶期奶牛摄入氮、粪氮、粪尿氮总排泄量和沉积氮显著增加(P < 0.05),氮利用率有提高的趋势(P=0.086),而粪尿氮总排泄量占摄入氮的比例有下降的趋势(P=0.086)。
|
|
表 4 饲粮能量水平对干奶期奶牛氮代谢的影响 Table 4 Effects of dietary energy level on nitrogen metabolism of dairy cows during dry period |
从表 5可以看出,随着饲粮能量水平的提高,干奶期奶牛血浆胰岛素含量显著提高(P < 0.05),葡萄糖含量有提高的趋势(P=0.088),而NEFA含量显著降低(P < 0.05)。饲粮能量水平对其他血浆生化指标没有显著影响(P>0.10)。
|
|
表 5 饲粮能量水平对干奶期奶牛血浆生化指标的影响 Table 5 Effects of dietary energy level on plasma biochemical parameters of dairy cows during dry period |
瘤胃pH是衡量瘤胃内环境变化的一项重要指标,受到多种因素的影响。瘤胃pH决定着瘤胃微生物对底物的利用效率,当瘤胃pH < 6.2时微生物合成蛋白质的效率下降[16]。Van Houter[17]认为,瘤胃微生物达到最大生长速度的适宜pH在5.7以上。本试验中,随着饲粮能量水平的提高,瘤胃pH有下降的趋势,但各时间点瘤胃pH均维持在6.2以上,比较适宜微生物的生长。在生产中,饲粮精粗比是影响瘤胃pH的重要因素,精料中可被快速发酵的碳水化合物和可溶性淀粉含量高,所以饲粮中精料比例提高时,瘤胃pH会随之降低[18]。秦正君等[19]也发现,饲粮中精饲料比例提高,可使瘤胃pH降低。这可能是因为在高精料饲粮条件下,瘤胃内产酸过多致使pH迅速下降。反之,粗饲料中的纤维素难以被快速发酵,而且物理有效纤维可以促进反刍产生唾液等缓冲物质,所以当粗饲料比例较高时,瘤胃pH能维持在较高的水平。本试验随着饲粮能量水平的升高,饲粮精粗比增加,这可能是瘤胃pH降低的主要原因。
瘤胃NH3-N主要来源于食糜中的蛋白质和非蛋白氮(NPN)的降解,瘤胃NH3-N含量的高低在一定程度上反映了蛋白质降解与合成间所达到的平衡状况。瘤胃内NH3-N作为纤维分解菌的必需氮源,非纤维分解菌的部分氮源,是影响微生物活力的一项重要指标。正常情况下,瘤胃NH3-N含量应该保持适宜水平。瘤胃NH3-N含量过低无法满足微生物合成蛋白质的需要,过高则表明氨生成量高于微生物对其吸收和利用,会造成氮的损失,严重者还可发生氨中毒。关于微生物最佳生长的瘤胃NH3-N含量,Satter等[20]试验结果表明,NH3-N小于5 mg/dL时发酵的“解偶联”作用引起微生物的产量降低,生产效率下降,该值被广泛用作瘤胃最低NH3-N含量的标准。Preston等[21]报道微生物生长对瘤胃NH3-N含量耐受的临界范围为6~30 mg/dL。本试验4种饲粮的奶牛瘤胃NH3-N含量在5.35~7.48 mg/dL,各时间点的平均含量也基本处于适宜瘤胃微生物生长的范围,与大部分学者的研究结果相一致。但本研究发现,低能量水平饲粮瘤胃NH3-N含量低于6.0 mg/dL,表明该饲粮瘤胃微生物生产效率偏低。涂瑞等[22]在对牦牛的研究中还发现,饲粮精粗比与小肽之间存在互作效应,共同影响瘤胃体外发酵特性。
VFA为奶牛的代谢过程和牛奶合成提供了大部分的能量前体[23]。反刍动物的消化能60%~80%由VFA提供。瘤胃VFA含量主要取决于VFA的产量和吸收速率。各种VFA的吸收速率不同,且受到瘤胃pH的影响。一般当瘤胃pH≥7时,吸收顺序为乙酸﹥丙酸﹥丁酸;而pH在5.8左右时,吸收顺序恰好相反。黄文明[24]试验结果表明,低能量水平饲粮显著降低了产前瘤胃液丙酸和丁酸含量。Murphy等[25]研究发现,给泌乳中期奶牛饲喂不同能量水平的饲粮对瘤胃TVFA含量没有显著影响,但高能量水平饲粮的乙酸/丙酸较小。本试验中,随着饲粮能量水平的提高,瘤胃丙酸含量以及乙酸和丙酸增加,这可能是因为能量水平增加导致非结构性碳水化合物(NSC)代替了结构性碳水化合物(SC),由于前者能够快速完全地被消化,使乙酸和丙酸的比例随之改变,NSC(淀粉、单糖等)的发酵通常产生低比例的乙酸和高比例的丙酸。增加饲粮中的可消化碳水化合物,不仅可提高丙酸的比例,还可显著提高TVFA的产量。但在本试验中并未发现TVFA含量发生显著变化,这可能是由于高能量水平组丙酸产量高而且易于吸收,在瘤胃内存留时间短的原因。异丁酸和异戊酸主要是经支链氨基酸的脱氨基作用产生,二者随精料水平的增高而增高,在一定程度上反映了更多的饲粮蛋白质或微生物蛋白质被降解。
3.2 饲粮能量水平对干奶期奶牛消化代谢的影响反刍动物对饲粮营养物质的消化利用实际上是与瘤胃微生物协同进行的。因此,瘤胃内微生物种类和数量的变化会改变营养物质的利用情况,饲料的消化程度由其物理和化学等内在特征、瘤胃分解菌活性及饲料在瘤胃内的滞留时间来决定。Zhou等[26]和Coblentz等[27]研究结果表明,高能量水平饲粮DM全消化道表观消化率较高,本试验与其研究结果一致。
本研究还发现,NDF和ADF的表观消化率随着饲粮能量水平的提高有降低的趋势。这可能是由瘤胃pH降低导致的,因为瘤胃内纤维分解菌对瘤胃pH比较敏感,当pH低于6.2,其活性会就受到严重抑制,最终导致饲粮纤维消化率的降低[28]。但本试验中各时间点pH均在6.2以上,表明pH下降可能不是NDF和ADF的表观消化率下降的主要原因。还可能是因为微生物对发酵底物的竞争,即“碳水化合物效应”,当饲粮中可溶性糖增加时,这种效应非常明显,因为瘤胃微生物具有优先利用易发酵可溶性碳水化合物的特性,当饲粮富含可溶性碳水化合物时,瘤胃内的非纤维分解菌会优先从可溶性碳水化合物中获得能量,从而竞争性地抑制纤维分解菌的生长。也有可能是因为利用纤维分解产物的纤毛虫从其他途径获取了所需的能量,不再与纤维分解菌协同作用,从而阻止了纤维物质的降解。但Su等[29]通过添加苜蓿茎干或麦秸来稀释饲粮能量水平,与低能量水平饲粮相比,高能量水平饲粮奶牛DM、NDF、氮的表观消化率更高。可能是因为高能量水平饲粮中含有更高含量的淀粉和其他非纤维成分[27]。
本研究中,随着饲粮能量水平的提高,氮摄入量显著增加,且氮利用率也有增加的趋势,这表明提高能量摄入水平可促进氮沉积量的增加,并提高净蛋白质利用率。Su等[29]研究也发现,提高饲粮能量水平能促进氮的沉积。氮利用率与摄入氮和氮沉积量之间有直接关系,是由两者共同决定的。反刍动物对氮的利用与饲粮氮的瘤胃降解特性及饲粮提供的微生物可利用能有关,当饲粮提供的微生物可利用能与氮的降解不偶联时,导致饲粮氮的利用效率下降。本研究中,各组饲粮蛋白质水平一定,提高能量水平即增加了微生物可利用能,这可能是高能量水平饲粮提高氮利用率的主要原因。
3.3 饲粮能量水平对干奶期奶牛血浆生化指标的影响血糖水平的变化是机体对葡萄糖的吸收、运转和代谢动态平衡状态的反映。本研究发现,提高干奶期奶牛饲粮能量水平具有增加血浆葡萄糖含量趋势。干物质采食量和丙酸供应增加促进了肝脏中糖异生作用,可能是血浆葡萄糖含量升高的主要原因。Janovick等[30]报道称,与饲喂能量需要量为100%或80%的奶牛相比,饲喂能量需要量为150%的奶牛的血浆葡萄糖含量显著升高。胰岛素在反刍动物摄食和调节体重方面具有重要作用,其首要功能是控制血糖平衡,血浆葡萄糖含量增加会刺激胰岛素分泌增加,通过促进肝糖原合成和外周组织脂肪合成,增加细胞对葡萄糖的吸收和利用,降低血糖水平。因此,本试验中高能量水平饲粮奶牛血浆胰岛素含量的升高可能就是对于血浆葡萄糖含量升高的应答,以促进全身各组织和细胞对葡萄糖的摄取和利用,一方面将其转化为糖原贮存起来,或在肝细胞内将葡萄糖转变成脂肪酸,转运到脂肪组织贮存;另一方面促进葡萄糖氧化生成高能磷酸化合物作为能量来源,促进血糖水平下降。因此,当动物机体能量代谢紊乱时,可首先通过胰岛素的释放进行调节。Graugnard等[31]和Haisan等[32]给产前奶牛饲喂高能量水平饲粮,血浆葡糖糖、胰岛素含量显著升高。然而,也有研究显示,产前能量水平对血浆葡萄糖含量没有显著影响[33]。奶牛在营养不足的情况下,为了满足能量需要,动员脂肪组织,导致血液中NEFA含量和肝脏摄入的NEFA含量急剧升高。血液中NEFA含量增加是奶牛在营养不足情况下经典的葡萄糖节约机制。本试验中,干奶期奶牛饲喂高能量水平饲粮后血浆NEFA含量显著降低,表明干奶期高能量水平饲粮可以减少产前奶牛脂肪动员,改善能量平衡状况,这可能是由于DM和能量摄入增加所致。Frederick等[34]报道,血糖水平较低的奶牛血液中NEFA含量升高,而胰岛素含量降低。
4 结论干奶期奶牛饲喂高能量水平饲粮可以促进采食,提高营养物质表观消化率、氮利用率和肝糖异生前体物质的产量,改善干奶期奶牛能量平衡状况。
| [1] |
WILKENS M R, NELSON C D, HERNANDEZ L L, et al. Symposium review: transition cow calcium homeostasis-health effects of hypocalcemia and strategies for prevention[J]. Journal of Dairy Science, 2020, 103(3): 2909-2927. DOI:10.3168/jds.2019-17268 |
| [2] |
ARSHAD U, ZENOBI M G, STAPLES C R, et al. Meta-analysis of the effects of supplemental rumen-protected choline during the transition period on performance and health of parous dairy cows[J]. Journal of Dairy Science, 2020, 103(1): 282-300. DOI:10.3168/jds.2019-16842 |
| [3] |
MC S, O'MARA F P, RATH M, et al. Effects of different transition diets on dry matter intake, milk production, and milk composition in dairy cows[J]. Journal of Dairy Science, 2003, 86: 2397-2408. DOI:10.3168/jds.S0022-0302(03)73834-X |
| [4] |
DANN H M, LITHERLAND N B, UNDERWOOD J P, et al. Prepartum nutrient intake has minimal effects on postpartum dry matter intake, serum nonesterified fatty acids, liver lipid and glycogen contents, and milk yield[J]. Journal of Dairy Science, 2003, 86(Suppl.1): 106. |
| [5] |
RUKKWAMSUK T, WENSING T, GEELEN M J H. Effect of overfeeding during the dry period on regulation of adipose tissue metabolism in dairy cows during the periparturient period[J]. Journal of Dairy Science, 1998, 81: 2904-2911. DOI:10.3168/jds.S0022-0302(98)75851-5 |
| [6] |
INGVARTSEN K L, ANDERSEN J B. Integration of metabolism and intake regulation: a review focusing on periparturient animals[J]. Journal of Dairy Science, 2000, 83: 1573-1597. DOI:10.3168/jds.S0022-0302(00)75029-6 |
| [7] |
CONTRERAS L L, RYAN C M, OVERTON T R. Effects of dry cow grouping strategy and prepartum body condition score on performance and health of transition dairy cows[J]. Journal of Dairy Science, 2004, 87: 517-523. DOI:10.3168/jds.S0022-0302(04)73191-4 |
| [8] |
HUANG W M, TIAN Y J, WANG Y J, et al. Effect of reduced energy density of close-up diets on dry matter intake, lactation performance and energy balance multiparous Holstein cows[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 47-54. DOI:10.1186/s40104-015-0046-8 |
| [9] |
Dancy K M, RIBEIRO E S, DEVRIES T J. Effect of dietary transition at dry off on the behavior and physiology of dairy cows[J]. Journal of Dairy Science, 2019, 102(5): 4387-4402. DOI:10.3168/jds.2018-15718 |
| [10] |
BAUR F J, ENSMINGER L G. The association of official analytical chemists (AOAC)[J]. Journal of the American Oil Chemists Society, 1977, 54(4): 171-172. DOI:10.1007/BF02670789 |
| [11] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and non-starch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74: 3593-3597. |
| [12] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63: 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [13] |
ERWIN E S, MARCOAND G J, EMERY E M. Volatile fatty acid analysis of food and rumen fluid by gas chromatography[J]. Journal of Dairy Science, 1961, 44: 1768-1777. DOI:10.3168/jds.S0022-0302(61)89956-6 |
| [14] |
CAO Z J, MA M, YAN X Y, et al. A simple urine-collecting apparatus and method for cows and heifers[J]. Journal of Dairy Science, 2009, 92: 5224-5228. DOI:10.3168/jds.2009-2036 |
| [15] |
BRODERICK G A, CLAYTON M K. A Statistical evaluation of animal and nutritional factors influencing concentrations of milk urea nitrogen[J]. Journal of Dairy Science, 1997, 80: 2964-2971. DOI:10.3168/jds.S0022-0302(97)76262-3 |
| [16] |
NRC. Nutrient requirements of dairy cattle[S]. Washington, D.C. : National Academy Press, 2001.
|
| [17] |
VAN HOUTER M F J. The production and metabolism of volatile fatty acids by ruminants fed roughages: a review[J]. Animal Feed Science and Technology, 1993, 43: 189-225. DOI:10.1016/0377-8401(93)90078-X |
| [18] |
杨晓东, 李常瑞, 冀国珍, 等. 不同精粗比饲粮中添加复合益生菌及其培养物对绵羊瘤胃发酵指标的影响[J]. 饲料研究, 2020, 43(11): 16-22. YANG X D, LI C R, JI G Z, et al. Effects of adding compound probiotics and their cultures in diets with different concentrate-to-forage ratios on rumen fermentation indexes of sheep[J]. Feed Research, 2020, 43(11): 16-22 (in Chinese). |
| [19] |
秦正君, 王若勇, 时国峰, 等. 饲粮精粗比对奶牛瘤胃发酵及生产性能的影响[J]. 畜牧兽医杂志, 2018, 37(1): 83-85. QIN Z J, WANG R Y, SHI G F, et al. The effect of dietary concentrate ratio on the rumen fermentation and production performance of dairy cows[J]. Journal of Animal Science and Veterinary Medicine, 2018, 37(1): 83-85 (in Chinese). DOI:10.3969/j.issn.1004-6704.2018.01.033 |
| [20] |
SATTER L D, SLYTER L L. Effect of ammonia concentration on rumen microbial protein production in vitro[J]. British Journal of Nutrition, 1974, 32: 199-208. DOI:10.1079/BJN19740073 |
| [21] |
PRESTON H, LENG D. Automated simultaneous determination of ammonia and total amino acid in ruminal fluids and in vitro media[J]. Journal of Dairy Science, 1987, 63: 64-67. |
| [22] |
涂瑞, 苗建军, 彭忠利, 等. 不同精粗比饲粮中添加小肽对牦牛瘤胃体外发酵特性的影响[J]. 草业学报, 2020, 29(3): 78-88. TU R, MIAO J J, PENG Z L, et al. The effect of adding small peptides in diets with different concentrate to crude ratios on the in vitro fermentation characteristics of yak's rumen[J]. Acta Prataculturae Sinica, 2020, 29(3): 78-88 (in Chinese). |
| [23] |
HUANG W M, TIAN Y J, WU Z H, et al. Reduced energy density of close-up diets decrease ruminal pH and increase concentration of volatile fatty acids postpartum in Holstein cows[J]. Animal Science Journal, 2017, 88(11): 1700-1708. DOI:10.1111/asj.12835 |
| [24] |
黄文明. 围产前期日粮能量水平对奶牛能量代谢和瘤胃适应性影响的研究[D]. 硕士学位论文. 北京: 中国农业大学, 2014: 6-7. HUANG W M. Study on the effect of dietary energy level during prenatal period on energy metabolism and rumen adaptability of dairy cows[D]. Master's Thesis. Beijing: China Agricultural University, 2014: 6-7. (in Chinese) |
| [25] |
MURPHY M M, KERLIND A, HOLTENIUS K. Rumen fermentation in lactating cows selected for milk fat content fed two forage to concentrate ratios with hay or silage[J]. Journal of Dairy Science, 2000, 83: 756-764. DOI:10.3168/jds.S0022-0302(00)74938-1 |
| [26] |
ZHOU X Q, ZHANG Y D, ZHAO M, et al. Effect of dietary energy source and level on nutrient digestibility, rumen microbial protein synthesis, and milk performance in lactating dairy cows[J]. Journal of Dairy Science, 2015, 98: 1-9. DOI:10.3168/jds.2014-8433 |
| [27] |
COBLENTZ W K, ESSER N M, HOFFMAN P C, et al. Growth performance and sorting characteristics of corn silage alfalfa haylage diets with or without forage dilution offered to replacement Holstein dairy heifers[J]. Journal of Dairy Science, 2015, 98: 8018-8034. DOI:10.3168/jds.2015-9491 |
| [28] |
MOULD F L, ORSKOV E R, MANN S O. Associative effects of mixed feeds.Ⅰ.Effects of type and level of supplementation and the influence of the rumen fluid pH on cellulolysis in vivo and dry matter digestion of various roughage[J]. Animal Feed Science and Technology, 1983, 10: 15-30. DOI:10.1016/0377-8401(83)90003-2 |
| [29] |
SU H W, AKINS M S, NANCY M, et al. Effects of feeding alfalfa stemlage or wheat straw for dietary energy dilution on nutrient intake and digestibility, growth performance, and feeding behavior of Holstein dairy heifers[J]. Journal of Animal Science, 2017, 100: 7106-7115. |
| [30] |
JANOVICK N A, BOISCLAIR Y R, DRACKLEY J K. Prepartum dietary energy intake affects metabolism and health during the periparturient period in primiparous and multiparous holstein cows[J]. Journal of Dairy Science, 2011, 94: 1385-1400. DOI:10.3168/jds.2010-3303 |
| [31] |
GRAUGNARD D E, BIONAZ M, TREVISI E, et al. Blood immunometabolic indices and polymorphonuclear neutrophil function in peripartum dairy cows are altered by level of dietary energy prepartum[J]. Journal of Animal Science, 2012, 95: 1749-1758. |
| [32] |
HAISAN J, INABU Y, SHI W, et al. Effects of pre- and postpartum dietary starch content on productivity, plasma energy metabolites, and serum inflammation indicators of dairy cows[J]. Journal of Animal Science, 2021, 102(4): 3082-3096. |
| [33] |
LAW R A, YOUNG F J, PATTERSON D C, et al. Effect of precalving and postcalving dietary energy level on performance and blood metabolite concentrations of dairy cows throughout lactation[J]. Journal of Dairy Science, 2011, 94: 808-823. DOI:10.3168/jds.2009-2728 |
| [34] |
FREDERICK Y O, AHMAD R, SIMON H, et al. Blood metabolite profile in Holstein-Friesian cows fed diets varying in dry matter and metabolizable energy density during early lactation[J]. Journal of Dairy Science, 2018, 27(5): 1191-1197. |




