2. 天津师范大学生命科学学院, 天津市动物多样性保护与利用重点实验室, 天津 300387
2. Tianjin Key Laboratory of Conservation and Utilization of Animal Diversity, College of Life Sciences, Tianjin Normal University, Tianjin 300387, China
当前,我国已经实施饲料端全面禁抗,绿色饲料添加剂的研发有利于我国畜禽业的健康可持续发展,然而在评价这些饲料添加剂的功效时,却面临着试验动物疾病模型的缺乏以及疾病模型的不稳定性等问题,因此,建立一个高效的动物疾病模型有着重要深远的意义。小鼠基因组与人类基因组具有较高的同源性,其生理生化指标及其调控机制与人类和其他哺乳动物相似,亦能通过对比研究获取人类或其他动物疾病方面的研究成果[1]。肠道是机体最大的免疫器官,对维持机体健康具有极其重要的地位[2]。产肠毒素型大肠杆菌(enterotoxigenic Escherichia coli, ETEC)是生产中常见的引起畜禽(尤其是幼龄动物)肠炎腹泻的主要病原菌[3],通过其黏附素黏附于宿主的小肠上皮细胞,在肠内繁殖时释放肠毒素,对肠上皮细胞产生毒性作用[4],最终引起动物肠炎、腹泻、脱水甚至死亡[5]。然而,目前关于ETEC引致动物肠炎的分子机制尚不十分清楚,因此,本研究在ETEC感染小鼠肠炎模型成功建立的基础上,进一步探讨该炎症反应发生的分子机制,能够为利用此模型评价抗炎饲料添加剂的功效提供可借鉴的检测指标。
目前,有关ETEC定植后对肠道功能的改变已被广泛研究。有多项研究表明,ETEC感染小鼠出现炎症反应,伴有血清中促炎性细胞因子白细胞介素-6(interleukin-6, IL-6)和肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)含量升高[6-7],且显著提高肠道内上述关键促炎症反应因子基因的表达水平[8-9],Finamore等[10]报道ETEC通过增加Toll-样受体4(Toll-like receptor 4, TLR4)和髓样分化因子88(myeloid differentiation factor88, MyD88)mRNA的相对表达量激活TLR4/核因子-κB(NF-κB)信号通路,然而,也有报道发现ETEC可通过分泌一种热稳定的蛋白性因子,阻断正常由肿瘤坏死因子(TNF)、白细胞介素-1β(interleukin-1β, IL-1β)和鞭毛蛋白诱导的NF-κB信号通路[11]。因此,关于ETEC引致炎症反应的分子机制仍有争议,还需进一步探索。
Toll样受体(TLR)是一大类模式识别受体,其中TLR4在识别ETEC感染中具有重要作用[12],与ETEC表面的脂多糖结合后能进一步激活NF-κB,从而调控促炎性细胞因子和C反应蛋白(C-reactive protein, CRP)的生成[13-14]。鉴于目前关于TLR4/NF-κB信号通路在ETEC引发小鼠肠炎中的分子机制尚不十分清楚,以及高效试验动物肠炎模型的缺乏,因此,本研究利用生产中常见病原菌ETEC来建立小鼠肠炎模型,通过检测模型小鼠血液炎性指标(如急性反应蛋白、促炎性细胞因子等)的表达,以及小鼠临床表现、体重和病理组织学的变化等判定肠道炎症模型构建成功与否,并通过检测TLR4/NF-κB信号通路上关键蛋白的变化规律来深入研究ETEC引致肠炎的分子机制,具有重要的理论意义和实践意义。
1 材料与方法 1.1 菌株和试验动物ETEC菌株由天津农学院动物科学与动物医学学院实验室保存;6~8周龄雄性昆明小鼠购买自中国食品药品检定研究院。
1.2 主要试剂小鼠CRP、TNF-α和白细胞介素-8(interleukin-8, IL-8)酶联免疫吸附测定(ELISA)检测试剂盒均购自美国BD公司;RNA提取试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒均购自美国GeneCpoeia公司。
1.3 试验设计将120只SPF级昆明小鼠随机分为4个组,即对照组、低剂量组、中剂量组和高剂量组,每组30只,每组5个重复,每个重复6只。攻毒前3天,观察小鼠临床表现,待小鼠正常后开始进行正式试验,试验期为5 d。参照本课题组试验方法制备攻毒用大肠杆菌菌液[12]。攻毒前,将制备的菌液用生理盐水稀释成合适的浓度。分别对低剂量组、中剂量组和高剂量组小鼠经口腔灌服ETEC稀释液1×105、1×106和1×107 CFU/只,对照组口腔灌服等体积的生理盐水,各组注射剂量均为0.2 mL。
1.4 小鼠临床观察和体重称量攻毒后,每天观察小鼠精神、毛色、眼分泌物等,在感染后24、48、72、96和120 h分别称量每只小鼠体重。
1.5 样品采集与保存在小鼠体重称量后,随机从各组中选取6只小鼠进行眶下静脉采血并分离血清,-80 ℃保存备用。解剖小鼠,观察其肠道、肝脏和脾脏变化,同时采集肠道、肝脏和脾脏样品,一部分置于-80 ℃保存,用于分析组织中目的蛋白的表达情况,另一部分固定在4%甲醛溶液中,用于分析其组织病理变化。
1.6 血清急性反应蛋白和促炎性细胞因子含量的检测采用ELISA方法,严格按照厂家产品说明书进行操作,检测小鼠血清中CRP、TNF-α和IL-8的含量。
1.7 小鼠组织切片观察参考文献[15]方法进行小鼠组织病理学分析,将空肠、肝脏和脾脏样品进行切片苏木精-伊红(HE)染色后,显微镜下观察炎症细胞浸润和肠绒毛完整性等病理变化。
1.8 实时荧光定量PCR检测TLR4/NF-κB信号通路关键mRNA相对表达量根据NCBI数据库中小鼠TLR4、NF-κB p65、MyD88、B细胞淋巴瘤因子3(recombinant B-cell, BCl3)和内参基因甘油醛-3-磷酸脱氢酶(GAPDH)的mRNA序列,利用Primer Premier 5.0软件设计引物(表 1),并委托生工生物工程(上海)股份有限公司合成。
|
|
表 1 引物序列 Table 1 Primer sequences |
按照Taco公司的核酸提取试剂盒说明书对小鼠肠道组织进行RNA提取。根据反转录试剂盒说明书对RNA进行反转录。以反转录产物cDNA为模板进行定量分析。按照SYBR Premix Ex TaqTM荧光定量试剂盒操作说明进行实时荧光定量PCR反应体系的配制:上、下游引物各1 μL,all-in-one qPCR Mix(2×)10 μL,cDNA 3 μL,补加焦碳酸二乙酯(DEPC)处理的灭菌水至20 μL。实时荧光定量PCR反应条件:95 ℃预变性10 min;95 ℃变性20 s,56 ℃退火20 s,72 ℃延伸15 s,40个循环;熔解曲线条件为65 ℃ 0.05 s、+0.5 ℃(温度每升高0.5 ℃检测1次信号)和95 ℃ 5 s。每个样品均设置未经逆转录的模板作为阴性对照,同时每个样品均设置相应的内参作为对照,得到各自的荧光阈值循环数(Ct值),采用相对定量法2-ΔΔCt进行计算。
1.9 数据统计分析使用Excel 2016对数据进行初步处理,使用SPSS 26.0软件进行过多因素方差分析与单因子方差分析(one-way ANOVA)和组间差异显著性检验,以P < 0.05为差异显著,P < 0.01为差异极显著,P>0.05为无显著差异。另使用GraphPad Prism 5软件进行图像制作。
2 结果与分析 2.1 小鼠临床表现及体重变化在攻毒48 h后,试验组小鼠均出现精神沉郁、反应迟钝、进食量减少等现象,至攻毒后72 h,部分小鼠眼睛出现黄色分泌物、被毛杂乱无光,随着攻毒时间的延长,至96 h以后,小鼠的精神状态、行为活动和食欲等逐步恢复正常,且攻毒剂量越高,上述临床表现变化越明显。在整个试验期间,对照组小鼠则被毛光滑、体态活泼、食欲正常。
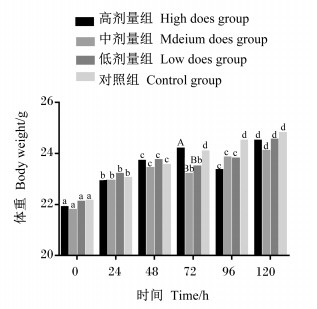
由图 1可知,在ETEC感染后0、24、48、120 h时,各组之间体重无显著差异(P>0.05);在感染后96 h,高剂量组体重为(23.34±1.18) g,显著低于对照组(P < 0.05);在感染后72 h,中剂量组体重为(23.20±1.02) g,显著低于对照组(P < 0.05)和高剂量组(P < 0.01),随后体重逐步回升至正常水平;低剂量组体重变化与中剂量组基本相似。结果表明,高、中、低3个剂量的ETEC感染小鼠后,均能够影响小鼠正常生理机能,降低小鼠体重
|
数据柱标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05),不同大写字母表示差异极显著(P < 0.01)。下图同。 Value columns with the same letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05), and with different capital letters mean extremely significant difference (P < 0.01). The same as below. 图 1 小鼠体重变化分析 Fig. 1 Analysis of body weight changes in mice |
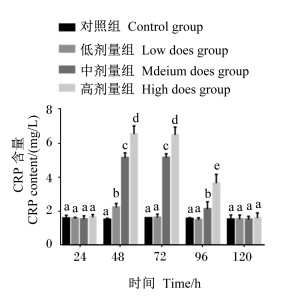
由图 2可知,与对照组相比,在攻毒后24和120 h,各试验组血清CRP含量均差异不显著(P>0.05),在攻毒后48 h,3个试验组血清CRP含量均极显著升高(P < 0.01),在攻毒后72 h,中剂量组和高剂量组血清CRP含量极显著升高(P < 0.01),攻毒后96 h,高剂量组血清CRP含量极显著升高(P < 0.01)。结果表明,高、中、低3个剂量的ETEC均能引起小鼠产生炎症反应,且炎症反应强度与剂量呈正相关,从攻毒后48 h时小鼠开始出现明显的炎症反应,到攻毒后96 h时所有试验组小鼠均炎症消失。
|
图 2 血清CRP含量的变化 Fig. 2 Changes of serum CRP content |
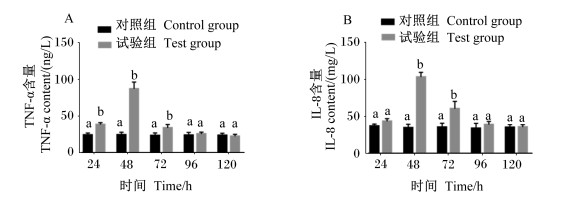
由2.2结果可知,3个剂量组均能出现明显的炎症反应,且中剂量组炎症反应较为典型,因而本研究选用中剂量组为研究对象,进一步分析了血清促炎性细胞因子TNF-α和IL-8含量的变化规律。由图 3可知,与对照组相比,在攻毒后24、48和72 h,试验组血清TNF-α含量极显著升高(P < 0.01),在攻毒后48和72 h,试验组血清IL-8含量极显著升高(P < 0.01),且在攻毒后48 h试验组血清TNF-α和IL-8含量最高,攻毒后96 h此2种细胞因子含量恢复至正常水平。结果表明,ETEC感染小鼠血清中促炎性细胞因子TNF-α和IL-8含量从攻毒后24 h开始出现明显增高,48 h达到高峰,96 h回归正常水平。
|
图 3 血清中促炎性细胞因子含量的变化 Fig. 3 Changes of proinflammatory cytokine contents in serum |
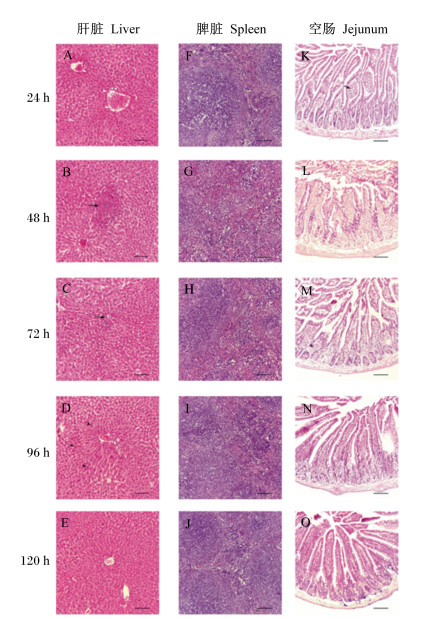
小鼠肝脏、脾脏、空肠病理变化如图 4所示。在攻毒后24 h,试验组小鼠肝脏(图 4-A)、空肠(图 4-F)中均伴随淋巴细胞,脾脏(图 4-K)白髓中部分淋巴细胞溶解;在攻毒后48 h,肝脏(图 4-B)出现片状坏死且肝周隙淋巴细胞大量浸润,脾脏(图 4-G)部分白髓结构消失,空肠(图 4-L)部分肠隐窝丢失,绒毛间隙不清,固有层溃疡,病理变化明显;在攻毒后72、96和120 h,炎症逐步开始好转,肝周隙(图 4-C至图 4-E)淋巴细胞减少,脾脏(图 4-H至图 4-J)红髓、白髓结构清晰、易于分辨,空肠(图 4-M至图 4-O)绒毛受损情况逐渐减轻。其中,以攻毒后48 h的肝脏、脾脏和空肠炎症反应最为明显。结果表明,ETEC感染能够使小鼠肝脏、脾脏和肠道出现炎症反应,且出现不同程度的病理损伤。
|
图 4 组织病理切片观察 Fig. 4 Observation of pathological tissue sections (100×) |
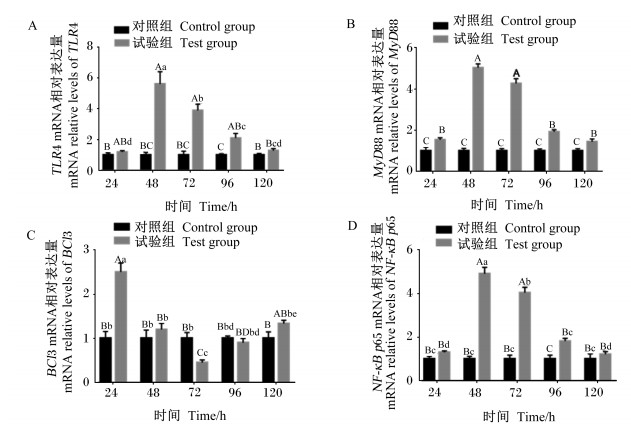
由图 5可知,与对照组相比,在ETEC攻毒后48、72、96 h,试验组肠道TLR4(图 5-A)和NF-κB p65(图 5-D)mRNA相对表达量均极显著升高(P < 0.01),且试验组攻毒后48 h时的肠道TLR4和NF-κB p65 mRNA相对表达量均显著高于攻毒后其他时间点(P < 0.05);在ETEC攻毒后24、48、72、96和120 h试验组肠道MyD88(图 5-B)mRNA相对表达量均极显著升高(P < 0.01),且试验组攻毒后48和72 h的肠道MyD88 mRNA相对表达量均极显著高于攻毒后其他时间点(P < 0.01);在ETEC攻毒后24和120 h试验组肠道BCl3(图 5-C)mRNA相对表达量分别极显著或显著升高(P < 0.01或P < 0.05),且攻毒后24 h的肠道BCl3 mRNA相对表达量显著高于攻毒后120 h (P < 0.05),攻毒后72 h的肠道BCl3 mRNA相对表达量极显著下降(P < 0.01)。结果表明,在ETEC诱导的小鼠肠道炎症反应中,TLR4/NF-κB信号通路很可能发挥着一定的调节作用。
|
图 5 ETEC对小鼠空肠组织中关键因子mRNA相对表达量的影响 Fig. 5 Effects of ETEC on mRNA relative expression levels of key factors in jejunum tissues |
CRP是机体应急时产生的一种急性相蛋白,主要在肝细胞中合成,也可通过平滑肌细胞、巨噬细胞、脂肪细胞等合成[16],在防御入侵病原体和炎症中发挥重要作用,因此临床上常用CRP的含量作为炎症性疾病活动性指标[17]。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成,还可与染色体结合,消除坏死组织里的细胞DNA[18]。本研究发现,血清中CRP含量的变化与小鼠炎症反应的严重程度呈正相关,且炎症反应最明显时,小鼠体重也呈明显下降。这说明小鼠受到感染应激后,其免疫系统被激活,机体内的养分流向和分配可能发生了改变,用于小鼠正常生长的养分被转而用于支持抵抗ETEC的相关生理过程和生物活性物质(如CRP等)的合成,导致小鼠生长下降,也有可能是疾病小鼠采食下降,养分吸收受限导致其体重下降。在炎症性肠病(IBD)小鼠中也出现类似的情况,表现为小鼠血清CRP含量显著增高时体重下降也最为明显[19]。
促炎性细胞因子是一系列可以促进炎症的细胞因子的总称,常见的包括TNF-α、IL-8等。TNF-α可作用于多种细胞,从而激发一系列炎症反应,使机体释放大量的IL-6与IL-8[20-21],主要是在感染部位通过促进血管内皮细胞的表达,刺激白细胞介素和趋化因子,诱导白细胞在炎症部位大量聚集,促使对炎症部位细菌的清除[22],是治疗炎性疾病的药物作用靶点[13]。冯其麟等[23]研究显示,抗炎组小鼠血清中TNF-α、IL-6含量显著低于重症腹腔感染小鼠,提示炎症反应减弱。IL-8又称嗜中性粒细胞因子,是炎症性疾病的重要介质,在抗感染、免疫反应调节及抗肿瘤方面具有重要作用[24],在代谢性炎症中有着关键的地位[25],研究表明IL-8可有效刺激中性粒细胞向炎症部位迁移[26],还可促进巨噬细胞浸润脂肪组织[27],引起局部和全身炎症。本研究发现,ETEC引致小鼠产生炎症,且血清中TNF-α、IL-8含量极显著增多,说明小鼠的先天性免疫系统被ETEC激活,导致促炎性细胞因子过量产生,从而加剧了小鼠的炎性反应。
TLR是参与非特异性免疫的一类重要蛋白质分子,主要激活机体TLR信号通路,引起机体炎症反应[28]。TLR4是模式识别受体家族成员,在先天免疫中起关键作用,可激活促炎症信号通路,脂多糖作为大肠杆菌的致病因子之一,能够与细胞膜表面的TLR4结合,可以激活2种不同的细胞内信号通路,包括MyD88依赖通路和MyD88非依赖通路。其中MyD88的激活触发下游信号级联反应,导致NF-κβ和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路的激活[13],还可激活上皮细胞释放大量的细胞因子和炎性介质,加剧炎症反应和局部组织的炎性损伤[29]。在核因子kappa-B抑制蛋白α(inhibitor of nuclear factor kappa-B kinase α, IκBα)磷酸化后,NF-κB激活并转位到细胞核,与DNA调控元件如IL-6、IL-8、MCP-1和TNF-α结合激活靶基因,促进炎性细胞因子包括TNF-α、IL-1β、IL-6的转录,进一步促进NF-κB的活化,形成局部炎症扩大的级联效应[26]。NF-κB是一种与细胞周期调节和炎症相关的一个转录因子家族[30],广泛存在于各种细胞中,被广泛认为是通过协调控制炎症、组织损伤和免疫应答的多种基因的表达来触发炎症的产生和消退[31-33],可被多种刺激因子如脂多糖、TNF、IL-1β等激活,诱导促炎性细胞因子(IL-1、IL-6、TNF-α)的大量表达[29]。本试验检测了产肠毒素型大肠杆菌感染小鼠后TLR4、NF-κB p65、MyD88 mRNA相对表达量的变化,均随着炎症反应剧烈程度的加深而增高,且三者的相对增长幅度极为一致,与CRP、TNF-α、IL-8的含量变化也基本吻合,显示ETEC感染小鼠后可能是通过TLR4/NF-κB信号通路诱导促炎性细胞因子生成,引起小鼠炎症反应。
BCl3是IκB家族成员之一,位于细胞核中,能够与NF-κB作用调节其转录功能[12],在近10年的研究中,BCl3被广泛认为是一种抗炎蛋白[34],在接触性皮炎[35]、急性炎性肺损伤[36]、急性肾损伤[37]等相关研究中,均发现BCl3蛋白具有抗炎作用。且有大肠杆菌K88致仔猪肠炎的研究发现,BCl3在炎症反应中发挥着与TLRs信号通路重要负调控因子Tollip相似的负调控作用[12]。尽管也有一些研究表明,BCl3与人类某些炎性疾病的形成相关,在炎症中的作用可能不是单方面的,到底是抗炎蛋白还是促炎蛋白尚未阐明,但不论是上调或下调BCl3蛋白表达,都会对免疫功能的部分作用产生负面影响[30]。因此,本试验还检测了ETEC攻毒小鼠肠道组织中BCl3 mRNA相对表达量,以期能进一步探索BCl3在炎症反应中发挥的作用。研究发现其表达量随着炎症反应程度的加深而降低,且与TLR4、NF-κB p65、MyD88的mRNA相对表达量呈负相关,推测在ETEC诱导的小鼠肠炎中BCl3蛋白可能发挥着抗炎作用。
综上所述,产肠毒素型大肠杆菌灌服小鼠后,血清中CRP、TNF-α、IL-8的含量升高,且CRP含量随着灌服菌液浓度的升高而增多,NF-κB p65、TLR4及其信号通路接头蛋白MyD88 mRNA相对表达量增多,抗炎蛋白BCl3 mRNA相对表达量降低,经感观、血液学和病理学分析,成功建立了ETEC感染小鼠肠炎模型,并初步证实了该炎症反应可能与TLR4/NF-κB信号通路有关,并且受到该信号通路关键蛋白MyD88的正向调控和BCl3的负向调控。
4 结论本研究通过灌服产肠毒素型大肠杆菌成功建立小鼠肠炎模型,同时发现,ETEC感染小鼠后,通过促进TLR4、MyD88和NF-κB p65的mRNA相对表达量,抑制抗炎蛋白BCl3的mRNA相对表达量,从而促进促炎性细胞因子TNF-α和IL-8以及CRP的生成增多,导致小鼠出现肠道炎症反应。证实了ETEC引致小鼠肠炎与TLR4/NF-κB信号通路的活化相关。
| [1] |
BULT C J, EPPIG J T, BLAKE J A, et al. Mouse genome database 2016[J]. Nucleic Acids Research, 2016, 44(D1): D840-D847. DOI:10.1093/nar/gkv1211 |
| [2] |
周贝, 林焱, 朱伟云. 猪肠道大肠杆菌噬菌体对产肠毒素大肠杆菌的抑菌作用[J]. 畜牧兽医学报, 2020, 51(7): 1748-1755. ZHOU B, LIN Y, ZHU W Y. Study on the bacteriostatic effect of porcine coliphages on enterotoxigenic Escherichia coli[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1748-1755 (in Chinese). |
| [3] |
XI M L, QI Y, GE W P, et al. Effects of stachyose on intestinal microbiota and immunity in mice infected with enterotoxigenic Escherichia coli[J]. Journal of Functional Foods, 2020, 64: 103689. DOI:10.1016/j.jff.2019.103689 |
| [4] |
MIRHOSEINI A, AMANI J, NAZARIAN S. Review on pathogenicity mechanism of enterotoxigenic Escherichia coli and vaccines against it[J]. Microbial Pathogenesis, 2018, 117: 162-169. DOI:10.1016/j.micpath.2018.02.032 |
| [5] |
齐宇, 王开, 伊淑帅, 等. 产肠毒素大肠杆菌K88诱发BALB/c鼠肠炎模型的建立及评价[J]. 中国预防兽医学报, 2016, 38(1): 19-22. QI Y, WANG K, YI S S, et al. Establishment and evaluation of bacterial enteritis model in BALB/c mice induced by enterotoxigenic Escherichia coli K88[J]. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(1): 19-22 (in Chinese). DOI:10.3969/j.issn.1008-0589.2016.01.05 |
| [6] |
LIN Q, SU G Q, WU A M, et al. Bombyx mori gloverin A2 alleviates enterotoxigenic Escherichia coli-induced inflammation and intestinal mucosa disruption[J]. Antimicrobial Resistance and Infection Control, 2019, 8: 189. DOI:10.1186/s13756-019-0651-y |
| [7] |
LIN Q, FU Q Q, LI X, et al. Human β-defensin 118 attenuates Escherichia coli K88-induced inflammation and intestinal injury in mice[J]. Probiotics and Antimicrobial Proteins, 2021, 13(2): 586-597. DOI:10.1007/s12602-020-09725-9 |
| [8] |
PU J N, CHEN D W, TIAN G, et al. Protective effects of benzoic acid, Bacillus coagulans, and oregano oil on intestinal injury caused by enterotoxigenic Escherichia coli in weaned piglets[J]. BioMed Research International, 2018, 2018: 1829632. |
| [9] |
WAN J, ZHANG J, WU G Z, et al. Amelioration of enterotoxigenic Escherichia coli-induced intestinal barrier disruption by low-molecular-weight chitosan in weaned pigs is related to suppressed intestinal inflammation and apoptosis[J]. International Journal of Molecular Sciences, 2019, 20(14): 3485. DOI:10.3390/ijms20143485 |
| [10] |
FINAMORE A, ROSELLI M, IMBINTO A, et al. Lactobacillus amylovorus inhibits the TLR4 inflammatory signaling triggered by enterotoxigenic Escherichia coli via modulation of the negative regulators and involvement of TLR2 in intestinal Caco-2 cells and pig explants[J]. PloS One, 2014, 9(4): e94891. DOI:10.1371/journal.pone.0094891 |
| [11] |
WANG X G, HARDWIDGE P R. Enterotoxigenic Escherichia coli prevents host NF-κB activation by targeting IκBα polyubiquitination[J]. Infection and Immunity, 2012, 80(12): 4417-4425. DOI:10.1128/IAI.00809-12 |
| [12] |
李海花, 朱琪, 王世琼, 等. 产肠毒素大肠杆菌K88诱导仔猪炎症反应的分子机制[J]. 中国畜牧兽医, 2017, 44(1): 262-267. LI H H, ZHU Q, WANG S Q, et al. Molecular mechanism of the inflammatory response induced by enterotrxigenic E.coli K88 in piglets[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(1): 262-267 (in Chinese). |
| [13] |
CHU C Q. Molecular probing of TNF: from identification of therapeutic target to guidance of therapy in inflammatory diseases[J]. Cytokine, 2018, 101: 64-69. DOI:10.1016/j.cyto.2016.08.020 |
| [14] |
窦彩霞, 李海花, 孙泽阳, 等. 核转录因子-κB/β-连环蛋白信号通路介导肠产毒性大肠杆菌引致IPEC-J2细胞损伤[J]. 动物营养学报, 2020, 32(12): 5893-5902. DOU C X, LI H H, SUN Z Y, et al. Nuclear transcription factor-κB/β-catenin signaling pathway mediates enterotoxigenic Escherichia coli causing IPEC-J2 cell injury[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5893-5902 (in Chinese). |
| [15] |
于晴晴, 钟高龙, 万方, 等. 高铜对大鼠肾细胞炎性因子和细胞增殖的影响[J]. 畜牧兽医学报, 2020, 51(11): 2849-2857. YU Q Q, ZHONG G L, WAN F, et al. Effects of high copper on inflammatory factors and cell proliferation in rat kidney cells[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2849-2857 (in Chinese). DOI:10.11843/j.issn.0366-6964.2020.11.023 |
| [16] |
SPROSTON N R, ASHWORTH J J. Role of C-reactive protein at sites of inflammation and infection[J]. Frontiers in Immunology, 2018, 9: 754. DOI:10.3389/fimmu.2018.00754 |
| [17] |
WU Y, POTEMPA L A, EL KEBIR D, et al. C-reactive protein and inflammation: conformational changes affect function[J]. Biological Chemistry, 2015, 396(11): 1181-1197. DOI:10.1515/hsz-2015-0149 |
| [18] |
LIU G X, LIU G L, CHEN H, et al. Involvement of Ca2+ activated Cl- channel Ano6 in platelet activation and apoptosis[J]. Cellular Physiology and Biochemistry, 2015, 37(5): 1934-1944. DOI:10.1159/000438554 |
| [19] |
陈文晓, 林海华, 陈仁聘, 等. 血淀粉样蛋白、CRP、降钙素在炎症性肠病小鼠模型中表达水平及其与疾病活动性的相关性研究[J]. 新医学, 2017, 48(3): 153-159. CHEN W X, LIN H H, CHEN R P, et al. Expression level of serum amyloid protein, C-reactive protein and procalcitonin and the correlation with disease activity index in inflammatory bowel disease mouse model[J]. New Medicine, 2017, 48(3): 153-159 (in Chinese). DOI:10.3969/j.issn.0253-9802.2017.03.004 |
| [20] |
刘艳艳, 张凯, 关家伟, 等. 人参皂苷对BALB/c小鼠肠道菌群的影响[J]. 现代生物医学进展, 2015, 15(6): 1041-1045. LIU Y Y, ZHANG K, GUAN J W, et al. The effects of ginsenoside on the intestinal microbiota of mice[J]. Progress in Modern Biomedicine, 2015, 15(6): 1041-1045 (in Chinese). |
| [21] |
谭婉贤, 熊晏, 赖莉敏, 等. 5-氟尿嘧啶诱导小鼠化疗性肠黏膜炎模型的建立[J]. 中国实验动物学报, 2018, 26(3): 372-377. TAN W X, XIONG Y, LAI L M, et al. Establishment of a mouse model of 5-fluorouracil-induced intestinal mucositis[J]. Acta Laboratorium Animalis Scientia Sinica, 2018, 26(3): 372-377 (in Chinese). DOI:10.3969/j.issn.1005-4847.2018.03.016 |
| [22] |
华锋. TNF-α在抗感染中的作用[J]. 南昌大学学报(医学版), 2012, 52(5): 96-99. HUA F, LIU J H. The role of TNF-α in anti-infection[J]. Journal of Nanchang University (Medical Science), 2012, 52(5): 96-99. (in Chinese) |
| [23] |
冯其麟, 邓艾平, 刘珏, 等. 人参对感染后小鼠肠黏膜的干预效果及对血清CRP、TNF-α、IL-6水平的影响[J]. 中国医药导报, 2019, 16(4): 18-21. FENG J L, DENG A P, LIU J, et al. Effects of ginseng on intestinal mucosa and the levels of serum CRP, TNF-α and IL-6 in mice after infection[J]. China Medical Herald, 2019, 16(4): 18-21 (in Chinese). |
| [24] |
VERNON P J, PAREDES R M, SOOTER A J, et al. Severe hemorrhagic shock induces acute activation and expansion of IL-8+/IL-10+neutrophils with enhanced oxidative reactivity in Non-Human primates[J]. Shock (Augusta, Ga.), 2016, 46(3 Suppl.1): 129-136. |
| [25] |
HASAN A, AKHTER N, AL-ROUB A, et al. TNF-α in combination with palmitate enhances IL-8 production via the MyD88-independent TLR4 signaling pathway: potential relevance to metabolic inflammation[J]. International Journal of Molecular Sciences, 2019, 20(17): 4112. DOI:10.3390/ijms20174112 |
| [26] |
TANG S C, LIAO P Y, HUNG S J, et al. Topical application of glycolic acid suppresses the UVB induced IL-6, IL-8, MCP-1 and COX-2 inflammation by modulating NF-κB signaling pathway in keratinocytes and mice skin[J]. Journal of Dermatological Science, 2017, 86(3): 238-248. DOI:10.1016/j.jdermsci.2017.03.004 |
| [27] |
YAMAGUCHI R, YAMAMOTO T, SAKAMOTO A, et al. Chemokine profiles of human visceral adipocytes from cryopreserved preadipocytes: neutrophil activation and induction of nuclear factor-kappa B repressing factor[J]. Life Sciences, 2015, 143: 225-230. DOI:10.1016/j.lfs.2015.11.010 |
| [28] |
刘灿, 王婵, 左之才, 等. 黄芪多糖对腹腔注射大肠杆菌小鼠TLR信号通路MyD88、ERK及细胞因子的影响[J]. 浙江农业科学, 2017, 58(1): 143-146. LIU C, WANG C, ZUO Z C, et al. Effects of Astragalus polysaccharides on TLR signaling pathway MyD88, ERK and cytokines in mice intraperitoneally injected with enterotoxigenic Escherichia coli[J]. Journal of Zhejiang Agricultural Sciences, 2017, 58(1): 143-147 (in Chinese). |
| [29] |
李春林, 张翥, 曾荣荣, 等. 黄连水提物对LPS诱导的猪肠道上皮细胞IL-1β、IL-6、TNF-α mRNA表达及NF-κB/MAPK信号通路的调控作用[J]. 中国兽医学报, 2020, 40(2): 361-368. LI C L, ZHANG Z, ZENG R R, et al. Effect of Rhizoma coptidis water extract on expression of IL-1β, IL-6, TNF-α mRNA and regulation of NF-κB/MAPK signal pathways in porcine intestinal epithelial cells induced by LPS[J]. Chinese Journal of Veterinary Science, 2020, 40(2): 361-368 (in Chinese). |
| [30] |
LEMIESZEK M L, NUNES F M, MARQUES G, et al. Cantharellus cibarius branched mannans inhibits colon cancer cells growth by interfering with signals transduction in NF-κB pathway[J]. International Journal of Biological Macromolecules, 2019, 134: 770-780. DOI:10.1016/j.ijbiomac.2019.05.072 |
| [31] |
XIE C H, KANG J, FERGUSON M E, et al. Blueberries reduce pro-inflammatory cytokine TNF-α and IL-6 production in mouse macrophages by inhibiting NF-κB activation and the MAPK pathway[J]. Molecular Nutrition & Food Research, 2011, 55(10): 1587-1591. |
| [32] |
LEE S, PARK Y, DELLSPERGER K C, et al. Exercise training improves endothelial function via adiponectin-dependent and Independent pathways in type 2 diabetic mice[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2011, 301(2): H306-H314. DOI:10.1152/ajpheart.01306.2010 |
| [33] |
LI R Y, ZHANG W Z, YAN X T, et al. Arginyl-fructosyl-glucose, a major maillard reaction product of red ginseng, attenuates cisplatin-induced acute kidney injury by regulating nuclear factor κB and Phosphatidylinositol 3-kinase/protein kinase B signaling pathways[J]. Journal of Agricultural and Food Chemistry, 2019, 67(20): 5754-5763. DOI:10.1021/acs.jafc.9b00540 |
| [34] |
胡章威, 李芬, 左晶晶, 等. BCL3与免疫及肿瘤相关性的研究进展[J]. 中国医药生物技术, 2018, 13(6): 552-555. HU Z W, LI F, ZUO J J, et al. Research progress on the correlation between BCL3 and immunity and tumor[J]. Chinese Medicinal Biotechnology, 2018, 13(6): 552-555 (in Chinese). DOI:10.3969/j.issn.1673-713X.2018.06.013 |
| [35] |
WEIGHARDT H, FÖRSTER I. Bcl-3 puts the brakes on contact hypersensitivity[J]. European Journal of Immunology, 2015, 45(4): 971-974. DOI:10.1002/eji.201545524 |
| [36] |
KREISEL D, SUGIMOTO S, TIETJENS J, et al. Bcl3 prevents acute inflammatory lung injury in mice by restraining emergency granulopoiesis[J]. The Journal of Clinical Investigation, 2011, 121(1): 265-276. DOI:10.1172/JCI42596 |
| [37] |
POVEDA J, SANZ A, CARRASCO S, et al. Bcl3:a regulator of NF-κB inducible by TWEAK in acute kidney injury with anti-inflammatory and antiapoptotic properties in tubular cells[J]. Experimental & Molecular Medicine, 2017, 49(7): e352. |




