2. 大连海洋大学, 辽宁省北方鱼类应用生物学与增养殖重点实验室, 大连 116023;
3. 广州市博仕奥生化技术研究有限公司, 广州 511356
2. Key Laboratory of Applied Biology and Aquaculture Northern Fish in Liaoning Province, Dalian Ocean University, Dalian 116023, China;
3. Guangzhou Bosio Biochemical Technology Research Co., Ltd., Guangzhou 511356, China
大口黑鲈(Micropterus salmoides),又名加州鲈,隶属鲈形目(Perciforme),太阳鱼科(Ceutrarchidac),黑鲈属(Micropterus)。由于其生长速度快、肉质鲜美和较高的市场价值,2019年在我国产量达到47.78万t,已成为我国重要的商业养殖品种之一[1-2]。作为典型的肉食性鱼类,传统养殖模式下以饲喂冰鲜饵料为主[3]。近年来,随着环保压力的增加,在由冰鲜鱼向人工配合饲料转型的过程中,鱼粉和其他动物蛋白质仍是其主要蛋白质源,尤其对鱼粉的依赖程度较高,商业配方中鱼粉含量高达30%以上[4-5]。尽管鱼粉具有不可替代的优势,但是其较高的成本价格已经成为制约水产养殖业可持续发展的限制性因素。因此,寻找新型蛋白质源来减少大口黑鲈配方中鱼粉的用量,提高非鱼粉蛋白利用率,降低氮磷排放,开发环境友好型饲料,是水产养殖业可持续发展亟需解决的重要问题[6-7]。
植物蛋白质源价格低于鱼粉,来源广泛,一直是鱼粉替代研究的热点。但植物蛋白质源本身含有多种抗营养因子、氨基酸不平衡及适口性差等问题,对于需求高蛋白质的养殖鱼类,尤其是在肉食性鱼类中利用率相对偏低[8-9]。棉籽浓缩蛋白(cottonseed protein concentration, CPC)与传统的棉籽粕原料相比,采用软化轧胚、低温烘干等工艺取代了高温蒸炒/膨化过程,可以有效降低蛋白质的热变性程度,使其更好地被动物消化吸收,作为鱼粉替代蛋白质源在水产动物中应用日益广泛[10-11]。此外,近年来研究表明可通过一些非抗生素类饲料添加剂来减少环境污染和改善水产动物健康减少植物蛋白质的潜在不利影响,以改善水生动物的肝肠健康和对植物蛋白质的利用率。例如,在饲粮中添加酶制剂可以有效消除这些抗营养因子的不良影响,提高水产动物生长性能、营养物质表观消化率和肠道消化酶活性,改善肠道功能,降低饲料系数,减少磷的排放量,从而减轻环境污染等[12-15]。此外,植物蛋白质源常存在一些非淀粉多糖、果胶、纤维素聚合物等,这些物质使水产动物消化道内容物的黏度增加,影响水产动物对有效营养成分的消化和吸收,而在饲料中添加酶制剂,可有效去除非淀粉多糖等[16-17]。蛋白酶是催化分解肽键的一类酶的总称,能将蛋白质降解为小分子的蛋白胨、肽和氨基酸,从而提高蛋白质的消化利用率[18-20]。
大口黑鲈作为典型肉食性鱼类,对配合饲料中淀粉利用能力较差,易引起肝脏组织糖原积累、糖、脂代谢紊乱和代谢性肝病[21-22],而淀粉作为膨胀剂和黏合剂,在膨化浮性饲料的加工中至关重要[23],低淀粉会给膨化浮性饲料的加工带来巨大挑战,限制了大口黑鲈产业的可持续发展。因此,大口黑鲈对糖的不耐受所引发糖、脂代谢异常和营养性肝病是限制人工配合饲料应用的重要原因。目前为止,蛋白酶在水产动物中的研究主要集中在生长性能、营养物质消化率和肠道健康等方面[24-25],而在高比例植物蛋白质替代鱼粉后对大口黑鲈生长性能、蛋白质和糖、脂代谢的影响未见报道。
因此,本试验旨在通过采用CPC替代配方中40%鱼粉蛋白,并在此基础上添加不同剂量蛋白酶,研究CPC替代以及蛋白酶对大口黑鲈生长性能、肝功能、消化酶活性以及蛋白质和糖、脂代谢的影响,进而确定蛋白酶在大口黑鲈饲料中的适宜添加量。
1 材料与方法 1.1 试验鱼试验用水产动物为大口黑鲈,于2019年5月购买于天津玉清水产科技发展公司。试验正式开始前,试验鱼在养殖系统中暂养1周,暂养期间投喂鱼粉含量为50%的饲料(HFM)。
1.2 试验设计及饲料试验将初始体重为(31.39±0.05) g的大口黑鲈幼鱼240尾,随机分为2个对照组和2个试验组,每组3个重复,每个重复20尾鱼。采用HFM为正对照饲料(HFM组),采用CPC替代40%鱼粉蛋白的饲料(LFM,鱼粉含量为30%)为基础对照饲料(LFM组),在LFM基础上分别添加300、500 mL/t的中性蛋白酶配制试验饲料,在40 ℃、pH 7.0~7.5条件下,蛋白酶的活性为15 000 U/mL。将2种试验饲料分别命名为LFM+E4500和LFM+E7500(LFM+E4500组和LFM+E7500组)。LFM、LFM+E4500和LFM+E7500组饲料中分别添加蛋氨酸、苏氨酸和鱼油来平衡必需氨基酸和必需脂肪酸,以磷酸二氢钙补充有效磷,各组饲料等氮等能。物料经超微粉碎过80目筛并均匀混合后,使用双螺杆挤压膨化机(洋工机械TSE65)挤压膨化,制成粒径为3 mm的颗粒饲料,自然晾干后于-20 ℃储存备用。饲料组成及营养水平见表 1。
|
|
表 1 饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
试验在国家水产饲料安全评价基地(北京,南口)室内循环水养殖系统中进行,水源为曝气井水,流量为9.64 L/min。用2%食盐水消毒试验鱼及养殖系统后,随机挑选体质健康、个体均匀的大口黑鲈[平均初始体重为(31.39±0.05) g],分配到容积为0.26 m3的圆锥形养殖桶中。养殖周期为65 d,每天表观饱食投喂2次,投喂时间分别为08:00和17:00,并记录死鱼和收集残饵。定期检测水质,水质条件保持在溶氧(DO)浓度>7.0 mg/L,总氨氮浓度 < 0.3 mg/L,pH =7.5~8.5,水温24.0~27.5 ℃。
1.4 样品采集生长试验结束并禁食24 h后分别对各桶鱼称重,用于计算生长指标。每组随机取12尾鱼(每桶4尾鱼),用三氯叔丁醇麻醉后测量体长、体重及内脏、肝脏和腹脂重量,用于计算形体指标;用含有氟化钠草酸钾抗凝剂的注射器从麻醉鱼的尾静脉抽取血液,在4 ℃、4 000 r/min的条件下离心10 min,取上层血浆备用。血浆、肝脏、腹脂、肠道和全鱼等样品均在-80 ℃条件下保存。
1.5 指标测定 1.5.1 常规营养成分分别采用105 ℃常压干燥法(GB/T 6435—2006)、凯氏定氮法(GB/T 6432—1994)、酸水解粗脂肪法(GB/T 6433—2006)、550 ℃灼烧法(GB/T 6438—2007)测定原料、饲料和鱼体的水分、粗蛋白质、粗脂肪、粗灰分含量;总能的检测方法参照ISO 9831:1998,采用氧弹仪测定;饲料中氨基酸含量采用GB/T 18246—2000中方法进行测定。
1.5.2 生长指标各指标计算公式如下:

|
式中:N0为初始鱼数量(尾);Nt为终末鱼数量(尾);W0为初始鱼体总重(g);Wt为终末鱼体总重(g);Wd为死亡鱼体总重(g);C为摄食量(g);Wtp为终末全鱼粗蛋白质含量(%);W0p为初始全鱼粗蛋白质含量(%);Wf为饲料投喂量(g);Wfp为饲料粗蛋白质含量(%);t为试验天数(d)。
1.5.3 形体指标各指标计算公式如下:

|
血浆中总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、总胆汁酸(TBA)含量,碱性磷酸酶(AKP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性,总抗氧化能力(T-AOC)和肝脏TG、糖原(GLY)含量等指标均按照南京建成生物工程研究所的试剂盒说明书进行测定;血浆葡萄糖(GLU)含量按照上海荣盛药业有限公司的试剂盒说明书进行测定;肝脏环磷酸腺苷(cAMP)、肠道蛋白酶含量及葡萄糖激酶(GK)、丙酮酸激酶(PK)、磷酸烯醇式丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸酶(G6Pase)、甘油三酯脂肪酶(ATGL)、激素敏感性脂肪酶(HSL)、单酰甘油脂肪酶(MGL)活性按照江苏酶免实业有限公司的试剂盒说明书,使用酶标仪(Bio-Tek,Burlington,美国)进行检测。
1.5.5 肝脏和腹腔脂肪代谢相关基因表达用RNAiso Plus试剂(日本TaKaRa)从肝组织中提取总RNA,用NanoDrop 2000(美国Thermo)分光光度法定量,并在1%变性琼脂糖凝胶上电泳以评估RNA完整性,采用gDNA Eraser处理1.0 μg总RNA以去除基因组DNA污染物,然后使用PrimeScript RT试剂盒(日本TaKaKa)在20 μL体积内通过反转录进行cDNA合成。
大口黑鲈基因序列是从转录组数据库中获得,用于实时定量聚合酶链反应(RT-qPCR)基因特异性引物设计,并以表达不受处理影响的延长因子1α(EF1α)(GenBank登录号:KT827794)作为内参,引物序列如表 2所示。用肝脏和腹脂产生的cDNA的连续稀释液制作标准曲线,测定内参基因和靶基因的扩增效率(E值)。E值范围为90.4%~113.6%(表 2)。使用CFX96TM实时系统(美国Bio-Rad)在20 μL反应体积中进行RT-qPCR分析,该反应体积包含iTaqTMUniversal SYBR Green® Supermix(美国Bio-Rad)。所有基因的RT-qPCR温度分布为95 ℃,持续30 s,然后在95 ℃下循环10 s,在退火温度(Tm)下循环30 s(每个引物退火温度如表 2所示),在72 ℃下循环40 s。在最后1个PCR循环后,系统地监测熔解曲线(65 ℃温度梯度为0.05 ℃/10 s,从65 ℃升到95 ℃)。在检测过程中,每1个样品进行3次技术性重复。无RNA/DNA酶水代替模板作为阴性对照。采用2-△△Ct法计算目标基因的相对表达量。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences for real-time PCR |
试验数据以平均值±均值标准误(mean±SEM)表示,所有数据用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),Duncan氏多重比较法检验差异显著性,显著性水平为P < 0.05。图形由GraphPad Prism 8.0(GraphPad,美国)绘制。
2 结果 2.1 生长性能和形体指标由表 3可知,饲料中以CPC替代40%鱼粉蛋白后,与HFM组相比,大口黑鲈终末体重、增重率和特定生长率显著提高(P < 0.05)。添加4 500 U/kg蛋白酶后,生长性能与LFM组无显著差异(P>0.05);添加7 500 U/kg蛋白酶后,与LFM组相比,饲料系数显著升高(P < 0.05),鱼体蛋白质沉积率显著降低(P < 0.05)。各组间存活率均无显著差异(P>0.05),但LFM+E4500和LFM+E7500组的存活率较LFM组有一定程度的提高。
|
|
表 3 饲料中添加蛋白酶对大口黑鲈生长性能和形体指标的影响 Table 3 Effects of dietary protease on growth performance and body indexes of largemouth bass (n=3) |
CPC替代40%鱼粉蛋白后,与HFM组相比,大口黑鲈肝体比显著升高(P < 0.05),添加7 500 U/kg蛋白酶显著降低肝体比和脏体比(P < 0.05),但各组肝体比均未高于2,属于正常范围。变化最为显著的是蛋白酶对大口黑鲈腹脂率的影响,与LFM组相比,2组腹脂率均显著降低(P < 0.05)。
2.2 血浆肝功能和抗氧化指标由表 4可知,CPC替代40%鱼粉蛋白后,血浆ALT、AST活性较HFM组显著升高(P < 0.05),AKP活性无显著差异(P>0.05);添加蛋白酶后,血浆ALT、AST活性较LFM组显著下降(P < 0.05),AKP活性与LFM组无显著差异(P>0.05)。各组间血浆TP、TBA含量和T-AOC均无显著差异(P>0.05)。
|
|
表 4 饲料中添加蛋白酶对大口黑鲈血浆肝功能和抗氧化指标的影响 Table 4 Effects of dietary protease on plasma liver function and antioxidant indexes of largemouth bass (n=8) |
由表 5可见,CPC替代40%鱼粉蛋白后,全鱼体成分与HFM组无显著差异(P>0.05)。与LFM组相比,添加4 500 U/kg蛋白酶后,鱼体水分含量显著上调(P < 0.05),粗脂肪含量显著下调(P < 0.05);添加7 500 U/kg蛋白酶后,鱼体水分含量显著上调(P < 0.05)。各组间鱼体粗灰分、粗蛋白质和肝脂含量均无显著差异(P>0.05)。
|
|
表 5 饲料中添加蛋白酶对大口黑鲈体成分的影响 Table 5 Effects of dietary protease on body composition of largemouth bass (n=3) |
由表 6可知,CPC替代40%鱼粉蛋白后,前、中、后肠蛋白酶含量与HFM组均无显著差异(P>0.05);与LFM组相比,添加蛋白酶后,显著提高大口黑鲈前、后肠蛋白酶含量(P < 0.05)。各组间中肠蛋白酶含量均无显著差异(P>0.05)。
|
|
表 6 饲料中添加蛋白酶对大口黑鲈肠道蛋白酶含量的影响 Table 6 Effects of dietary protease on protease content in intestine of largemouth bass (n=8) |
由图 1-A可见,CPC替代40%鱼粉蛋白后,肝脏GLY含量显著增加(P < 0.05);与LFM组相比,添加蛋白酶后,LFM+E4500组空腹血浆葡萄糖含量显著升高(P < 0.05),LFM+E4500和LFM+E7500组GLY含量显著减少(P < 0.05),但均与HFM组无显著差异(P>0.05)。糖代谢相关酶活性如图 1-B,在餐后24 h,CPC替代40%鱼粉蛋白后,与HFM组相比,肝脏糖酵解酶GK活性显著下调(P < 0.05)。添加4 500 U/kg蛋白酶后,肝脏糖酵解酶GK和糖异生酶PEPCK、G6Pase活性较LFM组显著提高(P < 0.05);添加7 500 U/kg蛋白酶后,肝脏糖代谢相关酶活性与LFM组无显著差异(P>0.05)。
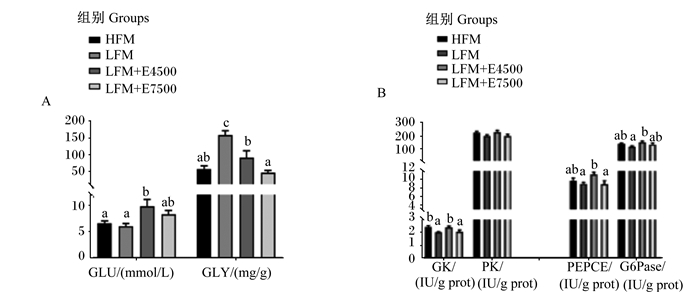
|
GLU: 葡萄糖glucose; GLY: 糖原glycogen; GK: 葡萄糖激酶glucokinase; PK: 丙酮酸激酶pyruvate kinase; PEPCE: 磷酸烯醇式丙酮酸羧激酶phosphoenolpyruvate carboxykinase; G6Pase: 葡萄糖-6-磷酸酶glucose-6-phosphatase. 图A:血浆GLU和肝脏GLY含量;图B:肝脏GK、PK、PEPCK和G6Pase活性。Fig.A: plasma GLU and liver GLY contents;Fig.B: activities of GK, PK, PEPCK and G6Pase in liver. 数据柱形标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲料中添加蛋白酶(4 500 U/kg)对大口黑鲈糖代谢的影响 Fig. 1 Effects of dietary protease (4 500 U/kg) on glucose metabolism of largemouth bass |
由图 2-A可见,CPC替代40%鱼粉蛋白后,与HFM组相比,血浆TC、TG含量显著增加(P < 0.05),肝脏TG含量显著减少(P < 0.05);添加蛋白酶后,LFM+E4500和LFM+E7500组血浆TG含量较LFM组显著减少(P < 0.05);由图 2-B可见,CPC替代40%鱼粉蛋白后,与HFM组相比,肝脏中脂肪合成基因PPARγ、脂肪分解基因ATGL和β氧化相关基因PPARα mRNA相对表达量均显著上调(P < 0.05),脂肪分解基因HSL mRNA相对表达量显著下调(P < 0.05)。与LFM组相比,添加蛋白酶后,LFM+E4500组肝脏中ATGL mRNA相对表达量显著下调(P < 0.05),HSL mRNA相对表达量显著上调(P < 0.05),PPARα mRNA相对表达量保持高表达;LFM+E7500组肝脏中PPARγ、ATGL和PPARα mRNA相对表达量显著下调(P < 0.05),HSL mRNA相对表达量显著上调(P < 0.05)。由图 2-C可知,CPC替代40%鱼粉蛋白质后,肝脏酶活性与HFM组无显著差异(P>0.05);添加蛋白酶后,LFM+E4500组肝脏ATGL和MGL活性较LFM组显著上调(P < 0.05);LFM+E7500组肝脏ATGL和MGL活性与LFM组无显著差异(P>0.05)。
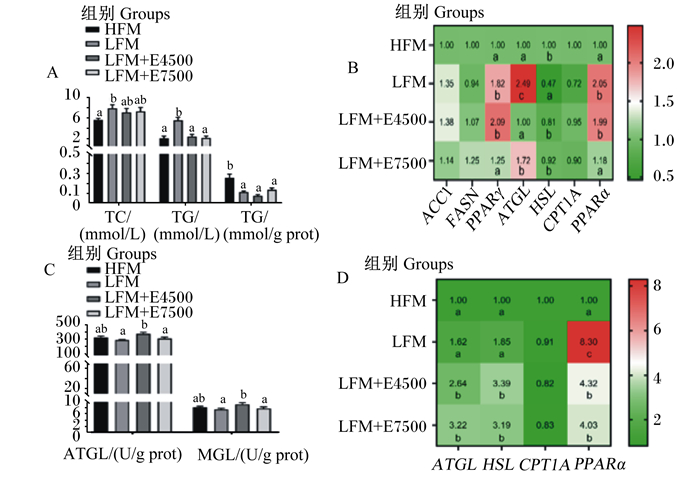
|
TC: 胆固醇cholesterol; TG: 甘油三酯triglyceride; ACC1: 乙酰辅酶A羧化酶1 acetyl CoA carboxylase 1; FASN: 脂肪酸合成酶fatty acid synthetase; PPARγ: 过氧化物酶体增殖物激活受体γ peroxisome proliferator-activated receptor γ; ATGL: 脂肪甘油三酯脂肪酶adipose triacylglyceride lipase; HSL: 激素敏感性脂肪酶hormone-sensitive triglyceride lipase; CPT1A: 肉毒碱棕榈酰基转移酶1A carnitine palmitoyltransferase 1A; PPARα: 过氧化物酶体增殖物激活受体α peroxisome proliferator-activated receptor α; MGL: 单酰甘油脂肪酶monoacylglycerol lipase. 图A:血浆TC、TG和肝脏TG含量;图B:肝脏中脂代谢相关基因mRNA相对表达量;图C:肝脏ATGL和MGL活性;图D:腹腔脂肪脂解和β-氧化相关基因mRNA相对表达量。 Fig.A: contents of TC, TG in plasma and TG in liver;Fig.B: the mRNA relative expression levels of genes related to fat metabolism in liver;Fig.C: the activities of ATGL and MGL in liver;Fig.D: the mRNA relative expression levels of genes related to lipolysis and beta oxidation in abdominal fat. 图 2 饲料中添加蛋白酶对大口黑鲈肝脏脂代谢和腹脂脂解的影响 Fig. 2 Effects of dietary protease on liver lipid metabolism and abdominal lipolysis of largemouth bass |
由图 2-D可知,CPC替代40%鱼粉蛋白后,腹脂β氧化基因PPARα mRNA相对表达量较HFM组显著上调(P < 0.05)。添加蛋白酶后,2个试验组腹脂脂肪分解基因ATGL和HSL mRNA相对表达量较LFM组显著上调(P < 0.05),β氧化相关基因PPARα mRNA相对表达量较LFM组显著下调(P < 0.05),但仍然较HFM组显著上调(P < 0.05)。
2.7 基础能量代谢水平CPC替代40%鱼粉蛋白后,肝脏cAMP含量较HFM组显著降低(P < 0.05)(图 3-A);添加蛋白酶后,2个试验组肝脏cAMP含量和肝脏CREB mRNA相对表达量均较LFM组显著增加(P < 0.05)(图 3-B)。
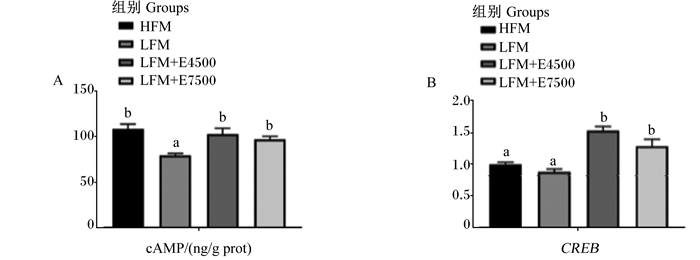
|
cAMP: 环磷酸腺苷cyclic adenosine monophosphate; CREB: 环磷腺苷效应元件结合蛋白cAMP-response element binding protein。 图A:肝脏cAMP含量;图B:肝脏CREB mRNA相对表达量。 Fig.A: cAMP content in liver; Fig.B: mRNA relative expression level of CREB in liver. 图 3 饲料中添加蛋白酶对大口黑鲈基础能量代谢水平的影响 Fig. 3 Effects of dietary protease on basal energy metabolism level of largemouth bass |
由图 4可知,CPC替代40%鱼粉蛋白后,肝脏蛋白质合成相关基因TOR和IGF-1 mRNA相对表达量较HFM组显著上调(P < 0.05)。添加蛋白酶后,LFM+E4500组肝脏TOR和IGF-1 mRNA相对表达量与LFM组无显著差异(P>0.05);但LFM+E7500组肝脏TOR和IGF-1 mRNA相对表达量较LFM组显著下调(P < 0.05)。
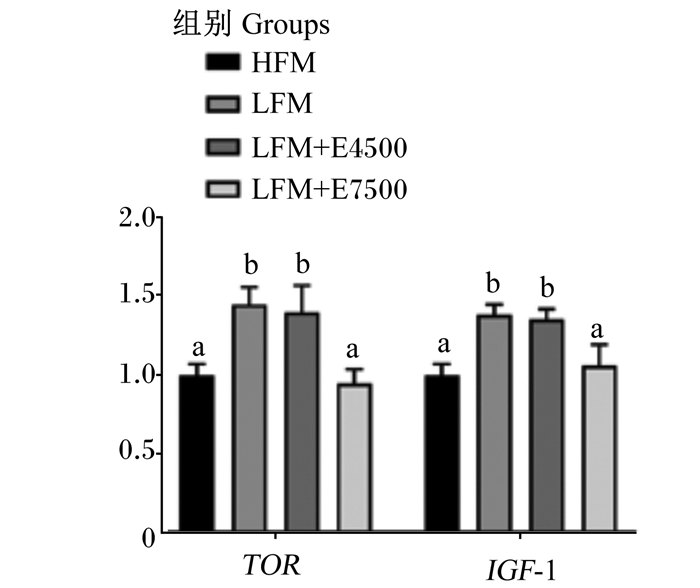
|
TOR: 雷帕霉素靶蛋白target of rapamycin; IGF-1:类胰岛素生长因子-1 insulin-like growth factors-1。 图 4 饲料中添加蛋白酶(7 500 U/kg)对大口黑鲈肝脏TOR和IGF-1 mRNA相对表达量的影响 Fig. 4 Effects of dietary protease (7 500 U/kg) on mRNA relative expression levels of TOR and IGF-1 in liver of largemouth bass |
酶制剂作为一种绿色饲料添加剂,其在水产饲料中的应用已有广泛研究,但在生产实践中受热敏性限制,并未被广泛应用。近年来,随着真空后喷涂技术在水产饲料中的应用,使得液体酶制剂在水产膨化饲料中的应用成为可能[26]。董颖超等[27]对植酸酶的研究表明,真空后喷涂技术可以显著提高膨化饲料中酶活性的保存率,避免酶制剂中有效成分的损失,为酶制剂在水产饲料中的实践应用提供有力支撑。
已有研究表明,CPC是一种在水产饲料行业具备优秀潜力,且氨基酸均衡、蛋白质变性小、营养价值高、适口性好的非粮蛋白质源[28-30]。本研究显示,饲料中以CPC替代40%的鱼粉蛋白后,生长性能反而显著升高。本试验结果说明平衡必需营养素后,大口黑鲈饲料中适当降低鱼粉用量(30%)是可行的,同时说明CPC作为一种低抗营养因子的植物蛋白质源,在大口黑鲈膨化饲料中具有较好的应用前景。目前,中性蛋白酶在水产动物配合饲料中的应用研究还比较少。有研究表明,饲料中添加适量蛋白酶可以显著提高蛋白质等营养物质的消化率,从而提高生长性能[31-32]。在对罗非鱼[13]、吉富罗非鱼[18]、鲤鱼[33-34]、凡纳滨对虾[35]和虹鳟[36]的研究中表明,饲料中添加蛋白酶可以显著提高水生动物的生长性能。以上对罗非鱼[13]、吉富罗非鱼[18]、鲤鱼[33-34]、凡纳滨对虾[35]和虹鳟[36]的研究是在鱼粉含量(0、5%、6%、10%等)偏低而植物蛋白质含量较高的基础饲料中添加外源蛋白酶,可以降低植物蛋白质中抗胰蛋白酶的作用,从而使鱼类能更好地利用植物蛋白质,提高生长性能。本研究在LFM(鱼粉含量为30%)基础上添加4 500 U/kg蛋白酶对生长性能没有显著影响,与上述研究结果不同,可能与基础饲料鱼粉含量较高有关。本研究显示,饲料中添加7 500 U/kg蛋白酶显著降低大口黑鲈鱼体蛋白质沉积率,并提高饲料系数,降低饲料利用率。这说明酶制剂在水产饲料中的使用需精准添加,添加量要与饲料配方底物中的量相适应,否则会影响水产动物生长性能并降低饲料利用率。
血液指标是衡量鱼类健康状态的一个重要指标[37]。AST和ALT主要存在于心脏和肝脏组织中,其活性高低可以反映出动物对蛋白质合成和分解的能力,同时AST和ALT是反映动物肝脏运作状态的重要代谢酶,其活性较高时可作为衡量肝脏的损伤与否及损伤程度的指标[38-40]。石泽[41]、Ndazigaruye等[42]研究表明,饲料中添加蛋白酶对建鲤和肉鸡的血清ALT、AST活性无显著影响。本研究显示,添加蛋白酶后血清AST、ALT活性显著下降,与建鲤和肉鸡的研究结果不同,可能与蛋白酶理化性质不同和物种不同有关。本研究说明添加蛋白酶对大口黑鲈肝功能有一定保护作用。LFM和LFM+E4500组血浆AKP活性较高,但各组血浆TBA含量没有显著差异,说明各组并未显示明显胆汁淤积症表型。
蛋白酶是蛋白质代谢过程中非常重要的一类消化酶,能催化分解肽键,将大分子的蛋白质降解为蛋白胨、肽和氨基酸等小分子的营养物质,从而促进蛋白质的消化,提高动物对蛋白质的消化率和饲料利用率[43]。在对中华草龟[44]、虹鳟[45]、吉富罗非鱼[18]和鲤鱼[33]等的研究表明,饲料中添加中性蛋白酶可以显著提高肠道蛋白酶活性。本研究显示,饲料中添加4 500和7 500 U/kg蛋白酶可以显著提高大口黑鲈前、后肠蛋白酶含量,与上述研究结果一致。其作用机理可能是饲料中添加外源性蛋白酶可以水解蛋白质类抗营养因子,提高蛋白质的消化率[46-47],并且能促进鱼体内源性蛋白酶的分泌,从而提高大口黑鲈肠道蛋白酶活性,内外协同提高鱼体对蛋白质的消化吸收能力[22]。
与鱼粉相比,植物蛋白质中不但缺乏必需氨基酸、必需脂肪酸和有效磷,并且其碳水化合物含量也较高[48]。大口黑鲈作为一种肉食性鱼类,对碳水化合物的利用能力和对糖代谢稳态的控制能力都比较差[49]。饲料中添加蛋白酶可以显著提高大口黑鲈肠道蛋白酶活性,从而可以将蛋白质更高效地分解成氨基酸等小分子物质,提供底物来促进肝脏糖异生作用[50]。目前为止,蛋白酶对大口黑鲈糖、脂代谢方面的影响研究较少。对建鲤[51]和黄颡鱼[52]的研究表明,饲料中添加蛋白酶对血浆GLU含量均无显著影响。本研究结果显示,在餐后24 h,CPC替代40%鱼粉蛋白后,糖代谢过程与HFM组无显著差异。添加4 500 U/kg蛋白酶后,对空腹糖异生有明显的促进作用,显示蛋白酶添加有助于大口黑鲈在空腹状态时相关酶的正常表达。LFM+E4500组空腹血浆GLU含量显著升高,可能与其糖异生作用增加有关。鱼类的内脏、肝脏和肌肉中分布着大量的脂肪细胞。鱼类腹部脂肪蓄积后会导致机体营养代谢紊乱,从而使抗病力抗应激能力下降,以至于在受到外界环境刺激后容易爆发疾病甚至大部分死亡[53]。对异育银鲫[41]和黄颡鱼[52]的研究表明,饲料中添加蛋白酶对血浆TG含量均无显著影响。本研究结果显示,CPC替代40%鱼粉蛋白后,LFM组大口黑鲈肝脏脂代谢循环上调;添加蛋白酶后,可以明显加速肝脏和腹部脂肪分解过程,减少大口黑鲈肝脏和腹部脂肪积聚,可以使鱼体可食用部分增加,极大地提高了大口黑鲈的商业价值和经济效益。
cAMP是由糖酵解和三羧酸循环产生的三磷酸腺苷合成的第二信使分子,cAMP/CREB途径可以上调脂解/β氧化的基因表达,提高基础能量代谢水平,从而保护肝脏组织免受脂质积聚[54-55]。脂肪脂解作用上调后,产生的甘油和游离脂肪酸可分别通过磷酸化和β氧化途径转变为磷酸二羟丙酮和草酰乙酸,作为糖异生的底物来促进肝脏糖异生[56]。本研究中,CPC部分替代鱼粉后,LFM组肝脏cAMP含量显著降低;添加4 500 U/kg蛋白酶后,肝脏cAMP含量显著提高到与HFM组无显著差异的水平,表明蛋白酶可以提高大口黑鲈的基础能量代谢水平,建议在添加蛋白酶的饲料中要适当提高饲料能量水平,并且活化的cAMP通过上调CREB表达量,上调脂解/β-氧化的基因(HSL、PPARα)表达和肝脏脂解关键酶ATGL、MGL活性,从而保护肝脏组织免受脂质积聚,并进一步增强大口黑鲈的肝脏糖异生作用。TOR是一种存在于胞浆中的蛋白激酶,胰岛素样生长因子IGF-1可通过激活TOR的表达量来促进机体蛋白质的合成[57-58]。本研究显示,饲料中添加7 500 U/kg蛋白酶后,肝脏中IGF-1 mRNA相对表达量显著下调,从而使TOR mRNA相对表达量显著下调,抑制大口黑鲈机体蛋白质的合成,并且LFM+E7500组的基础能量代谢水平与LFM+E4500组同样保持高表达,从而显著降低鱼体蛋白质沉积率。
4 结论综上所述,饲料中CPC替代40%鱼粉蛋白(鱼粉用量由50%降低到30%)后,大口黑鲈生长性能反而升高。在低鱼粉基础饲料中添加4 500 U/kg的蛋白酶,可进一步提高大口黑鲈的基础能量代谢水平和前、后肠蛋白酶含量,促进空腹状态下糖代谢关键酶的正常表达,并可以减少肝脏和鱼体脂质积累,但过量添加(7 500 U/kg)蛋白酶会降低鱼体蛋白质沉积率,提高饲料系数,从而降低饲料利用率。
| [1] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴2020[M]. 中国农业出版社, 2020: 33. Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of fisheries. China fisheries statistical yearbook 2020[M]. China Agriculture Press, 2020: 33 (in Chinese). |
| [2] |
GONG G, XUE M, WANG J, et al. The regulation of gluconeogenesis in the Siberian sturgeon (Acipenser baerii) affected later in life by a short-term high-glucose programming during early life[J]. Aquaculture, 2015, 436: 127-136. DOI:10.1016/j.aquaculture.2014.10.044 |
| [3] |
HUANG D, WU Y B, LIN Y Y, et al. Dietary protein and lipid requirements for juvenile largemouth bass, Micropterus salmoides[J]. Journal of the World Aquaculture Society, 2017, 48(5): 782-790. DOI:10.1111/jwas.12417 |
| [4] |
JOBLING M. Nutrient requirements and feeding of finfish for aquaculture[J]. Aquaculture International, 2001, 9(4): 367-368. DOI:10.1023/A:1020466312058 |
| [5] |
MA H J, MOU M M, PU D C, et al. Effect of dietary starch level on growth, metabolism enzyme and oxidative status of juvenile largemouth bass, Micropterus salmoides[J]. Aquaculture, 2019, 498: 482-487. DOI:10.1016/j.aquaculture.2018.07.039 |
| [6] |
SUBASINGHE R P, ARTHUR J R, BARTLEY D M, et al. Farming the waters for people and food[C]//Proceedings of the Global Conference on Aquaculture 2010, [s.l.]: Food & Agriculture Organization of the United Nations, 2012: 193-231.
|
| [7] |
JEONG J S, PARK J W, LEE S I, et al. Apparent ileal digestibility of nutrients and amino acids in soybean meal, fish meal, spray-dried plasma protein and fermented soybean meal to weaned pigs[J]. Animal Science Journal, 2016, 87(5): 697-702. DOI:10.1111/asj.12483 |
| [8] |
刘行彪, 付熊, 吴晗冰, 等. 水产动物对植物蛋白源利用的研究进展[J]. 饲料工业, 2010, 31(24): 21-25. LIU H B, FU X, WU H B, et al. Advances in utilization of plant protein sources by aquatic animals[J]. Feed Industry, 2010, 31(24): 21-25 (in Chinese). DOI:10.3969/j.issn.1001-991X.2010.24.006 |
| [9] |
申建飞, 陈铭灿, 刘泓宇, 等. 浓缩棉籽蛋白替代鱼粉对卵形鲳鲹幼鱼生长性能、血清生化指标、肝脏抗氧化指标及胃肠道蛋白酶活性的影响[J]. 动物营养学报, 2019, 31(2): 746-756. SHEN J F, CHEN M C, LIU H Y, et al. Effects of fish meal replacement by concentrated cottonseed protein on growth performance, serum biochemical indices, liver antioxidant indices and gastrointestinal tract protease activities of juvenile Trachinotus Ovatus[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 746-756 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.02.031 |
| [10] |
MBAHINZIREKI G B, DABROWSKI K, LEE K J, et al. Growth, feed utilization and body composition of tilapia (Oreochromis sp.) fed with cottonseed meal-based diets in a recirculating system[J]. Aquaculture Nutrition, 2001, 7(3): 189-200. DOI:10.1046/j.1365-2095.2001.00172.x |
| [11] |
SHEN J F, LIU H, TAN B, et al. Effects of replacement of fishmeal with cottonseed protein concentrate on the growth, intestinal microflora, haematological and antioxidant indices of juvenile golden pompano (Trachinotus ovatus)[J]. Aquaculture Nutrition, 2020, 26(4): 1119-1130. DOI:10.1111/anu.13069 |
| [12] |
STAESSEN T, VERDEGEM M, WETHTHASINGHE P, et al. The effect of dietary non-starch polysaccharide level and bile acid supplementation on fat digestibility and the bile acid balance in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2020, 523: 735174. DOI:10.1016/j.aquaculture.2020.735174 |
| [13] |
LI X Q, ZHANG X Q, CHOWDHURY M A K, et al. Dietary phytase and protease improved growth and nutrient utilization in tilapia (Oreochromis niloticus×Oreochromis aureus) fed low phosphorus and fishmeal-free diets[J]. Aquaculture Nutrition, 2019, 25(1): 46-55. DOI:10.1111/anu.12828 |
| [14] |
LIU S, FENG L, JIANG W D, et al. Impact of exogenous lipase supplementation on growth, intestinal function, mucosal immune and physical barrier, and related signaling molecules mRNA expression of young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2016, 55: 88-105. |
| [15] |
杨璐. 添加植酸酶提高中华绒螯蟹幼蟹对植物蛋白利用率的初步研究[D]. 硕士学位论文. 上海: 华东师范大学, 2019. YANG L. Preliminary study on the application of phytase to increase the utilization of plant protein on juvenile Chinese mitten crab (Eriocheir sinensis)[D]. Master's Thesis. Shanghai: East China Normal University, 2019. (in Chinese) |
| [16] |
樊荟慧, 宾石玉, 陈李婷. 非淀粉多糖酶制剂及其在畜禽生产中的应用[J]. 饲料博览, 2018(12): 30-34. FAN H H, BIN S Y, CHEN L T. Research progress on non-starch polysaccharide enzymes and application in animal production[J]. Feed Review, 2018(12): 30-34 (in Chinese). DOI:10.3969/j.issn.1001-0084.2018.12.006 |
| [17] |
ZHANG G G, YANG Z B, WANG Y, et al. Effects of dietary supplementation of multi-enzyme on growth performance, nutrient digestibility, small intestinal digestive enzyme activities, and large intestinal selected microbiota in weanling pigs[J]. Journal of Animal Science, 2014, 92(5): 2063-2069. DOI:10.2527/jas.2013-6672 |
| [18] |
赵觅美, 齐遵利, 张秀文. 饲料中添加中性蛋白酶对吉富罗非鱼生长和消化功能的影响[J]. 河北渔业, 2018(1): 17-21. ZHAO M M, QI Z L, ZHANG X W. Effects of neutral protease on growth and digestive function of GIFT tilapia (Oreochromis niloticus)[J]. Chinese Journal of Hebei Fisheries, 2018(1): 17-21 (in Chinese). DOI:10.3969/j.issn.1004-6755.2018.01.004 |
| [19] |
冷向军. 水产饲料中酶制剂的研究与应用[J]. 饲料工业, 2018, 39(22): 1-7. LENG X J. Application and research of enzymes in aquaculture feed[J]. Feed Industry, 2018, 39(22): 1-7 (in Chinese). |
| [20] |
张晓燕, 国立东, 刘晓艳. 枯草芽孢杆菌中性蛋白酶的研究进展[J]. 中国酿造, 2018, 37(4): 12-15. ZHANG X Y, GUO L D, LIU X Y. Research advances in the neutral protease of Bacillus subtilis[J]. China Brewing, 2018, 37(4): 12-15 (in Chinese). |
| [21] |
GOODWIN A E, LOCHMANN R T, TIEMAN D M, et al. Massive hepatic necrosis and nodular regeneration in largemouth bass fed diets high in available carbohydrate[J]. Journal of the World Aquaculture Society, 2002, 33(4): 466-477. DOI:10.1111/j.1749-7345.2002.tb00026.x |
| [22] |
MAHER J J. Pathogenesis of NAFLD and NASH[M]//CHALASANI N, SZABO G. Alcoholic and non-alcoholic fatty liver disease. Cham: Springer, 2016: 71-101.
|
| [23] |
CHENG Z J, HARDY R W. Effects of extrusion processing of feed ingredients on apparent digestibility coefficients of nutrients for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture Nutrition, 2003, 9(2): 77-83. DOI:10.1046/j.1365-2095.2003.00226.x |
| [24] |
陈建明, 叶金云, 许尧兴, 等. 饲料中添加中性蛋白酶对青鱼生长、消化及鱼体组成的影响[J]. 水生生物学报, 2009, 33(4): 726-731. CHEN J M, YE J Y, XU Y X, et al. Effect of adding neutral protease to diets on growth performance, digestion, and body composition of fingerling black carp (Mylopharyngodon Piceus)[J]. Acta Hydrobiologica Sinica, 2009, 33(4): 726-731 (in Chinese). |
| [25] |
郑欣, 徐树德, 唐启峰, 等. 低磷低鱼粉饲料中添加植酸酶和蛋白酶对草鱼生长性能和消化生理的影响[J]. 动物营养学报, 2020, 32(4): 1788-1799. ZHENG X, XU S D, TANG Q F, et al. Effects of adding phytase and protease in low phosphorus and low fish meal diets on growth performance and digestive physiology of grass carp (Ctenopharyngodon idella)[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1788-1799 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.037 |
| [26] |
李军国, 任广跃, 牛力斌, 等. 液体饲料添加剂真空后喷涂工艺技术研究[J]. 饲料工业, 2003, 24(11): 7-9. LI J G, REN G Y, NIU L B, et al. Study on vacuum post spraying technology of liquid feed additive[J]. Feed Industry, 2003, 24(11): 7-9 (in Chinese). |
| [27] |
董颖超, 李俊, 秦玉昌, 等. 真空后喷涂技术在酶制剂中的应用研究[J]. 饲料研究, 2008(6): 6-8. DONG Y C, LI J, QIN Y C, et al. Application of vacuum post spraying technology in enzyme preparation[J]. Feed Research, 2008(6): 6-8 (in Chinese). |
| [28] |
YIN B, LIU H Y, TAN B P, et al. Cottonseed protein concentrate (CPC) suppresses immune function in different intestinal segments of hybrid grouper ♀ Epinephelus fuscoguttatus×Epinephelus lanceolatu via TLR-2/MyD88 signaling pathways[J]. Fish & Shellfish Immunology, 2018, 81: 318-328. |
| [29] |
YE G L, DONG X H, YANG Q H, et al. Low-gossypol cottonseed protein concentrate used as a replacement of fish meal for juvenile hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus): effects on growth performance, immune responses and intestinal microbiota[J]. Aquaculture, 2020, 524: 735309. DOI:10.1016/j.aquaculture.2020.735309 |
| [30] |
SHEN J F, LIU H Y, TAN B P, et al. Effects of replacement of fishmeal with cottonseed protein concentrate on the growth, intestinal microflora, haematological and antioxidant indices of juvenile golden pompano (Trachinotus ovatus)[J]. Aquaculture Nutrition, 2020, 26(4): 1119-1130. DOI:10.1111/anu.13069 |
| [31] |
杨文娇, 宋春阳, 于振洋, 等. 复合蛋白酶添加量对鲁烟白猪生产性能、养分消化率及血液生化指标的影响[J]. 中国饲料, 2018(7): 59-63. YANG W J, SONG C Y, YU Z Y, et al. Effects of protamex on production performance, nutrient digestibility and blood biochemical index of Luyan white pigs[J]. China Feed, 2018(7): 59-63 (in Chinese). |
| [32] |
YIN Y L, BAIDOO S K, JIN L Z, et al. The effect of different carbohydrase and protease supplementation on apparent (ileal and overall) digestibility of nutrients of five hulless barley varieties in young pigs[J]. Livestock Production Science, 2001, 71(2/3): 109-120. |
| [33] |
郑欣, 徐树德, 唐启峰, 等. 低磷低鱼粉饲料中添加植酸酶和蛋白酶对草鱼生长性能和消化生理的影响[J]. 动物营养学报, 2020, 32(4): 1788-1799. ZHENG X, XU S D, TANG Q F, et al. Effects of adding phytase and protease in low phosphorus and low fish meal diets on growth performance and digestive physiology of grass carp (Ctenopharyngodon idella)[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1788-1799 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.037 |
| [34] |
王拥军, 李秀颖, 李改娟, 等. 饲料中添加蛋白酶对鲤鱼生长性能的影响[J]. 现代农业科技, 2016(18): 238. WANG Y J, LI X Y, LI G J, et al. Effects of protease on growth performance of carp (Cyprinus carpio)[J]. Modern Agricultural Science and Technology, 2016(18): 238 (in Chinese). DOI:10.3969/j.issn.1007-5739.2016.18.134 |
| [35] |
宋红利. 蛋白酶、有机酸盐及其复配物对凡纳滨对虾生理的影响[D]. 硕士学位论文. 湛江: 广东海洋大学, 2016. SONG H L. Effects of protease, organic acid salts, and protease-organic acid salts combination on physiology of white shrimp, Litopenaeus vannamei[D]. Master's Thesis. Zhanjiang: Guangdong Ocean University, 2016. (in Chinese) |
| [36] |
DREW M D, RACZ V J, GAUTHIER R, et al. Effect of adding protease to coextruded flax: pea or canola: pea products on nutrient digestibility and growth performance of rainbow trout (Oncorhynchus mykiss)[J]. Animal Feed Science and Technology, 2005, 119(1/2): 117-128. |
| [37] |
SILVEIRA-COFFIGNY R, PRIETO-TRUJILLO A, ASCENCIO-VALLE F. Effects of different stressors in haematological variables in cultured Oreochromis aureus S.[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2004, 139(4): 245-250. |
| [38] |
KUMAR V, MAKKAR H P S, DEVAPPA R K, et al. Isolation of phytate from Jatropha curcas kernel meal and effects of isolated phytate on growth, digestive physiology and metabolic changes in Nile tilapia (Oreochromis niloticus L.)[J]. Food and Chemical Toxicology, 2011, 49(9): 2144-2156. DOI:10.1016/j.fct.2011.05.029 |
| [39] |
NYBLOM H, BERGGREN U, BALLDIN J, et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism, 2004, 39(4): 336-339. DOI:10.1093/alcalc/agh074 |
| [40] |
ZHONG Y F, SHI C M, ZHOU Y L, et al. Optimum dietary fiber level could improve growth, plasma biochemical indexes and liver function of largemouth bass, Micropterus salmoides[J]. Aquaculture, 2020, 518: 734661. DOI:10.1016/j.aquaculture.2019.734661 |
| [41] |
石泽. 蛋白酶、有机酸对异育银鲫(Carassius auratus gibelio)和建鲤(Cyprinus carpio var. Jian)生长、营养物质利用率的影响[D]. 硕士学位论文. 上海: 上海海洋大学, 2016. SHI Z. Effects of dietary protease and organic acids on growth and nutrient utilization of gibel carp, Carassius auratus gibelio and Jian carp, Cyprinus carpio var. Jian[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2016. (in Chinese) |
| [42] |
NDAZIGARUYE G, KIM D H, KANG C W, et al. Effects of low-protein diets and exogenous protease on growth performance, carcass traits, intestinal morphology, cecal volatile fatty acids and serum parameters in broilers[J]. Animals, 2019, 9(5): 226. DOI:10.3390/ani9050226 |
| [43] |
SHI Z, LI X Q, CHOWDHURY M A K, et al. Effects of protease supplementation in low fish meal pelleted and extruded diets on growth, nutrient retention and digestibility of gibel carp, Carassius auratus gibelio[J]. Aquaculture, 2016, 460: 37-44. DOI:10.1016/j.aquaculture.2016.03.049 |
| [44] |
梁洁雯, 范怡杰, 莫文艳, 等. 蛋白酶对中华草龟生长性能、形态性状及消化酶活性的影响[J]. 饲料工业, 2019, 40(2): 54-59. LIANG J W, FAN Y J, MO W Y, et al. Effects of protease on growth performance, morphological characters and digestive enzyme activities in Chinemys reevesii[J]. Feed Industry, 2019, 40(2): 54-59 (in Chinese). |
| [45] |
张娟娟, 李小勤, 冷向军, 等. 外源蛋白酶对虹鳟生长和肠道组织结构的影响[J]. 大连海洋大学学报, 2012, 27(6): 534-538. ZHANG J J, LI X Q, LENG X J, et al. Effects of supplemental protease on growth and intestinal tissue structure in rainbow trout Oncorhynchus mykiss[J]. Journal of Dalian Fisheries University, 2012, 27(6): 534-538 (in Chinese). DOI:10.3969/j.issn.2095-1388.2012.06.009 |
| [46] |
GHAZI S, ROOKE J A, GALBRAITH H, et al. The potential for the improvement of the nutritive value of soya-bean meal by different proteases in broiler chicks and broiler cockerels[J]. British Poultry Science, 2002, 43(1): 70-77. DOI:10.1080/00071660120109935 |
| [47] |
LAW F L, ZULKIFLI I, SOLEIMANI A F, et al. The effects of low-protein diets and protease supplementation on broiler chickens in a hot and humid tropical environment[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(8): 1291-1300. DOI:10.5713/ajas.17.0581 |
| [48] |
ZHANG Y, CHEN P, LIANG X F, et al. Metabolic disorder induces fatty liver in Japanese seabass, Lateolabrax japonicas fed a full plant protein diet and regulated by cAMP-JNK/NF-κB-caspase signal pathway[J]. Fish & Shellfish Immunology, 2019, 90: 223-234. |
| [49] |
WILSON R P. Utilization of dietary carbohydrate by fish[J]. Aquaculture, 1994, 124(1/2/3/4): 67-80. |
| [50] |
KREBS M, BREHM A, KRSSAK M, et al. Direct and indirect effects of amino acids on hepatic glucose metabolism in humans[J]. Diabetologia, 2003, 46(7): 917-925. DOI:10.1007/s00125-003-1129-1 |
| [51] |
张晓清, 李小勤, 陈佳楠, 等. 无鱼粉低磷饲料中添加中性蛋白酶和植酸酶对建鲤生长及营养物质利用的影响[J]. 水生生物学报, 2017, 41(6): 1291-1300. ZHANG X Q, LI X Q, CHEN J N, et al. Effects of supplementation of neutral protease and neutral phytase in fish meal free diet with low phosphorus level on growth, nutrients digestibility and deposition of Jian carp (Cyprinus carpio var.Jian)[J]. Acta Hydrobiologica Sinica, 2017, 41(6): 1291-1300 (in Chinese). |
| [52] |
张若然. 蛋白酶、脂肪酶、非淀粉多糖酶在黄颡鱼饲料中的应用研究[D]. 硕士学位论文. 广州: 华南农业大学, 2018. ZHANG R R. Application of proteinase, lipase and non-starch polysaccharide enzymes in diets of yellow catfish (Pelteobagrus fulvidraco)[D]. Master's Thesis. Guangzhou: South China Agricultural University, 2018. (in Chinese) |
| [53] |
HIXSON S M. Fish nutrition and current issues in aquaculture: the balance in providing safe and nutritious seafood, in an environmentally sustainable manner[J]. Journal of Aquaculture Research & Development, 2014, 5: 3. |
| [54] |
WAHLANG B, MCCLAIN C, BARVE S, et al. Role of cAMP and phosphodiesterase signaling in liver health and disease[J]. Cellular Signalling, 2018, 49: 105-115. DOI:10.1016/j.cellsig.2018.06.005 |
| [55] |
KEMP B E, MITCHELHILL K I, STAPLETON D, et al. Dealing with energy demand: the AMP-activated protein kinase[J]. Trends in Biochemical Sciences, 1999, 24(1): 22-25. DOI:10.1016/S0968-0004(98)01340-1 |
| [56] |
SUN H, LIU D. Hydrodynamic delivery of interleukin 15 gene promotes resistance to high fat diet-induced obesity, fatty liver and improves glucose homeostasis[J]. Gene Therapy, 2015, 22(4): 341-347. DOI:10.1038/gt.2014.114 |
| [57] |
姜伟, 王修启, 束刚, 等. 雷帕霉素靶蛋白(mTOR)结构功能及其对骨骼肌蛋白质合成影响的研究进展[J]. 中国畜牧兽医, 2010, 37(6): 21-25. JIANG W, WANG X Q, SHU G, et al. Advances in the studies of the structure, function and skeletal muscle protein synthesis of mTOR[J]. Chinese animal husbandry and veterinary medicine, 2010, 37(6): 21-25 (in Chinese). |
| [58] |
MA X M, BLENIS J. Molecular mechanisms of mTOR-mediated translational control[J]. Nature Reviews Molecular Cell Biology, 2009, 10(5): 307-318. DOI:10.1038/nrm2672 |




