枣中含有丰富的生物活性物质,如多糖、酚类化合物、三萜类化合物、维生素C、挥发油类化合物等[1]。我国枣资源丰富,年产量在800万t左右,其中有110万t左右残次枣。残次枣价格低廉、营养物质和活性物质丰富、易处理加工、适口性好,具有作为能量饲料、抗氧化剂等的潜力,近年来受到饲料行业的广泛青睐。但残次枣存在不耐贮存、营养成分利用较差、杂菌毒素超标等问题,限制了其在饲粮中的应用。微生物发酵饲料是依靠酵母菌、芽孢杆菌等有益微生物的新陈代谢,将饲料中不利于动物消化吸收的一些大分子及抗营养物质等降解转化,形成一种富含高活性益生菌和营养物质的生物饲料。它不仅能调节动物肠道的微生态平衡,抑制和杀死有害菌,改善消化吸收能力,提高机体免疫功能,有效促进动物生长,还具有保护环境,原料广泛存在,投入少、产出多等优势[1-3]。白莉圆[4]研究表明,将植物乳杆菌和发酵乳杆菌按体积比1∶1混合,接种量为10%,麸皮和红枣以干物料按质量比3∶2混合,含水量为60%,在36.5 ℃下发酵48 h,发酵所得醪液中总酸含量为25.9 g/kg,甜酸适口,风味协调,无异味。童鑫等[5]利用酿酒酵母和嗜酸乳杆菌对枣渣进行发酵,确定了最优复合菌剂配比为酿酒酵母∶嗜酸乳酸杆菌=2∶1;最佳接种量为15%;最适培养基为枣渣∶玉米∶麸皮∶硫酸铵∶碳酸钙∶硫酸镁∶磷酸二氢钾=50.0∶20.0∶30.0∶1.0∶0.6∶0.4∶1.5;在发酵温度为32 ℃的条件下发酵84 h,发酵产物的真蛋白质含量比发酵前提高了5.38%。关于对枣粉进行微生物发酵的研究较少,且发酵产品质量参差不齐,品质不一,微生物发酵枣粉技术落后。因此,优化枣粉固态发酵工艺、降低毒素含量成为残次枣饲料化利用迫切需要解决的问题。
为了寻求固态发酵枣粉的最佳复合菌剂配比、发酵条件和发酵时间,进一步提高枣粉的饲用价值和黄酮类功能成分含量,本试验将酿酒酵母、植物乳酸杆菌与枯草芽孢杆菌混合作为复合菌剂对枣粉进行固态发酵,优化发酵条件,以发酵枣粉的营养成分含量、pH和毒素含量作为指标,综合评价复合菌剂固态发酵对枣粉饲用品质的影响,为残次枣的饲料化利用提供参考依据。
1 材料与方法 1.1 试验材料发酵菌种:酿酒酵母2株(S2、S11)、植物乳酸杆菌2株(R7、R9)、枯草芽孢杆菌3株(B26、B37、C61)。以上菌株均分离自玉米秸秆,将各菌种与30%无菌甘油1∶1混合,于-80 ℃冰箱中保存备用。
培养基:LB液体培养基、PDA液体培养基、MRS液体培养基均参考高旭红[6]的方法配制,相应的固体培养基在液体培养基成分的基础上加入1.5%的琼脂。
发酵原料:红枣为陕西某公司提供的黄河滩枣,制成枣粉后使用;麸皮和豆粕均为市售饲料原料。发酵原料营养水平见表 1。
|
|
表 1 发酵原料营养水平(风干基础) Table 1 Nutrient levels of fermentation raw materials (air-dry basis) |
发酵袋:20 cm×30 cm单向出气阀微生物专用发酵袋,购自温州冠华包装材料有限公司。
1.2 试验仪器AIRTECH超净工作台、ZWALWAY-G154DW型高压灭菌锅、THERMO FISHER超纯水仪、SUKUNSKY-200B恒温培养摇床、EPOCH超微量分光光度仪、SARTORIOUS Pb-21型酸度计、VORTEX-5型涡旋振荡器、EPPENDORF-5810离心机、THERMO TECH-320型循环水浴锅、KT-R4300全自动热量仪。
1.3 试验方法 1.3.1 试验1:正交试验优化复合菌剂复合菌剂中酿酒酵母、植物乳酸杆菌、枯草芽孢杆菌的配比为试验因素,设计3因素3水平正交试验,共9个组(Mix1~9组)。将解冻的菌液以4%的比例接种到相应的液体培养基中,37 ℃、160 r/min恒温摇床(乳酸菌厌氧、静置培养)培养24 h,培养结束后用灭菌的生理盐水对各菌种进行梯度稀释;再取3个适宜梯度涂布于相应的固体培养基上,37 ℃恒温培养48 h,培养结束后挑取生长状态良好的单菌落,点接种至相应液体培养基,活化3代。活化后按表 2中的配比进行接种,接种量为3%。各菌液中活菌数均≥9×109 CFU/mL,其中酿酒酵母是由2株酿酒酵母(S2、S11)按1∶1比例混合后添加,植物乳酸杆菌是由2株植物乳酸杆菌(R7、R9)按1∶1比例混合后添加,枯草芽孢杆菌是由3株枯草芽孢杆菌(B26、B37、C61)按1∶1∶1比例混合后添加。枣粉、麸皮与豆粕的比例为7∶3∶1,含水量为30%,搅拌混匀后装入发酵袋中,每袋300 g,每个组设3个重复,手工挤压排气后封口,37 ℃条件下发酵7 d,取样测定营养成分含量、pH。
|
|
表 2 复合菌剂中酿酒酵母、植物乳酸杆菌、枯草芽孢杆菌的配比 Table 2 Saccharomyces cerevisiae, Lactobacillus plantarum and Bacillus subtilis proportions in compound bacteria agent |
以复合菌剂(Mix4、Mix5、Mix8)、含水量(20%、30%、40%)、麸皮添加量(20%、30%、40%)为试验因素,设计3因素3水平的正交试验,共9个组(MixA~I组),各组中含水量、麸皮添加量和复合菌剂见表 3。按照试验设计将发酵菌种与发酵基质混合,加水调节含水量,搅拌均匀,装入发酵袋中,每袋300 g,密封发酵,发酵温度控制在37 ℃。每个组设3个重复,0 h开始,每24 h取样检测pH(每个重复3个平行),连续测定8次。取发酵0和168 h的样品,进行相关指标的测定,确定最佳发酵条件。
|
|
表 3 各组的含水量、麸皮添加量和复合菌剂 Table 3 Water content, bran additive amount and compound bacteria agent in each group |
采用单因素设计试验,以发酵时间(1、2、3、4、5、6、7 d)为唯一变量,含水量、麸皮添加量、复合菌剂组合按照1.3.2所得最优发酵条件设定。将发酵菌种与发酵基质混合,加水调节含水量,搅拌均匀,装入发酵袋中,每袋300 g,密封发酵,发酵温度控制在37 ℃,每个发酵时间设3个重复,在设定的发酵时间取样,检测发酵产品的营养物质含量、pH和毒素含量的动态变化,以确定最佳发酵时间。
1.4 测定指标和测定方法发酵枣粉的感官评定参考青贮饲料的评定方法[7];pH参照王旭明等[8]的方法,称取5 g发酵样品,放入三角瓶中,加入50 mL蒸馏水,用磁力搅拌器搅拌15 min,静置20 min后用pH计测定;还原糖含量采用3, 5-二硝基水杨酸(DNS)比色法[9]测定;黄酮含量采用紫外分光光度法[10]测定;多酚含量采用Folin-Ciocaileu比色法[11]测定;干物质、水分、粗脂肪、粗蛋白质、粗灰分、酸性洗涤纤维、中性洗涤纤维、钙、磷含量均参考《饲料分析及饲料质量检测技术》测定;总能采用弹式测热计(Bomb Calorimeter)测定;黄曲霉毒素B1和玉米赤霉烯酮含量采用酶联免疫吸附试验法测定。
1.5 数据统计与分析数据经Excel 2010初步处理后,用SPSS 13.0统计软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较检验,试验数据用平均值±标准误表示,P < 0.05为差异显著性判断标准。
2 结果与分析 2.1 发酵枣粉感官评定发酵枣粉含水量为30%及以下时均为棕褐色,质地松软,有较浓郁醇香味和酸香味,无结块现象,无黏手现象;含水量高于30%时呈黑褐色,有明显结块,质地较硬,有黏手触感,醇香味与酸香味不明显;未发酵枣粉呈浅褐色,无醇香味与酸香味。
2.2 复合菌剂对发酵枣粉营养成分含量及pH的影响由表 4可知,Mix4、Mix5、Mix8组黄酮、多酚、还原糖含量极显著高于其他组(P < 0.01),中性洗涤纤维、酸性洗涤纤维含量极显著低于其他组(P < 0.01);Mix8组粗蛋白质含量显著高于其他组(P < 0.05);Mix5组粗灰分含量显著高于其他组(P < 0.05)。综上可知,采用Mix8组的复合菌剂进行固体发酵对枣粉中营养成分含量的改善效果最佳。
|
|
表 4 复合菌剂对发酵枣粉营养成分含量的影响(风干基础) Table 4 Effects of compound bacteria agent on nutritional component contents of fermented jujube powder (air-dry basis)1) |
如图 1所示,发酵6 d时,各组发酵枣粉的pH均达到最低,且以Mix4、Mix5、Mix8组较低,分别降至4.23、4.19和4.26。
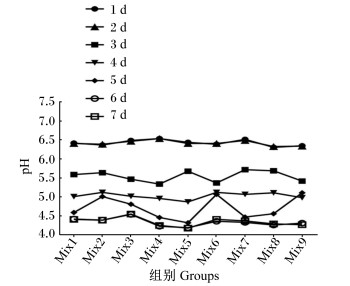
|
图 1 复合菌剂对发酵枣粉不同发酵时间pH的影响 Fig. 1 Effects of compound bacteria agent on pH of fermented jujube powder at different fermentation time |
由表 5可知,发酵提高了枣粉的黄酮含量,MixA组黄酮含量最高,极显著高于其他组和未发酵组(P < 0.01);MixA组多酚含量最高,极显著高于MixC、MixE、MixF、MixH组和和未发酵组(P < 0.01);MixC组还原糖含量最高,极显著高于MixA、MixD组外的其他组和未发酵组(P < 0.01);MixA组中性洗涤纤维含量显著低于其他组和未发酵组(P < 0.05);MixA组酸性洗涤纤维含量极显著低于MixH组外的其他组和未发酵组(P < 0.01);MixD组粗蛋白质含量显著高于MixE、MixF、MixG、MixI组和未发酵组(P < 0.05);MixC组粗灰分含量显著高于MixF、MixI组(P < 0.05)。
|
|
表 5 发酵条件对发酵枣粉营养成分含量的影响(风干基础) Table 5 Effects of fermentation condition on nutritional component contents of fermented jujube powder (air-dry basis) |
如图 2所示,发酵6 d时,各组发酵枣粉的pH均达到最低,且以MixA组最低,降至4.13。综合分析可知,MixA组的发酵条件对发酵枣粉营养成分含量及pH的改善效果最优。
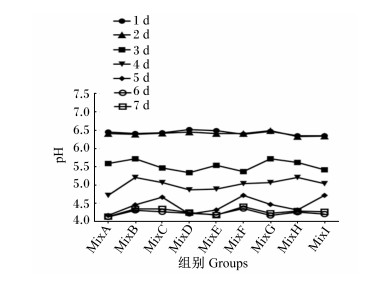
|
图 2 发酵条件对发酵枣粉不同发酵时间pH的影响 Fig. 2 Effects of fermentation condition on pH of fermented jujube powder at different fermentation time |
由表 6可知,发酵枣粉的中性洗涤纤维和酸性洗涤纤维含量在发酵7 d时极显著低于其他发酵时间(P < 0.01);粗蛋白质含量在发酵6 d时显著高于其他发酵时间(P < 0.05);粗灰分含量在发酵5 d时显著高于其他发酵时间(P < 0.05);黄酮含量在发酵5 d时极显著高于发酵0、4、6 d时(P < 0.01);多酚含量在发酵5、6和7 d时显著高于发酵0、4 d时(P < 0.05);还原糖含量在发酵7 d时极显著高于其他发酵时间(P < 0.01),在发酵5和6 d时极显著高于发酵0、4 d时(P < 0.01)。综上可知,发酵时间为6 d时对发酵枣粉营养成分含量提高的效果较好。
|
|
表 6 发酵时间对发酵枣粉营养成分含量的影响(风干基础) Table 6 Effects of fermentation time on nutritional component contents of fermented jujube powder (air-dry basis) |
如图 3所示,发酵6 d时,发酵枣粉pH达到最低,为4.11。由表 7可知,不同发酵时间下发酵枣粉中黄曲霉毒素B1与玉米赤酶烯酮含量均未超出我国《饲料卫生标准》(GB 13078—2017)规定的允许量。
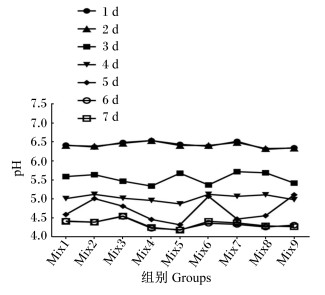
|
图 3 发酵时间对发酵枣粉pH的影响 Fig. 3 Effects of fermentation time on the pH of fermented jujube powder |
|
|
表 7 发酵时间对发酵枣粉pH及黄曲霉毒素B1和玉米赤霉烯酮含量的影响 Table 7 Effects of fermentation time on pH, aflatoxin B1 and zearalenone contents of fermented jujube powder |
由表 8可知,在复合菌剂(酿酒酵母∶植物乳酸杆菌∶枯草芽孢杆菌=2∶1∶2)接种量为3%,麸皮添加量为20%,接种前发酵基质含水量为20%,发酵时间为6 d条件下,原料组干物质含量显著高于空白发酵组和发酵组(P < 0.05);发酵组黄酮、多酚、还原糖和粗脂肪含量极显著高于原料组与空白发酵组(P < 0.01),粗蛋白质和粗灰分含量显著高于原料组与空白发酵组(P < 0.05),中性洗涤纤维、酸性洗涤纤维含量及pH极显著低于原料组与空白发酵组(P < 0.01);发酵组玉米赤霉烯酮含量显著低于空白发酵组和原料组(P < 0.05)。
|
|
表 8 发酵前后枣粉营养品质对比(风干基础) Table 8 Comparison of nutritional quality of jujube powder before and after fermentation (air-dry basis) |
复合菌发酵不仅能够提高饲料消化率,而且由于益生菌大量繁殖,使发酵饲料兼有益生菌添加剂的特点[12]。利用微生物之间协同的关系,把几种微生物有机结合在一起时,一般能产生优于单菌发酵的效果[13]。适宜的复合菌剂配比和接种量对保证发酵效果具有重要意义[14]。李佳腾[15]研究表明,枯草芽孢杆菌、黑曲霉、乳酸片球菌、酿酒酵母按体积比为3.0∶1.5∶1.0∶1.0的比例进行混合,作为发酵复合菌剂,接种量为6.5%,可以显著提高杏鲍菇菌糠的营养价值和感官品质。张立明等[16]选用麦麸、米糠、枣渣等为原料进行微生物固态发酵,结果表明,复合菌剂最佳配比为酿酒酵母BC:酿酒酵母XR4:枯草芽孢杆菌A15=2∶2∶1,接种量为8%,在此条件下,综合指标最优。童鑫等[5]利用酿酒酵母和嗜酸乳杆菌对枣渣进行固态发酵,最终确定菌剂复合菌最佳配比为酿酒酵母∶嗜酸乳酸杆菌=2∶1;最佳接种量为15%。本试验中,复合菌剂对发酵枣粉营养成分含量有极显著影响,Mix4、Mix5、Mix8组复合菌剂配比对发酵枣粉营养成分含量的改善效果较其他组更好,且这3个组发酵枣粉的pH低于其他组,即酿酒酵母∶植物乳酸杆菌∶枯草芽孢杆菌为3∶3∶4、3∶4∶2或2∶1∶2,复合菌剂接种量为3%时枣粉的发酵效果较好。
3.2 发酵条件优化含水量会对发酵过程和饲料发酵品质产生重要影响,微生物的前期生长,纤维素酶的分泌、传递及作用均需要一定量的水参与[15]。含水量过高会导致发酵原料黏性增加,料间空隙减少,换气量减少,生长代谢产生的废气影响菌株的正常生长,从而引起发酵停滞。研究表明,随着含水量的增加,固态发酵棉籽粕脱除棉酚的效果先升高后降低[17]。郭宝珠等[18]研究发现,在一定范围内随着料水比的降低,发酵亚麻籽中生氰糖苷含量先保持不变后上升,最适料水比为1.0∶0.6。枣粉中丰富的单糖及多糖类物质在提供了必需的碳源及能量的同时容易致使枣粉在发酵过程中发霉变质,进而降低枣粉的发酵品质。麸皮质地蓬松多空,可吸附枣粉的部分单糖和多糖,防止枣粉结块粘连,有助于复合菌剂充分接触空气,促进前期好氧菌的增殖。在以麦麸、米糠和枣渣等为原料进行的微生物固态发酵试验中,最佳的麦麸添加量为8.6%,发酵的初始含水量为45%[16]。利用酿酒酵母和嗜酸乳杆菌对枣渣进行发酵[5],其中最佳的麸皮添加量为30%。
本研究中,MixA组的发酵条件对发酵枣粉营养成分含量及pH的改善效果最优,即复合菌剂配比为酿酒酵母∶植物乳酸杆菌∶枯草芽孢杆菌=2∶1∶2,接种量为3%,接种前发酵基质含水量为20%,麸皮添加量为20%。固态发酵枣粉时添加适量的麸皮,可在中和部分可溶性糖与水分的基础上诱导产生丰富的纤维素酶,然后作用于枣粉的细胞壁,改善细胞壁的通透性,从而使包被于细胞壁阻碍被机体高效吸收利用的黄酮、多酚类物质得以释放。
3.3 发酵时间优化发酵时间是影响发酵进程与结果的重要因素,主要通过影响发酵菌株的数量以及产酶量而间接影响发酵结果[19]。研究表明,不同发酵时间下生氰糖苷脱除量存在显著差异,发酵72 h后,生氰糖苷得到有效脱除,若此时继续延长发酵时间,发酵效果不会发生显著变化,而且还会因过度发酵导致其他营养成分的损失,同时增加发酵成本[18]。童鑫等[5]利用酿酒酵母和嗜酸乳杆菌对枣渣进行发酵,最适发酵时间为84 h,发现此发酵时间下发酵产物的真蛋白质含量比发酵前提高5.38%。李佳腾[15]在利用混菌发酵对杏鲍菇菌糠的饲用品质与安全性进行了分析,研究发现最适的发酵时间为8 d。本研究中,在MixA组的发酵条件下,随着发酵时间的延长,pH下降缓慢,维持在一定水平。这可能是因为,随着pH的降低,发酵产生的有机酸积累到一定程度,优势菌群(乳酸菌等)的生存受到的酸抑制作用增强,活性逐渐减弱,从而造成产酸能力下降。发酵6 d时对发酵枣粉的营养成分含量提高效果较好,且pH达到最低值4.11,毒素含量降低。研究表明,适当延长发酵时间可以增加菌群的数量、生物活性酶的产量和生物活性酶的作用时间,提高纤维素降解率[15]。
总之,在优化的发酵条件下对枣粉进行固体发酵,其营养成分含量均得到不同程度的提高,黄酮、多酚类物质含量提高,且能有效降低pH、粗纤维及毒素含量。
3.4 复合菌剂固体发酵对枣粉营养品质的影响植物外围包含着一层厚壁即细胞壁,纤维素酶能通过降解作用使包裹在细胞壁中的黄酮溶出,且不破坏其生物活性[20]。粗纤维的降解使还原糖含量得到提高,木质纤维素在酶的作用下降解成各种单糖、醛和酸等,这些成分可能未被菌体全部利用,致使基质中无氮浸出物的含量大致呈递增趋势。黄玉岚[21]研究显示,发酵枣粉的粗蛋白质含量较未发酵枣粉增加45.37%,粗脂肪含量减少46%,粗纤维含量变化不大。选用麦麸、枣渣等为原料进行固态发酵,结果表明发酵产物中β-葡聚糖、甘露聚糖、多肽含量比未进行发酵的对照组分别提高了7.5%、7.6%、3.0%[16]。利用酿酒酵母和嗜酸乳杆菌对枣渣进行固态发酵,发酵产物的真蛋白质含量比发酵前提高了5.38%[5]。马文强等[22]利用枯草芽孢杆菌、酿酒酵母、乳酸菌对豆粕进行发酵,结果显示粗蛋白质、粗脂肪含量较发酵前分别提高了13.48%、18.18%。本研究中,经过复合菌剂发酵后枣粉的黄酮、多酚、还原糖、粗脂肪、粗蛋白质含量明显提高,而中性洗涤纤维、酸性洗涤纤维含量降低,这可能是由于粗纤维的降解使得发酵基质中干物质含量减少,粗蛋白质和粗脂肪含量发生相对浓缩,或者形成菌体蛋白,进而表现为含量的增加,该结果与李佳腾[15]、陆亚珍等[23]所得结果相似。
发酵过程中有机酸含量的增加有利于饲料的长期保存,且饲料pH的降低与有机酸含量的增加有直接关系[24-25]。Álvarez-Martín等[26]研究发现,酵母菌和乳酸菌混合发酵可以调控代谢产物的变化,酵母菌能够通过与乳酸菌的共生作用刺激乳酸菌活动,从而促进乳酸的产生及pH的降低。枯草芽孢杆菌能够代谢产生乳酸等有机酸,同时消耗环境中的游离氧,创造厌氧条件,促进乳酸菌的大量繁殖并产生乳酸,降低pH。考书娟等[27]对丝状真菌YW-7和乳酸菌混合发酵豆粕进行了研究,发酵后豆粕中的粗蛋白质含量大于53%,pH为4.4。本研究结果与此相似,复合菌剂为酿酒酵母∶植物乳酸杆菌∶枯草芽孢杆菌=2∶1∶2时,发酵枣粉的pH为4.11,发酵进程较快。这表明复合菌剂按照一定比例混合后进行发酵,能够充分利用彼此间的协同性、互补性,发挥组合正效应,促进乳酸等有机酸的产生,降低饲料pH。
本研究中,在最优发酵条件下经过固体发酵后,枣粉中黄曲霉毒素B1、玉米赤霉烯酮含量分别为1.82、52.14 μg/kg,分别较原料组下降了6.19%和14.98%。本试验所得发酵产物中这2个毒素的含量均低于《饲料卫生标准》(GB 13078—2017)规定的允许量。黄曲霉毒素B1作为霉菌毒素中毒性最强的毒素,主要由黄曲霉和寄生曲霉产生,动物长期摄入被黄曲霉毒素B1污染的饲料会对肝脏组织和细胞造成严重损伤[28]。芽孢杆菌已经被证明对黄曲霉毒素B1具有降解作用[29],这可能为发酵枣粉中黄曲霉毒素B1含量下降的主要原因,发酵枣粉中玉米赤霉烯酮含量显著下降可能是因为添加的菌株对这种毒素的降解能力较强。
4 结论枣粉固态发酵的最优条件为:复合菌剂配比为酿酒酵母∶植物乳酸杆菌∶枯草芽孢杆菌=2∶1∶2,接种量为3%,麸皮添加量为20%,接种前发酵基质含水量为20%,发酵时间为6 d。在最优发酵条件下进行固体发酵后,红枣的黄酮、多酚、还原糖和粗蛋白质含量分别提高了31.23%、17.12%、41.43%和29.87%,pH、黄曲霉毒素B1、玉米赤霉烯酮含量分别降低了38.10%、6.19%和14.98%。
| [1] |
丁胜华, 王蓉蓉, 吴继红, 等. 枣果实中生物活性成分与生物活性的研究进展[J]. 现代食品科技, 2016, 32(5): 332-348, 321. DING S H, WANG R R, WU J H, et al. A review of the bioactive components and biological activities of Zizyphus jujuba Mill.(Jujube) fruits[J]. Modern Food Science & Technology, 2016, 32(5): 332-348, 321 (in Chinese). |
| [2] |
COUTO S R, SANROMÁN M A. Application of solid-state fermentation to ligninolytic enzyme production[J]. Biochemical Engineering Journal, 2005, 22(3): 211-219. DOI:10.1016/j.bej.2004.09.013 |
| [3] |
姜传慧. 微生物发酵饲料的发展及应用[J]. 养殖与饲料, 2015(7): 29-30. JIANG C H. Development and application of microbial fermentation feed[J]. Animals Breeding and Feed, 2015(7): 29-30 (in Chinese). DOI:10.3969/j.issn.1671-427X.2015.07.011 |
| [4] |
白莉圆. 麸皮红枣乳酸发酵片加工工艺研究[D]. 硕士学位论文. 西安: 陕西师范大学, 2019. BAI L Y. Research on the processing technology of lactic acid fermentation flakes of bran and red dates[D]. Master's Thesis. Xi'an: Shaanxi Normal University, 2019. (in Chinese) |
| [5] |
童鑫, 徐庆阳. 固态联合发酵生产枣渣生物饲料的工艺研究[J]. 发酵科技通讯, 2019, 48(3): 137-140. TONG X, XU Q Y. Study on combined solid state fermentation for production of jujube residue biological feed[J]. Bulletin of Fermentation Science and Technology, 2019, 48(3): 137-140 (in Chinese). |
| [6] |
高旭红. 饲用微生物的分离鉴定及其发酵杏鲍菇菌糠饲用效果的研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018. GAO X H. Isolation and identification of feeding microorganisms and application effect of fermented Pleurotus feeds[D]. Master's Thesis. Yangling: Northwest A & F University, 2018. (in Chinese) |
| [7] |
刘建新, 杨振海, 叶均安, 等. 青贮饲料的合理调制与质量评定标准(续)[J]. 饲料工业, 1999(4): 3-5. LIU J X, YANG Z H, YE J A, et al. Reasonable preparation and quality evaluation standard of silage (continued)[J]. Feed Industry, 1999(4): 3-5 (in Chinese). |
| [8] |
王旭明, 倪永珍, 李维炯, 等. 有效微生物群(EM)对饲料pH值及营养价值的影响[J]. 浙江大学学报(农业与生命科学版), 2002, 28(4): 431-434. WANG X M, NI Y Z, LI W J, et al. Effects of EM on pH value and nutritive value of feed[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2002, 28(4): 431-434 (in Chinese). DOI:10.3321/j.issn:1008-9209.2002.04.018 |
| [9] |
李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技, 2013, 34(18): 75-77. LI H, LU J P, WANG D J. Study on determination of reducing sugar from haw flakes with DNS colorimetry method[J]. Science and Technology of Food Industry, 2013, 34(18): 75-77 (in Chinese). |
| [10] |
刘玉芬, 夏海涛, 杨树平. 紫外分光光度法测定剑麻花中总黄酮的含量[J]. 食品科学, 2005, 26(9): 418-419. LIU Y F, XIA H T, YANG S P. Quantitative determination of total flavonoids in sisal flower by UV spectrophotometry[J]. Food Science, 2005, 26(9): 418-419 (in Chinese). DOI:10.3321/j.issn:1002-6630.2005.09.108 |
| [11] |
曹艳萍, 代宏哲, 曹炜, 等. Folin-Ciocaileu比色法测定红枣总酚[J]. 安徽农业科学, 2008, 36(4): 1299-1299, 1302. CAO Y P, DAI H Z, CAO H, et al. Determination of total phenols in Zizyphus jujuba Mill. by Folin-Ciocaileu colorimetry[J]. Journal of Anhui Agricultural Sciences, 2008, 36(4): 1299-1299, 1302 (in Chinese). DOI:10.3969/j.issn.0517-6611.2008.04.010 |
| [12] |
刘瑞丽, 李龙, 陈小莲, 等. 复合益生菌发酵饲料对肥育猪消化与生产性能的影响[J]. 上海农业学报, 2011, 27(3): 121-125. LIU R L, LI L, CHEN X L, et al. The effects of complex probiotics fermented feed on digestion and performance of finishing pigs[J]. Acta Agriculturae Shanghai, 2011, 27(3): 121-125 (in Chinese). DOI:10.3969/j.issn.1000-3924.2011.03.028 |
| [13] |
刘海燕, 秦贵信, 于维, 等. 发酵豆粕对仔猪生长性能、血液生化和抗氧化指标的影响[J]. 中国饲料, 2010(17): 19-21. LIU H Y, QIN G X, YU W, et al. Effects of fermented soybean on growth performance, blood biochemical indices and antioxidant ability in piglets[J]. China Feed, 2010(17): 19-21 (in Chinese). DOI:10.3969/j.issn.1004-3314.2010.17.007 |
| [14] |
张文芝, 郭坚华. 微生物发酵工艺优化研究进展[J]. 广东农业科学, 2013, 40(6): 114-117. ZHANG W Z, GUO J H. Research advances in microbial fermentation process optimization[J]. Guangdong Agricultural Sciences, 2013, 40(6): 114-117 (in Chinese). DOI:10.3969/j.issn.1004-874X.2013.06.034 |
| [15] |
李佳腾. 纤维素降解优势菌株的筛选与杏鲍菇菌糠混菌发酵条件的优化[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2019. LI J T. Screening of dominant cellulose-degradation strains and condition optimization of mixed strains fermentation of Pleurotus eryngii spent mushroom substrate[D]. Master's Thesis. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [16] |
张立明, 郭鹏, 张政, 等. 肉羊微生物固态发酵饲料组方筛选及翻料工艺的研究[J]. 中国畜牧兽医, 2016, 43(9): 2302-2309. ZHANG L M, GUO P, ZHANG Z, et al. Study on formula screening and mixing technology of microbial solid-state fermentation feed for mutton sheep[J]. China Animal Husbandry & Veterinary Medicine, 2016, 43(9): 2302-2309 (in Chinese). |
| [17] |
王云超. 棉籽蛋白固态发酵菌种筛选、组合优化及生产工艺的研究[D]. 硕士学位论文. 南京: 南京农业大学, 2017: 24-25. WANG Y C. Research on strain screening, combination optimization and production technology of cottonseed protein solid-state fermentation[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2017: 24-25. (in Chinese) |
| [18] |
郭宝珠, 蔡辉益, 刘国华, 等. 固态发酵亚麻籽饼工艺优化及其对1~21日龄肉鸡生长性能、免疫及抗氧化功能的影响[J]. 动物营养学报, 2021, 32(1): 257-269. GUO B Z, CAI H Y, LIU G H, et al. Process optimization of solid-state fermented flaxseed cake and its effects on growth performance, immunity and antioxidant function of broilers during 1 to 21 days of age[J]. Chinese Journal of Animal Nutrition, 2021, 32(1): 257-269 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.027 |
| [19] |
吴正可, 刘国华, 李阳, 等. 混菌固态发酵菜籽粕工艺优化[J]. 中国农业科学, 2019, 52(24): 4603-4612. WU Z K, LIU G H, LI Y, et al. Optimization of solid state fermentation for rapeseed meal with mixed strains[J]. Scientia Agricultura Sinica, 2019, 52(24): 4603-4612 (in Chinese). DOI:10.3864/j.issn.0578-1752.2019.24.014 |
| [20] |
何鸿源, 陈文, 王湘君, 等. 一点红中黄酮提取工艺研究综述[J]. 内江科技, 2018, 39(8): 48-49. HE H Y, CHEN W, WANG X J, et al. A review of research on extraction technology of flavonoids from a little red[J]. Neijiang Science & Technology, 2018, 39(8): 48-49 (in Chinese). |
| [21] |
黄玉岚. 枣粉及发酵枣粉对母猪生产性能、血液指标及粪便微生物的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018. HUANG Y L. Effects of jujube powder and fermented jujube powder on production performance, blood indicators and fecal microbes flora in sows[D]. Master's Thesis. Yangling: Northwest A & F University, 2018. (in Chinese) |
| [22] |
马文强, 冯杰, 刘欣. 微生物发酵豆粕营养特性研究[J]. 中国粮油学报, 2008, 23(1): 121-124. MA W Q, FENG J, LIU X. Nutritional characteristics of microbe fermented soybean meal[J]. Journal of the Chinese Cereals and Oils Association, 2008, 23(1): 121-124 (in Chinese). |
| [23] |
陆亚珍, 王恒昌, 申远航, 等. 杏鲍菇菌糠的营养价值评价及其在羊日粮中的应用效果[J]. 安徽农业科学, 2017, 45(3): 117-118, 166. LU Y Z, WANG H C, SHEN Y H, et al. Nutritional value evaluation of Pleurotus eryngii bran and its application effects in the diet of goat and sheep[J]. Journal of Anhui Agricultural Sciences, 2017, 45(3): 117-118, 166 (in Chinese). |
| [24] |
VIJAYALAKSHMI S P, RAICHUR A M. The utility of Bacillus subtilis as a bioflocculant for fine coal[J]. Colloids and Surfaces B: Biointerfaces, 2003, 29(4): 265-275. DOI:10.1016/S0927-7765(03)00005-5 |
| [25] |
张国华, 何国庆. 传统发酵食品中乳酸菌多样性及其功能特性[J]. 中国食品学报, 2013, 13(9): 174-181. ZHANG G H, HE G Q. Diversity of lactic acid bacteria in traditional fermented foods and its functional properties[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(9): 174-181 (in Chinese). |
| [26] |
ÁLVAREZ-MARTÍN P, FLÓREZ A B, HERNÁNDEZ-BARRANCO A, et al. Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control, 2007, 19(1): 62-70. |
| [27] |
考书娟, 张锋, 张彬. 丝状真菌YW-7与乳酸菌共同培养发酵豆粕的研究[J]. 家禽科学, 2008(6): 9-12. KAO S J, ZHANG F, ZHANG B. The study of co-culture of filamentous fungi YW-7 and lactic acid bacteria to produce fermented soybean meal[J]. Poultry Science, 2008(6): 9-12 (in Chinese). |
| [28] |
GHOLAMI-AHANGARAN M, RANGSAZ N, AZIZI S. Evaluation of turmeric (Curcuma longa) effect on biochemical and pathological parameters of liver and kidney in chicken aflatoxicosis[J]. Pharmaceutical Biology, 2016, 54(5): 780-787. |
| [29] |
VERHEECKE C, LIBOZ T, MATHIEU F. Microbial degradation of aflatoxin B1: current status and future advances[J]. International Journal of Food Microbiology, 2016, 237: 1-9. DOI:10.1016/j.ijfoodmicro.2016.07.028 |




