2. 北京市饲料监察所, 北京 100107;
3. 中国农业科学院饲料研究所, 北京 100081;
4. 卫辉市农业农村局, 卫辉 453100;
5. 山东鲁莘饲料集团有限公司, 聊城 252000
2. Beijing Institute of Feed Control, Beijing 100107, China;
3. Feed Research Institute Chinese Academy of Agricultural Sciences, Beijing 100081, China;
4. Weihui Bureau of Agriculture and Rural Affairs, Weihui 453100, China;
5. Shandong Luxin Feed Group Co., Ltd., Liaocheng 252000, China
啤酒花(Humulus lupulus L.),也可称为酒花、酵母花、蛇麻花等[1],是传统的中药之一,有健胃、安神[2-3]、抗氧化[4]、化痰止咳、抗菌消炎[5-6]等功效。2019年1月25日,欧盟批准啤酒花抽提物(Humulus lupulus L. flos)作为饲料添加剂用于断奶仔猪、育肥猪等。
目前,国内外啤酒花提取工艺具有一定的研究进展。艾娜丝等[7]对啤酒花精油超临界CO2萃取工艺进行了优化。Latif等[8]研究了酶解辅助提取啤酒花精油。白璐[9]利用响应面法优化微波提取啤酒花α-酸的工艺,提取溶剂为有机溶剂。目前,啤酒花的有机溶剂提取研究较多[10-12],但有机溶剂的挥发及后续处理问题较为复杂,不利于行业健康可持续发展。
提取条件如溶剂类型、超声功率及温度等均对提取率产生显著影响[13-14],超声提取中关于料液比、提取时间及提取温度这3个因素对α-酸和β-酸提取率的影响研究较少。常规单因素试验优化提取条件不仅耗时,且需要大量试验,同时无法考虑变量之间的交互作用。Box-Behnken设计响应面法是一种用于多变量建模和优化的数学统计方法,能够综合评价一组变量与响应值(因变量)的关系,可用于优化提取条件。本试验采用乙醇作为提取溶剂,利用超声空化作用、热作用、机械搅拌、扩散、乳化和机械粉碎等优势,采用Box-Behnken设计,以提取得到的α-酸和β-酸的含量为评价指标,探究超声提取工艺的最佳条件,为啤酒花提取加工企业提供技术支持。
1 材料与方法 1.1 试验原料颗粒状啤酒花样品由新疆某啤酒花有限公司提供。
1.2 主要试剂甲醇(分析纯,天津康科德科技有限公司)、乙醇(分析纯、潍坊铭阳实验分析仪器有限公司)、氢氧化钠饱和溶液、蒸馏水等。
1.3 主要仪器Multiskan Go分光光度计(金业德祥生物科技有限公司)、METVX200-T振荡器(施锐贸易有限公司)、FRQ-1004T超声波清洗机(苏州力翰威自动化设备有限公司)、ZN-02型粉碎机(兴时立和科技发展有限公司)等。
1.4 α-酸和β-酸含量检测方法啤酒花中的活性成分主要为α-酸(葎草酮类)和β-酸(蛇麻酮类),其中α-酸主要为葎草酮、合葎草酮和加葎草酮,β-酸主要为蛇麻酮、合蛇麻酮和加蛇麻酮[5]。
啤酒花α-酸、β-酸含量的检测方法参照GB/T 20639—2006。准确称取混合均匀的啤酒花样品1.000 0 g,放入烧杯中,加入20.0 mL乙醇,放入超声波清洗机中进行超声提取,精确移取0.5 mL上清液放入10 mL的容量瓶中,用甲醇定容,此为A液。再移取A液0.6 mL放入10 mL的容量瓶中,用碱性甲醇(100 mL的甲醇中加入6 mol/L的NaOH 0.2 mL)定容,此为B液。分别在波长275、325及355 nm下测定B液的吸光度值,α-酸和β-酸含量的计算公式为:
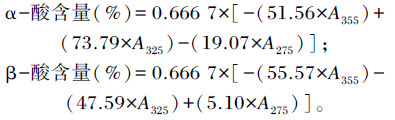
|
式中:A355、A325、A275分别为B液在波长355、325、275 nm下的吸光度值,其余数据均为公式中的经验值。
1.5 试验单因素设定范围本试验以乙醇为溶剂,超声清洗机频率为49 Hz,经前期摸索,料液比分别设为1 ∶ 10、1 ∶ 15、1 ∶ 20、1 ∶ 25、1 ∶ 30 (g ∶ mL);提取温度分别设为20、30、40、50、60 ℃;提取时间分别设为10、20、30、40、50 min。单因素试验每个试验点重复4次。
1.6 Box-Behnken响应面试验根据单因素试验结果,利用Design Expert软件,以料液比、提取时间、提取温度3个因素为自变量,提取液中α-酸和β-酸含量为响应值,按照3因素3水平进行Box-Behnken响应面试验,确定啤酒花超声提取的最佳工艺条件。
1.7 数据处理与分析采用SPSS 18.0对试验结果进行均值差异显著性检验,显著标准为P < 0.05。采用Design-Expert 10.0.4对试验结果进行分析,建立以α-酸和β-酸含量为响应值的复合评价体系,设计3因素3水平的二次回归方程,拟合自变量与响应值的函数关系。将得到的2个回归方程联立共解,以获得同时满足α-酸、β-酸提取的最佳条件。
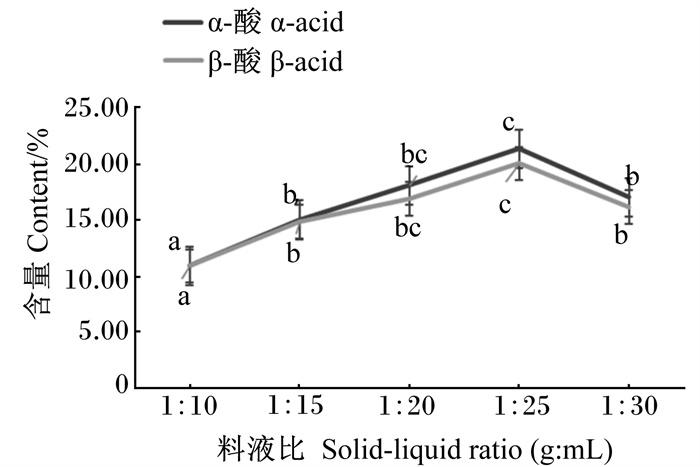
2 结果与分析 2.1 单因素试验 2.1.1 料液比对超声提取啤酒花中α-酸和β-酸含量的影响不同料液比对α-酸和β-酸含量的影响见图 1。提取液中α-酸和β-酸含量随料液比的增加呈先升高后降低趋势。料液比为1 ∶ 25时α-酸和β-酸含量显著高于料液比为1 ∶ 10、1 ∶ 15及1 ∶ 30时(P<0.05),与料液比为1 ∶ 20时差异不显著(P>0.05)。根据上述结果,选择料液比1 ∶ 25作为响应面的中心点。
|
数据点标注不同小写字母表示差异显著(P<0.05)。下图同。 Data points with different small letters mean significant difference (P < 0.05). The same as below. 图 1 料液比对α-酸和β-酸含量的影响 Fig. 1 Effects of solid-liquid ratio on α-acid and β-acid contents |
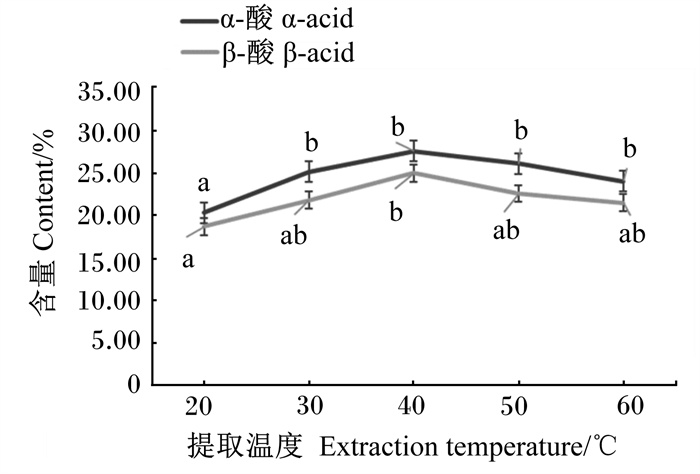
不同提取温度对α-酸和β-酸含量的影响见图 2。提取液中α-酸和β-酸含量随提取温度的升高先升高后降低。提取温度为20 ℃时α-酸含量显著低于其余4个提取温度(P<0.05);提取温度为40 ℃时β-酸含量显著高于20 ℃时(P<0.05)。根据上述结果可知,α-酸和β-酸的提取率随提取温度的升高呈先升高后降低趋势,30~60 ℃时虽差异不显著(P>0.05),但以40 ℃为中点,因此选择提取温度40 ℃作为响应面的中心点。
|
图 2 提取温度对α-酸和β-酸含量的影响 Fig. 2 Effects of extraction temperature on α-acid and β-acid contents |
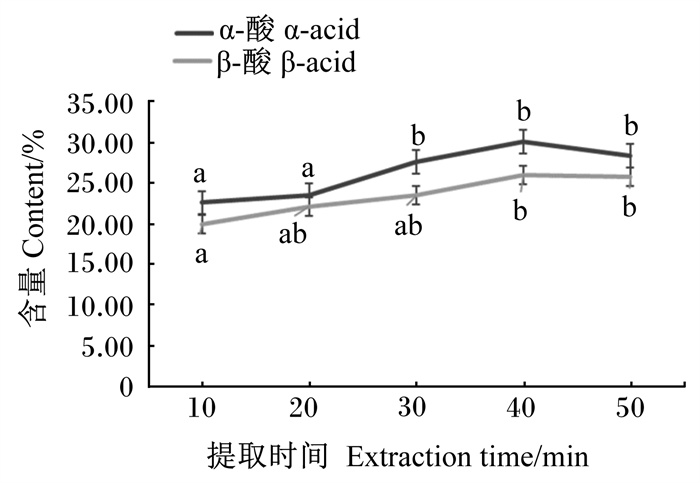
不同提取时间对α-酸和β-酸含量的影响见图 3。提取液中α-酸和β-酸含量随提取时间的延长呈升高趋势。提取时间为40 min时α-酸含量显著高于提取时间为10和20 min时(P<0.05),与提取时间为30、50 min时无显著差异(P>0.05);提取时间为40 min时β-酸含量显著高于提取时间为10 min时(P<0.05),与其余提取时间无显著差异(P>0.05)。α-酸和β-酸的提取率随提取时间的延长呈先升高后稳定的趋势,30~50 min时虽差异不显著,但以40 min为中点,因此选择提取时间40 min作为响应面的中心点。
|
图 3 提取时间对α-酸和β-酸含量的影响 Fig. 3 Effects of extraction time on α-acid and β-acid contents |
根据单因素试验结果,设定Box-Behnken响应面试验的因素和水平,详见表 1。Box-Behnken响应面试验结果见表 2。
|
|
表 1 响应面试验因素与水平 Table 1 Factors and their levels used in response surface test |
|
|
表 2 响应面试验结果 Table 2 Experimental results of response surface test |
利用Design Expert10.0.4软件进行回归模型方差分析和显著性检验,分别得到α-酸(Y1)和β-酸含量(Y2)与3个因素料液比(A)、提取时间(B)、提取温度(C)的三元二次多项式回归方程:
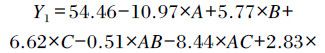
|
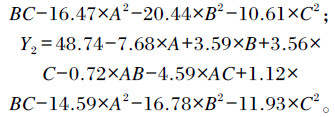
|
由表 3和表 4可以看出,2个回归模型都达到了极显著水平(P<0.01),决定系数(R2)分别为0.945 9和0.964 2,同时失拟检验不显著(P>0.05),说明模型与实际结果拟合良好。
|
|
表 3 α-酸含量作为响应值的回归模型方差分析 Table 3 ANOVA for regression model with α-acid content as response value |
|
|
表 4 β-酸含量作为响应值的回归模型方差分析 Table 4 ANOVA for regression model with β-acid content as response value |
利用Design Expert 10.0.4软件,根据得到的回归方程,对表 3和表 4的数据进行多元回归拟合,绘制不同的影响因素对响应值的三维曲线图,响应面的陡峭程度表明各个自变量对于α-酸和β-酸含量的影响情况。等高线的密集程度可表示因素的变化对α-酸和β-酸含量的影响程度[15-16]。
由图 4及表 3可知,在等高线的中心区域,α-酸含量最高,由中心向边缘逐渐降低。在3个因素中,料液比对α-酸含量的影响极显著(P<0.01),提取时间对α-酸含量的影响显著(P<0.05),提取温度对α-酸含量的影响显著(P<0.05),料液比和温度的交互作用对α-酸含量的影响显著(P<0.05)。等高线密集程度及响应面的陡峭程度表明,料液比对α-酸含量的影响最大,其次是提取温度及提取时间。
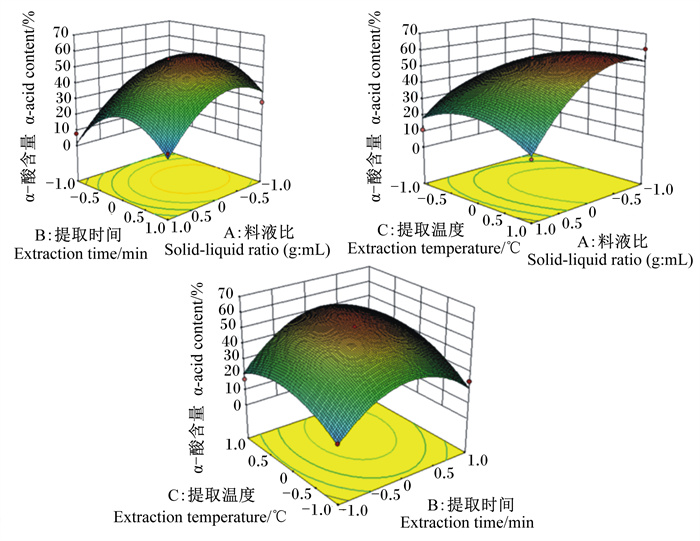
|
图 4 各因素对α-酸含量影响的响应面图 Fig. 4 Response surface graphs for effects of various factors on α-acid content |
由图 5及表 4可知,在等高线的中心区域,β-酸含量最高,由中心向边缘逐渐降低。3个因素中,料液比对β-酸含量的影响极显著(P<0.01),提取时间及提取温度对β-酸含量的影响呈弱显著性(P=0.058 2、P=0.059 8),提取温度和提取时间的交互作用显著影响β-酸含量(P<0.05)。等高线密集程度及响应面的陡峭程度表明,对β-酸含量影响最大的是料液比,其次是提取时间及提取温度。
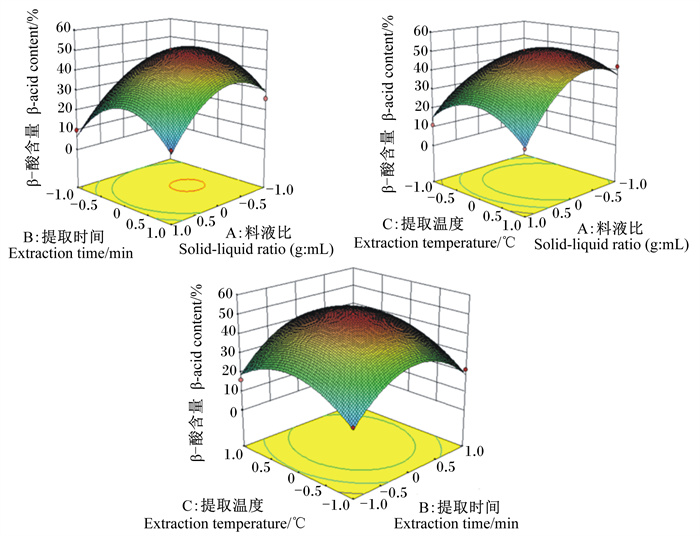
|
图 5 各因素对β-酸含量影响的响应面图 Fig. 5 Response surface graphs for effects of various factors on β-acid content |
将2个回归方程联立求解,对各自变量求导,得到α-酸和β-酸的最佳提取条件:即料液比1 ∶ 10,提取时间50 min,提取温度54 ℃,此时回归模型预测α-酸含量为51.16%,β-酸含量为43.16%。
为验证试验结果的可靠性,用试验得到的最佳提取条件对啤酒花中的α-酸和β-酸进行超声提取,共重复3次作为平行试验,测定α-酸和β-酸含量,取平均值,最终得到的实测结果α-酸含量为50.89%,β-酸含量为42.93%。实测值与预测值接近,吻合良好,模型准确可靠,能较好地预测啤酒花实际提取中α-酸和β-酸的提取情况。
3 讨论 3.1 料液比对超声提取啤酒花中α-酸和β-酸含量的影响料液比是直接影响物质与溶剂间扩散效率的重要因素之一,在料液比较小或处于某一范围内时,提取率随料液比的增大而增大,溶剂析出效应占主导[17],但当物质与溶剂间的扩散达到了平衡状态时,料液比增大将会出现提取率下降趋势[15, 18]。连文绮[14]研究微波提取啤酒花中α-酸和β-酸时发现,料液比过小,萃取不完全,料液比过大,造成萃取溶剂浪费及后期加工费用提升等问题。此外,料液比与溶液黏稠度相关,料液比较低时,溶液黏稠,有效成分溶解不够充分,不利于超声提取,当料液比增加时,多糖分子易于溶出,提取率增大[19]。在本试验中,改变料液比,α-酸和β-酸含量随料液比增加而呈现出先上升后下降的趋势。在料液比由1 ∶ 10增加至1 ∶ 25时,α-酸和β-酸含量逐渐上升,原因可能是料液比较小时,溶液的黏度较大,分子扩散速度低,提取率小,随着料液比的继续增加,溶液中α-酸和β-酸的含量降低,使更多的α-酸和β-酸从啤酒花中释放出来,提高提取率。当料液比进一步提升时,α-酸和β-酸从啤酒花中释放出来的增加量小于溶剂添加量,溶质被进一步稀释,因此α-酸和β-酸的含量又呈现出下降的趋势。
3.2 提取温度对超声提取啤酒花中α-酸和β-酸含量的影响温度升高能够加快分子运动速度和分子渗透扩散能力,加快物质溶出率,提高提取率[20]。冷进松等[21]研究啤酒花精油超声辅助水酶法提取工艺,研究发现最适提取温度为50 ℃。王亚南[22]提取啤酒花中总黄酮,最适提取温度为52 ℃,超声负压连续提取有效减少提取过程中活性成分损失。在本试验中,α-酸和β-酸含量随提取温度的升高而呈现出先上升后下降的趋势,提取温度升高,啤酒花内部的分子热运动加剧,更有利于α-酸和β-酸的析出,提取液中α-酸和β-酸的含量升高,提取率增加,但是提取温度继续升高,超过40 ℃后会对啤酒花分子造成一定程度的破坏,从而导致提取率降低。夏娜[23]研究发现,温度越高,啤酒花中α-酸和β-酸提取率变化幅度变大,损失率升高,与本试验研究结果一致。
3.3 提取时间对超声提取啤酒花中α-酸和β-酸含量的影响超声具有空化作用、热作用、机械搅拌、扩散、乳化和机械粉碎等优势,一定范围内,延长提取时间可提升提取率[24-25]。孙世琨[26]探究啤酒花中黄酮类物质的提取,发现超声最佳提取条件为:乙醇溶液浓度60%,提取时间15 min,料液比1 ∶ 30(g ∶ mL)。在本试验中,提取液中α-酸和β-酸含量均随提取时间的延长而呈现出上升的趋势,但到40 min后α-酸和β-酸含量会逐渐变得平稳,无明显下降,超声时间的延长对其提取率的改变已无明显作用。与前人研究结果不同的原因在于,本试验采用超声提取,以乙醇作为提取溶剂,从提取率来看,本试验采用超声提取的提取率优于微波提取[23, 26]。
3.4 本试验α-酸和β-酸提取率与前人结果对比分析提取方式不同,啤酒花中α-酸和β-酸的提取率有所差异。艾娜丝等[7]探究超临界CO2萃取“青岛大花”啤酒花精油的最适工艺参数,以干制啤酒花为原料,以萃取压力、萃取温度、萃取时间为试验因子,采用正交试验设计筛选最佳工艺参数,啤酒花精油的得油率为5.3%,主要成分为月桂烯(40.37%)、α-律草烯(9.12%)、反式石竹烯(4.67%)。白璐[9]采用响应面法建立乙醇浓度、料液比、微波时间3个因素与α-酸含量之间的数学模型,确定啤酒花的最优提取工艺条件为:乙醇浓度70.74%,料液比1 ∶ 20.93,微波时间79.62 s。在此条件下,α-酸含量可达14.02%。连文绮[14]通过单因素试验和正交试验优化微波辅助萃取α-酸、β-酸的最佳工艺参数,最佳条件下α-酸含量(质量分数)为43.65%,β-酸含量(质量分数)为35.03%。本试验采用超声提取,最佳提取条件下,α-酸含量为50.89%,β-酸含量为42.93%。与前人研究结果不同的原因在于,超声提取与微波提取方式不同,但α-酸含量均呈现高于β-酸含量的趋势。
4 结论利用响应面法优化超声提取条件后可有效提高啤酒花中α-酸和β-酸的提取率,与本文中单因素试验结果相比,α-酸提取率提高约20%,β-酸提取率提高约16%。优化后啤酒花中α-酸和β-酸的最佳提取条件为:料液比1 ∶ 10、提取温度54 ℃、提取时间50 min。
| [1] |
刘景雪, 姜玉, 谢和辉, 等. 中药啤酒花药理作用的研究进展[J]. 药学实践杂志, 2019, 37(1): 5-8, 13. LIU J X, JIANG Y, XIE H H, et al. Advances in pharmacological effects of traditional Chinese medicine hops[J]. Journal of Pharmaceutical Practice, 2019, 37(1): 5-8, 13 (in Chinese). DOI:10.3969/j.issn.1006-0111.2019.01.002 |
| [2] |
FVSSEL A, WOLF A, BRATTSTRÖM A. Effect of a fixed valerian-hop extract combination (Ze 91019) on sleep polygraphy in patients with non-organic insomnia: a pilot study[J]. European Journal of Medical Research, 2000, 5(9): 385-390. |
| [3] |
康连虎, 李吕木. 啤酒花的生物活性及其活性成分提取工艺研究进展[J]. 酿酒科技, 2015(4): 92-95. KANG L H, LI L M. Research progress in beer hops bioactivities and the extracting techniques of its active components[J]. Liquor-Making Science & Technology, 2015(4): 92-95 (in Chinese). |
| [4] |
TAGASHIRA M, WATANABE M, UEMITSU N. Antioxidative activity of hop bitter acids and their analogues[J]. Bioscience, Biotechnology, and Biochemistry, 1995, 59(4): 740-742. DOI:10.1271/bbb.59.740 |
| [5] |
李雪, 李爽, 武盈吉, 等. 啤酒花的研究进展[J]. 吉林医药学院学报, 2019, 40(2): 143-145. LI X, LI S, WU Y J, et al. Research progress of hop[J]. Journal of Jilin Medical College, 2019, 40(2): 143-145 (in Chinese). |
| [6] |
杨静文, 刘泽畅, 陈培, 等. 啤酒花中不同比例β-酸同系物的抗氧化及抑菌活性[J]. 食品科学, 2020, 41(23): 83-90. YANG J W, LIU Z C, CHEN P, et al. Antioxidant and antibacterial activities of β-acid homologue mixtures with different ratios from Hops[J]. Food Science, 2020, 41(23): 83-90 (in Chinese). DOI:10.7506/spkx1002-6630-20191112-157 |
| [7] |
艾娜丝, 蒋玉梅, 毕阳, 等. 啤酒花精油的超临界CO2萃取工艺优化及其组成分析[J]. 食品工业科技, 2011, 32(4): 232-235. AI N S, JIANG Y M, BI Y, et al. Optimization of extracting process of essential oil from hop (Humulus lupulus L.) with supercritical CO2 and analysis of composition[J]. Science and Technology of Food Industry, 2011, 32(4): 232-235 (in Chinese). |
| [8] |
LATIF S, DIOSADY L L, ANWAR F. Enzyme-assisted aqueous extraction of oil and protein from canola (Brassica napus L) seeds[J]. European Journal of Lipid Science and Technology, 2008, 110(10): 887-892. DOI:10.1002/ejlt.200700319 |
| [9] |
白璐. 啤酒花浸膏加工工艺研究[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2011: 9-18. BAI L. Study on processing technic of hop conrcrete[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2011: 9-18. (in Chinese) |
| [10] |
NAGYBÁKAY N E, SYRPAS M, VILIMAITÉ V, et al. Optimized supercritical CO2 extraction enhances the recovery of valuable lipophilic antioxidants and other constituents from dual-purpose hop (Humulus lupulus L.) variety Ella[J]. Antioxidants, 2021, 10(6): 918. DOI:10.3390/antiox10060918 |
| [11] |
魏文慧, 刘小波, 于长青, 等. 超声-微波协同优化啤酒花残渣中原花青素的提取工艺[J]. 食品工业科技, 2020, 41(21): 185-192. WEI W H, LIU X B, YU C Q, et al. Optimization of ultrasonic-microwave assisted extraction of procyanidins from hops residue[J]. Science and Technology of Food Industry, 2020, 41(21): 185-192 (in Chinese). |
| [12] |
许月明, 张建花, 蒋益萍, 等. 正交实验优选啤酒花黄酮类成分提取工艺[J]. 医药导报, 2018, 37(9): 1103-1105. XU Y M, ZHANG J H, JIANG Y P, et al. Extraction process of flavonoids from Humulus lupulus L. by orthogonal experiment design[J]. Herald of Medicine, 2018, 37(9): 1103-1105 (in Chinese). |
| [13] |
KNEZ HRNČIČ M, ŠPANINGER E, KOŠIR I J, et al. Hop compounds: extraction techniques, chemical analyses, antioxidative, antimicrobial, and anticarcinogenic effects[J]. Nutrients, 2019, 11(2): 257. DOI:10.3390/nu11020257 |
| [14] |
连文绮. 啤酒花中α-酸、β-酸分离提取工艺优化及其抑菌活性分析[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2012: 21-54. LIAN W Q. The optimization of extracting and separating process of α-acids and β-acids in hops and the analysis of their antimicrobial activity[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2012: 21-54. (in Chinese) |
| [15] |
常娅妮, 王亚岚, 李玲. 酸木瓜总黄酮提取工艺的优化[J]. 食品研究与开发, 2019, 40(17): 52-57. CHANG Y N, WANG Y L, LI L. Optimization of extraction process of total flavonoids from sour papaya[J]. Food Research and Development, 2019, 40(17): 52-57 (in Chinese). DOI:10.12161/j.issn.1005-6521.2019.17.010 |
| [16] |
刘洋. 基于DSP的泥沙含量传感器的设计与实现[D]. 硕士学位论文. 太原: 太原理工大学, 2007: 5-25. LIU Y. Designing and realizing of silt sensor based on DSP[D]. Master's Thesis. Taiyuan: Taiyuan University of Technology, 2007: 5-25. (in Chinese) |
| [17] |
刘艳红, 许海燕, 彭修娟, 等. 响应面分析法优化秦皮多酚超声提取工艺及体外抗氧化活性研究[J]. 西北药学杂志, 2019, 34(5): 574-579. LIU Y H, XU H Y, PENG X J, et al. Optimization of extraction technology of polyphenols from fraxini cortex by response surface method and study on its antioxidant activity in vitro[J]. Northwest Pharmaceutical Journal, 2019, 34(5): 574-579 (in Chinese). DOI:10.3969/j.issn.1004-2407.2019.05.002 |
| [18] |
陈文强, 邓百万, 刘开辉, 等. 猪苓多糖超声提取工艺条件优化[J]. 食品与生物技术学报, 2008, 27(4): 53-57. CHEN W Q, DENG B W, LIU K H, et al. Study on the optimization of ultrasonic extracting technique of polysaccharide from Polyporus umbellatus[J]. Journal of Food Science and Biotechnology, 2008, 27(4): 53-57 (in Chinese). DOI:10.3321/j.issn:1673-1689.2008.04.012 |
| [19] |
吴双双, 王娇, 张大强. 紫薯多糖超声提取工艺优化及抗氧化活性研究[J]. 农产品加工, 2019(11): 40-41, 45. WU S S, WANG J, ZHANG D Q. Ultrasonic extraction optimization and antioxidant activity of purple sweet potato polysaccharide[J]. Farm Products Processing, 2019(11): 40-41, 45 (in Chinese). |
| [20] |
任丹丹, 陈谷. 响应面法优化黄秋葵多糖超声提取工艺[J]. 食品科学, 2011, 32(8): 143-146. REN D D, CHEN G. Optimization of ultrasound-assisted extraction of polysaccharides from okra by response surface analysis[J]. Food Science, 2011, 32(8): 143-146 (in Chinese). |
| [21] |
冷进松, 朱珠, 周跃勇. 超声波辅助水酶法提取啤酒花精油的研究[J]. 食品研究与开发, 2014, 35(1): 34-41. LENG J S, ZHU Z, ZHOU Y Y. The study of ultrasound-assisted aqueous enzymatic extraction of essential oil from Humulus lupulus[J]. Food Research and Development, 2014, 35(1): 34-41 (in Chinese). DOI:10.3969/j.issn.1005-6521.2014.01.009 |
| [22] |
王亚南. 啤酒花总黄酮连续提取及啤酒花精油微胶囊制备[D]. 硕士学位论文. 重庆: 重庆大学, 2016: 16-26. WANG Y N. Hops flavonoids' continuous extraction and hops essential oil microcapsules' preparation[D]. Master's Thesis. Chongqing: Chongqing University, 2016: 16-26. (in Chinese) |
| [23] |
夏娜. 干燥与贮藏对啤酒花品质的影响及黄腐酚提取[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2012: 22-62. XIA N. Effect of drying and storage on the quality of hops and etraction of xanthohumol[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2012: 22-62. (in Chinese) |
| [24] |
任雪峰, 吴冬青, 王永生, 等. 人参果多糖超声提取工艺的研究[J]. 食品研究与开发, 2010, 31(1): 9-11. REN X F, WU D Q, WANG Y S, et al. Study on ultrasonic extraction process of polysaccharides from Solanum muricatum[J]. Food Research and Development, 2010, 31(1): 9-11 (in Chinese). DOI:10.3969/j.issn.1005-6521.2010.01.004 |
| [25] |
赖富饶, 李臻, 吴晖, 等. 甜玉米芯多酚的超声提取工艺优化[J]. 现代食品科技, 2012, 28(1): 52-55, 17. LAI F R, LI Z, WU H, et al. Optimization of ultrasonic extraction process of polyphenols from sweet corncobs[J]. Food Science and Technology, 2012, 28(1): 52-55, 17 (in Chinese). |
| [26] |
孙世琨. 啤酒花中黄酮类物质的提取及纯化工艺探究[D]. 硕士学位论文. 兰州: 兰州大学, 2017: 15-38. SUN S K. Extraction and purification technology of flavonoids from hops[D]. Master's Thesis. Lanzhou: Lanzhou University, 2017: 15-38. (in Chinese) |




