2. 湖南省农用微生物应用工程技术研究中心, 饲用微生态制剂湖南省工程实验室, 长沙 410009
2. Agricultural Microbiology Application Engineering and Technology Research Center of Hunan Province, Hunan Engineering Laboratory of Feeding Microbioecologics, Changsha 410009, China
硅是地壳中除氧之外最丰富的化学元素,也是构成动物机体的基础元素之一。已经有研究表明硅对低等生物如硅藻、放射虫等及某些高等植物如水稻来说是一种必需的营养元素。但是对于动物硅一直被认为不是一种必需元素,后来发现硅会影响胶原蛋白、骨组织的合成,与心血管保护、免疫系统增强、阿尔茨海默病等有关[1-2],表明硅对动物具有重要生理作用。然而,硅对动物的确切生物学作用机制仍然未知。因此,本文综述了硅的生物来源、对动物生理功能的影响、动物对硅的吸收、在动物体内分布和转运等,旨在为硅在动物生产中的应用提供参考。
1 硅的生物来源硅在自然界分布广泛,因此饮食中硅的来源非常丰富。富含纤维的植物如大米、燕麦、大麦等都是动物良好的硅源,豆类、菠菜和一些块根类蔬菜也含有比较丰富的硅[3],但是动物性食品如肉、奶中硅含量较低,这些食物硅含量为1~440 mg/kg[4-6]。此外,饮用水、矿泉水和啤酒中也含有少量的硅。部分食物中硅含量见表 1。食物中的硅大多以硅酸盐、二氧化硅的形式存在,几乎不溶于水,不易被动物机体吸收。硅溶解在水中后以原硅酸(H4SiO4)的形式存在,是动物胃肠道硅吸收的有效形式,能被胃肠道迅速吸收,是动物机体硅元素的主要生物利用来源。
2 硅对动物生理功能的影响 2.1 硅对动物结缔组织生物学功能的影响硅存在于动物及人体多种器官组织中,据报道,在骨和其他结缔组织中硅的含量最高。硅能够改善骨基质的质量,促进骨的矿化。增加硅的摄入能够增加机体骨密度[7-8],从而改善骨强度。同时,硅在胶原蛋白和蛋白多糖的交联中起重要作用。在动物试验中发现给予低硅饮食的大鼠的骨密度下降,胶原蛋白合成能力降低,分解增加。给予硅缺乏饮食的大鼠,股骨中钙含量下降[9]。而在鸡的研究中也表明在饲粮中补充硅可增加鸡的骨密度和骨强度[10-11];给年轻赛马额外补充硅可明显减少骨损伤[12],并且发现给断奶的马额外补充硅,可使其第3掌骨骨矿物质含量明显增加[13]。董盟[14]研究表明,硅酸对成骨细胞Ⅰ型胶原(collagen type-1,COL-1)的合成具有促进作用,并能诱导成骨细胞的分化,而且硅酸可促进COL-1 mRNA的转录。通过体外试验也进一步证实了硅可以通过诱导COL-1合成并增强成骨细胞分化,增加骨基质的合成,从而促进骨的形成[15]。
结缔组织中的硅含量可能随着动物年龄的增长而降低。在动物生长过程中如果饮食中严重缺硅可引起结缔组织生长异常和缺陷。硅除了影响骨的合成外,还可保持血管结构完整性、弹性、渗透性,能增强血管的弹力纤维强度,防止粥样硬化斑块的形成,降低冠心病的发病率。有研究表明,血管壁中的硅含量与动脉粥样硬化程度成反比[16]。Vidé等[17]研究表明,富硅螺旋藻(silicon-enriched spirulina,SES)可以减轻高脂饮食引起的仓鼠血管功能障碍,预防动脉粥样硬化。Pérez-Granados等[16]研究表明,饮水中添加硅酸盐能够降低血浆中的总脂质含量;此外,结缔组织中的硅和透明质酸含量下降会导致皮肤和头发水分含量降低、弹性丧失,皮肤老化,影响头发和指甲的外观。Barel等[18]和Wickett等[19]研究表明,原硅酸能够刺激胶原蛋白的产生以及结缔组织修复。
2.2 硅对动物免疫功能的影响近年来,对硅与动物机体免疫之间的关系进行了一些研究,发现硅对机体免疫功能具有重要作用,硅可以刺激免疫细胞增殖,调节免疫功能。Seaborn等[9]研究表明,在食物中补充精氨酸可显著降低伴刀豆球蛋白A(concanavalin A,ConA)诱导的脾脏T淋巴细胞DNA合成,但受饮食中硅的影响,饮食中的硅不足会损害脾淋巴细胞的免疫应答。同时,大量研究表明,二氧化硅影响各种细胞免疫反应,硅能够激活淋巴细胞增殖,而硅不足则抑制淋巴细胞增殖。在对小鼠和大鼠的研究中,Antonini等[20-21]研究显示,亚慢性和短期接触二氧化硅晶体可以通过增加大鼠嗜中性粒细胞、T淋巴细胞和自然杀伤(NK)细胞刺激免疫系统,对呼吸防御机制产生有益作用;它还能激活吞噬细胞,产生额外的活性氧(reactive oxygen species,ROS),从而有助于肺部感染因子的清除。在大鼠中,结晶二氧化硅还可以促进CD8+ T细胞以及少量CD4+ T细胞的增殖和活化。BarodonW是一种硅酸钠和某些金属盐在碱性溶液中形成的矿物复合物,其中硅酸钠占总量的60%。近年来,对BarodonW在动物免疫功能影响方面进行了相关研究,Koo等[22]和Yoo等[23]研究表明,BarodonW对马、猪具有免疫刺激作用。BarodonW在赛马中具有非特异性的免疫刺激作用,并且对马葡萄球菌亚种和金黄色葡萄球菌具有更高的吞噬活性。使用了BarodonW的马群减少了应激诱发的呼吸道疾病等临床并发症的发生,BarodonW具有类似于灭活痤疮丙酸杆菌的免疫细胞激活作用。同时,BarodonW诱导主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ,MHCⅡ)淋巴细胞和非T/B(N)细胞水平的增加,提高植物血凝素(phytohemagglutinin,PHA)、ConA和商陆有丝分裂原的活性。BarodonW还可通过增加抗体滴度和免疫细胞比例对猪霍乱和胸膜肺炎放线杆菌疫苗免疫发挥辅助作用。
硅除了可以刺激免疫细胞增殖,调节机体免疫功能外,还在机体对抗炎症过程中发挥作用。Vidé等[17]在仓鼠高脂饮食中添加SES,与对照组相比,SES可以减少炎症,降低肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukine-6,IL-6)含量,降低多形核细胞数量和核转录因子-κB(nuclear factor-kappa B,NF-κB)活性。Radovanovic等[24]评估了摄入富硅水对长期暴露于饮食铝中的大鼠的全身炎症的影响,结果表明,长期摄入铝会引发全身性和局部性腹膜炎症反应、腹膜巨噬细胞(peritoneal macrophage,PM)功能障碍,导致体外试验中PM受到脂多糖(lipopolysaccharide,LPS)刺激时,PM表现出低吞噬活性和低TNF-α分泌,摄入富硅水组大鼠可通过恢复PM的吞噬作用和细胞因子的产生逆转铝引起的血清白细胞介素-2(interleukine-2,IL-2)含量的增加,恢复大鼠PM中白细胞介素-10(interleukine-10,IL-10)和TNF-α的分泌,减轻慢性炎症反应,降低铝的免疫毒性。而Oner等[25]的研究表明,偏硅酸钠具有免疫刺激作用,并可充当有效的线粒体激活剂;饲粮中添加偏硅酸钠,可以通过提高线粒体氧的利用来激活氨的形成。这些发现进一步表明硅酸钠可能具有免疫刺激及抗炎作用。
2.3 硅对动物抗氧化功能的影响动物体内存在着氧化系统与抗氧化系统,在机体健康情况下,体内氧化系统与抗氧化系统处于相对平衡状态,共同维持机体健康,但是在受到外界环境过冷、过热、断奶应激等不良影响,导致动物体内氧化系统与抗氧化系统失衡时,会产生氧化应激。在氧化应激状态下,大量的自由基在细胞内蓄积,造成生物膜损伤,破坏细胞完整性,影响免疫功能和酶的活性,导致多种疾病的发生,近年来的研究发现硅具有抗氧化活性。
2.3.1 硅对高脂饮食氧化应激保护机理饲喂高饱和脂肪酸/高胆固醇饮食的动物,其中的胆固醇和胆酸盐可引起机体脂肪变性、炎症和氧化应激。目前认为硅对高脂饮食或高胆固醇引起的氧化应激保护机制主要有2个方面:一是通过降低血脂,减少脂质氧化引起的氧化损伤来达到抗氧化作用。Garcimartín等[26]研究发现,在饲喂高胆固醇重组猪肉(restructured pork,RP)的老年大鼠饮食中添加硅,有助于老年大鼠的极低密度脂蛋白(very low density lipoprotein,VLDL)组成正常化并减少VLDL氧化,降低高胆固醇饮食带来的负面影响,表明硅可以降胆固醇和血脂,减少脂质氧化。二是通过影响抗氧化酶的活性来达到抗氧化作用。Vidé等[27]研究表明,给饲喂高脂饮食的仓鼠补充硅,可增强超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的活性。Santos-López等[28]研究表明,在高胆固醇饮食中添加硅,提高了大鼠肝脏的SOD活性,并且增加了肝脏锰超氧化物歧化酶(Mn-SOD)和铜锌超氧化物歧化酶(CuZn-SOD)表达量,减少了大鼠肝脏的氧化损伤,其作用效果优于强抗氧化剂羟基酪醇。
核转录因子红细胞系相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)抗氧化反应元件(antioxidant response element,ARE)信号通路参与调控多种抗氧化基因的表达,进而平衡机体内氧化还原体系,维持细胞正常生命活动。Nrf2是细胞氧化还原稳态的关键成分,参与机体抗氧化应激。Suh等[29]研究表明,在正常情况下,Nrf2通路抗氧化过程的激活与谷胱甘肽(glutathione,GSH)的合成、脂质代谢以及炎症抑制有关。Yates等[30]研究表明,Nrf2的激活可以抑制参与脂肪酸合成关键酶的表达,并降低肝脏内脂质含量;Nrf2通过抑制脂肪生成和促进脂肪酸氧化来保护肝脏免受脂肪变性的影响。Santos-López等[28]研究表明,硅可通过促进Nrf2的活化、增加Nrf2的表达来参与高胆固醇/高脂饮食和衰老引起的氧化应激反应,并且Nrf2与SOD、过氧化氢酶(catalase,CAT)之间存在显著的正相关。硅还可通过激活的Nrf2激发Ⅱ相解毒酶的表达,从而为机体提供额外的抗氧化保护作用。Vidé等[17]研究表明,在高脂饮食的仓鼠饲粮中添加SES可以降低仓鼠血脂的产生,还可通过降低其心脏和肝脏的烟酰胺腺嘌呤二核苷酸磷酸氧化酶活性,并且保持SOD和GPx的活性来防止氧化应激,表明SES具有预防高脂饮食引起的氧化应激作用。这些研究结果均表明,硅通过降低血脂的产生,调节抗氧化酶的表达来达到抗氧化应激的作用。
2.3.2 硅对ROS氧化应激保护机理ROS包括过氧化物(O22-)、超氧化物(O2-)、羟自由基(·OH)等。正常情况下,ROS是动物机体内的正常代谢产物,在细胞信号传导中具有重要作用。当机体受到各种氧化应激时,ROS产生超过正常水平会严重损伤细胞结构和功能。H2O2是机体ROS的一种,可引起脂质过氧化,导致乳酸脱氢酶(lactate dehydrogenase,LDH)释放,诱导细胞凋亡;H2O2还可以诱导神经细胞氧化应激,导致细胞死亡(图 1)。Garcimartín等[31-32]在对人类神经母细胞瘤SH-SY5Y细胞进行研究时发现,添加50~500 ng/mL硅处理过的SH-SY5Y细胞,可以在很大程度上降低H2O2诱导的LDH释放,去除ROS,从而增加细胞存活率,减轻H2O2诱导的神经毒性,表明硅可以保护SH-SY5Y细胞免受H2O2介导的氧化应激的影响。
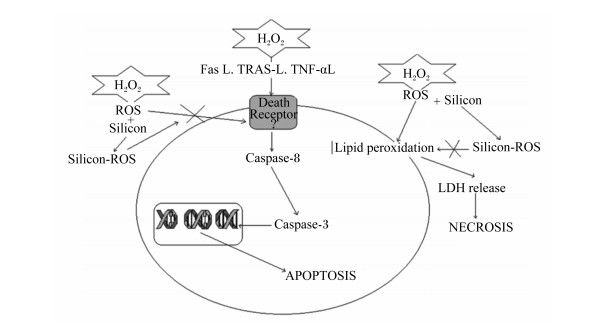
|
H2O2: 过氧化氢hydrogen peroxide;ROS:活性氧reactive oxygen species;Silicon: 硅; Fas L: 自杀相关因子配体factor associated suicide ligand;TRAS-L: 肿瘤坏死因子相关凋亡诱导配体tumor necrosis factor-related apoptosis ligand;TNF-αL: 肿瘤坏死因子-α配体tumor necrosis factor-α ligand;Death Receptor: 死亡受体;Lipid peroxidation: 脂质过氧化物; LDH: 乳酸脱氢酶lactate dehydrogenase; release: 释放; NECROSIS: 坏死; Caspase-8:半胱氨酸蛋白酶-8 cysteine-aspartic acid specific protease-8;Caspase-3:半胱氨酸蛋白酶-3 cysteine-aspartic acid specific protease-3;APOPTOSIS: 凋亡。 图 1 H2O2诱导细胞损伤和硅的神经保护机制 Fig. 1 Cellular damage induced by H2O2 and neuroprotection mechanism of Si[31] |
铝是一种常见的金属材料,在日常生活中被广泛使用。铝除了具有公认的生理作用外,还可对动物机体产生不利影响。铝具有神经毒性,在大脑累积可引发大脑的氧化损伤,铝可通过血脑屏障,与帕金森氏病、阿尔茨海默氏病的形成有关[33]。铝在机体其他器官组织积累,也会导致脂质过氧化,DNA损伤引发氧化应激和炎症[24]。目前认为硅主要通过调节与铝相关的抗氧化酶的活性、减少消化道对铝的吸收、促进铝的排泄来减轻铝的毒性。Kobayashi等[34]发现,在6-羟基多巴胺诱发的半帕金森氏病小鼠模型中,使用硅基药物进行治疗可减轻小鼠的多巴胺能神经元变性,并防止运动平衡和协调能力受损。Gonzalez-Muñoz等[35]研究表明,硅酸可诱导与铝相关的内源性抗氧化酶的表达下调并使TNF-α mRNA表达正常化。硅还可以降低铝的生物利用度,从而减少铝的神经毒性。人和小鼠食用适量的啤酒和原硅酸,可以减少消化道对铝的吸收,并减少铝在大脑中的积累[35-36]。Davenward等[37]研究表明,饮用富含硅的矿泉水,可以通过促进尿液铝的排泄来减轻阿尔茨海默氏症患者身体的铝负担。Noremberg等[33]研究发现,通过腹膜内施用与胃肠内营养相似浓度的硅,可以减少长期暴露于铝引起的大鼠脑中与氧化应激有关的脂质过氧化物(lipid peroxidation,LPO)含量的升高带来的有害作用;同时,硅还可降低硫代巴比妥酸反应物质(thiobarbituric acid reactive substances,TBARS)含量,表明硅对铝诱导的氧化应激引起的细胞损伤具有保护作用。
3 动物对硅的吸收与代谢 3.1 硅的吸收尽管外界环境和食物中存在大量的硅,但是多数含硅复合物不易溶于水,生物利用度低。过去认为人类对硅的需求量为5~25 mg/d;有文献报道,在美国硅摄入量为每天20~50 mg/d,在芬兰每日平均摄入硅29 mg/d,英国则是20~50 mg/d[38]。但是,对动物目前尚无确切的每日硅建议需要量。
3.2 硅的代谢从饮食中摄入的硅可被吸收并进入血液,硅吸收进入血液后,会迅速转移到组织和细胞中,参与代谢或被机体储存[39]。血液中的硅浓度保持相对恒定,在10~50 μmol/L[40]。在血液之外,原硅酸主要与糖胺聚糖结合,在主动脉、气管、肌腱、骨骼和皮肤中含量特别丰富,但是在肝脏、肾脏等器官含量较低。从饮食中摄取的硅除了部分被机体吸收外,可经粪便和尿液排泄,硅的尿排泄量随硅摄入量的增加而增加,但达到最大值后将不随硅摄入量的增加而增加[2]。Pruksa等[41]研究表明,被吸收的硅在24 h后大约96.3%随粪便和尿液排出,其中约有57%经尿液排出,约39.3%经粪便排出。Marcowycz等[42]研究表明,与对照组相比,健康受试者摄入原硅酸-香兰素(orthosilicic acid-vanillin,OSA-VC)后,6 h内尿硅排泄量显著增加,并且摄入的硅大约有21%从尿液中排出。
硅的运输由硅转运蛋白(silicon transporter,SIT)介导,包含硅摄入蛋白和硅外排蛋白。硅转运蛋白最早是在硅藻中被发现,其存在于多种硅藻、鞭毛藻中,后来在植物中也发现了硅转运蛋白,它们属于水通道蛋白,分别为负责将硅转运到细胞内的摄入蛋白(如Lsi1、Lsi6)和将硅转运到细胞外的外排蛋白(如Lsi2)[43]。但是,目前对于脊椎动物的硅转运蛋白研究较少。Alexandre[40]首次发现了人类的甘油水通道蛋白(aquaglycer-oporins,AQP)家族的AQP3、AQP7、AQP9和AQP10,可以在非洲爪蟾卵母细胞和HEK-293细胞中充当硅转运蛋白,将硅转运到细胞内。而Ratcliffe等[43]发现了动物的硅外排转运蛋白Slc34a2(也称为NaPiⅡb)是一种磷酸钠共转运蛋白,该蛋白在慢性硅缺乏饮食的大鼠肾脏中表达上调。当该蛋白在非洲爪蟾卵母细胞中异源表达时,硅的外排活性被诱导,其表达量与植物硅转运蛋白Lsi2相似。硅外排转运蛋白Slc34a2与植物、硅藻中的硅转运蛋白基因序列没有相似性,但却与植物硅外排蛋白有很高的结构相似性。Carpentier等[44]则首次对哺乳动物AQP选择性硅转运蛋白相关残基的结构-功能进行了分析,结果表明,AQP1的XX/R过滤器由残基F56-H180组成,而AQP10中的XX/R过滤器由残基G62-G202组成,当将AQP1通过FH→GG进行置换突变时,硅运输能力增强,而当将AQP10进行GG→FH置换突变时,则失去了硅的运输能力。
4 小结综上所述,硅具有促进动物骨骼生长发育、维持皮肤与头发弹性,影响心血管健康、伤口愈合,参与免疫调节和抗氧化等多种生物学作用。目前对硅在动物免疫调节和抗氧化应激作用机制方面的研究还存在一些不足,硅对机体免疫功能调控和抗氧化相关分子机理研究相对较少;此外,对硅在动物体内的转运及调控方面研究不多,除了已经发现的2种硅转运蛋白,是否还存在其他的硅转运蛋白还不是很清楚,这些方面都有待进一步研究,为实际应用硅营养促进动物健康生长提供理论依据。
| [1] |
CANDY J M, EDARDSON J A, KLINOWSKI J, et al. Co-localization of aluminium and silicon in senile plaques: implications for the neurochemical pathology of Alzheimer's disease[M]//TRABER J, GISPEN W H. Senile dementia of the alzheimer type. Heidelberg: Springer, 1985: 183-197.
|
| [2] |
JURKIĆ L M, CEPANEC I, PAVELIĆ S K, et al. Biological and therapeutic effects of ortho-silicic acid and some ortho-silicic acid-releasing compounds: new perspectives for therapy[J]. Nutrition & Metabolism, 2013, 10(1): 2. |
| [3] |
JUGDAOHSINGH R. Silicon and bone health[J]. The Journal of Nutrition, Health & Aging, 2007, 11(2): 99-110. |
| [4] |
MARTIN K R. The chemistry of silica and its potential health benefits[J]. The Journal of Nutrition, Health & Aging, 2007, 11(2): 94-97. |
| [5] |
POWELL J J, MCNAUGHTON S A, JUGDAOHSINGH R, et al. A provisional database for the silicon content of foods in the United Kingdom[J]. British Journal of Nutrition, 2005, 94(5): 804-812. DOI:10.1079/BJN20051542 |
| [6] |
JUGDAOHSINGH R, ANDERSON S H C, TUCKER K L, et al. Dietary silicon intake and absorption[J]. American Journal of Clinical Nutrition, 2002, 75(5): 887-893. DOI:10.1093/ajcn/75.5.887 |
| [7] |
JUGDAOHSINGH R, WATSON A I E, BHATTACHARYA P, et al. Positive association between serum silicon levels and bone mineral density in female rats following oral silicon supplementation with monomethylsilanetriol[J]. Osteoporosis International, 2015, 26(4): 1405-1415. DOI:10.1007/s00198-014-3016-7 |
| [8] |
ARORA M, ARORA E. The promise of silicon: bone regeneration and increased bone density[J]. Journal of Arthroscopy and Joint Surgery, 2017, 4(3): 103-105. DOI:10.1016/j.jajs.2017.10.003 |
| [9] |
SEABORN C D, NIELSEN F H. Dietary silicon and arginine affect mineral element composition of rat femur and vertebra[J]. Biological Trace Element Research, 2002, 89(3): 239-250. DOI:10.1385/BTER:89:3:239 |
| [10] |
SCHOLEY D V, BELTON D J, BURTON E J, et al. Bioavailability of a novel form of silicon supplement[J]. Scientific Reports, 2018, 8: 17022. DOI:10.1038/s41598-018-35292-9 |
| [11] |
SGAVIOLI S, DE FARIA DOMINGUES C H, CASTIBLANCO D M C, et al. Silicon in broiler drinking water promotes bone development in broiler chickens[J]. British Poultry Science, 2016, 57(5): 693-698. |
| [12] |
NIELSEN B D, POTTER G D, MORRIS E L, et al. Training distance to failure in young racing quarter horses fed sodium zeolite A[J]. Journal of Equine Veterinary Science, 1993, 13(10): 562-567. DOI:10.1016/S0737-0806(06)81526-1 |
| [13] |
FREY K S, POTTER G D, ODOM T W, et al. Plasma silicon and radiographic bone density in weanling quarter horses fed sodium zeolite A[J]. Journal of Equine Veterinary Science, 1992, 12(5): 292-296. DOI:10.1016/S0737-0806(06)81335-3 |
| [14] |
董盟. 原硅酸通过BMP-2/Smad/RUNX2信号通路促进成骨细胞分化的机制研究[D]. 硕士学位论文. 济南: 山东大学, 2016. DONG M. Mechanism research in orthosilicic acid promoting osteogenic differentiation through BMP-2/Smad/RUNX2 signaling pathway[D]. Master's Thesis. Jinan: Shandong University, 2016. (in Chinese) |
| [15] |
DONG M, JIAO G J, LIU H C, et al. Biological silicon stimulates collagen type 1 and osteocalcin synthesis in human osteoblast-like cells through the BMP-2/Smad/RUNX2 signaling pathway[J]. Biological Trace Element Research, 2016, 173(2): 306-315. DOI:10.1007/s12011-016-0686-3 |
| [16] |
PÉREZ-GRANADOS A M, VAQUERO M P. Silicon, aluminium, arsenic and lithium: essentiality and human health implications[J]. The Journal of Nutrition, Health & Aging, 2002, 6(2): 154-162. |
| [17] |
VIDÉ J, VIRSOLVY A, ROMAIN C, et al. Dietary silicon-enriched spirulina improves early atherosclerosis markers in hamsters on a high-fat diet[J]. Nutrition, 2015, 31(9): 1148-1154. DOI:10.1016/j.nut.2015.03.014 |
| [18] |
BAREL A, CALOMME M, TIMCHENKO A, et al. Effect of oral intake of choline-stabilized orthosilicic acid on skin, nails and hair in women with photodamaged skin[J]. Archives of Dermatological Research, 2005, 297(4): 147-153. DOI:10.1007/s00403-005-0584-6 |
| [19] |
WICKETT R R, KOSSMANN E, BAREL A, et al. Effect of oral intake of choline-stabilized orthosilicic acid on hair tensile strength and morphology in women with fine hair[J]. Archives of Dermatological Research, 2007, 299(10): 499-505. DOI:10.1007/s00403-007-0796-z |
| [20] |
ANTONINI J M, ROBERTS J R, YANG H M, et al. Effect of silica inhalation on the pulmonary clearance of a bacterial pathogen in Fischer 344 rats[J]. Lung, 2000, 178(6): 341-350. DOI:10.1007/s004080000038 |
| [21] |
ANTONINI J M, YANG H M, MA J Y, et al. Subchronic silica exposure enhances respiratory defense mechanisms and the pulmonary clearance of Listeria monocytogenes in rats[J]. Inhalation Toxicology, 2000, 12(11): 1017-1036. DOI:10.1080/08958370050164635 |
| [22] |
KOO H, RYU S H, AHN H J, et al. Immunostimulatory effects of the anionic alkali mineral complex Barodon on equine lymphocytes[J]. Clinical and Vaccine Immunology, 2006, 13(11): 1255-1266. DOI:10.1128/CVI.00150-06 |
| [23] |
YOO B W, CHOI S I, KIM S H, et al. Immunostimulatory effects of anionic alkali mineral complex solution Barodon in porcine lymphocytes[J]. Journal of Veterinary Science, 2001, 2(1): 15-24. DOI:10.4142/jvs.2001.2.1.15 |
| [24] |
RADOVANOVIC Z, DJINDJIC B, DZOPALIC T, et al. Effect of silicon-rich water intake on the systemic and peritoneal inflammation of rats with chronic low levels of aluminum ingestion[J]. Journal of Trace Elements in Medicine and Biology, 2018, 46: 96-102. DOI:10.1016/j.jtemb.2017.12.001 |
| [25] |
ONER G, CIRRIK S, BAKAN O. Effects of silica on mitochondrial functions of the proximal tubule cells in rats[J]. Kidney & Blood Pressure Research, 2005, 28(4): 203-210. |
| [26] |
GARCIMARTÍN A, SANTOS-LÓPEZ J A, BASTIDA S, et al. Silicon-enriched restructured pork affects the lipoprotein profile, VLDL oxidation, and LDL receptor gene expression in aged rats fed an atherogenic diet[J]. The Journal of Nutrition, 2015, 145(9): 2039-2045. DOI:10.3945/jn.115.213934 |
| [27] |
VIDÉ J, VIRSOLVY A, ROMAIN C, et al. Dietary silicon-enriched spirulina improves early atherosclerosis markers in hamsters on a high-fat diet[J]. Nutrition, 2015, 31(9): 1148-1154. DOI:10.1016/j.nut.2015.03.014 |
| [28] |
SANTOS-LÓPEZ J A, GARCIMARTÍN A, MERINO P, et al. Effects of silicon vs. hydroxytyrosol-enriched restructured pork on liver oxidation status of aged rats fed high-saturated/high-cholesterol diets[J]. PLoS One, 2016, 11(1): e0147469. DOI:10.1371/journal.pone.0147469 |
| [29] |
SUH J H, SHENVI S V, DIXON B M, et al. Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(10): 3381-3386. DOI:10.1073/pnas.0400282101 |
| [30] |
YATES M S, TRAN Q T, DOLAN P M, et al. Genetic versus chemoprotective activation of Nrf2 signaling: overlapping yet distinct gene expression profiles between Keap1 knockout and triterpenoid-treated mice[J]. Carcinogenesis, 2009, 30(6): 1024-1031. DOI:10.1093/carcin/bgp100 |
| [31] |
GARCIMARTÍN A, MERINO J J, SANTOS-LÓPEZ J A, et al. Silicon as neuroprotector or neurotoxic in the human neuroblastoma SH-SY5Y cell line[J]. Chemosphere, 2015, 135: 217-224. DOI:10.1016/j.chemosphere.2015.04.060 |
| [32] |
GARCIMARTÍN A, MERINO J J, GONZÁLEZ M P, et al. Organic silicon protects human neuroblastoma SH-SY5Y cells against hydrogen peroxide effects[J]. BMC Complementary and Alternative Medicine, 2014, 14: 384. DOI:10.1186/1472-6882-14-384 |
| [33] |
NOREMBERG S, BOHRER D, SCHETINGER M R C, et al. Silicon reverses lipid peroxidation but not acetylcholinesterase activity induced by long-term exposure to low aluminum levels in rat brain regions[J]. Biological Trace Element Research, 2016, 169(1): 77-85. DOI:10.1007/s12011-015-0392-6 |
| [34] |
KOBAYASHI Y, IMAMURA R, KOYAMA Y, et al. Renoprotective and neuroprotective effects of enteric hydrogen generation from Si-based agent[J]. Scientific Reports, 2020, 10: 5859. DOI:10.1038/s41598-020-62755-9 |
| [35] |
GONZALEZ-MUÑOZ M J, MESEGUER I, SANCHEZ-REUS M I, et al. Beer consumption reduces cerebral oxidation caused by aluminum toxicity by normalizing gene expression of tumor necrotic factor alpha and several antioxidant enzymes[J]. Food and Chemical Toxicology, 2008, 46(3): 1111-1118. DOI:10.1016/j.fct.2007.11.006 |
| [36] |
EDWARDSON J A, MOORE P B, FERRIER I N, et al. Effect of silicon on gastrointestinal absorption of aluminum[J]. Lancet, 1993, 342(8865): 211-212. DOI:10.1016/0140-6736(93)92301-9 |
| [37] |
DAVENWARD S, BENTHAM P, WRIGHT J, et al. Silicon-rich mineral water as a non-invasive test of the 'aluminum hypothesis' in Alzheimer's disease[J]. Journal of Alzheimers Disease, 2013, 33(2): 423-430. |
| [38] |
NIELSEN F H. Micronutrients in parenteral nutrition: boron, silicon, and fluoride[J]. Gastroenterology, 2009, 137(Suppl.5): S55-S60. |
| [39] |
JUGDAOHSINGH R, HUI M O, ANDERSON S H, et al. The silicon supplement 'monomethylsilanetriol' is safe and increases the body pool of silicon in healthy pre-menopausal women[J]. Nutrition & Metabolism, 2013, 10(1): 37. |
| [40] |
GARNEAU A P, CARPENTIER G A, MARCOUX A A, et al. Aquaporins mediate silicon transport in humans[J]. PLoS One, 2015, 10(8): e0136149. DOI:10.1371/journal.pone.0136149 |
| [41] |
PRUKSA S, SIRIPINYANOND A, POWELL J J, et al. Silicon balance in human volunteers; a pilot study to establish the variance in silicon excretion versus intake[J]. Nutrition & Metabolism, 2014, 11(1): 4. |
| [42] |
MARCOWYCZ A, HOUSEZ B, MAUDET C, et al. Digestive absorption of silicon, supplemented as orthosilicic acid-vanillin complex[J]. Molecular Nutrition & Food Research, 2015, 59(8): 1584-1589. |
| [43] |
RATCLIFFE S, JUGDAOHSINGH R, VIVANCOS J, et al. Identification of a mammalian silicon transporter[J]. American Journal of Physiology: Cell Physiology, 2017, 312(5): C550-C561. DOI:10.1152/ajpcell.00219.2015 |
| [44] |
CARPENTIER G A, GARNEAU A P, MARCOUX A A, et al. Identification of key residues involved in Si transport by the aquaglyceroporins[J]. Journal of General Physiology, 2016, 148(3): 239-251. DOI:10.1085/jgp.201611598 |




