昆虫种类繁多、形态各异,属于无脊椎动物中的节肢动物,是地球上数量最多的动物群体。昆虫抗菌肽(antimicrobial peptides,AMPs)是昆虫体内经诱导而产生的一类小分子碱性多肽物质,是昆虫先天免疫的重要效应分子,它具有不易形成耐药性、广谱抗菌、分子质量小等特点,并且对病毒、细菌、真菌、癌细胞具有杀伤作用。AMPs是由较少氨基酸组成的小分子,其氨基酸由12~50个氨基酸残基组成,通常具有正净电荷[1]。AMPs是先天免疫的重要效应分子,参与昆虫机体内的一些防御过程,如中和内毒素、调节免疫反应、杀死病原体。第1个昆虫AMPs是在1980年从惜古比蚕蛾(Hyalophora cecropia)的蛹中分离出来的,之后人们在细菌、真菌、植物和动物中发现了大量AMPs[2]。大多数昆虫AMPs是带有阳离子的分子,具有抗细菌活性的碱性残基。根据氨基酸序列和结构,AMPs可分为4类:半胱氨酸多肽、甘氨酸多肽、脯氨酸多肽和α-螺旋多肽。
在过去的数十年里,由于昆虫基因组、转录组和蛋白质组数据的发表,鉴定出的昆虫AMPs数量在增加。发现AMPs会因昆虫的体液免疫反应产生,这些AMPs在微生物感染后释放到昆虫血淋巴。从昆虫幼虫体中提取的血淋巴,通过组学分析法和质谱法对其进行分析,可分析出昆虫血淋巴中分离的AMPs数量以及抗菌活性[3-4]。昆虫AMPs具有广泛的抗菌、抗病毒、抗真菌和抗癌活性。因此,昆虫AMPs的发现以及多方面的应用研究具有巨大的发展空间。
1 昆虫AMPs的分类与活性 1.1 半胱氨酸AMPs防御素(defensin)属于半胱氨酸AMPs,是一类短阳离子肽,含34~51个氨基酸残基,含有6个保守的半胱氨酸,形成3个分子内二硫键,由于存在碱性氨基酸,特别是精氨酸具有抗菌活性。在大多数昆虫中,包括白蛉(Phlebotomus duboscqi)、熊蜂(Bombus pascuorum)、红头丽蝇(Calliphoravicina)、始红蝽(Pyrrhocorisapterus)、椰蛀犀金龟(Oryctes rhinoceros)等发现此类AMPs。昆虫防御素对革兰氏阳性(G+)菌和革兰氏阴性(G-)菌具有抗菌活性。铜绿丽金龟(Anomalacuprea)的防御素A和防御素B也是一种半胱氨酸AMPs,其中防御素B对G+菌和G-菌均有效,而防御素A只对G+菌有效[5]。
1.2 α-螺旋AMPs天蚕素(cecropins,Cec)属于α-螺旋AMPs,是昆虫中数量最多的线性α-螺旋AMPs,由58~79个氨基酸组成,主要对G-菌有活性,其次对G+菌有活性。天蚕素对G-菌的活性比在蟾蜍和哺乳动物分离出的马盖宁(magainins)要高10倍,而且多数天蚕素都经过C-末端的酰胺化这种翻译后的修饰,可提高它们的抗菌活性[6]。圆二色谱分析表明,天蚕素在水溶液中呈无规则卷曲结构,在作用微生物膜时,呈α-螺旋结构有利于插入细胞膜[7]。Cec A在家蚕体内外均可以抑制球孢白僵菌的增殖,这表明Cec A对球孢白僵菌具有较好的抗真菌活性[8]。
1.3 甘氨酸AMPs攻击素(attacins)属于甘氨酸AMPs,是由蛋白原前体产生的,这个蛋白原前体有1个信号肽、1个前肽、1个N端的攻击素结构域和2个甘氨酸结构域(G1和G2结构域),它们可分为2类: 酸性攻击素(攻击素E和F)和碱性攻击素(攻击素A~D)[9]。在鳞翅目和双翅目昆虫中都发现了攻击素,主要抗G-菌,特别是大肠杆菌,但对一些G+菌也有活性[10]。例如,甜菜夜蛾(Spodoptera exigua)的攻击素肽对G-大肠杆菌和菊苣假单胞菌有活性,但对G+枯草芽孢杆菌和单核细胞增生性李斯特菌也有活性[11]。
葛佬素(gloverins)是鳞翅目昆虫中发现的富含甘氨酸的多肽,是碱性分子,在水溶液中呈随机卷曲结构,在疏水环境中呈α-螺旋结构;葛佬素主要对G-菌具有活性特别是大肠杆菌,但其中一些对G+菌、真菌和病毒也显示出抗菌活性[12]。猎蝽素(prolixicin)是从长红猎蝽(Rhodnius Prolixus)中分离得到的一种多肽,其N端有1个信号肽,C端有1个富含甘氨酸的G结构域,在细菌感染血淋巴后由中肠组织释放[13]。
1.4 脯氨酸AMPsLebocins是家蚕淋巴中分离得到的富含脯氨酸的多肽, 对G+菌和G-菌以及一些真菌都有抗性作用,经O-糖基化后对不动杆菌以及大肠杆菌具有活性[14]。由26个氨基酸组成的Metchnikowin在黑腹果蝇中分离鉴定,是一种富含脯氨酸的免疫诱导线性肽,对G-菌无抗性,而对G+菌和真菌具有抗性。Metchnikowin可以抑制线粒体中复合体Ⅱ琥珀酸-Q还原酶的铁硫蛋白,也会抑制β(1,3)-葡萄糖基转移酶,干扰真菌细胞壁的合成,因为β(1,3)-葡萄糖基转移酶负责细胞壁β(1,3)-葡萄糖链的延伸[15]。
2 昆虫AMPs的活性机制 2.1 昆虫AMPs的免疫机制通过识别受体,检测到外来微生物后,一些信号分子被激活。其中主要的途径是免疫缺陷(IMD)、Janus激酶信号传导和转录激活因子(JAK-STAT)和Toll途径,黑腹果蝇的体液免疫反应主要受Toll和IMD途径控制,导致AMPs的产生。
2.1.1 Toll信号通路途径在昆虫中,G+菌和真菌的抗原主要激活Toll通路(图 1-A)。在G+菌感染的情况下,通过肽聚糖识别蛋白SA, SD(PGRP-SA, SD)、G-菌结合蛋白1(GNBP1)激活Toll;而在真菌感染的情况下,Toll的激活是由G-菌结合蛋白3(GNBP3)介导的触发丝氨酸蛋白酶级联反应,神经生长因子同源物(Spätzle)的非活性区域被丝氨酸蛋白酶级联反应剪切而被激活,Spätzle在神经生长因子同源物激活酶(SPE)作用下活化[16]。活化的Spätzle与Toll受体结合时,激活Toll信号,随后胞质内Toll的白细胞介素受体结构域开始二聚化,然后与蛋白髓样分化初级反应基因88结合[17]。这个复合物再与接头蛋白Tube结合,从而促进蛋白激酶(PELLE)进行自动磷酸化和核转录因子-κB(NF-κB)抑制蛋白(cactus)的磷酸化和降解,然后NF-κB转录因子(DorsalL或Dif)被移位到细胞核中,它们在核内激活AMPs的转录[18]。
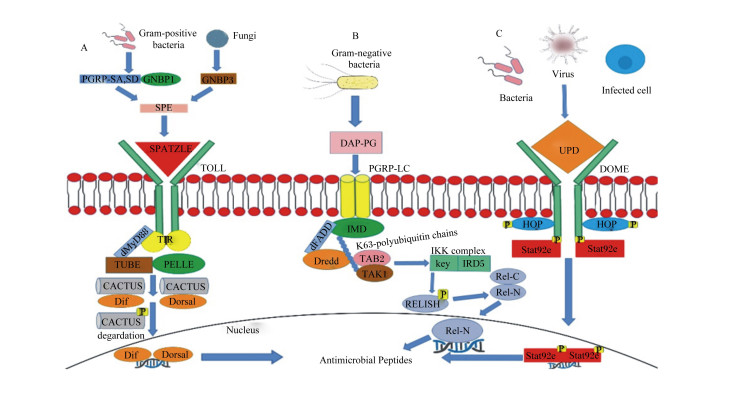
|
GNBP3:革兰氏阴性菌结合蛋白3 Gram-negative binding protein 3;GNBP1:革兰氏阴性菌结合蛋白1 Gram-negative binding protein 1;PGRP-SA, SD: 肽聚糖识别蛋白SA, SD peptidoglycan recognition protein-SA,SD;TIR: Toll的白细胞介素1受体Toll interleukin 1 receptor;dMyD88:果蝇骨髓分化初级反应蛋白同源物drosophila homologue of myeloid differentiation primary response protein;Tube : 含有死亡结构域接头蛋白contains death domain adaptor proteins;PELLE : 蛋白激酶protein kinase;DorsalL, Dif : NF-κB转录因子NF-κB transcription factor;Cactus : IκB(NF-κB抑制蛋白)同源物IκB (NF-κB inhibitor protein) homologue;DAP-PG: 二氨基庚二酸型肽聚糖diaminopimelic acid peptidoglycan;PGRP-LC: 肽聚糖识别蛋白LC peptidoglycan recognition protein LC;IMD: 免疫缺陷immune deficiency;dFADD: 含死亡结构域的Fas相关蛋白drosophila Fas-associated with death domain;Dredd: 半胱氨酸蛋白酶的同源物homologue of cysteine protease; K63-polyubiquitin chains: K63多聚泛素链;TAK1:生长因子β活化酶1 growth factor beta activase 1; TAB 2:生长因子β活化酶2 growth factor beta activase;IKK complex(IRD5, key): IKK(IκB kinase)复合体IKK (IκB kinase) complex; Relish: NF-κB转录因子NF-κB transcription factor;Upd: 不成对的细胞因子unpaired cytokines; HOP: 酪氨酸蛋白激酶tyrosine protein kinase; Stat92e: 信号转导和转录激活因子92e the signal transducer and activator of transcription at 92e。 图 1 Toll(A)、IMD(B)和JAK-STAT(C)信号通路示意图 Fig. 1 Schematic representation of Toll(A), IMD(B)and JAK-STAT(C)signaling pathways[22, 25] |
G-菌的感染信号使肽聚糖识别蛋白LC(PGRP-LC)受体与二氨基庚二酸型肽聚糖(DAP-PG)结合,IMD信号通路被激活(图 1-B)。IMD与含有死亡结构域Fas相关蛋白(dFADD)、半胱氨酸蛋白酶的同源物(DREDD)组成信号复合体,而DREDD被用来裂解IMD,K63泛素化裂解后的IMD,K63的多聚泛素链有助于IMD-dFADD-DREDD复合体与生长因子β活化酶(TAK1蛋白、TAB 2蛋白)连接起来,激活NF-κB抑制蛋白(IκB)激酶(IKK复合体),并可以降解IκB使NF-κB转录因子(Relish)磷酸化[19]。在Relish经过裂解和磷酸化之后,Relish的C端部分仍在细胞质中,活性N端部分转移到细胞核中,在那里它激活特定AMPs的转录[20]。
2.1.3 JAK-STAT信号通路途径在昆虫JAK-STAT中(图 1-C),在不成对的细胞因子(Upd)与其DOME(Domeless)受体结合后JAK被激活,Upd细胞因子诱导酪氨酸蛋白激酶(HOP,1个JAK分子)自身磷酸化以及DOME受体的细胞质部分酪氨酸残基发生磷酸化,受体上磷酸化的酪氨酸是STAT信号转导因子的识别和结合位点[21]。同时,单个信号转导和转录激活因子92e(Stat92e)与DOME受体上的磷酸化酪氨酸结合,并被HOP磷酸化[22]。酪氨酸磷酸化的stat92e从DOME受体上分离出来,形成二聚体并进入细胞核,在那里它们与其目标基因的启动子结合,诱导含有硫酯的蛋白基因和图兰朵基因的转录[23-24]。
2.2 昆虫AMPs的抗菌作用机制大多数昆虫AMPs带有正电荷,与细菌细胞表面的负电荷相互作用,分别为G-菌的脂多糖和G+菌的磷壁酸,静电吸引是多肽和细胞膜之间发生的第1个相互作用。AMPs引起细菌细胞膜去极化,这一过程导致细菌细胞膜的通透性增加,达到起始浓度后,可以诱导孔隙或通道的形成以及细胞死亡[26]。目前已经提出了几种模型机制来解释孔隙的形成。
2.2.1 环孔模型环孔模型是溶膜机制的一部分,环孔模型的特征是由多肽和脂类构成,多肽垂直排列。与桶板模型相似,在环形孔模型中,多肽垂直插入膜内形成孔隙,而肽的亲水区与脂头基团结合,肽的疏水区与膜脂的疏水核心结合[27]。因此,多肽和磷脂头部基团的亲水性区域形成裂口,随着脂质分子的倾斜,双层膜也向内弯曲,形成1个由脂头基团排列并被多肽覆盖的孔隙[28]。
2.2.2 桶板模型在桶板模型中多肽垂直插入磷脂双分子层,多肽的疏水区域与膜的疏水核心相结合,而亲水区域彼此相对,形成孔隙或通道,使外界水分子和离子等渗透入细胞内部,破坏细胞膜[27]。最初多肽与双层膜表面结合,通过构象改变,多肽的疏水区域与双层膜上的疏水成分相互作用进而插入到膜中。当达到一个阈值时,多肽通过亲水性氨基酸残基之间的相互作用进而更深地插入疏水膜核心中[29]。桶板模型有3个特征:1)肽在垂直方向上形成孔隙或通道;2)膜脂不镶嵌在孔隙的内部,并且与上面环孔模型相比,在孔隙形成过程中它们不会与多肽一起弯曲或倾斜;3)孔隙是动态结构且轮廓分明[30]。研究者观察到惜古比蚕蛾体内发现的天蚕素可形成1个桶板,它可以穿透细菌细胞膜,使其细胞内容物外泄导致细胞死亡[28]。在意大利蜜蜂毒液中被鉴定出来的蜂毒肽是1种26个残基的多肽毒素,它对几种细菌有很强的抗菌活性,它结合到细菌细胞膜表面导致孔隙形成,进而溶解细胞[31-32]。
2.2.3 地毯模型地毯模型既不需要特定的多肽结构,也不需要形成结构化的通道。在地毯模型中,多肽与膜结合,平行于磷脂双分子层表面,多肽覆盖了整个膜表面并且仅与脂头基团作用。这种作用破坏了磷脂的包装,并由于多肽对磷脂的置换而导致双层膜流动性的改变,因此细胞膜的稳定性受到干扰[33]。多肽的正电荷氨基酸沿非极性侧链扩散,而多肽的非极性侧链又与膜疏水核心结合,使多肽穿透膜的疏水核心、极性残基与磷脂结合从而形成通道破坏细胞膜[28]。即使多肽不与膜疏水核心结合,不插入膜疏水核心,当达到多肽阈值浓度时,双层膜也是会以类似分散的方式溶解,双层膜会破裂[27]。在低肽浓度时,天蚕素AMPs可在膜的特定部位形成通道或孔[34]。
2.2.4 其他此外,昆虫AMPs也可以通过非溶膜机制产生作用。AMPs可以靶向细菌的几种功能,包括核酸、蛋白质、酶和细胞壁的合成。AMPs干扰细菌几种生物合成途径的能力说明了对AMPs产生耐药性的难度[35]。Attacins通过与脂多糖结合而不穿过内膜或细胞质,阻止几种细菌外膜蛋白如OmpA、OmpC和OmpF的合成,从而抑制大肠杆菌的生长[36]。
3 提高昆虫AMPs的稳定性AMPs在血浆中的稳定性较低,会迅速被肝脏和肾脏清除。因此已开发出了不同的策略来提升AMPs的稳定性, 其中主要有D-氨基酸替换、N-末端氨基酸残基的修饰、环化等。
通过D-氨基酸(DAA)替换特定区域以及天然序列,有助于立体化学结构的部分或全部翻转,有助于增强多肽对蛋白酶的稳定性[37]。Jia等[38]将Polybia-CP天然序列用DAA进行部分和全部替换,发现Polybia-CP的对映异构体类似物和反转型类似物与天然序列的Polybia-CP具有相似的抗菌活性,对酶降解的稳定性也有所提高。因此,DAA的替换可以提高AMPs对蛋白酶降解的稳定性。然而,尽管可以防止蛋白酶降解,但已证明用DAA部分或全部替换是非常昂贵的[39]。
细菌和真核生物氨基酸的N端氨基酸可以甲基化。例如,N-甲基化氨基酸是环孢菌素A的结构特征,含有N-甲基化氨基酸的多肽对蛋白降解能力表现出更好的抗性,而且也具有更好的膜渗透能力[40]。Liu等[41]对蜂毒AMP anoplin的天然序列进行了修饰,从独居的蜘蛛蜂的毒囊中分离出最小的一种线性α-螺旋AMPs anoplin,将N-甲基化氨基酸选择特定的位置,并连接不同链长的脂肪酸。它们先采用单一和多个N-甲基氨基酸替换anoplin来提高肽对酶降解的抗性,再引入从C8到C14的脂肪酸来修饰N-末端,进而发现含C12/C14的N-甲基化脂肽对G-菌和G+菌均表现出较强的抗菌活性。
几个富含二硫键的多肽,如植物环肽或灵长类的θ防御素,显示出具有半胱氨酸的三维稳定结构[42-43]。半胱氨酸的侧链硫醇氧化后可以形成二硫键,而形成二硫键可以使AMPs更稳定。目前通过形成肽键、内酰胺键或二硫键都可以实现环化,进而提升AMPs的稳定性。可以引入一些构象来限制肽链弯曲;也可以环化修饰天然序列,使肽链具有刚性,难以发生弯曲。因此,刚性肽链的结构构象对蛋白酶水解具有一定抗性[44]。
4 小结昆虫缺乏适应性免疫,它们的生存依赖于广谱AMPs的产生,而广谱AMPs使它们能够创造强大的防御机制来对抗感染。事实上,由于它们吃的食物种类不同,以及它们生活的环境不同,昆虫在先天免疫中产生了各种各样的反应,而且昆虫的物种超过100万个,几乎是取之不尽用之不竭的生物活性化合物的来源。因此,昆虫AMPs的研发具有重要意义和巨大潜力。昆虫AMPs在食品领域是一大研发热点,虽可以作为饲料添加剂,但其纯度仍需进一步提高。一些细菌对抗生素产生了耐药性,因此需要寻找和开发新的抗菌药物,而昆虫AMPs因为具有抗微生物等多种生物学功能有着广阔的应用前景。但其研发和制备仍存在一些问题,抗菌活性还需不断优化并且其作用机理及应用效果有待更进一步研究。昆虫AMPs的不稳定性以及未知的药代动力学,使量产的可行性较低,而通过化学合成、基因工程等方法虽然能实现量产,但是高昂的成本也使AMPs研发受到了限制。随着昆虫AMPs的研究和开发不断地深入研究有望提高其产量,这将会对昆虫AMPs新用途的开发起到推动作用。
| [1] |
YI H Y, CHOWDHURY M, HUANG Y D, et al. Insect antimicrobial peptides and their applications[J]. Applied Microbiology and Biotechnology, 2014, 98(13): 5807-5822. DOI:10.1007/s00253-014-5792-6 |
| [2] |
苗璐, 武慧, 王晶, 等. 昆虫抗菌肽的生物信息学预测及分析[J]. 广东农业科学, 2014, 41(8): 181-184. MIAO L, WU H, WANG J, et al. Bioinformatics prediction and analysis of insect antimicrobial peptides[J]. Guangdong Agricultural Sciences, 2014, 41(8): 181-184 (in Chinese). DOI:10.3969/j.issn.1004-874X.2014.08.041 |
| [3] |
RÖHRICH C R, NGWA C J, WIESNER J, et al. Harmonine, a defence compound from the harlequin ladybird, inhibits mycobacterial growth and demonstrates multi-stage antimalarial activity[J]. Biology Letters, 2012, 8(2): 308-311. DOI:10.1098/rsbl.2011.0760 |
| [4] |
VILCINSKAS A. Evolutionary plasticity of insect immunity[J]. Journal of Insect Physiology, 2013, 59(2): 123-129. DOI:10.1016/j.jinsphys.2012.08.018 |
| [5] |
YAMAUCHI H. Two novel insect defensins from larvae of the cupreous chafer, Anomala cuprea: purification, amino acid sequences and antibacterial activity[J]. Insect Biochemistry and Molecular Biology, 2001, 32(1): 75-84. DOI:10.1016/S0965-1748(01)00082-0 |
| [6] |
TONK M, VILCINSKAS A, RAHNAMAEIAN M. Insect antimicrobial peptides: potential tools for the prevention of skin cancer[J]. Applied Microbiology and Biotechnology, 2016, 100(17): 7397-7405. DOI:10.1007/s00253-016-7718-y |
| [7] |
EFIMOVA S S, MEDVEDEV R Y, CHULKOV E G, et al. Regulation of the pore-forming activity of cecropin a by local anesthetics[J]. Cell and Tissue Biology, 2018, 12(4): 331-341. DOI:10.1134/S1990519X18040028 |
| [8] |
LU D D, GENG T, HOU C X, et al. Bombyx mori cecropin A has a high antifungal activity to entomopathogenic fungus Beauveria bassiana[J]. Gene, 2016, 583(1): 29-35. DOI:10.1016/j.gene.2016.02.045 |
| [9] |
HEDENGREN M, BORGE K, HULTMARK D. Expression and evolution of the Drosophila attacin/diptericin gene family[J]. Biochemical and Biophysical Research Communications, 2000, 279(2): 574-581. DOI:10.1006/bbrc.2000.3988 |
| [10] |
BUONOCORE F, FAUSTO A M, DELLA PELLE G, et al. Attacins: a promising class of insect antimicrobial peptides[J]. Antibiotics, 2021, 10(2): 212. DOI:10.3390/antibiotics10020212 |
| [11] |
BANG K, PARK S, YOO J Y, et al. Characterization and expression of attacin, an antibacterial protein-encoding gene, from the beet armyworm, Spodoptera exigua (Hübner) (Insecta: Lepidoptera: Noctuidae)[J]. Molecular Biology Reports, 2012, 39(5): 5151-5159. DOI:10.1007/s11033-011-1311-3 |
| [12] |
AXÉN A, CARLSSON A, ENGSTRÖM A, et al. Gloverin, an antibacterial protein from the immune hemolymph of Hyalophora pupae[J]. European Journal of Biochemistry, 1997, 247(2): 614-619. DOI:10.1111/j.1432-1033.1997.00614.x |
| [13] |
时红, 陈斌, 何正波. 东亚飞蝗prolixicin基因的克隆与表达分析[J]. 应用与环境生物学报, 2013, 19(2): 236-240. SHI H, CHEN B, HE Z B. Cloning and expression analysis of the prolixicin gene from Locusta migratoria manilensis (Meyen)[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(2): 236-240 (in Chinese). |
| [14] |
HARA S, YAMAKAWA M. A novel antibacterial peptide family isolated from the silkworm, Bombyx mori[J]. Biochemical Journal, 1995, 310(2): 651-656. DOI:10.1042/bj3100651 |
| [15] |
MOGHADDAM M B, GROSS T, BECKER A, et al. The selective antifungal activity of Drosophila melanogaster metchnikowin reflects the species-dependent inhibition of succinate-coenzyme Q reductase[J]. Scientific Reports, 2017, 7(1): 8192. DOI:10.1038/s41598-017-08407-x |
| [16] |
SHIA A K H, GLITTENBERG M, THOMPSON G, et al. Toll-dependent antimicrobial responses in Drosophila larval fat body require Spätzle secreted by haemocytes[J]. Journal of Cell Science, 2009, 122(24): 4505-4515. DOI:10.1242/jcs.049155 |
| [17] |
VALANNE S, WANG J H, RÄMET M. The drosophila toll signaling pathway[J]. Journal of Immunology, 2011, 186(2): 649-656. DOI:10.4049/jimmunol.1002302 |
| [18] |
IMLER J L, HOFFMANN J A. Toll receptors in drosophila: a family of molecules regulating development and immunity[J]. Current Topics in Microbiology and Immunology, 2002, 270: 63-79. |
| [19] |
LEULIER F, VIDAL S, SAIGO K, et al. Inducible expression of double-stranded RNA reveals a role for dFADD in the regulation of the antibacterial response in Drosophila adults[J]. Current Biology, 2002, 12(12): 996-1000. DOI:10.1016/S0960-9822(02)00873-4 |
| [20] |
ERTVRK-HASDEMIR D, BROEMER M, LEULIER F, et al. Two roles for the drosophila IKK complex in the activation of relish and the induction of antimicrobial peptide genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(24): 9779-9784. DOI:10.1073/pnas.0812022106 |
| [21] |
O'SHEA J J, PLENGE R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease[J]. Immunity, 2012, 36(4): 542-550. DOI:10.1016/j.immuni.2012.03.014 |
| [22] |
STOKES B A, YADAV S, SHOKAL U, et al. Bacterial and fungal pattern recognition receptors in homologous innate signaling pathways of insects and mammals[J]. Frontiers in Microbiology, 2015, 6: 19. |
| [23] |
KIU H, NICHOLSON S E. Biology and significance of the JAK/STAT signalling pathways[J]. Growth Factors, 2012, 30(2): 88-106. DOI:10.3109/08977194.2012.660936 |
| [24] |
SHOKAL U, ELEFTHERIANOS I. Evolution and function of thioester-containing proteins and the complement system in the innate immune response[J]. Frontiers in Immunology, 2017, 8: 759. DOI:10.3389/fimmu.2017.00759 |
| [25] |
HULTMARK D. Drosophila immunity: pathsandpatterns[J]. Current Opinion in Immunology, 2003, 15(1): 12-19. DOI:10.1016/S0952-7915(02)00005-5 |
| [26] |
ANDERSSON D I, HUGHES D, KUBICEK-SUTHERLAND J Z. Mechanisms and consequences of bacterial resistance to antimicrobial peptides[J]. Drug Resistance Updates, 2016, 26: 43-57. DOI:10.1016/j.drup.2016.04.002 |
| [27] |
GIULIANI A, PIRRI G, NICOLETTO S F. Antimicrobial peptides: an overview of a promising class of therapeutics[J]. Central European Journal of Biology, 2007, 2(1): 1-33. |
| [28] |
TRAVKOVA O G, MOEHWALD H, BREZESINSKI G. The interaction of antimicrobial peptides with membranes[J]. Advances in Colloid and Interface Science, 2017, 247: 521-532. DOI:10.1016/j.cis.2017.06.001 |
| [29] |
YEAMAN M R, YOUNT N Y. Mechanisms of antimicrobial peptide action and resistance[J]. Pharmacological Reviews, 2003, 55(1): 27-55. DOI:10.1124/pr.55.1.2 |
| [30] |
BROGDEN K A. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria?[J]. Nature Reviews Microbiology, 2005, 3(3): 238-250. DOI:10.1038/nrmicro1098 |
| [31] |
RADY I, SIDDIQUI I A, RADY M, et al. Melittin, a major peptide component of bee venom, and its conjugates in cancer therapy[J]. Cancer Letters, 2017, 402: 16-31. DOI:10.1016/j.canlet.2017.05.010 |
| [32] |
JAMASBI E, LUCKY S S, LI W Y, et al. Effect of dimerized melittin on gastric cancer cells and antibacterial activity[J]. Amino Acids, 2018, 50(8): 1101-1110. DOI:10.1007/s00726-018-2587-6 |
| [33] |
POWERS J P, HANCOCK R E W. The relationship between peptide structure and antibacterial activity[J]. Peptides, 2003, 24(11): 1681-1691. DOI:10.1016/j.peptides.2003.08.023 |
| [34] |
EFIMOVA S S, SCHAGINA L V, OSTROUMOVA O S. Channel-forming activity of cecropins in lipid bilayers: effect of agents modifying the membrane dipole potential[J]. Langmuir, 2014, 30(26): 7884-7892. DOI:10.1021/la501549v |
| [35] |
SIERRA J M, FUSTÉ E, RABANAL F, et al. An overview of antimicrobial peptides and the latest advances in their development[J]. Expert Opinion on Biological Therapy, 2017, 17(6): 663-676. DOI:10.1080/14712598.2017.1315402 |
| [36] |
CARLSSON A, ENGSTRÖM P, PALVA E T, et al. Attacin, an antibacterial protein from Hyalophora cecropia, inhibits synthesis of outer membrane proteins in Escherichia coli by interfering with omp gene transcription[J]. Infection and immunity, 1991, 59(9): 3040-3045. DOI:10.1128/iai.59.9.3040-3045.1991 |
| [37] |
EZZATI-TABRIZI R, FARROKHI N, TALAEI-HASSANLOUIR T, et al. Insect inducible antimicrobial peptides and their applications[J]. Current Protein and Peptide Science, 2013, 14(8): 698-710. |
| [38] |
JIA F J, WANG J Y, PENG J X, et al. D-amino acid substitution enhances the stability of antimicrobial peptide polybia-CP[J]. Acta Biochimica et Biophysica Sinica, 2017, 49(10): 916-925. DOI:10.1093/abbs/gmx091 |
| [39] |
FALANGA A, NIGRO E, DE BIASI M G, et al. Cyclic peptides as novel therapeutic microbicides: engineering of human defensin mimetics[J]. Molecules, 2017, 22(7): 1217. DOI:10.3390/molecules22071217 |
| [40] |
MINDT M, RISSE J M, GRUB H, et al. One-step process for production of N-methylated amino acids from sugars and methylamine using recombinant Corynebacterium glutamicum as biocatalyst[J]. Scientific Reports, 2018, 8(1): 12895. DOI:10.1038/s41598-018-31309-5 |
| [41] |
LIU T Q, ZHU N Y, ZHONG C, et al. Effect of N-methylated and fatty acid conjugation on analogs of antimicrobial peptide Anoplin[J]. European Journal of Pharmaceutical Sciences, 2020, 152: 105453. DOI:10.1016/j.ejps.2020.105453 |
| [42] |
OGUIS G K, GILDING E K, HUANG Y H, et al. Insecticidal diversity of butterfly pea (Clitoriaternatea) accessions[J]. Industrial Crops and Products, 2020, 112214. |
| [43] |
KOEHBACH J, CRAIK D J. The vast structural diversity of antimicrobial peptides[J]. Trends in Pharmacological Sciences, 2019, 40(7): 517-528. DOI:10.1016/j.tips.2019.04.012 |
| [44] |
WANG G S. Post-translational modifications of natural antimicrobial peptides and strategies for peptide engineering[J]. Current Biotechnology, 2012, 1(1): 72-79. DOI:10.2174/2211550111201010072 |




