2. 湖南畜禽安全生产协同创新中心, 长沙 410128
2. Hunan Collaborative Innovation Center of Animal Production Safety, Changsha 410128, China
微量元素硒对肉牛具有重要的生理功能,在体内发挥抗氧化、免疫、运输和调节激素合成等重要作用[1]。硒的合理利用可以起到增强肉牛抗病力,提升机体健康水平和生产性能的作用。新型微量元素的使用可以起到减量增效的作用,降低微量元素使用量,缓解环境压力[2]。微生态制剂具有提高动物生长性能、维持肠道菌群平衡、改善肉品质、增强抗病力等多种作用。微生态制剂作为绿色添加剂具有生态、高效、无公害和无残留等特点,已经成为当前研究的热点,在反刍动物与环境治理上应用越来越广泛。大量研究表明,硒和微生态制剂在生物学上具有相似的功能,均能提高畜禽的健康水平与生产力[3-6]。然而,硒与微生态制剂联用对肉牛营养物质消化率、瘤胃发酵及瘤胃微生物区系的影响却鲜有报道。因此,本研究旨在探究2种形式硒源和微生态制剂对育肥肉牛营养物质消化率、瘤胃发酵及瘤胃微生物区系的影响,从而为硒和微生态制剂联用产品的研究开发及其在我国肉牛生产中的应用提供一定的理论依据。
1 材料与方法 1.1 试验材料无机硒:亚硒酸钠,硒含量为1%。
有机硒:酵母硒,硒含量为0.2%。
微生态制剂:乳酸菌数量≥2×108 CFU/kg,酵母菌数量≥3×107 CFU/kg,为EM菌深度发酵产品。
1.2 试验设计采用2×2双因子随机试验设计,选取平均体重为(407.48±36.13) kg的健康新疆褐牛杂交牛24头,随机分为4组,每组6个重复,每个重复1头牛。在精料补充料中,A组添加0.68 mg/kg无机硒(亚硒酸钠);B组混合添加0.68 mg/kg无机硒(亚硒酸钠)和3%微生态制剂;C组添加0.68 mg/kg有机硒(酵母硒);D组混合添加0.68 mg/kg有机硒(酵母硒)和3%微生态制剂。预试期14 d,正试期37 d。
1.3 试验饲粮及饲养管理试验饲粮参照我国《肉牛饲养标准》(NY/T 815—2004)配制,精粗比为37 ∶ 63,试验饲粮组成及营养水平见表 1,试验用粗饲料营养水平见表 2。试验牛全部采用栓系饲喂,每日喂2次(09:00、16:00),试验期间精料补充料与粗饲料每天按组称量后按先粗后精的顺序饲喂,试验牛自由采食和饮水,圈舍保持干净卫生,每周消毒1次。精料补充料的饲喂量为肉牛体重的1%,每月根据体重调整1次饲喂量。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the experimental diet (DM basis) |
|
|
表 2 粗料的营养水平 Table 2 Nutrient levels of forages |
利用全收粪法于正试期第33天从每组中选取3头健康、体重相近的试验牛进行消化试验,采用集粪桶连续收集5 d的全部粪样,每12 h收集1次,称重后按总重量的10%取样,每100 g加入20 mL 10%硫酸进行固氮,将5 d的粪样混合好后置于-20 ℃冰箱保存。利用杨胜[8]介绍的饲料分析方法分别对饲粮和粪样中干物质(DM)、中性洗涤纤维(NDF)、粗蛋白质(CP)含量进行测定。各营养物质消化率计算公式如下:

|
于试验最后1 d每组选取健康、体重相近的3头牛进行瘤胃液的采集。每头牛采集饲后3 h的瘤胃液,采样前保证每头牛有充足的饮水,提前固定试验牛的活动。采样时,首先将每头牛的牛头进行固定,几个人同时合作,拉拽牛头向正前方,使牛的头部位置便于插管,使颈部向上伸直,然后,将清洗干净的不锈钢弹簧软管插入,经咽喉、食管放入瘤胃。确认位置后,用针筒抽拉抽取瘤胃液。从每头牛的瘤胃中抽取约100 mL的瘤胃液,瘤胃液采完后缓慢抽出采样管。采样时,对所有牛应尽量采用相同的插入手法和深度,在采集每头牛的瘤胃液样品后,用清水将采样管内、外部清洗干净,再采取下一头牛的瘤胃液。抽取出的瘤胃液应去出除浮沫,用酸度计直接测定pH(PHS-10便携式pH计),再用4层纱布过滤,滤去大块的食物残渣,装于冻存管中放入液氮,后-80 ℃保存。
瘤胃液氨态氮(NH3-N)浓度参照冯宗慈[9]的比色法测定。用日本岛津GC-2010Plus气相色谱仪测定瘤胃液挥发性脂肪酸浓度,色谱条件为:色谱柱选用DB-FFAP柱,规格为30 m×250 μm×0.25 μm;载气为高纯氮气(99.999%),流量0.8 mL/min;辅助气为高纯氢气(99.999%),火焰离子化检测器(FID)温度280 ℃,进样口温度250 ℃,分流比50 ∶ 1,进样量为1 μL;程序升温,初始温度60 ℃,以20 ℃/min速率升温至220 ℃,保持1 min。
1.4.3 瘤胃内微生物区系的测定将瘤胃液样品在干冰条件下送至上海美吉科技生物有限公司,采用Illumina MiSeq/NovaSeq平台对24个肉牛瘤胃液样本中细菌群落DNA片段进行16S rRNA基因的V3~V4区双端(paired-end)测序。从DNA提取到上机测序步骤:1)微生物组总DNA提取;2)目标片段PCR扩增;3)扩增产物磁珠纯化回收;4)扩增产物荧光定量;5)测序文库制备;6)上机进行高通量测序;7)结果分析,包括对高通量测序的原始下机数据根据序列质量进行初步筛查,对问题样本进行重测、补测,然后切除序列的引物片段,弃去未匹配引物的序列,进行质控、去噪、拼接、去嵌合体等步骤。使用DADA2质控后产生的每个去重的序列称为特征序列,即操作分类单元(OTU)代表序列,而这些序列在样本中的丰度表称为特征表(对应于OTU表)。进行生物信息学分析主要包括OTU聚类分析、Alpha多样性分析、微生物群落结构分析、菌群门和属相对丰度的分类学组成分析、Beta多样性分析等。
1.5 数据分析数据经Excel 2016进行初步整理后,用SPSS 26.0进行单因素方差分析(one-way ANOVA), 若差异显著,则采用Duncan氏法进行多重比较;进一步采用一般线性模型单变量双因素方差分析处理,分析硒源和微生态制剂2个主效应以及硒源与微生态制剂交互作用的影响。结果用平均值±标准差表示,以P < 0.05为差异显著,P < 0.01为差异极显著,0.05≤P < 0.10为差异有显著趋势。
2 结果与分析 2.1 硒源和微生态制剂对肉牛营养物质消化率的影响由表 3可知,各组之间DM、CP、NDF消化率差异均不显著(P>0.05),但从数值上看:C组的DM消化率最高,其次是B组,A组最低;C组的CP排出量最低,相较于A组、B组、D组分别降低22.58%、3.45%、24.32%,同时C组的CP消化率最高,A组最低;C组的NDF消化率最高,其次是B组,D组最低。硒源和微生态制剂以及二者的交互作用对肉牛DM、CP、NDF消化率均无显著影响(P>0.05)。
|
|
表 3 硒源和微生态制剂对肉牛营养物质消化率的影响 Table 3 Effects of selenium source and microecological agent on nutrient digestibility of beef cattle |
由表 4可知,各项瘤胃发酵参数在各组间差异不显著(P>0.05)。硒源除对瘤胃液乙酸/丙酸值的影响有显著的趋势(P=0.098)外,对其他瘤胃发酵参数均无显著影响(P>0.05),其中有机硒组的乙酸/丙酸值小于无机硒组。微生态制剂对瘤胃液氨态氮浓度的影响显著(P < 0.05)。综上可知,饲粮中添加不同硒源对肉牛各项瘤胃发酵参数均无显著影响,添加微生态制剂可以显著提高瘤胃液氨态氮浓度,硒源和微生态制剂的交互作用对各项瘤胃发酵参数无显著影响。
|
|
表 4 硒源和微生态制剂对肉牛瘤胃发酵参数的影响 Table 4 Effects of selenium source and microecological agent on rumen fermentation parameters of beef cattle |
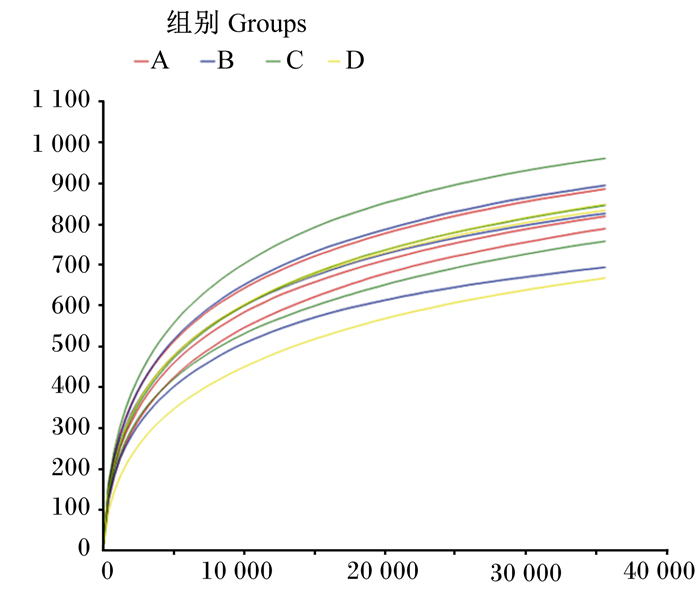
本试验检测了12个肉牛瘤胃液样本,共计得到590 636条有效序列和4 666个相似性大于97%的OTU,各组样本具体情况见表 5。稀疏曲线可以评估测序深度是否足以覆盖样本中所有物种,是生态学领域的一种常用方法,通过从每个样本中随机抽取一定数量的序列(即在不超过现有样本测序量的某个深度下进行重抽样),可以预测样本在一系列给定的测序深度下,所可能包含的物种总数及其中每个物种的相对丰度。稀疏曲线的平缓程度反映了测序深度对于观测样本多样性的影响大小,曲线越平缓,表明测序结果已足够反映当前样本所包含的多样性,继续增加测序深度已无法检测到大量的尚未发现的新OTU;反之,则表明Alpha多样性尚未接近饱和。图 1为瘤胃液12个样本的稀疏曲线,稀疏曲线逐渐平缓,说明测序数据量足够大,可以反映样品中绝大多数的微生物物种信息。
|
|
表 5 样本有效序列及OTU数目统计 Table 5 Statistics of sample effective sequence and OTU number |
|
横坐标代表随机抽取的测序数据量;纵坐标代表观测到的物种数量。 The abscissa represented the amount of sequencing data randomly extracted; the vertical axis represented the number of species observed. 图 1 瘤胃液12个样本的稀释曲线 Fig. 1 Rarefaction curve of 12 rumen fluid samples |
试验肉牛瘤胃微生物Alpha多样性指数分析见表 6。代表群落多样性的Shannon指数越大,其群落多样性就越高,其中,B组数值最高,D组数值最低,但各组间差异均不显著(P>0.05)。代表群落丰富度的Chao指数越大,其群落丰富度就越高,其中C组数值最高,D组数值最低,但各组间差异均不显著(P>0.05)。
|
|
表 6 硒源和微生态制剂对肉牛瘤胃微生物Alpha多样性指数的影响 Table 6 Effects of selenium source and microecological agent on rumen microbial Alpha diversity indexes of beef cattle |
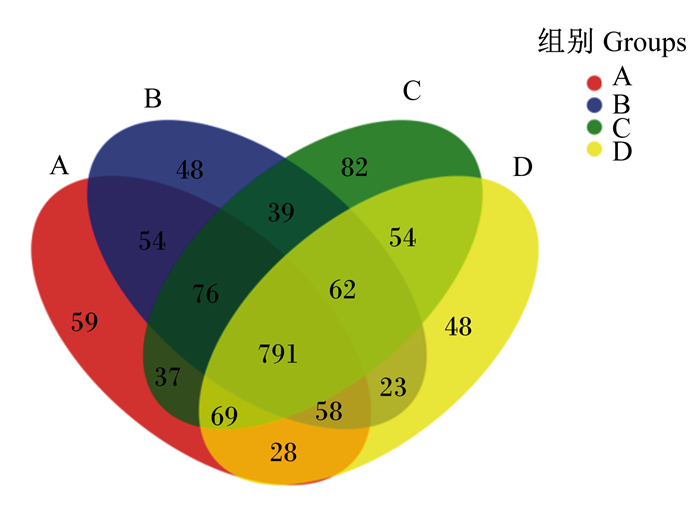
各组肉牛瘤胃微生物韦恩图见图 2。由韦恩图可知,在相似性大于97%的水平下,A组OTU数目为1 172个,B组为1 151个,C组为1 210个,D组为1 133个,C组OTU最丰富。各组共用的OTU数目为791个。A组特有OTU数目为59个,B组为48个,C组为82个,D组为48个,分别占其OTU数目的5.03%、4.17%、6.78%、4.24%,表明各组OTU组成相似度高,差异较小。
|
图 2 瘤胃微生物韦恩图 Fig. 2 Venn diagram of rumen microbes |
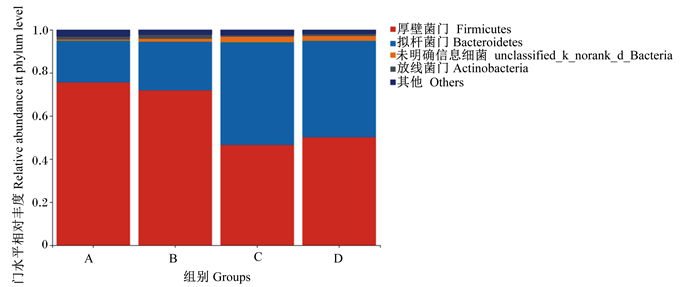
物种注释共获得20个门,其中有3个优势菌门,相对丰度由高到低依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria),各组肉牛瘤胃菌群在门水平上的组成见图 3。对排名靠前的几个菌门的相对丰度进行分析,结果见表 7。A组和B组厚壁菌门的相对丰度显著高于C组(P < 0.05),拟杆菌门的相对丰度显著低于C组(P < 0.05)。硒源对厚壁菌门的相对丰度有极显著影响(P < 0.01),对拟杆菌门、放线菌门的相对丰度有显著影响(P < 0.05)。微生态制剂以及硒源与微生态制剂的交互作用对瘤胃各菌门的相对丰度均无显著影响(P>0.05)。
|
图 3 瘤胃菌群门水平组成 Fig. 3 Composition of rumen bacterial community at phylum level |
|
|
表 7 硒源和微生态制剂对肉牛瘤胃菌群门水平相对丰度的影响 Table 7 Effects of selenium source and microecological agent on relative abundance of rumen bacterial community at phylum level of beef cattle |
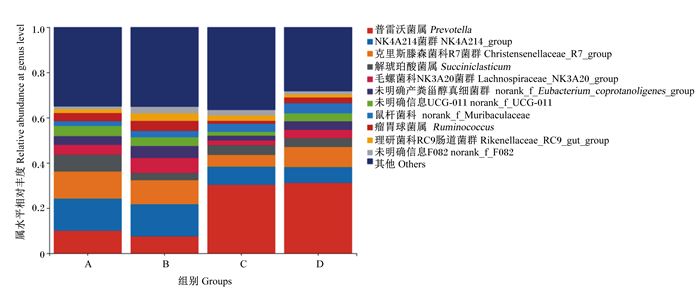
物种注释共获得282个属,其中普雷沃菌属(Prevotella)、NKA214菌群(NK4A214_group)、克里斯滕森菌科R7菌群(Christensenellaceae_R7_group)、解琥珀酸菌属(Succiniclasticum)、毛螺菌科NK3A20菌群(Lachnospiraceae_NK3A20_group)属于核心菌属,各组肉牛瘤胃菌群在属水平上的组成见图 4。对排名靠前的几个菌属的相对丰度进行分析,结果见表 8。A组和B组瘤胃NKA214菌群的相对丰度显著高于C组和D组(P < 0.05)。硒源对瘤胃NKA214菌群的相对丰度有极显著影响(P < 0.01),对普雷沃菌属的相对丰度有显著影响(P < 0.05)。微生态制剂以及硒源与微生态制剂的交互作用对瘤胃各菌属的相对丰度均无显著影响(P>0.05)。
|
图 4 瘤胃菌群属水平组成 Fig. 4 Composition of rumen bacterial community at genus level |
|
|
表 8 硒源和微生态制剂对肉牛瘤胃菌群属水平相对丰度的影响 Table 8 Effects of selenium source and microecological agent on relative abundance of rumen bacterial community at genus level of beef cattle |
有研究表明,在饲粮中补充有机硒(纳米硒、酵母硒)可以提高绵羊的DM、有机物(OM)、CP、粗脂肪(EE)、NDF和酸性洗涤纤维(ADF)消化率,其中纳米硒还可提高瘤胃发酵功能[10]。董升[11]研究表明,饲粮中添加0.6 mg/kg包被硒可极显著提高玉米秸秆的OM、ADF、NDF降解率。但也有研究表明,饲粮中添加不同硒源(亚硒酸钠、硒代蛋氨酸、酵母硒)对奶牛饲粮的DM、CP、NDF、ADF消化率无显著影响[12]。本试验结果表明,硒源和微生态制剂对肉牛营养物质消化率均无显著影响,但与添加无机硒的A组相比,添加有机硒的C组的DM、CP、NDF消化率分别提高了6.09%、7.29%、3.64%。在本试验条件下,添加有机硒时肉牛营养物质消化率优于无机硒,这与前人研究结果基本相同,这可能是因为酵母硒含有大量的营养成分和某些协调因子,可增强瘤胃微生物的活性,间接性地促进营养物质在瘤胃中的消化吸收,具体原因有待进一步研究。
目前,大量研究表明益生菌可以分解大分子营养物质,如蛋白质、糖类等,同时还可以促进机体消化道的发育及内源酶的分泌[13-14]。高堂亮等[15]研究表明,饲粮中添加活菌量为5×1010 CFU/(头·d)的微生态制剂,可显著提高肉牛的DM消化率,改善其对CP、EE、NDF和ADF的消化能力。李光梅等[16]研究表明,在饲粮中添加500或1 000 mg/kg的微生态制剂可显著提高绵羊DM、EE、CP的消化率。本试验条件下,微生态制剂及其与硒联用对肉牛营养物质消化率无显著影响,与前人研究结果不一致,可能是因为微生态制剂中益生菌的种类、添加剂量,试验饲粮以及牛的品种与年龄不同造成的。
3.2 硒源和微生态制剂对肉牛瘤胃发酵的影响硒源对反刍动物瘤胃功能具有重要影响,微量元素可维持瘤胃微生物的正常功能[17]。硒对瘤胃功能的促进作用可能是因为硒可以促进瘤胃微生物与酶的活性[18]。Wei等[19]研究表明,蛋氨酸硒可提高泌乳中期奶牛中瘤胃液中总挥发性脂肪酸以及丙酸、丁酸浓度。本研究表明,肉牛饲粮中添加不同硒源对瘤胃发酵参数无显著影响,但对乙酸/丙酸值的影响有显著性趋势,其中有机硒组的乙酸/丙酸值小于无机组。这说明添加有机硒肉牛的瘤胃发酵更趋向与丙酸型发酵,而丙酸是肉牛主要的生糖物质,瘤胃中丙酸浓度越高说明肉牛可以获得的用于增重的能量越多。
Shen等[20]研究表明,酵母培养物可改善高精饲粮条件下肉牛瘤胃液pH的稳定性。瘤胃乳头高度、宽度及瘤胃壁厚度可以反映反刍动物瘤胃的发育情况,寇慧娟等[21]研究表明,酵母培养物可促进羔羊瘤胃发育。曹文新[22]在羔羊饲粮中添加灭活酵母培养物,结果表明灭活酵母可提高瘤胃液中丙酸、总挥发性脂肪酸的浓度,其中以添加量为15 g/(d·只)时效果最优。黎凌铄等[23]研究表明,微生态制剂可以促进瘤胃发酵从乙酸型向丙酸型转变,提高能量利用效率。但也有研究表明,微生态制剂对反刍动物瘤胃液pH与挥发性脂肪酸浓度无显著影响[24-25]。本试验中,硒源和微生态制剂对肉牛瘤胃液pH均无显著影响,且各组瘤胃液pH均在正常生理范围内;此外,硒源和微生态制剂对肉牛瘤胃液挥发性脂肪酸浓度均无显著影响,可能是硒与微生态制剂对瘤胃液中碳水化合物降解菌群的影响并不显著所导致。氨态氮主要由饲粮中蛋白质在瘤胃中被微生物降解生成,是合成菌体蛋白的重要前体物质。本试验中,添加微生态制剂促进了饲粮蛋白质在瘤胃中的分解,进而显著提高了瘤胃液氨态氮浓度。
3.3 硒源和微生态制剂对肉牛瘤胃微生物区系的影响Myer等[26]对10多种肉牛瘤胃微生物区系组成的研究结果表明,拟杆菌门与厚壁菌门是肉牛瘤胃中的优势菌门。本试验条件下,各组肉牛瘤胃中优势菌门为厚壁菌门与拟杆菌门,与前人结果一致。厚壁菌门主要参与纤维物质的降解,与乙酸和乳脂的生成及脂肪的沉积密切相关;拟杆菌门主要参与非纤维物质的降解,与瘤胃中丙酸的生成具有正相关关系[27]。本试验中,无机硒组厚壁菌门的相对丰度高于有机硒组,有机硒组拟杆菌门的相对丰度高于无机硒组,推测硒源可能会影响瘤胃中优势菌门的丰度,其中添加无机硒更易降解纤维素,提高乙酸浓度,添加有机硒更易降解非纤维类物质,提高丙酸浓度。这印证了本试验中乙酸/丙酸值的结果,添加有机硒的肉牛瘤胃发酵更趋向于丙酸型发酵,有利于获得更多能量用于增重。NKA214菌群是厚壁菌门中的一种革兰氏阴性菌,可降解纤维物质产生乙酸[28]。普雷沃菌属能够降解半纤维素为解琥珀酸菌属生成丙酸提供底物[29]。本试验中,有机硒组瘤胃NKA214菌群的相对丰度极显著低于无机硒组,有机硒组瘤胃普雷沃菌属的相对丰度显著高于无机硒组,表明有机硒可通过降低NKA214菌群的相对丰度,促进普雷沃菌属的增殖来提高乙酸、丙酸产量,改善瘤胃发酵模式。
4 结论在精料补充料中添加不同形式硒源与微生态制剂对肉牛的营养物质消化率均无显著影响,但添加微生态制剂可提高瘤胃液氨态氮浓度,促进蛋白质的利用,添加有机硒可影响瘤胃菌群组成,降低瘤胃液乙酸/丙酸值,改善瘤胃发酵。
| [1] |
LOPEZ HERAS I, PALOMO M, MADRID Y. Selenoproteins: the key factor in selenium essentiality.State of the art analytical techniques for selenoprotein studies[J]. Analytical and Bioanalytical Chemistry, 2011, 400(6): 1717-1727. DOI:10.1007/s00216-011-4916-4 |
| [2] |
方热军, 谢亮, 薛俊敬, 等. 猪日粮中铜、铁、锰、锌减量使用技术研究进展[J]. 饲料工业, 2019, 40(22): 1-5. FANG R J, XIE L, XUE J J, et al. Research progress on reduction of copper, iron, manganese and zinc in pig diet[J]. Feed Industry, 2019, 40(22): 1-5 (in Chinese). |
| [3] |
秦顺义, 赵方红, 张建斌, 等. 富硒益生菌和亚硒酸钠对羔羊生产性能和抗氧化及IL-6水平的影响[J]. 中国畜牧杂志, 2016, 52(21): 86-90. QIN S Y, ZHAO F H, ZHANG J B, et al. Study on performance, antioxidative capacity and IL-6 levels in lambs fed with selenium-enriched probiotics or selenite sodium[J]. Chinese Journal of Animal Science, 2016, 52(21): 86-90 (in Chinese). |
| [4] |
秦顺义, 唐小娟, 杨泽琳, 等. 富硒益生菌对小鼠血液硒含量、总抗氧化水平、免疫能力及肠道菌群的影响[J]. 黑龙江畜牧兽医, 2016(18): 176-178. QIN S Y, TANG X J, YANG Z L, et al. Effects of selenium enriched probiotics on serum selenium content, total antioxidant level, immune capacity and intestinal microflora of mice[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(18): 176-178 (in Chinese). |
| [5] |
冉林武, 黄克和, 李灵恩, 等. 富硒益生菌对山羊瘤胃发酵和瘤胃液脂肪酸含量的影响[J]. 南京农业大学学报, 2011, 34(5): 99-104. RAN L W, HUANG K H, LI L E, et al. Effects of Se-enriched probiotics supplementation on rumen fermentation and fatty acids concentration of rumen fluid in goats[J]. Journal of Nanjing Agricultural University, 2011, 34(5): 99-104 (in Chinese). |
| [6] |
吴显实, 张克春, 卫程武, 等. 日粮添加富硒益生菌对奶牛硒吸收转化、抗氧化能力与生产性能的影响[J]. 中国兽医学报, 2010, 30(8): 1111-1114, 1132. WU X S, ZHANG K C, WEI C W, et al. Effects of supplementary selenium-enriched probiotics on absorption and conversion of selenium, antioxidative capacity and performance in dairy cows[J]. Chinese Journal of Veterinary Science, 2010, 30(8): 1111-1114, 1132 (in Chinese). |
| [7] |
中华人民共和国农业部. 肉牛饲养标准: NY/T 815-2004[S]. 北京: 中国农业出版社, 2004. The Ministry of Agriculture of the People's Republic of China. Feeding standard of beef cattle: NY/T 815-2004[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [8] |
杨胜. 饲料分析及饲料质量检测技术[M]. 北京: 北京农业大学出版社, 1993. YANG S. Feed analysis and feed quality detection technology[M]. Beijing: Beijing Agricultural University Press, 1993 (in Chinese). |
| [9] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. FENG Z C, GAO M. Improvement of the method for determination of ammonia-nitrogen content in rumen fluid by colorimetry[J]. Animal Husbandry and Feed Science, 2010, 31(6/7): 37 (in Chinese). |
| [10] |
XUN W J, SHI L G, YUE W B, et al. Effect of high-dose nano-selenium and selenium-yeast on feed digestibility, rumen fermentation, and purine derivatives in sheep[J]. Biological Trace Element Research, 2012, 150(1/2/3): 130-136. |
| [11] |
董升. 不同硒源对瘤胃营养物质代谢影响的研究[D]. 硕士学位论文. 太谷: 山西农业大学, 2005. DONG S. Effects of different selenium sources on ruminal nutrients metabolism[D]. Master's Thesis. Taigu: Shanxi Agricultural University, 2005. (in Chinese) |
| [12] |
武霞霞. 硒源及硒水平对奶牛体外瘤胃发酵及营养物质降解的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2012. WU X X. Effect of sources and levels of selenium on in vitro ruminal fermentation and nutrient degradation of dairy cows[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2012. (in Chinese) |
| [13] |
徐晨, 李烨, 孙启睿, 等. 生物絮团养殖模式下益生菌添加对异育银鲫生长、消化酶活性及肠道组织结构的影响[J]. 中国水产科学, 2018, 25(5): 1004-1011. XU C, LI Y, SUN Q R, et al. Effects of probiotic addition on the growth performance, digestive en-zyme activity, and intestinal morphology of gibel carp (Carassius auratus gibelio) cultured using biofloc technology[J]. Journal of Fishery Sciences of China, 2018, 25(5): 1004-1011 (in Chinese). |
| [14] |
YANG H, LI Z B, CHEN Q, et al. Effect of fermented Enteromopha prolifera on the growth performance, digestive enzyme activities and serum non-specific immunity of red tilapia (Oreochromis mossambicus×Oreochromis niloticus)[J]. Aquaculture Research, 2016, 47(12): 4024-4031. DOI:10.1111/are.12856 |
| [15] |
高堂亮, 沈思军, 潘晓亮, 等. 真空冷冻干燥法制备微生态制剂及其对肉牛养分表观消化率的影响[J]. 饲料工业, 2018, 39(13): 42-46. GAO T L, SHEN S J, PAN X L, et al. Preparing probiotics by vacuum freeze-drying method and its effect on nutrient apparent digestibility of beef cattle[J]. Feed Industry, 2018, 39(13): 42-46 (in Chinese). |
| [16] |
李光梅, 南木甲, 祁全青, 等. 微生态制剂对青海细毛羊营养物质消化率、屠宰性能和肉品质的影响[J]. 黑龙江畜牧兽医, 2015(12): 59-60, 63. LI G M, NAN M J, QI Q Q, et al. Effects of microecological agents on nutrient digestibility, slaughter performance and meat quality of Qinghai fine-wool sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(12): 59-60, 63 (in Chinese). |
| [17] |
GENTHER O N, HANSEN S L. The effect of trace mineral source and concentration on ruminal digestion and mineral solubility[J]. Journal of Dairy Science, 2015, 98(1): 566-573. DOI:10.3168/jds.2014-8624 |
| [18] |
FAIXOVÁ Z, FAIS Š, LENG L', et al. Haematological, blood and rumen chemistry changes in lambs following supplementation with Se-yeast[J]. Acta Veterinaria Brno, 2007, 76(1): 3-8. DOI:10.2754/avb200776010003 |
| [19] |
WEI J Y, WANG J, LIU W, et al. Short communication: effects of different selenium supplements on rumen fermentation and apparent nutrient and selenium digestibility of mid-lactation dairy cows[J]. Journal of Dairy Science, 2019, 102(4): 3131-3135. DOI:10.3168/jds.2018-15455 |
| [20] |
SHEN Y Z, WANG H R, RAN T, et al. Influence of yeast culture and feed antibiotics on ruminal fermentation and site and extent of digestion in beef heifers fed high grain rations[J]. Journal of Animal Science, 2018, 96(9): 3916-3927. DOI:10.1093/jas/sky249 |
| [21] |
寇慧娟, 陈玉林, 刘敬敏, 等. 酵母培养物对羔羊生产性能、营养物质表现消化率及瘤胃发育的影响[J]. 西北农林科技大学学报(自然科学版), 2011, 39(8): 45-50. KOU H J, CHEN Y L, LIU J M, et al. Effects of supplemental yeast culture on performance, nutrient digestibility, and rumen development in Shanbei cashmere goat lambs[J]. Journal of Northwest A & F University (Natural Science Edition), 2011, 39(8): 45-50 (in Chinese). |
| [22] |
曹文新. 灭活酵母培养物对羔羊生长性能、瘤胃发酵及机体免疫的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2020. CAO W X. Effects of inactivated yeast culture on growth performance, rumen fermentation and immunity of lambs[D]. Master's Thesis. Baoding: Hebei Agricultural University, 2020. (in Chinese) |
| [23] |
黎凌铄, 彭忠利, 陈仕勇, 等. 小肽与酵母培养物对舍饲牦牛瘤胃微生物多样性和发酵参数的影响[J]. 中国饲料, 2021(5): 16-23. LI L S, PENG Z L, CHEN S Y, et al. Effects of small peptide and yeast culture on rumen microbial diversity and fermentation parameters of yaks[J]. China Feed, 2021(5): 16-23 (in Chinese). |
| [24] |
向洋. 不同淀粉水平日粮中添加酵母培养物对奶牛干物质采食量和瘤胃发酵功能的影响[J]. 中国饲料, 2019(4): 17-21. XIANG Y. Effects of yeast culture with dietary different starch levels supplementation on lactation performance and rumen fermentation of dairy cows[J]. China Feed, 2019(4): 17-21 (in Chinese). |
| [25] |
赵国宏, 王世琴, 王芬, 等. 湖羊育肥期饲粮添加酵母培养物对营养物质表观消化率及瘤胃发酵参数的影响[J]. 畜牧兽医学报, 2019, 50(10): 2156-2165. ZHAO G H, WANG S Q, WANG F, et al. Effects of yeast culture supplementation in high-concentration diet on nutrient digestibility and rumen fermentation of fattening Hu sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(10): 2156-2165 (in Chinese). |
| [26] |
MYER P R, SMITH T P L, WELLS J E, et al. Rumen microbiome from steers differing in feed efficiency[J]. PLoS One, 2015, 10(6): e0129174. DOI:10.1371/journal.pone.0129174 |
| [27] |
曾钰. 日粮中发酵杂粕替代豆粕和添加小肽产品对肉牛生长性能、养分消化、瘤胃发酵和菌群组成的影响[D]. 硕士学位论文. 成都: 西南民族大学, 2020. ZENG Y. Effects of fermented mixed meals to replace soybean meal and small peptide products supplementation in diets on growth performance, nutrient digestion, rumen fermentation and bacterial composition of beef cattle[D]. Master's Thesis. Chengdu: Southwest Minzu University, 2020. (in Chinese) |
| [28] |
曾钰, 高彦华, 彭忠利, 等. 饲粮中添加酵母培养物对舍饲牦牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 20, 32(4): 264-276. ZENG Y, GAO Y H, PENG Z L, et al. Effects of dietary yeast culture on rumen fermentation parameters and microflora of yaks[J]. Chinese Journal of Animal Nutrition, 20, 32(4): 264-276 (in Chinese). |
| [29] |
刘程, 何韵秋, 徐宁宁, 等. 复合益生菌对泌乳中后期奶牛生产性能和瘤胃菌群的影响[J]. 中国畜牧杂志, 2020, 56(4): 115-121. LIU C, HE Y Q, XU N N, et al. Effects of compound probiotics on performance and rumen microflora in middle and late lactation dairy cows[J]. Chinese Journal of Animal Science, 2020, 56(4): 115-121 (in Chinese). |




