剩余采食量(residual feed intake, RFI)是当前公认的评价饲料转化率的最有效指标之一,1962年Koch等[1]提出将RFI作为评定饲料转化效率的指标。RFI是指每只动物的体型和表现的实际饲料摄入量和预测摄入量之间的差值[2]。当RFI越小,即实际采食量减去预期采食量越小时,可以认为饲料利用率越高。RFI属中高等遗传力性状,对RFI的选择可提高饲料效率,降低采食量,减少机体脂肪沉积。近年来我国大力实施生态保护战略,饲养方式从放牧逐渐转向舍饲。在舍饲过程中,饲料成本占60%~70%,随着饲料原料价格的不断上涨,饲草料成本也逐渐升高。研究RFI调控机制可以降低饲草料成本,降低碳和甲烷的排放量,减少对环境的污染等,这是反刍动物养殖产业可持续性发展的关键[3-6]。
代谢物是生物体表型的基础,可以更直观有效地了解生物学过程及其机理。通过对代谢物的定性定量分析,可以解析代谢途径或代谢网络。代谢组学是一种运用高通量、高灵敏度的现代分析技术,是了解机体整体生理状态的一门新兴学科,它是系统生物学的重要构成部分之一[7]。非靶向代谢组学是通过液质联用、气质联用及核磁共振等分析平台来检测某一特定条件下生物体或生物体的某一特定组织中所有代谢物,通过对获得的多维海量数据进行降维和信息挖掘,筛选出反映代谢物变化的主要成分,通过模式识别与标准代谢物谱库比对等手段来寻找潜在的差异代谢物[8-11],并进一步研究所涉及的代谢途径和变化规律,粗略阐述生物体对刺激的响应机制[12-14]。超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法具有操作简单、稳定性好、回收率高、定量限低、抗干扰能力强的优点。本试验基于UPLC-MS/MS检测方法以及多元统计分析研究不同RFI滩羊血浆代谢物的变化,探究不同RFI滩羊血浆代谢物是否有差异,以期从分子水平解释不同RFI对滩羊代谢的影响机理,为后续提高滩羊饲料利用率提供依据。
1 材料与方法 1.1 试验群体本试验所有羊只来源于宁夏某滩羊核心育种场,并在该场内饲养。选择345只(163只公羊,182只母羊)健康、生长状况良好、体重[(30±5) kg]相近的6月龄滩羊,公母分开饲养。
1.2 饲养管理试验期共75 d,包括过渡期15 d,预试期10 d,正试期50 d。公母分开饲养,分为8圈,每圈40~50只。试验期所有羊饲喂相同颗粒饲料,饲喂时采用颈夹对羊只进行限制,饲喂结束后则放开颈夹,保证羊只自由活动及饮水。试验羊只每日定点饲喂2次,每次饲喂前进行称料,置于盆中。记录羊只开始饲喂时间与结束时间,每次采食时间为20~30 min。饲喂结束后,取下食盆对剩料进行称重并记录。在正试期第1、10、20、30、40、50天晨饲前空腹称量其体重。试验开始前对羊圈进行全面消毒,每周清扫羊圈2次,保证羊只健康无病。
1.3 RFI的计算和试验羊组别确定 1.3.1 RFI计算RFI的计算参照Rajaei等[15]根据RFI分类的羔羊生产力影响的研究中所建模型。计算模型如下:
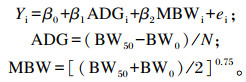
|
式中:ADG为平均日增重;MBW为平均中期代谢体重(W0.75);BW0为试验初始体重;BW50为试验终末体重;ADGi为动物i的平均日增重;MBWi为动物i的平均中期代谢体重;N为饲养天数,Yi表示动物i的实际干物质采食量;β0表示回归截距;β1为固定值,表示ADG对采食量的影响程度;β2为固定值,表示MBW对采食量的影响程度; ei表示动物i的实际采食量与拟合采食量之差,即RFI。
RFI计算公式:
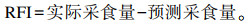
|
预测采食量计算公式:
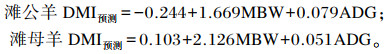
|
正试期结束后,按照RFI的平均值(mean)和标准差(SD)将试验羊分别归入高RFI组(RFI>mean+0.5SD)、中RFI组(mean-0.5SD≤RFI≤mean+0.5SD)和低RFI组(RFI < mean-0.5SD)。高RFI组和低RFI组公羊的平均体重分别为(50.93±0.62) kg、(51.80±0.83) kg,RFI分别为(0.11±0.02) kg、(-0.10±0.01) kg;高RFI组和低RFI组母羊的平均体重分别为(44.67±0.65) kg、(44.75±0.64) kg,RFI分别为(0.09±0.01) kg、(-0.08±0.01) kg[16]。根据RFI高低进行排序后,选择极高RFI滩羊14只(公、母各7只)和极低RFI滩羊12只(公、母各6只)作为本试验采集样品的羊只。
1.4 试验方法饲养试验结束后第1天晨饲前空腹对试验羊进行颈静脉采血5 mL,乙二胺四乙酸(EDTA)抗凝,采血结束后迅速3 000 r/min离心10 min,使用冻存管收集上层血浆,置于-80 ℃冰箱冷冻保存,以备后续分析。
从-80 ℃冰箱中取出血浆样品,于冰上解冻至样品中没有冰块(后续操作都要求在冰上进行)。血浆样品解冻后,涡旋10 s混匀,取50 μL加入到对应编号的离心管中;加入300 μL纯甲醇内标提取液;涡旋3 min,4 ℃条件下12 000 r/min离心10 min;吸取上清液200 μL到另一个对应编号的离心管中,-20 ℃冰箱中静置30 min;4 ℃条件下12 000 r/min再离心3 min;取150 μL上清液于对应进样瓶内衬管中,用于超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(tandem mass spectrometry,MS/MS)分析。
1.5 数据分析将试验羊的初始体重、终末体重、饲料转化率(FCR)、平均日增重(ADG)、平均中期代谢体重(MBW)、RFI数据用Excel 2019进行初步整理。将后续分析的数据导入SIMCA 14.1经pareto scaling处理后,利用无监督的主成分分析(PCA)和有监督的判别分析统计方法偏最小二乘-判别分析(PLS-DA)对数据进行分析;用正交偏最小二乘-判别分析(OPLS-DA)分析方法对PLS-DA分析结果进行修订,利用t检验和变异系数分析对预处理后的数据进行分析,筛选差异代谢物。绘制受试者工作特征曲线(ROC曲线),根据ROC曲线下的面积(AUC)进行判别,代谢物AUC>0.5时,说明此代谢物具有较好的识别能力,代谢物AUC>0.8时,说明此代谢物是识别血浆样品的主要指标。
2 结果与分析 2.1 差异代谢物分析 2.1.1 PCAPCA是一种非监督的数据分析方法,它将原本鉴定到的所有代谢物重新线性组合,形成一组新的综合变量,同时根据所分析的问题从中选取几个综合变量,使它们尽可能多地反映原有变量的信息,从而达到降维的目的。PCA模型参数R2X、Q2分别表示模型对X变量的解释率和模型预测能力,R2X越接近1表明模型越稳定可靠。按照性别差异与RFI差异分为3组(极低RFI公羊vs极高RFI公羊组、极低RFI母羊vs极高RFI母羊组、极低RFI羊vs极高RFI羊组),对不同组样品数据进行PCA,PCA得分图见图 1。由图可知,各样品能够较好地聚类在一起,说明代谢物检测系统的稳定性较好,代谢物检测数据可靠。虽然同组样品间有交叉现象,但是不同组之间仍有明显分开区域,可通过深入分析进一步研究不同组血浆代谢物的差异。
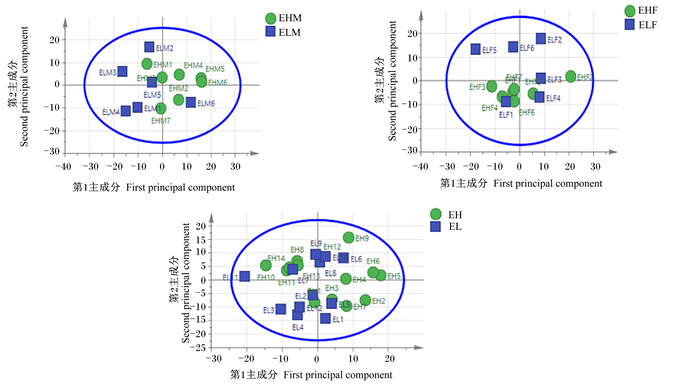
|
ELM与EHM分别表示极低RFI公羊与极高RFI公羊,ELF与EHF分别表示极低RFI母羊与极高RFI母羊,EL与EH分别表示极低RFI羊与极高RFI羊。下图同。 图A、B、C分别表示极低RFI公羊vs极高RFI公羊组、极低RFI母羊vs极高RFI母羊组、极低RFI羊vs极高RFI羊组PCA得分图。 ELM and EHM denoted extreme low RFI rams and extreme high RFI rams, respectively; ELF and EHF denoted extreme low RFI ewes and extreme high RFI ewes, respectively; EL and EH denoted extreme low RFI sheep and extreme high RFI sheep, respectively. The same as below. Figures A, B and C represented the PCA score plots of ELM vs EHM group, ELF vs EHF group and EL vs EH group, respectively. 图 1 3组滩羊PCA得分图 Fig. 1 PCA score plots of Tan sheep in three groups |
OPLS-DA是在PLS-DA的基础上对数据进行进一步修正,过滤无关的信息,从而提高模型的有效性,直接区分组间变异。如图 2中A、B、C所示,在OPLS-DA模型下,各组样品区分良好,可进一步计算用以衡量各代谢物的表达模式对样品分类判别的影响强度和解释能力的变量投影重要度(variable important for the projection,VIP),从而筛选标志差异代谢物。
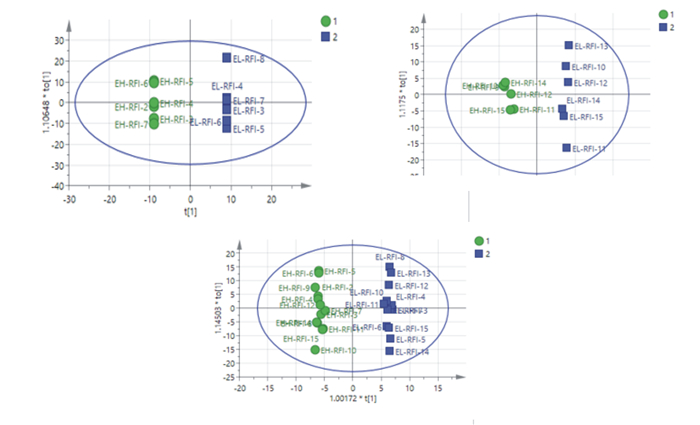
|
图A、B、C分别表示极低RFI公羊vs极高RFI公羊组、极低RFI母羊vs极高RFI母羊组、极低RFI羊vs极高RFI羊组OPLS-DA得分图。 Figures A, B and C represented the OPLS-DA score plots of ELM vs EHM group, ELF vs EHF group and EL vs EH group, respectively. 图 2 3组滩羊OPLS-DA得分图 Fig. 2 OPLS-DA score plots of Tan sheep in three groups |
利用t检验和变异系数分析对预处理后的数据进行分析。结合多元统计分析,利用OPLS-DA计算所得VIP,以VIP>1、P<0.05且FC>2或FC<0.5为标准筛选差异代谢物,并对其进行鉴定,结果如表 1所示。本试验中极低RFI公羊vs极高RFI公羊组共筛选鉴定出5种差异代谢物,为牛磺胆酸、β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱异构体,均下调;极低RFI母羊vs极高RFI母羊组共筛选鉴定出2种差异代谢物,为DL-3-苯基乳酸、十八碳二烯酰肉碱,均下调;极低RFI羊vs极高RFI羊组共筛选鉴定出4种差异代谢物,为β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱异构体,均下调。
|
|
表 1 已鉴定差异代谢物 Table 1 Identified differential metabolites |
使用MetaboAnalyst分析平台对筛选出的差异代谢物进行聚类分析。由图 3可知,极低RFI公羊和极高RFI公羊组、极低RFI母羊和极高RFI母羊组、极低RFI羊和极高RFI羊组内数据部分能聚集在一起,说明试验样品组内存在差异。
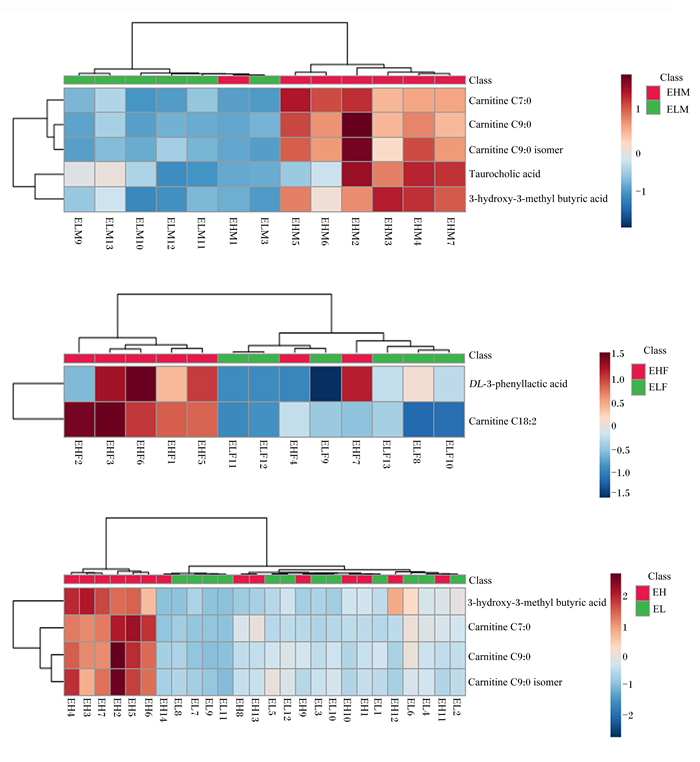
|
Class:分类;Carnitine C7 ∶ 0:庚酰肉碱;Carnitine C9 ∶ 0:壬酰肉碱;Carnitine C9 ∶ 0 isomer:壬酰肉碱异构体;Taurocholic acid:牛磺胆酸;3-hydroxy-3-methyl butyric acid:β-羟基异戊酸;DL-3-phenyllactic acid:DL-3-苯基乳酸;Carnitine C18 ∶ 2:十八碳二烯酰肉碱。 图A、B、C分别表示极低RFI公羊vs极高RFI公羊组、极低RFI母羊vs极高RFI母羊组、极低RFI羊vs极高RFI羊组层次聚类结果。Figures A, B and C represented the hierarchical clustering results of ELM vs EHM group, ELF vs EHF group and EL vs EH group, respectively. 图 3 3组滩羊差异代谢物层次聚类结果 Fig. 3 Hierarchical clustering results of differential metabolites of Tan sheep in three groups |
进一步采用ROC曲线对已筛选出的差异代谢物进行分析。由图 4可知,在公羊中,牛磺胆酸、β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱异构体AUC>0.5,说明这5种代谢物对公羊血浆样品具有较好的识别能力,其中β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱异构体AUC在0.80以上,说明这4种代谢物可作为识别高、低RFI公滩羊血浆的生物标志物。在母羊中,DL-3-苯基乳酸、十八碳二烯酰肉碱AUC>0.8,说明这2种代谢物对母羊血浆样品具有较好的识别能力,可以作为识别高、低RFI母滩羊血浆的生物标志物。在所有羊中,β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱异构体AUC>0.5,说明这4中代谢物对所有羊血浆样品具有较好的识别能力,其中庚酰肉碱AUC>0.8,说明庚酰肉碱可以作为识别滩羊血浆样品的主要指标。
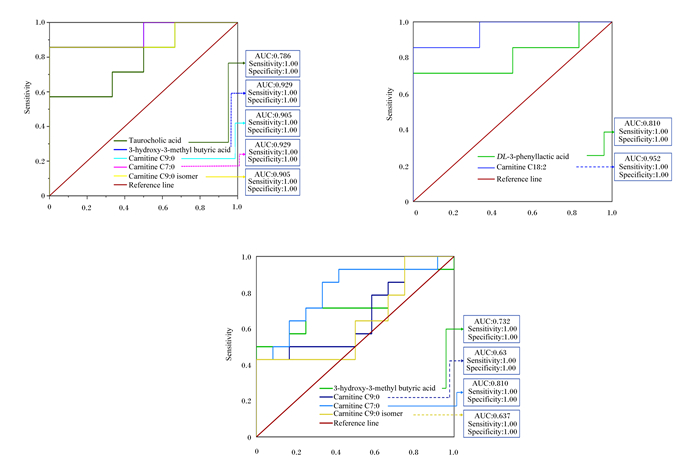
|
Carnitine C7 ∶ 0:庚酰肉碱;Carnitine C9 ∶ 0:壬酰肉碱;Carnitine C9 ∶ 0 isomer:壬酰肉碱异构体;Taurocholic acid:牛磺胆酸;3-hydroxy-3-methyl butyric acid:β-羟基异戊酸;DL-3-phenyllactic acid:DL-3-苯基乳酸;Carnitine C18 ∶ 2:十八碳二烯酰肉碱;Reference line:参考线;AUC:ROC曲线下面积area under ROC curve;Sensitivity:灵敏度;Specificity:特异性。 图A、B、C分别表示极低RFI公羊vs极高RFI公羊组、极低RFI母羊vs极高RFI母羊组、极低RFI羊vs极高RFI羊组ROC曲线。Figures A, B and C represented the ROC curves of ELM vs EHM group, ELF vs EHF group and EL vs EH group, respectively. 图 4 3组滩羊差异代谢物的ROC曲线 Fig. 4 ROC curves of differential metabolites of Tan sheep in three groups |
将AUC>0.8的差异代谢物进行峰强箱式图分析,进一步筛选差异代谢物。在图 5中可以看出,在母滩羊中,十八碳二烯酰肉碱能明显区分开,有望作为母滩羊RFI识别生物标志物;在公滩羊中,β-羟基异戊酸、庚酰肉碱,壬酰肉碱和壬酰肉碱异构体能明显区分开,有望作为公滩羊RFI识别生物标志物;在所有滩羊中,庚酰肉碱无法明显区分,故不能作为所有滩羊RFI识别生物标志物。
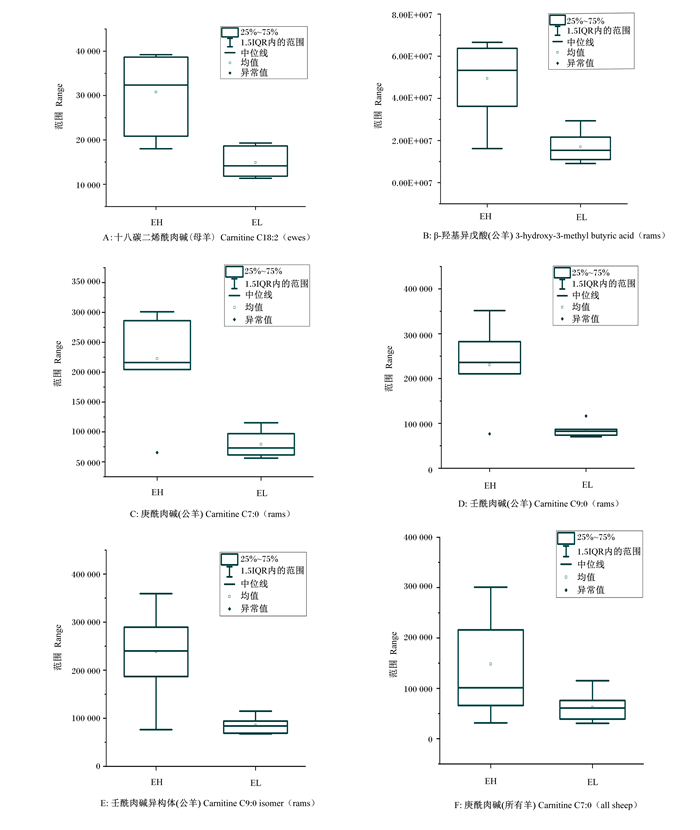
|
图 5 5个差异代谢物峰强度箱式图 Fig. 5 Peak intensity boxplot of five differential metabolites |
肉碱是一种B族维生素,又叫维生素Bt,其主要功能是作为转运长链脂肪酸的载体,将其转运至线粒体中参与脂肪酸β氧化[17]。肉碱在运输化合物的过程中会以酰基肉碱形式产生能量[18]。酰基肉碱是参与脂肪酸氧化和能量消耗的关键代谢产物[19],具有较高脂肪沉积能力的个体中酰基肉碱水平较高[20]。在脂肪代谢中,酰基肉碱水平的改变被认为是线粒体代谢改变的间接证据。酰基肉碱的积累也可被视为脂肪代谢状态不佳的标志。Clemmons等[21]在不同RFI黑安格斯肉牛血清代谢组研究中发现,肉碱水平在低RFI牛中含量较高。本研究发现在极低RFI公羊vs极高RFI公羊组中庚酰肉碱、壬酰肉碱和壬酰肉碱的异构体这3种酰基肉碱下调。导致这种现象的原因可能是与高RFI公羊相比,在极低RFI公羊中奇数中链脂肪酸在体内发生β氧化的量更多,产生更多的能量来维持机体的能量需求;而在极高RFI公羊中,奇数中链脂肪发生β氧化的较少,产生能量较少,导致酰基肉碱积累,所以饲料的利用率较低。这3种物质AUC均大于0.8,能识别不同RFI公滩羊,它们在脂肪代谢中发挥作用。
牛磺胆酸是动物胆汁成分中的一种[22],在羊胆汁中含量最高,是胆酸的羧基与牛磺酸的氨基以酰胺键相连的一种结合型胆汁酸[23]。牛磺胆酸对消化道中脂类的吸收是必需的。牛磺胆酸能增加各种脂肪酶的活性,加速脂肪水解;可降低脂肪的表面张力,增加脂肪酶作用的面积,促进水解的进行;能与甘油一酯结合,提高胆固醇和脂溶性维生素等的溶解性[24]。本研究发现在极低RFI公羊vs极高RFI公羊组中牛磺胆酸下调,可能原因是极低RFI公羊脂肪代谢能力更好,脂肪沉积更少,从而造成血浆中牛磺胆酸含量较低。虽然该物质的AUC较低,不能识别不同RFI公滩羊,但是其在脂肪代谢中发挥作用。
β-羟基异戊酸又称β-羟基-β-甲基丁酸,是亮氨酸代谢的一种中间产物,可以促进肌肉生长并减少脂肪沉积[25]。在营养研究中发现,β-羟基异戊酸作为补充剂可调节生长猪脂肪组织的脂质代谢,促进脂质代谢,导致脂肪组织减少;在饲粮中添加β-羟基异戊酸能够提高肉仔鸡的生长性能和屠宰性能[26-27]。在人类肥胖疾病的研究中发现,β-羟基异戊酸能够通过调节合成、代谢信号通路刺激蛋白质合成,发挥肌肉保护作用,可用于持续性减脂、瘦体重的保持和提高[25]。有试验表明β-羟基异戊酸能通过调节过氧化物酶体增殖物激活受体β/δ(PPARβ/δ)和细胞周期蛋白依赖性激酶4(CDK4)通路促进线粒体生物合成[28]和脂肪氧化[29]。在动物试验中,β-羟基异戊酸作为补充剂可以影响脂肪沉积,且过量补充亮氨酸可能会对脂肪代谢产生负面影响[30]。本研究中,在公羊中发现β-羟基异戊酸在极低RFI公滩羊中低表达,可能的原因是因为极低RFI公滩羊的脂肪代谢能力更好,β-羟基异戊酸作为亮氨酸代谢的中间产物,可以更好地参与到脂肪酸的氧化过程中。β-羟基异戊酸参与促进蛋白质合成,抑制蛋白质分解,促进肌肉生长,减少肌肉消耗,由于极低RFI公滩羊饲料利用率更高,脂肪储备更少,β-羟基异戊酸更多的被消耗。而极高RFI公滩羊饲料利用效率低,脂肪代谢能力较差,脂肪酸分解速率较慢,饲料更多转化为脂肪沉积,导致β-羟基异戊酸的积累。这个物质AUC大于0.8,能识别不同RFI公滩羊,其在脂肪代谢中发挥作用。
3.2 母羊差异代谢物DL-3-苯基乳酸可以与氧化态烟酰胺腺嘌呤二核苷酸(NAD+)结合生产3-羟基丙酮酸和还原态烟酰胺腺嘌呤二核苷酸(NADH),来释放能量。苯乳酸脱氢酶催化可逆的(R)-苯乳酸脱氢为(E)-肉桂酸。在苯乳酸脱水过程中,短暂的辅酶A酯的形成类似于由细菌柠檬酸裂解酶催化的柠檬酸裂解过程,其中包含1个共价结合到酰基载体蛋白(ACP)的乙酰辅酶A衍生物[31]。本研究中,在母羊中发现DL-3-苯基乳酸在极高RFI滩母羊中高表达,饲料效率较低,该物质的AUC较低,不能识别不同RFI母滩羊。DL-3-苯基乳酸代谢对饲料效率的机制还不清楚,需进一步研究。
十八碳二烯酰肉碱是一种长链酰基肉碱,肉碱棕榈酰转移酶1(CPT1)活性降低会导致十八碳二烯酰肉碱含量降低,而肉碱棕榈酰转移酶(CPT)家族成员控制脂肪酸的线粒体β氧化,并在脂质分解代谢中扮演关键分子的角色[32]。本研究中,在极低RFI母羊中发现十八碳二烯酰肉碱下调,在极高RFI滩母羊中则高表达,可能的原因是极高RFI滩母羊十八碳二烯酰肉碱分解的速度较慢,而极低RFI滩母羊脂肪的分解速率较快,分解速度快释放出大量的能量,导致饲料转化效率更高。这个物质AUC大于0.8,能识别不同RFI母滩羊,其在脂肪代谢中发挥作用。
3.3 所有滩羊差异表达分析本研究发现,在不同RFI下所有滩羊筛选出的差异代谢物与公羊出现了重复,庚酰肉碱在所有滩羊中下调,虽然AUC大于0.8,但箱式图中不能明显区分,故不能作为所有滩羊RFI的生物标志物。在对所有滩羊差异代谢物进行研究时,由于性别因素的影响,导致某些代谢物显著性水平发生变化。在公滩羊中筛选出3种奇数碳链的中链酰基肉碱差异表达,均下调,而在母滩羊中只检测到1种长链酰基肉碱,这说明性别会影响酰基肉碱的表达水平。研究发现RFI与脂肪沉积有关[33],而脂肪代谢较差会引起酰基肉碱的积累。有试验表明公绵羊的终末体重、日增重、采食量和饲料转化率等生长性能显著优于母绵羊[34]。Clare等[35]研究发现在不同RFI下性别会影响肉牛皮下脂肪组织脂肪生成途径的关键基因表达。Fan等[36]基于尾巴大小和性别对呼伦贝尔绵羊的尾脂肪沉积进行转录组研究,研究发现呼伦贝尔羊的脂肪代谢存在明显的性别差异。高栋等[37]研究了性别因素对苏尼特羊肌内脂肪沉积的影响,研究发现性别对苏尼特羊的脂肪沉积、脂代谢基因表达有影响,并且母羊体内含有正向调控脂肪沉积的基因含量显著高于公羊,说明母羊更易沉积脂肪。本研究在公滩羊中检测出多种酰基肉碱,可能也反映出性别对脂肪代谢有影响。
4 结论本试验发现在不同RFI下性别会影响血浆中的差异代谢物,血浆中β-羟基异戊酸、庚酰肉碱、壬酰肉碱、壬酰肉碱可作为识别高、低RFI公滩羊的生物标志物,血浆中十八碳二烯酰肉碱可作为识别高、低RFI母滩羊的生物标志物。
| [1] |
KOCH R M, SWIGER L A, CHAMBERS D, et al. Efficiency of feed use in beef cattle[J]. Journal of Animal Science, 1963, 22(2): 486-494. DOI:10.2527/jas1963.222486x |
| [2] |
AGGREY S E, REKAYA R. Dissection of Koch's residual feed intake: implications for selection[J]. Poultry Science, 2013, 92(10): 2600-2605. DOI:10.3382/ps.2013-03302 |
| [3] |
刘婵娟, 王生轩, 李冉冉, 等. 饲料转化效率及其在畜禽遗传育种中的研究进展[J]. 家畜生态学报, 2017, 38(10): 80-86. LIU C J, WANG S X, LI R R, et al. Feed conversion efficiency and its research progress in livestock or poultry genetics and breeding[J]. Acta Ecologae Animalis Domastici, 2017, 38(10): 80-86 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.10.015 |
| [4] |
霍鹏举, 王玉洁, 孙雨坤, 等. 剩余采食量在反刍动物生产中的研究进展[J]. 动物营养学报, 2019, 31(1): 63-69. HUO P J, WANG Y J, SUN Y K, et al. Recent advancement in residual feed intake for ruminant animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 63-69 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.008 |
| [5] |
MURO-REYSE A, GUTIERREZ-BANUELOS H, DIAZ-GARCIA L H, et al. Potential environmental benefits of residual feed intake asstrategy to mitigate methane emissions in sheep[J]. Journal of Animal and Veterinary Advances, 2012, 10(12): 1551-1556. |
| [6] |
HEGARTY R S, GOOPY J P, HERD R M, et al. Cattle selected for lower residual feed intake have reduced daily methane production[J]. Journal of Animal Science, 2007, 85(6): 1479-1486. DOI:10.2527/jas.2006-236 |
| [7] |
任向楠, 梁琼麟. 基于质谱分析的代谢组学研究进展[J]. 分析测试学报, 2017, 36(2): 161-169. REN X N, LIANG Q L. Advance in metabolomics based on mass spectrometry[J]. Journal of Instrumental Analysis, 2017, 36(2): 161-169 (in Chinese). DOI:10.3969/j.issn.1004-4957.2017.02.002 |
| [8] |
ARREOLA-RAMÍREZ J L, VARGAS M H, MANJARREZ-GUTIÉRREZ G, et al. Modifications of plasma 5-HT concentrations during the allergic bronchoconstriction in guinea pigs[J]. Experimental Lung Research, 2013, 39(7): 269-274. DOI:10.3109/01902148.2013.805855 |
| [9] |
LECHIN F, VAN DER DIJS B, OROZCO B, et al. Neuropharmacologic treatment of bronchial asthma with the antidepressant tianeptine: a double-blind, crossover placebo-controlled study[J]. Clinical Pharmacology & Therapeutics, 1998, 64(2): 223-232. |
| [10] |
BERGER M, GRAY J A, ROTH B L. The expanded biology of serotonin[J]. Annual Review of Medicine, 2009, 60: 355-366. DOI:10.1146/annurev.med.60.042307.110802 |
| [11] |
CLOUTIER N, ALLAEYS I, MARCOUX G, et al. Platelets release pathogenic serotonin and return to circulation after immune complex-mediated sequestration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(7): E1550-E1559. DOI:10.1073/pnas.1720553115 |
| [12] |
BRAND T, ANDERSON G M. The measurement of platelet-poor plasma serotonin: a systematic review of prior reports and recommendations for improved analysis[J]. Clinical Chemistry, 2011, 57(10): 1376-1386. DOI:10.1373/clinchem.2011.163824 |
| [13] |
MIDDELKOOP C M, DEKKER G A, KRAAYENBRINK A A, et al. Platelet-poor plasma serotonin in normal and preeclamptic pregnancy[J]. Clinical Chemistry, 1993, 39(8): 1675-1678. DOI:10.1093/clinchem/39.8.1675 |
| [14] |
MONAGHAN P J, BROWN H A, HOUGHTON L A, et al. Measurement of serotonin in platelet depleted plasma by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2009, 877(22): 2163-2167. DOI:10.1016/j.jchromb.2009.05.045 |
| [15] |
RAJAEI S H, NASERIAN A A, VALIZADEH R, et al. Growth performance, feed digestibility, body composition, and feeding behavior of high- and low-residual feed intake fat-tailed lambs under moderate feed restriction[J]. Journal of Animal Science, 2016, 94(8): 3382-3388. DOI:10.2527/jas.2015-0196 |
| [16] |
陈丽尧, 和东迁, 卢童童, 等. 在不限定运动的情况下滩羊RFI的测定及与其他生长性能之间的关系研究[J/OL]. 中国兽医学报, 2021, https://doi.org/10.16303/j.cnki.1005-4545.2021.10.26. CHEN L Y, HE D Q, LU T T, et al. The measurement of RFI traits of Tan sheep and the relationship with other growth performance without restricting exercise[J/OL]. Chinese Journal of Veterinary Science, 2021, https://doi.org/10.16303/j.cnki.1005-4545.2021.10.26. (in Chinese) |
| [17] |
BREMER J. Carnitine-metabolism and functions[J]. Physiological Reviews, 1983, 63(4): 1420-1480. DOI:10.1152/physrev.1983.63.4.1420 |
| [18] |
WANG W Z, FENG B, LI X, et al. Urinary metabolic profiling of colorectal carcinoma based on online affinity solid phase extraction-high performance liquid chromatography and ultra performance liquid chromatography-mass spectrometry[J]. Molecular BioSystems, 2010, 6(10): 1947-1955. DOI:10.1039/c004994h |
| [19] |
BOVO S, MAZZONI G, CALÒ D G, et al. Deconstructing the pig sex metabolome: targeted metabolomics in heavy pigs revealed sexual dimorphisms in plasma biomarkers and metabolic pathways[J]. Journal of Animal Science, 2015, 93(12): 5681-5693. DOI:10.2527/jas.2015-9528 |
| [20] |
SERRA D, MERA P, MALANDRINO M I, et al. Mitochondrial fatty acid oxidation in obesity[J]. Antioxidants & Redox Signaling, 2013, 19(3): 269-284. |
| [21] |
CLEMMONS B A, MIHELIC R I, BECKFORD R C, et al. Serum metabolites associated with feed efficiency in black angus steers[J]. Metabolomics, 2017, 13(12): 147. DOI:10.1007/s11306-017-1282-z |
| [22] |
李慧峰, 李培锋, 赵珍. 羊胆汁中甘氨胆酸提取工艺研究[J]. 安徽农业科学, 2008, 36(20): 8415. LI H F, LI P F, ZHAO Z. Study on extraction techniques of glycocholic acid from sheep bile[J]. Journal of Anhui Agricultural Sciences, 2008, 36(20): 8415 (in Chinese). DOI:10.3969/j.issn.0517-6611.2008.20.008 |
| [23] |
程雪葳. 羊胆汁中提取牛磺胆酸的中试试验及牛磺胆酸LC-MS/MS测定方法的建立[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. CHENG X W. A pilot test studies on the extraction of taurocholate acid from ovine bile and establishment of LC-MS/MS method for determination of taurocholate acid[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [24] |
侯晓礁, 李培锋. 牛磺胆酸的研究概况[J]. 中国畜牧兽医, 2007, 34(8): 146-147. HOU X J, LI P F. A review of the study of taurocholic acid[J]. China Animal Husbandry & Veterinary Medicine, 2007, 34(8): 146-147 (in Chinese). DOI:10.3969/j.issn.1671-7236.2007.08.052 |
| [25] |
王雪, 陈伟. β-羟基-β-甲基丁酸盐在肌肉减少性肥胖中的应用进展[J]. 中国医学前沿杂志(电子版), 2019, 11(12): 10-13. WANG X, CHEN W. Advances in the application of β-hydroxy-β-methylbutyrate in sarcopenic obesity[J]. Chinese Journal of the Frontiers of Medical Science(Electronic Version), 2019, 11(12): 10-13 (in Chinese). |
| [26] |
马友彪, 周梁, 王晶, 等. 胚蛋给养β-羟基-β-甲基丁酸对肉仔鸡生长性能、胴体组成和血浆激素指标的影响[J]. 动物营养学报, 2015, 27(2): 588-595. MA Y B, ZHOU L, WANG J, et al. Effects of in ovo feeding of β-hyroxy-β-methylbutyrate on growth performance, carcass composition and plasma hormones indexes in broilers[J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 588-595 (in Chinese). DOI:10.3969/j.issn.1006-267x.2015.02.031 |
| [27] |
DUAN Y H, ZHANG L Y, LI F N, et al. β-hydroxy-β-methylbutyrate modulates lipid metabolism in adipose tissues of growing pigs[J]. Food & Function, 2018, 9(9): 4836-4846. |
| [28] |
ZHONG Y Z, ZENG L M, DENG J P, et al. β-hydroxy-β-methylbutyrate (HMB) improves mitochondrial function in myocytes through pathways involving PPARβ/δ and CDK4[J]. Nutrition, 2019, 60: 217-226. DOI:10.1016/j.nut.2018.09.032 |
| [29] |
HE X, DUAN Y H, YAO K, et al. β-hydroxy-β-methylbutyrate, mitochondrial biogenesis, and skeletal muscle health[J]. Amino Acids, 2016, 48(3): 653-664. DOI:10.1007/s00726-015-2126-7 |
| [30] |
DUAN Y H, ZHANG L Y, LI F N, et al. β-hydroxy-β-methylbutyrate modulates lipid metabolism in adipose tissues of growing pigs[J]. Food & Function, 2018, 9(9): 4836-4846. |
| [31] |
CHIFIRIUC M C, BLEOTU C, DITU L M, et al. In vivo experimental model for the study of the influence of subinhibitory concentrations of phenyllactic acid on Staphylococcus aureus pathogenicity[J]. Roumanian Archives of Microbiology and Immunology, 2009, 68(1): 34-37. |
| [32] |
DICKERT S, PIERIK A J, LINDER D, et al. The involvement of coenzyme A esters in the dehydration of (R)-phenyllactate to (E)-cinnamate by Clostridium sporogenes[J]. European Journal of Biochemistry, 2003, 267(12): 3874-3884. |
| [33] |
LACOMBE V A. Expression and regulation of facilitative glucose transporters in equine insulin-sensitive tissue: from physiology to pathology[J]. ISRN Veterinary Science, 2014, 2014: 409547. |
| [34] |
DE VARGAS JUNIOR F M, MARTINS C F, DOS SANTOS PINTO G, et al. The effect of sex and genotype on growth performance, feed efficiency, and carcass traits of local sheep group Pantaneiro and Texel or Santa Inês crossbred finished on feedlot[J]. Tropical Animal Health and Production, 2014, 46(5): 869-875. DOI:10.1007/s11250-014-0579-4 |
| [35] |
CLARE M, RICHARD P, KATE K, et al. Residual feed intake phenotype and gender affect the expression of key genes of the lipogenesis pathway in subcutaneous adipose tissue of beef cattle[J]. Journal of Animal Science and Biotechnology, 2018, 9: 68. DOI:10.1186/s40104-018-0282-9 |
| [36] |
FAN H Y, HOU Y L, SAHANA G, et al. A transcriptomic study of the tail fat deposition in two types of Hulun Buir sheep according to tail size and sex[J]. Animals, 2019, 9(9): 655. DOI:10.3390/ani9090655 |
| [37] |
高栋, 高爱琴, 冀祥, 等. 性别因素对苏尼特羊背最长肌肌内脂肪沉积的影响及相关性研究[J]. 中国畜牧杂志, 2020, 56(5): 70-74. GAO D, GAO A Q, JI X, et al. Effects of gender on intramuscular fat deposition in longissimus dorsi of Sunit sheep and its correlation[J]. Chinese Journal of Animal Science, 2020, 56(5): 70-74 (in Chinese). |




