2. 上海海洋大学水产与生命学院, 上海 201306
2. College of Fisheries and Life sciences, Shanghai Ocean University, Shanghai 201306, China
锦鲤(Cyprinus carpio var. koi)也称绯鲤,属亚热带和温带淡水鱼,是一种高贵的大型观赏鱼类,以其鱼体呈现鲜艳似锦的色彩,变幻多姿的斑纹而得名,其体型矫健有力、游姿活泼沉稳,寿命也极长(平均60~70年),素有“好运鱼”、“水中活宝石”、“会游泳的艺术品”之美誉。目前,经人工选育的锦鲤品种已达百余种[1],而红白锦鲤是锦鲤的代表品种之一。锦鲤的躯干体型、花纹变化与体色色质是其经济价值和观赏价值的主要影响因素,也是锦鲤养殖所关注的重要形态特征。对单一品种而言,在光照、遗传、生理和饲料等影响鱼类体色的因素中,投喂着色饲料是最有效地改善锦鲤体色的办法。鱼类自身不能合成色素,但包括锦鲤在内的大部分淡水鱼类,可将玉米黄质、β-胡萝卜素、黄体素等其他类胡萝卜素转化成虾青素,也可将摄取食物中的虾青素直接存于体内,有效改善自身体色[2]。因此,开发既能满足营养需求又能改善体色的锦鲤配合饲料是对锦鲤养殖业可持续发展的支撑。
随着水产养殖业的持续发展,鱼粉作为水产饲料中不可或缺的优质蛋白质源需求量不断增大,长期以来价格不断攀升,寻找优质的新蛋白质源替代鱼粉是当前水产饲料产业亟需解决的问题[3]。南极磷虾是世界海洋中生物储备量最大的生物种类之一,其氨基酸、脂肪酸营养均衡,且具有适口性强、不含抗营养因子等优点,南极磷虾经加工后制成的南极磷虾粉可以作为一种新型的优质蛋白质源添加到水产饲料中[4],在鱼粉替代研究上具有较大的开发潜力。市售的南极磷虾粉包括脱脂磷虾粉和全脂磷虾粉2类,脱脂磷虾粉为全脂磷虾粉提取磷虾油后的副产品[5],其不仅包括了南极磷虾粉的肌肉成分,还包括外骨骼成分。已有研究表明,脱脂南极磷虾粉中含有较高比例的几丁质和氟,影响其在饲料中的添加比例[6],全脂磷虾粉中的南极磷虾油含有丰富的不饱和脂肪酸,使其在磷虾粉中较易氧化,不利于长期储存,此外,全脂磷虾粉和脱脂磷虾粉的氨基酸组成成分存在一定差异[7-8]。目前,关于南极磷虾粉(全脂磷虾粉)在水产饲料中的应用研究较多,已见于小丑鱼(Amphiprion latezonatus)[4]、虹鳟(Oncorhynchus mykiss)[5]、大西洋鲑(Salmo salar)[9]、星斑川鲽(Platichthys stellatus)[10]、大菱鲆(Scophthalmus maximus)[11]、尼罗罗非鱼(Tilapia nilotica)[12]等。脱脂磷虾粉作为一种新型蛋白质源,在水产饲料中的应用研究较少,仅见于圆斑星鲽(Verasper variegatus)[13]、黑鲷(Sparus macrocephlus)[14]等,而关于全脂和脱脂磷虾粉替代鱼粉对锦鲤生长性能及体色调控尚缺乏参考依据。因此,本研究拟通过使用全脂或脱脂磷虾粉梯度替代鱼粉,探讨饲料中添加不同比例全脂或脱脂磷虾粉对红白锦鲤生长性能、体色和血清生化指标的影响,为锦鲤配合饲料的开发提供参考依据。
1 材料与方法 1.1 试验鱼与养殖管理选取初体重为(13.50±0.05) g的红白锦鲤共计630尾作为试验对象,试验在中国水产科学研究院珠江水产研究所观赏鱼基地进行。将试验鱼随机分为7组(1个对照组和6个试验组),每组3个重复,每个重复30尾鱼,分别养殖在21个水族缸中,使用基础饲料投喂14 d后开始试验。试验期间每日投喂2次,投喂时间分别为07:00和14:00,每日投喂量约为鱼体质量的3%,水温(27±1) ℃,pH 7.6~7.8,每周进行换曝气水3次,换水量为全部水量1/3,水族缸不间断充气。
1.2 试验饲料试验饲料组成及营养水平见表 1,以进口鱼粉、大豆蛋白、小麦粉作为主要蛋白质源,鱼油、豆油作为脂肪源进行基础饲料的配制,在基础饲料中梯度添加全脂磷虾粉(全脂)或脱脂磷虾粉(脱脂),鱼粉替代水平分别为0、10%全脂、20%全脂、30%脱脂、10%脱脂、20%脱脂、30%脱脂,分别记为Q0、Q10、Q20、Q30、T10、T20、T30,各饲料原料均通过粉碎机粉碎后过80目网筛,经混合均匀后,制备成直径为2 mm的膨化颗粒饲料。饲料委托江门市蓬江区海豚水族有限公司加工。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
试验周期为60 d,试验开始前,每个重复取3尾鱼进行体重、体长测定,养殖期间持续记录试验鱼的死亡数量。养殖试验结束后,使用测色色差计从各重复随机取6尾鱼,即每组18尾鱼测量背鳍下方及侧线上方之间的红色体表区域的色度值,试验鱼禁食24 h,经麻醉后,称重并记录,于每个重复随机取3尾鱼置于冰盘上,尾部抽血,分离血清后置于-80 ℃保存备用。
1.4 指标测定 1.4.1 生长性能的测定根据下列公式,计算试验鱼的特定生长率(special growth ratio,SGR)、成活率(surviving rate,SR)、肥满度(condition factor, CF)。
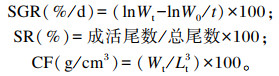
|
式中:W0为试验鱼初始总质量(g);Wt为试验鱼终末总质量(g);Wd为死亡试验鱼总质量(g);t为试验时间(d);Lt为鱼体长度(cm)。
1.4.2 色度值的测定采用国际发光照明委员会CIE规定的L*、a*、b*色空间表示体色,其中L*表示亮度值,-b*表示蓝度值,+b*表示黄度值,-a*表示绿度值,+a*表示红度值[15]。使用CR-400型色彩色差计(柯尼卡-美能达,日本)测定各组鱼体背鳍下方及侧线上方之间的区域,使用前用白板校准。试验结束后,每缸随机选取6尾鱼,每组共18尾鱼进行测定,测定位置为鱼身体背鳍下方及侧线鳞上方之间的红色体表区域。
1.4.3 血清生化指标的测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总胆固醇(TC)、甘油三酯(TG)含量均采用南京建成生物工程研究所试剂盒进行测定。
1.5 数据处理所有试验数据均以平均值±标准差(mean±SD)表示,使用SPSS 21.0软件进行单因素方差分析,用Duncan氏法进行多重比较,设定显著水平为0.05。
2 结果 2.1 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤生长性能的影响由表 2可知,Q0组的特定生长率显著低于试验组(P<0.05),试验组中,T30组的特定生长率最高,但与其余组无显著差异(P>0.05),随着南极磷虾粉替代水平的升高,红白锦鲤的肥满度逐渐降低,Q20和Q30组的肥满度最低,T10、T20、T30组间差异不显著(P>0.05)。
|
|
表 2 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤生长性能的影响 Table 2 Effects of replacing fish meal with whole fat or defatted Antarctic krill meal on growth performance of red-white koi carp |
由表 3可知,随着南极磷虾粉替代水平的升高,红白锦鲤体表红色区域各组间L*值无显著差异(P>0.05),Q30组的a*值最高,Q30、T30、Q20组的a*值显著高于其余组(P<0.05),Q10和T10组的b*值显著低于Q20、Q30组及T20、T30组(P<0.05),与Q0组无显著差异(P>0.05)。
|
|
表 3 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤体表L*、a*、b*值的影响 Table 3 Effects of replacing fish meal with whole fat or defatted Antarctic krill meal on L*, a*, b* values of red-white koi carp |
由表 4可知,随着南极磷虾粉替代鱼粉水平的升高,3个全脂组(Q10、Q20和Q30组)红白锦鲤的血清ALT活性有先降低后升高的趋势,但Q20和Q30组均显著低于Q0组(P<0.05),3个脱脂组(T10、T20和T30组)血清ALT活性逐渐下降,T30组的ALT活性最低,且T10、T20和T30组均显著低于Q0组(P<0.05);3个全脂组(Q10、Q20和Q30组)的血清AST活性均显著低于Q0组(P<0.05),且呈逐渐降低的趋势,而3个脱脂组(T10、T20和T30组)的AST活性呈先升高后降低的趋势,其中T20组显著高于Q0组。全脂组中的Q30组血清AST/ALT比值显著低于Q0组(P<0.05),2个脱脂组(T20和T30组)的血清AST/ALT比值显著高于Q0组(P<0.05)。各组间血清总胆固醇含量无显著差异(P>0.05)。各南极磷虾粉添加组血清甘油三酯含量均显著低于Q0组(P<0.05),且随着磷虾粉的添加量升高呈下降趋势。
|
|
表 4 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤血清生化指标的影响 Table 4 Effects of whole fat or defatted Antarctic krill meal instead of fish meal on serum biochemical indexes of red-white koi carp |
已有研究表明,饲料中添加适量的南极磷虾粉可以提高大西洋鳕鱼(Gadus morhua)、凡纳滨对虾(Litopenaeus vannamei)、半滑舌鳎(Cynoglossus semilaevis)等的生长性能[16],但对大西洋鲑、虹鳟、大西洋庸鲽(Hippoglossus hippoglossus)、大菱鲆的成活率和特定生长率无显著影响[11],本试验中,各组成活率无显著差异,使用全脂或脱脂南极磷虾粉替代鱼粉后,特定生长率显著升高,各替代水平间特定生长率无显著差异,表明南极磷虾粉替代鱼粉对红白锦鲤生长性能起到一定的促进作用。南极磷虾粉在不同种鱼类饲料中的替代水平不一,效果各异,这可能与试验鱼的种类、食性和试验环境有关。随着南极磷虾粉替代水平的升高,肥满度呈现逐渐降低的趋势,推测过量的南极磷虾粉影响了鱼体的脂肪消化率,进而降低鱼体脂肪含量[6]。
3.2 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤体表红质L*、a*、b*值的影响南极磷虾粉中含有约180 mg/kg的虾青素[17],而虾青素是类胡萝卜素合成的终点,在进入鱼体后可直接贮存沉积在组织中,并可与肌红蛋白非特异性结合。与其他类胡萝卜素相比,虾青素更易被鱼体所吸收和积累。因此,南极磷虾粉也有增加水产动物鲜艳色素的作用[15, 18]。L*值指发光体(反光体)表面发光(反光)强弱的物理量,亮度越高,表示颜色越鲜亮,a*和b*值分别是红度和黄度的定量分析指标,值越高,表示色块越红或越黄。在大西洋鳕饲料中使用磷虾粉替代鱼粉后,可以显著提高体表L*、a*、b*值[19],在人工养殖的赤鲷饲料中添加含有虾青素的南极磷虾粉,可以使其获得和野生赤鲷同样的红色体色[20]。本试验结果中,使用全脂或脱脂南极磷虾粉替代鱼粉后,随着替代水平的升高,各组间红白锦鲤体表L*值差异不显著,而体表a*、b*值呈现逐渐升高趋势,Q20、Q30和T30组的红白锦鲤体表a*值显著高于其余组,Q20、Q30组的b*值显著高于其余组,表明使用南极磷虾粉替代鱼粉,可以一定程度上改善红白锦鲤体表a*、b*值,增强鱼体的色彩饱满度有,但对其L*值无显著影响。全脂组(Q30和Q20组)与脱脂组(T30和T20组)相比,全脂组红白锦鲤的体表a*、b*值相对较高,推测是因为全脂南极磷虾粉中含有南极磷虾油,南极磷虾油含有40~5 000 mg/kg的虾青素[21],而脱脂南极磷虾粉中不含南极磷虾油,减弱了其着色能力。
3.3 全脂或脱脂南极磷虾粉替代鱼粉对红白锦鲤血清生化指标的影响ALT和AST主要存在于肝脏中,是氨基酸代谢中的2个关键酶,其活性大小不仅反映了氨基酸代谢程度的强弱,而且反映了肝脏功能的正常与否。正常状态下,这2种酶的活性很低,当组织细胞受损,细胞膜通透性发生改变时,才会进入血液,进而酶活性升高,此外,高比值的AST/ALT可以作为肝脏损伤的标志[22]。本试验中脱脂组(T20组)血清AST活性显著高于Q0组,而ALT活性显著低于Q0组,AST/ALT比值最高,推测在该替代水平下出现了一定程度的肝脏损伤,提高替代水平至30%时,血清AST、ALT活性显著降低,而AST/ALT比值依然显著高于其余组,则此时氨基酸代谢水平有所下降,肝脏损伤依然存在。全脂组(Q10、Q20和Q30组)中的血清ALT活性呈现先降低后升高的趋势,AST活性则呈现逐渐降低趋势,AST/ALT比值呈现降低趋势,Q10和Q20组的血清AST/ALT比值与Q0组无显著差异,Q30组的血清AST/ALT比值显著低于Q0组,则全脂组肝脏无损伤。
胆固醇是构成细胞膜的一种重要成分,也是胆汁、维生素D和激素在合成过程中所需要的原料,血液中的胆固醇70%~80%来源于肝脏,其余来自消化道,如果肝脏功能障碍,胆固醇的合成减少,血清中的胆固醇和甘油三酯的含量也随之下降[23]。本次研究结果显示,各组间血清总胆固醇含量差异不显著,但脱脂组(T30组)总胆固醇含量出现下降趋势,推测此时出现了肝脏损伤。甘油三酯是机体内存在最多的脂类,本试验中,与Q0组相比,各试验组的血清甘油三酯含量显著降低,并随着南极磷虾粉替代水平的升高而呈现下降趋势,表明机体脂肪代谢率有所下降[24]。
总体来看,全脂磷虾粉鱼粉替代水平提高对红白锦鲤血清AST/ALT比值、总胆固醇含量无显著影响,脱脂磷虾粉替代水平超过20%,血清AST/ALT比值显著升高,总胆固醇含量呈现下降趋势,肝脏出现损伤,随着替代水平的升高,3个全脂组和3个脱脂组的血清甘油三酯含量均出现下降趋势,机体脂肪代谢率都相应出现下降,脱脂磷虾粉与全脂磷虾粉相比,较高添加量易对红白锦鲤肝脏造成负面影响,推测是因为,脱脂南极磷虾粉作为提取南极磷虾油后的副产物,包括了南极磷虾的肌肉成分和外骨骼,其中有高含量的氟和几丁质,已有研究表明,氟化钠短期暴露即可对草鱼肝脏组织造成损伤,且损伤程度存在剂量依赖效应[25],而红白锦鲤属于淡水鱼,需要通过水环境和摄食矿物质来满足机体需要,体内较易积累高比例的氟,当脱脂磷虾粉添加水平过高时,氟在红白锦鲤体内的积累量随之升高,进而限制了脱脂南极磷虾粉在饲料中的添加比例[16]。
4 结论本研究结果表明,使用适量全脂或脱脂磷虾粉替代鱼粉可以在一定程度上提高红白锦鲤的生长性能,改善体色,优化血清生化指标,但当脱脂磷虾粉添加水平高于20%时,会对红白锦鲤肝脏造成损伤,而全脂磷虾粉更能有效维护肝脏健康。全脂磷虾粉与脱脂磷虾粉相比,对红白锦鲤的生长性能影响差异不显著,对体色、血清生化指标的改善优于脱脂磷虾粉。综合以上试验结果,推荐在鱼粉添加水平为500 g/kg的锦鲤饲料中,全脂磷虾粉的替代水平为20%~30%,脱脂磷虾粉的替代水平为10%~20%。
| [1] |
GORDON D R, GANTZ C A, JERDE C L, et al. Weed risk assessment for aquatic plants: modification of a New Zealand system for the United States[J]. PLoS One, 2012, 7(7): e40031. DOI:10.1371/journal.pone.0040031 |
| [2] |
孙刘娟, 吴李芸, 白东清, 等. 虾青素对血鹦鹉体色、生长和非特异性免疫指标的影响[J]. 北方农业学报, 2016, 44(1): 91-95. SUN L J, WU L Y, BAI D Q, et al. Effect of staxanthin on parrot blood body color, growth and nonspecific immune indexes[J]. Inner Mongolia Agricultural Science and Technology, 2016, 44(1): 91-95 (in Chinese). |
| [3] |
SHIMIZU C, IBRAHIM A, TOKORO T, et al. Feeding stimulation in sea bream, Pagrus major, fed diets supplemented with Antarctic krill meals[J]. Aquaculture, 1990, 89(1): 43-53. DOI:10.1016/0044-8486(90)90232-C |
| [4] |
李翔, 徐国辉, 姜光朋, 等. 南极磷虾粉替代鱼粉对公子小丑鱼生长性能、饲料利用和体色的影响[J]. 青岛农业大学学报(自然科学版), 2019, 36(3): 213-217. LI X, XU G H, JIANG G P, et al. Effect of fish meal replaced by Antarctic krill meal on growth performance, feed utilization and body color of juvenile ocellaris clownfish[J]. Journal of Qingdao Agricultural University (Natural Science Edition), 2019, 36(3): 213-217 (in Chinese). DOI:10.3969/J.ISSN.1674-148X.2019.03.010 |
| [5] |
YOSHITOMI B, AOKI M, OSHIMA S I, et al. Evaluation of krill (Euphausia superba) meal as a partial replacement for fish meal in rainbow trout (Oncorhynchus mykiss) diets[J]. Aquaculture, 2006, 261(1): 440-446. DOI:10.1016/j.aquaculture.2006.06.036 |
| [6] |
KOUSOULAKI K, RØNNESTAD I, OLSEN H J, et al. Krillhydrolysate free amino acids responsible for feed intake stimulation in Atlantic salmon (Salmosalar)[J]. Aquaculture Nutrition, 2013, 19(1): 47-61. |
| [7] |
全沁果, 段伟文, 曾雪鸽, 等. 预处理前后南极磷虾粉的氨基酸组成比较[J]. 广东海洋大学学报, 2018, 38(6): 42-47. QUAN Q G, DUAN W W, ZENG X G, et al. Comparative composition of amino acids in Antarctic krill meals before and after pretreatments[J]. Journal of Guangdong Ocean University, 2018, 38(6): 42-47 (in Chinese). DOI:10.3969/j.issn.1673-9159.2018.06.007 |
| [8] |
郑建明, 严俊丽, 陈四清, 等. 脱脂南极磷虾粉对圆斑星鲽幼鱼体组成和消化性能的影响[J]. 海洋科学, 2017, 41(12): 38-45. ZHENG J M, YAN J L, CHEN S Q, et al. Effects of dietary skimmed krill meal on the body composi-tion and digestive ability of juvenile spotted halibut (Verasper variegatus)[J]. Marine Sciences, 2017, 41(12): 38-45 (in Chinese). |
| [9] |
JULSHAMN K, MALDE M K, BJORVATN K, et al. Fluoride retention of Atlantic salmon (Salmo salar) fed krill meal[J]. Aquaculture Nutrition, 2015, 10(1): 9-13. |
| [10] |
魏佳丽. 磷虾粉在星斑川鲽和珍珠龙胆石斑鱼幼鱼饲料中的应用研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2015. WEI J L. Application effects of krill meal in feeds for juvenile starry flounder (Platichthys stellatus) and pearl gentian grouper (♀Epinephelus fuscoguttatus×Epinephelus lanceolatu)[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2015. (in Chinese) |
| [11] |
孔凡华, 梁萌青, 吴立新, 等. 南极磷虾粉对大菱鲆生长、非特异性免疫及氟残留的影响[J]. 渔业科学进展, 2012, 33(1): 54-60. KONG F H, LIANG M Q, WU L X, et al. Effect of different level of Antarctic krill meal on growth, non-specific immunity and fluoride retention in diets of turbot Scophthalmus maximus[J]. Marine Fisheries Research, 2012, 33(1): 54-60 (in Chinese). DOI:10.3969/j.issn.1000-7075.2012.01.008 |
| [12] |
GABER M MA. The effect of different levels of krill meal supplementation of soybean-based diets on feed intake, digestibility, and chemical composition of juvenile Nile tilapia Oreochromis niloticus, L[J]. Journal of the World Aquaculture Society, 2005, 36(3): 346-353. |
| [13] |
严俊丽. 圆斑星鲽(Verasper variegatus)早期色素细胞发育及南极磷虾粉在圆斑星鲽幼鱼饲料中的应用研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2017. YAN J L. Early ontogeny of chromatophores in larval skin of spotted halibut (Verasper variegatus) and application effects of krillmeal in feeds for juvenile spotted halibut[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2017. (in Chinese) |
| [14] |
王月, 李广经, 黄勇, 等. 植物蛋白替代鱼粉饲料中添加脱脂磷虾粉对黑鲷幼鱼生长及饲料利用的影响[J]. 扬州大学学报(农业与生命科学版), 2015, 36(4): 52-57. WANG Y, LI G J, HUANG Y, et al. Effects of defat Antarctic krill meal on growing performance and feed utilization of Acanthopagrus schlegelii though replacement fish meal by two plant based proteins[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2015, 36(4): 52-57 (in Chinese). |
| [15] |
崔培, 姜志强, 韩雨哲, 等. 饲料脂肪水平对红白锦鲤体色、生长及部分生理生化指标的影响[J]. 天津农学院学报, 2011, 18(2): 23-31. CUI P, JIANG Z Q, HAN Y Z, et al. ffects of dietary lipid levels on body pigmentation, growth, partial physiological and biochemical indexes of ornamental carp (Cyprinus carpio L.)[J]. Journal of Tianjin Agricultural College, 2011, 18(2): 23-31 (in Chinese). DOI:10.3969/j.issn.1008-5394.2011.02.007 |
| [16] |
郑建明. 南极磷虾产品在圆斑星鲽幼鱼饲料中的应用研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2018. ZHENG J M. Application of Antarctic krill (Euphausia superba) products in diets for juvenile spotted halibut[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2018. (in Chinese) |
| [17] |
徐吟梅, 邱卫华, 余丽萍, 等. 南极磷虾粉的营养与功能[J]. 现代渔业信息, 2010, 25(8): 14-16. XU Y M, QIU W H, YU L P, et al. Nutrition composition and function of Antarctic krill meal[J]. Modern Fisheries Information, 2010, 25(8): 14-16 (in Chinese). DOI:10.3969/j.issn.1004-8340.2010.08.004 |
| [18] |
龚洋洋, 黄艳青, 陆建学, 等. 南极磷虾粉在水产饲料中的应用研究进展[J]. 海洋渔业, 2013, 35(2): 236-242. GONG Y Y, HUANG Y Q, LU J X, et al. Research progress on application of Antarctic krill meal in aquatic feed[J]. Marine fisheries, 2013, 35(2): 236-242 (in Chinese). DOI:10.3969/j.issn.1004-2490.2013.02.016 |
| [19] |
KARLSEN R, SUONTAMA J, OLSEN R E. Effect of Antarctic krillmeal on quality of farmed Atlantic cod (Gadus morhua L.)[J]. Aquaculture Research, 2010, 37(16): 1676-1684. |
| [20] |
CEJAS J R, ALMANSA E, TEJERA N, et al. Effect of dietary supplementation with shrimp on skin pigmentation and lipid composition of red porgy (Pagrus pagrus) alevins[J]. Aquaculture, 2003, 218(1/2/3/4): 457-469. |
| [21] |
周庆新, 黄子倩, 谷彩霞, 等. 南极磷虾油中虾青素分子种组成及其消化吸收特性研究[J]. 食品工业科技, 2021, 42(12): 347-353. ZHOU Q X, HUANG Z Q, GU C X, et al. Molecular composition, digestion and absorption characteristics of astaxanthin in antarctic krill oil[J]. Science and Technology of Food Industry, 2021, 42(12): 347-353 (in Chinese). |
| [22] |
NYBLOM H, BERGGREN U, BALLDIN J, et al. High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J]. Alcohol and Alcoholism (Oxford, Oxfordshire), 2004, 39(4): 336-339. DOI:10.1093/alcalc/agh074 |
| [23] |
吴莉芳, 秦贵信, 刘春力, 等. 饲料大豆蛋白对鲤鱼消化酶活力和血液主要生化指标的影响[J]. 西北农林科技大学学报(自然科学版), 2009, 37(8): 63-69. WU L F, QIN G X, LIU C L, et al. Effects of dietary soybean protein on the activity of digestive enzyme and blood biochemical parameters of carp[J]. Journal of Northwest A&F University (Natural Science Edition), 2009, 37(8): 63-69 (in Chinese). |
| [24] |
NIU J, DU Q, LIN H Z, et al. Quantitative dietary methionine requirement of juvenile golden pompano Trachinotus ovatus at a constant dietary cystine level[J]. Aquaculture Nutrition, 2013, 19(5): 677-686. DOI:10.1111/anu.12015 |
| [25] |
陈剑杰, 曹谨玲, 罗永巨. 氟对草鱼肝脏组织显微和超微结构的影响[J]. 中国畜牧兽医, 2013, 40(12): 108-111. CHEN J J, CAO J L, LUO Y J. Effects of NaF on microstructure and ultrastructure of the liver of grass carp (Ctenopharyngodon idellus)[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(12): 108-111 (in Chinese). |




