2. 河北省牛羊胚胎技术创新中心, 保定 071000
2. Cattle and Sheep Embryo Technology Innovation Center of Hebei Province, Baoding 071000, China
枯草芽孢杆菌(Bacillus subtilis)是饲料常用益生菌种之一,它是以芽孢的形式添加到饲料中。芽孢是一种休眠状态的活细胞,能够在饲料加工过程中稳定地保持形态,有利于制成菌剂后的运输储存,在食用至机体消化道后可以极快地生长增殖[1]。而枯草芽孢杆菌对于禽畜肠道有多方面影响,主要包含调控肠道微生物平衡,调节肠道营养代谢,维护黏膜屏障的完整性,改善肠道形态,强化免疫能力,这对于肠道健康具有着重要意义[2]。任永军等[3]研究表明,在饲粮中添加枯草芽孢杆菌和地衣芽孢杆菌复合杆菌制剂300~400 mg/kg时可提高十二指肠和回肠的绒毛高度,降低十二指肠、空肠和回肠隐窝深度,提高十二指肠、空肠和回肠绒毛高度/隐窝深度(绒隐比),即能有效促进小肠发育。丁洪涛等[4]试验表明,饲粮中添加枯草芽孢杆菌能提高瘤胃发酵产气量,提高瘤胃氨态氮、总挥发性脂肪酸及丙酸含量,降低瘤胃乙酸和丙酸含量,提高瘤胃纤维的降解率,有效提高饲料的利用率。谢开春[5]研究表明,饲粮中添加酵母硒和枯草芽孢杆菌可以提高兔粪中乳酸杆菌和双歧杆菌的数量,降低大肠杆菌的数量,改善肠道微生态平衡,达到了降低消化道pH的效果。目前,尽管对枯草芽孢杆菌的研究较多,但是对于枯草芽孢杆菌对肉兔肠道微生物的影响鲜有报道。因此,本试验旨在研究枯草芽孢杆菌对肉兔肠道结构、盲肠挥发性脂肪酸含量和微生物多样性的影响,为枯草芽孢杆菌在肉兔生产中的应用提供理论支持。
1 材料与方法 1.1 试验材料及基础饲粮枯草芽孢杆菌含量为3.0×109 CFU/g。基础饲粮参照谷子林等[6]推荐的兔营养需求进行配制,基础饲粮组成及营养水平见表 1。枯草芽孢杆菌以粉剂的形式加入基础饲粮中,逐级稀释,混合均匀,制成颗粒饲料。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选取80只30日龄、体重[(1.15±0.05) kg]相近的健康伊拉肉兔,随机分为4组,每组20个重复,每个重复1只,单笼饲养。对照组饲喂基础饲粮,试验Ⅰ、Ⅱ、Ⅲ组在基础饲粮中分别添加100、200、300 g/t枯草芽孢杆菌。
1.3 饲养管理试验前对兔舍以及用具进行消毒,采用3层阶梯式金属笼单笼饲养,各个重复均匀分布,自然采光通风。每日07:00、18:00各饲喂1次,自由采食饮水。预试期7 d,正试期30 d。
1.4 测定指标和方法 1.4.1 肠道结构在正试期的第30天进行屠宰试验,每组选取体重相近的6只试验兔(公母各占1/2),颈椎脱臼处死,取各试验兔空肠、回肠、盲肠固定,制作石蜡切片,用苏木精-伊红染色显示肠黏膜结构,在光镜下观察,测量各试验兔盲肠的黏膜厚度、肌层厚度;空肠、回肠的绒毛高度、隐窝深度,并计算绒隐比。
1.4.2 盲肠pH取混合均匀的盲肠内容物3 g,在烧杯中稀释,用ST2100型酸度计进行测量。
1.4.3 盲肠挥发性脂肪酸含量取盲肠内容物1 g,用蒸馏水稀释10倍,将稀释液离心10 min(4 ℃,10 000 r/min),取1 mL上清液,加入0.2 mL含有内标物的25%偏磷酸溶液,混匀,冰水浴中放置30 min以上,再次离心10 min(4 ℃,10 000 r/min),去除样品中的蛋白质沉淀物,去上清液,使用普析G5型气相色谱仪测量盲肠总挥发性脂肪酸以及乙酸、丙酸、丁酸含量。
1.4.4 微生物多样性 1.4.4.1 DNA提取与测序文库构建无菌操作将适量盲肠内容物放入无菌冻存管中,-80 ℃超低温保存。每组分别选取6份粪便样品,每份准确称取0.2 g置于2 mL离心管中,使用特定引物对序列进行扩增,PCR产物经2%琼脂糖凝胶电泳验证。在NovaSeq PE250平台上对库进行排序(由成都联川生物科技股份有限公司完成)。
1.4.4.2 生信分析流程样品在Illumina NovaSeq平台上进行测序。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的barcode和引物序列去除。使用Vsearch软件对嵌合序列进行过滤。利用DADA2进行解调,得到特征表和特征序列。多样性和多样性通过归一化到相同的随机序列来计算。然后根据SILVA(release 132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha多样性用于分析样本物种多样性的复杂性,Beta多样性采用Blast进行序列比对,每个代表性序列用SILVA数据库对特征序列进行注释。
1.5 数据处理与分析采用Excel 2010对数据进行初步计算,再用SPSS 20.0软件对数据进行均值比较和差异性检验,用one-way ANOVA程序检验各组数据间差异是否显著,差异显著者用LSD法进行多重比较。P < 0.05为差异显著,P < 0.01为差异极显著,结果表示为平均值±标准差。
2 结果 2.1 枯草芽孢杆菌对肉兔生长性能的影响由表 2可知,与对照组相比,试验Ⅰ组平均日增重显著升高(P < 0.05),试验Ⅰ组平均日采食量显著升高(P < 0.05)。
|
|
表 2 枯草芽孢杆菌对肉兔生长性能的影响 Table 2 Effects of Bacillus subtilis on growth performance of meat rabbits |
由表 3可知,与对照组相比,试验Ⅰ组空肠绒毛高度极显著升高(P < 0.01);试验Ⅲ组空肠绒隐比极显著低于试验Ⅰ组(P < 0.01)。试验Ⅲ组回肠绒毛高度显著低于对照组和试验Ⅰ组(P < 0.05);试验Ⅲ组回肠隐窝深度极显著高于试验Ⅰ组(P < 0.01),显著高于对照组(P < 0.05);与对照组相比,试验Ⅱ组和试验Ⅲ组回肠绒隐比极显著降低(P < 0.01)。各组盲肠黏膜层厚度和肌层厚度差异均不显著(P > 0.05)。
|
|
表 3 枯草芽孢杆菌对肉兔肠道结构的影响 Table 3 Effects of Bacillus subtilis on intestinal structure of meat rabbits |
由表 4可知,与对照组相比,试验Ⅲ组盲肠pH显著升高(P < 0.05)。各组乙酸、丙酸、丁酸、总挥发性脂肪酸含量差异均不显著(P > 0.05)。
|
|
表 4 枯草芽孢杆菌对肉兔盲肠pH和挥发性脂肪酸含量的影响 Table 4 Effects of Bacillus subtilis on cecal pH and volatile fatty acid contents of meat rabbits |
采用NovaSeq PE250测序平台对试验兔盲肠内容物样本中16S rDNA的V3~V4区进行检测,20个样本测序共获得1 201 374条有效Tags,平均每个样品产生75 085条有效Tags。稀释曲线(rarefaction curve)可直接反映测序数据量的合理性,并间接反映样品中物种的丰富程度。由图 1可以看出,各组稀释曲线趋向平坦,说明测序数据量渐进合理。
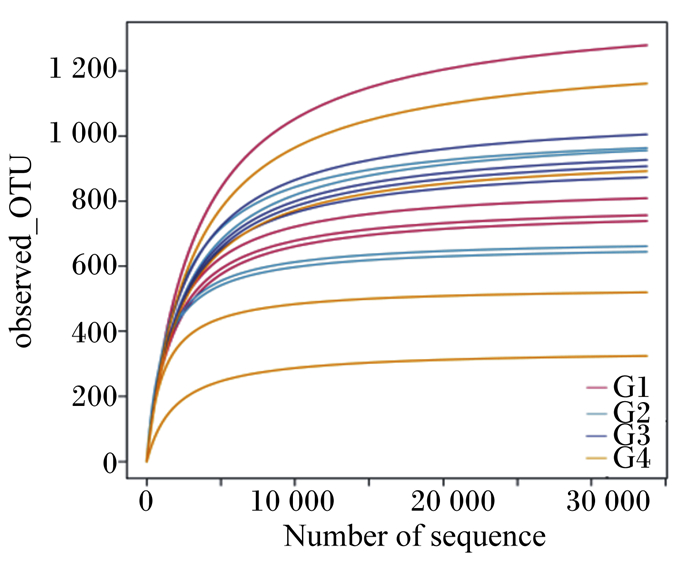
|
Number of sequence:数据排列;observed-OTU:操作分类单元观测数值。 G1:对照组;G2:试验Ⅰ组;G3:试验Ⅱ组;G4:试验Ⅲ组。下图同。 G1: control group; G2: test group Ⅰ; G3: test group Ⅱ; G4: test group Ⅲ. The same as below. 图 1 稀释曲线 Fig. 1 Rarefaction curves |
根据特征值操作分类单元(OTU)丰度表,计算各组共有OTU的数目,并通过Venn图解释各组共有和特有的OTU数目,若OTU只存在于1个分组,则该OTU为该分组特有。图中每个圈代表 1个样本/分组,圈和圈重叠部数目个数代表不同组的共有数目。由图 2可以看出,对照组,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组特有的OTU数目分别为1 783、1 388、1 749和1 432个。
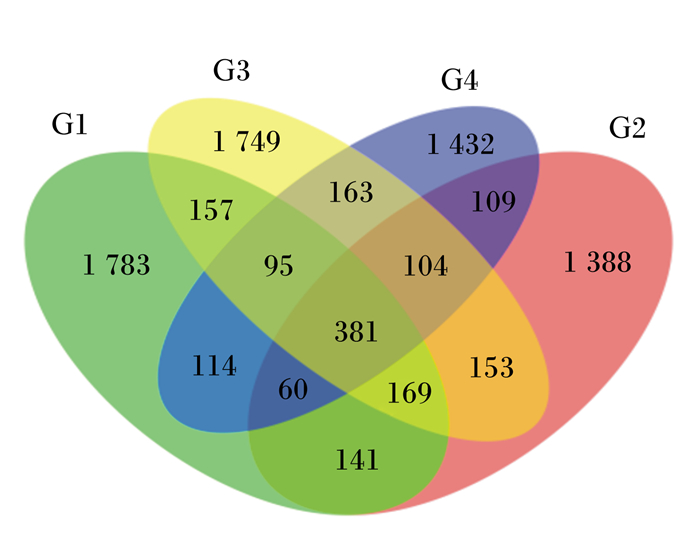
|
图 2 特征值分布Venn图 Fig. 2 Venn diagram feature distribution |
由表 5可知,与对照组相比,试验Ⅰ组盲肠微生物OTU数目和Chao1指数极显著提高(P < 0.01),试验Ⅲ组盲肠微生物OTU数目和Chao1指数极显著降低(P < 0.01)。各组盲肠微生物Shannon指数和Simpson指数差异不显著(P > 0.05)。
|
|
表 5 Alpha多样性指数 Table 5 Alpha diversity index |
对各组试验兔盲肠微生物群落进行主坐标分析(PCoA),如图 3所示。对照组和试验组组内样本聚集度较高,各组均能够区分开来。
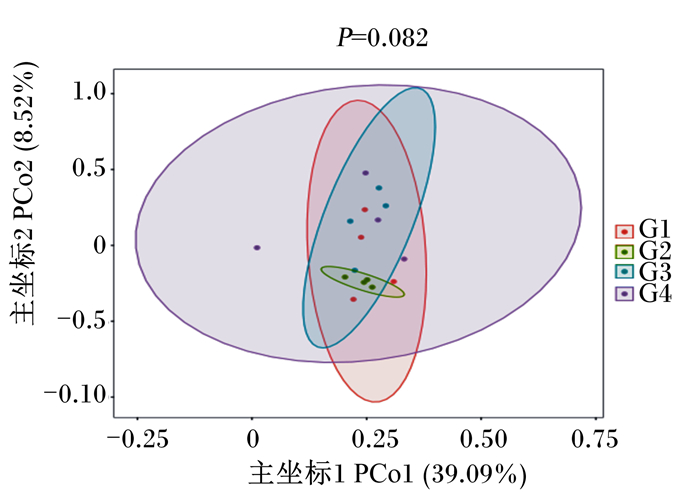
|
图 3 盲肠微生物菌群构成的主坐标分析图 Fig. 3 PCoA diagram of cecal microflora composition |
由图 4可知,各组试验兔盲肠微生物在门水平上均主要由厚壁菌门、拟杆菌门、疣微菌门、放线菌门及变形菌门这5种菌门组成。由表 5可知,与对照组相比,试验Ⅲ组厚壁菌门的相对丰度极显著降低(P < 0.01),试验Ⅲ组拟杆菌门的相对丰度极显著升高(P < 0.01);试验Ⅱ和Ⅲ组疣微菌门的相对丰度显著高于试验Ⅰ组(P < 0.05);与对照组相比,试验Ⅱ组变形菌门的相对丰度显著降低(P < 0.05)。
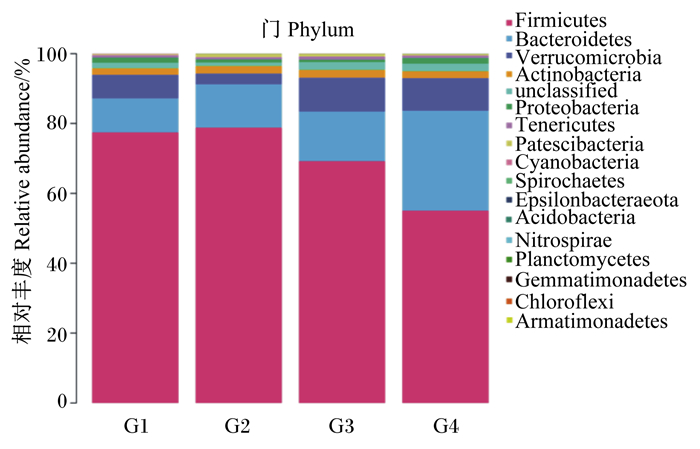
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Verrucomicrobia:疣微菌门;Actinobacteria:放线菌门;unclassified:未分类;Proteobacteria:变形菌门;Tenericutes:软壁菌门;Patescibacteria:杆菌门;Cyanobacteria:蓝藻菌门;Spirochaetes:螺旋体菌门;Epsilonbacteraeota;Acidobacteria:酸杆菌门;Nitrospirae:硝化螺旋菌门;Planctomycetes:浮霉菌门;Gemmatimonadetes:芽单胞菌门;Chloroflexi:绿弯菌门;Armatimonadetes:装甲菌门。 图 4 门水平上盲肠微生物菌群相对丰度 Fig. 4 Relative abundance of caecal microflora at phylum level |
由图 5可知,各组试验兔盲肠微生物在属水平上均主要由瘤胃球菌科NK4A214群、克里斯滕森氏菌R-7群、瘤胃球菌科UCG-014、桑科未分类菌属、艾克曼菌属、厚壁菌门未分类菌属、Subdoligranulum这7种菌属组成。由表 6可知,与对照组相比,各试验组瘤胃球菌科NK4A214群的相对丰度均显著降低(P < 0.05);各试验组克里斯滕森氏菌R-7群的相对丰度均极显著降低(P < 0.01),试验Ⅰ组瘤胃球菌科UCG-014的相对丰度极显著升高(P < 0.01),试验Ⅰ组桑科未分类菌属的相对丰度显著升高(P < 0.05),试验Ⅰ组艾克曼菌属的相对丰度极显著降低(P < 0.01),试验Ⅰ组Subdoligranulum的相对丰度极显著降低(P < 0.01),试验Ⅲ组副室杆菌属的相对丰度极显著升高(P < 0.01),试验Ⅱ组理研菌科RC9肠菌群的相对丰度显著升高(P < 0.05)。
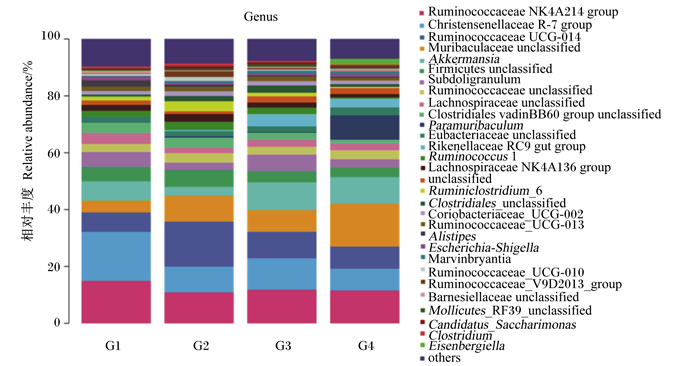
|
Ruminococcaceae NK4A214 group:瘤胃球菌科NK4A214群;Christensenellaceae R-7 group:克里斯滕森氏菌R-7群;Ruminococcaceae UCG-014:瘤胃球菌科UCG-014;Muribaculaceae unclassified:桑科未分类菌属;Akkermansia:艾克曼菌属;Firmicutes unclassified:厚壁菌门未分类菌属;Ruminococcaceae unclassified:瘤胃球菌科未分类菌属;Lachnospiraceae unclassified:毛螺菌科未分类菌属;Clostridiales vadinBB60 group unclassified:梭菌科vadinBB60群未分类菌属;Paramuribaculum:副室杆菌属;Eubacteriaceae unclassified:真杆菌科未分类菌属;Rikenellaceae RC9 gut group:理研菌科RC9肠菌群;Ruminococcus 1:瘤胃球菌属1;Lachnospiraceae NK4A136 group:毛螺菌科NK4A136群;unclassified:未分类;Ruminiclostridium_6:瘤胃梭菌属_6;Clostridiales_unclassified:梭菌未分类菌属;Coriobacteriaceae_UCG-002:红椿杆菌科_UCG-002;Ruminococcaceae_UCG-013:瘤胃球菌科_UCG-013;Alistipes:另支菌属;Escherichia-Shigella:大肠杆菌属-志贺氏菌属;Ruminococcaceae_UCG-010:瘤胃球菌科_UCG-010;Ruminococcaceae_V9D2013_group:瘤胃球菌科_V9D2013_群;Mollicutes_RF39_unclassified:柔膜菌属_RF39未分类;Candidatus_Saccharimonas:韧皮部杆菌属;Clostridium:梭菌属;Eisenbergiella:大肠杆菌属;others:其他。 图 5 属水平上盲肠微生物菌群相对丰度 Fig. 5 Relative abundance of caecal microflora at genus level |
|
|
表 6 试验兔盲肠微生物菌群在门水平上的分布 Table 6 Distribution of caecal microflora of experimental rabbits at phylun level |
绒毛高度和隐窝深度的变化反映着肠道消化吸收营养物质能力的变化,绒隐比升高表示肠壁接触食糜的面积增大,从而可以更好地吸收营养物质,黏膜的厚薄与营养物质的吸收和转运过程相关[5]。在本试验中,试验Ⅰ组空肠绒毛高度与对照组相比极显著升高;试验Ⅱ和Ⅲ组回肠绒隐比与对照组相比极显著降低。于洁等[7]试验表明,饲粮中添加枯草芽孢杆菌使肉鹅回肠绒毛高度显著提升。张雪等[8]试验表明,饲粮中添加枯草芽孢杆菌组使肉鸡回肠绒隐比提高,在一定程度上改善了回肠肠道形态。郭聪聪等[9]试验表明,枯草芽孢杆菌能提高乳鼠小肠紧密连接的形成以及改善肠屏障功能,有利于肠道发育。以上研究结果与本试验结果一致。这是因为枯草芽孢杆菌进入畜禽肠道内会迅速萌发成营养细胞,与肠道黏膜位点结合并定植[10],形成生物屏障来阻止病原微生物的吸附与繁殖,从而改善肠道结构,且能够合成脂肽类抗菌肽和蛋白类抗菌物质2种抑菌物质,通过作用于生物膜的磷脂双分子层或改变细胞膜的表面张力等途径抑制有害菌的繁殖,促进肠道内微生物菌群的平衡[2, 11]。
3.2 枯草芽孢杆菌对肉兔盲肠挥发性脂肪酸含量的影响肠道消化代谢产物与肠道健康息息相关,挥发性脂肪酸含量的提高可以改善肠道屏障功能,提高营养物质吸收效率,保护黏膜上皮细胞的完整性,增强肠道免疫功能[12-13]。本试验结果表明,与对照组相比,试验Ⅰ组肠道pH显著降低。李月明等[14]研究表明,枯草芽孢杆菌使牛体外瘤胃液总挥发性脂肪酸含量显著升高。李晓斌等[15]研究表明,添加益生菌使马驹粪便中挥发性脂肪酸含量显著提高。这些都与本试验结果一致,说明添加枯草芽孢杆菌可以提高肠道挥发性脂肪酸生成,降低肠道pH,促进肠道有益菌增殖,调节肠道菌群平衡,此外挥发性脂肪酸还可以为肠道发育供能,促进肠道发育,增强肠道屏障功能,进而改善肠道健康[2]。
3.3 枯草芽孢杆菌对肉兔盲肠微生物多样性的影响Alpha多样性是指一个特定环境或生态系统内的多样性,主要用来反映物种丰富度和均匀度以及测序深度。Beta多样性是指不同环境群落之间的物种差异性。二者一起构成了总体多样性或一定环境群落的生物异质性[16-17]。本试验结果显示,与对照组相比,试验Ⅰ组盲肠微生物OTU数目和Chao1指数极显著提高,试验Ⅲ组OTU数目和Chao1指数极显著降低。张书环等[18]研究发现,在饲粮中添加低剂量枯草芽孢杆菌使杂交鲟肠道微生物多样性升高,但随着添加剂量增加,肠道微生物多样性显著下降。Li等[19]的研究发现,枯草芽孢杆菌增加了肉鸡回肠的微生物多样性。张雯等[20]的研究发现,枯草芽孢杆菌作为益生菌剂能够对罗非鱼肠道菌群起到显著调节作用,并使罗非鱼肠道菌群多样性维持在了一个相对稳定的水平。以上研究结果与本试验结果一致,枯草芽孢杆菌定植于肠道可以有效阻止致病菌与肠道黏膜受体结合,抑制病原菌的扩散;且能消耗大量的氧气,阻止肠道中部分有害需氧菌的繁殖,为乳酸菌、双歧杆菌等有益厌氧菌的生长提供了条件,使肠道菌群得以稳定[2, 21]。但在本试验,中、高剂量枯草芽孢杆菌对微生物多样性造成了负面影响,这可能是因为过高剂量的枯草芽孢杆菌会改变肠道内微生物群落的结构,造成肠道菌群失调,影响了肠道健康。
|
|
表 7 试验兔盲肠微生物菌群在属水平上的分布 Table 7 Distribution of cecal microflora of experimental rabbits at genus level |
肠道健康与否主要与微生物群落的稳定性、肠道结构的完整度和黏膜屏障等有关[22]。已知厚壁菌门细菌类群参与复杂碳水化合物的降解和短链脂肪酸的产生[23]。拟杆菌属的成员是参与碳水化合物代谢的主要生物,它们通过表达糖基转移酶、糖苷水解酶和多糖裂解酶等酶来完成代谢[24]。本试验结果表明,在门水平上,拟杆菌门和厚壁菌门为主要菌落,占微生物群落总数的80%以上,与对照组相比,试验Ⅰ组厚壁菌门和拟杆菌门的相对丰度提高,使有益菌占比上升。这与前人的结论[25-27]一致;与对照组相比,试验Ⅱ组变形菌门的相对丰度显著降低。变形菌门包括大肠杆菌、沙门氏菌等有害菌,其占比上升将导致机体肠道炎症,造成病变[28]。Xing等[29]研究也表明,饲粮添加枯草芽孢杆菌对肉鸭小肠内大肠杆菌抑制作用明显,且提高了盲肠内乳酸菌和双歧杆菌的数量,乳酸菌通过竞争排斥抑制各种沙门氏菌的黏附,并参与肠细胞和其他上皮细胞的相互作用,以改善免疫系统。本试验结果表明,在属水平上,与对照组相比,试验Ⅰ组瘤胃球菌科NK4A214群、克里斯滕森氏菌R-7群、瘤胃球菌科UCG-014、桑科未分类菌属、艾克曼菌属的相对丰度较高。瘤胃球菌科通常是短链脂肪酸的生产者,它在降解多种多糖和纤维中发挥着关键作用[30]。克里斯滕森氏菌是属于厚壁菌门的一类菌科,同是代表机体健康的类群[31]。桑菌科则是属于拟杆菌门的一类菌科,同属有益菌[32]。艾克曼菌是一种定植于黏膜层的肠道共生体,被认为是一种很有前途的候选益生菌。在改善宿主代谢功能和免疫应答方面具有重要价值[33]。这些益生菌的相对丰度均增高,说明肠道菌群平衡变好。
4 结论饲粮添加枯草芽孢杆菌会影响肉兔盲肠菌群结构,添加适宜剂量(100 g/t)枯草芽孢杆菌可以改善肉兔肠道形态,丰富肉兔盲肠微生物多样性,平衡肠道菌群,提高家兔生长性能;而枯草芽孢杆菌添加量过高,则会对肉兔肠道健康造成负面影响。
| [1] |
闫杨, 刘月静, 陈芳. 枯草芽孢杆菌的应用现状概述[J]. 生物学教学, 2019, 44(2): 2-3. YAN Y, LIU Y J, CHEN F. An overview of the application research of Bacillus subtilis[J]. Biology Teaching, 2019, 44(2): 2-3 (in Chinese). |
| [2] |
吴丽娟, 邱光忠, 谢乔, 等. 枯草芽孢杆菌对畜禽肠道健康影响的研究进展[J]. 饲料研究, 2020, 43(7): 126-129. WU L J, QIU G Z, XIE Q, et al. Research progress of Bacillus subtilis on intestinal health of livestock[J]. Feed Research, 2020, 43(7): 126-129 (in Chinese). |
| [3] |
任永军, 雷岷, 邝良德. 复合芽孢杆菌制剂对肉兔生产性能、免疫器官指数及肉质的影响[C]//第四届(2014)中国兔业发展大会. 德阳: 中国畜牧业协会, 2014: 10-14. REN Y J, LEI M, KUANG L D. Effect of compound Bacillus preparation on performance, immune organ index and meat quality of meat rabbits[C]//The Fourth (2014) China Rabbit Industry Development Conference. Deyang: China Animal Husbandry Association, 2014: 10-14. (in Chinese) |
| [4] |
丁洪涛, 夏冬华, 秦珊珊, 等. 枯草芽孢杆菌对奶牛体外瘤胃发酵的影响[J]. 饲料研究, 2012(1): 57-59. DING H T, XIA D H, QIN S S, et al. Effects of Bacillus subtilis on in vitro rumen fermentation of dairy cows[J]. Feed Research, 2012(1): 57-59 (in Chinese). |
| [5] |
谢开春. 枯草芽孢杆菌制剂和有机硒在肉兔生产中的应用研究[D]. 博士学位论文. 南京: 南京农业大学, 2011. XIE K C. Study on application of Bacillus subtilis preparation and organic selenium in meat rabbit production[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2011. (in Chinese) |
| [6] |
谷子林, 秦应和, 任克良. 中国养兔学[M]. 北京: 中国农业出版社, 2013. GU Z L, QIN Y H, REN K L. China rabbit science[M]. Beijing: China Agriculture Press, 2013 (in Chinese). |
| [7] |
黄玉岚, 霍小东, 姚宏明, 等. 枯草芽孢杆菌WEI-62体外益生评价及其对仔猪生长性能、肠道形态和肠道菌群的影响[J]. 中国畜牧杂志, 2020, 56(11): 140-145. HUANG Y L, HUO X D, YAO H M, et al. Effects of Bacillus subtilis WEI-62 on growth performance, intestinal morphology and intestinal microflora of piglets[J]. Chinese Journal of Animal Science, 2020, 56(11): 140-145 (in Chinese). |
| [8] |
于洁, 范雪, 赵敏孟, 等. 丁酸梭菌和枯草芽孢杆菌对肉鹅生长性能、消化酶活性、抗氧化功能和肠道形态的影响[J]. 动物营养学报, 2021, 33(2): 860-868. YU J, FAN X, ZHAO M M, et al. Effects of Clostridium butyricum and Bacillus subtilis on growth performance, digestive enzyme activities, antioxidant function and intestinal morphology of meat geese[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 860-868 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.02.027 |
| [9] |
张雪, 张珊, 钟光, 等. 枯草芽孢杆菌对肉鸡生长性能、肠道组织形态和盲肠微生物组成的影响[J]. 动物营养学报, 2020, 32(11): 5195-5208. ZHANG X, ZHANG S, ZHONG G, et al. Effects of Bacillus subtilis on growth performance, intestinal morphology and cecal microbial composition of broilers[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5195-5208 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.11.025 |
| [10] |
郭聪聪, 李艳茹, 耿萌, 等. 枯草芽孢杆菌RZ001对乳鼠肠道发育、肠道菌群和Wnt信号通路相关基因表达的影响[J]. 动物营养学报, 2021, 33(1): 506-518. GUO C C, LI Y R, GENG M, et al. Effects of Bacillus subtilis RZ001 on intestinal development, intestinal microbiota and expression of Wnt signaling pathway related genes of suckling mice[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 506-518 (in Chinese). |
| [11] |
梁仙志, 廖旻晶, 王宏波, 等. 肠道微生物群与部分人类疾病的研究进展[J]. 基因组学与应用生物学, 2020, 39(12): 5874-5880. LIANG X Z, LIAO M J, WANG H B, et al. Research progress on the relation of human gut microbiota and some diseases[J]. Genomics and Applied Biology, 2020, 39(12): 5874-5880 (in Chinese). |
| [12] |
YEOMAN C J, CHIA N, JERALDO P, et al. The microbiome of the chicken gastrointestinal tract[J]. Animal Health Research Reviews, 2012, 13(1): 89-99. |
| [13] |
ZHAO T Z, LUO H L, ZHANG Y W, et al. Effect of vitamin E supplementation on growth performance, carcass characteristics and intramuscular fatty acid composition of longissimus dorsi muscle in Tan sheep[J]. Chilean Journal of Agricultural Research, 2013, 73(4): 358-365. |
| [14] |
李月明, 栾嘉明, 张敏, 等. 不同浓度枯草芽孢杆菌对体外瘤胃发酵特性的影响[J]. 中国畜牧兽医, 2019, 46(4): 1031-1037. LI Y M, LUAN J M, ZHANG M, et al. Effects of Bacillus subtilis on in vitro rumen fermentation characteristics[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(4): 1031-1037 (in Chinese). |
| [15] |
李晓斌, 臧长江, 谢景龙, 等. 补喂复合益生菌对3~6月龄伊犁马粪便纤维含量、挥发性脂肪酸浓度和血浆细胞因子水平的影响[J]. 中国畜牧兽医, 2019, 46(1): 140-146. LI X B, ZANG C J, XIE J L, et al. Effect of supplement feeding compound probiotics on feces fiber, VFA concentration and plasma cytokines levels of 3-6 months old Yili horse[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(1): 140-146 (in Chinese). |
| [16] |
LI B, ZHANG X X, GUO F, et al. Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J]. Water Research, 2013, 47(13): 4207-4216. |
| [17] |
CAO G T, DAI B, WANG K L, et al. Bacillus licheniformis, a potential probiotic, inhibits obesity by modulating colonic microflora in C57BL/6J mice model[J]. Journal of Applied Microbiology, 2019, 127(3): 880-888. |
| [18] |
张书环, 吴金平, 褚志鹏, 等. 饲喂枯草芽孢杆菌对杂交鲟生长和肠道菌群结构的影响[J]. 海洋渔业, 2021, 43(1): 71-80. ZHANG S H, WU J P, CHU Z P, et al. Effects of feeding Bacillus subtilis on growth and intestinal microflora of hybrid sturgeon[J]. Marine Fisheries, 2021, 43(1): 71-80 (in Chinese). |
| [19] |
LI C L, WANG J, ZHANG H J, et al. Corrigendum: intestinal morphologic and microbiota responses to dietary Bacillus spp. in a broiler chicken model[J]. Frontiers in Physiology, 2019, 10: 322. |
| [20] |
张雯, 王芳婷, 倪莉. 枯草芽孢杆菌对冰鲜罗非鱼肠道菌群的调节及保鲜作用[J]. 中国食品学报, 2020, 20(9): 173-179. ZHANG W, WANG F T, NI L. Effects of Bacillus subtilis on intestinal flora and freshness of tilapia during ice storage[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(9): 173-179 (in Chinese). |
| [21] |
黄东彦, 朱剑锋, 周海泳, 等. 益生菌群维持肠道健康分子机制的研究进展[J]. 湖南生态科学学报, 2016, 3(2): 43-50. HUANG D Y, ZHU J F, ZHOU H Y, et al. Reviewon molecular mechanisms of probiotics microbiota on maintaining of intestinal health[J]. Journal of Hunan Ecological Science, 2016, 3(2): 43-50 (in Chinese). |
| [22] |
TANG W J, QIAN Y, YU B, et al. Effects of Bacillus subtilis DSM32315 supplementation and dietary crude protein level on performance, gut barrier function and microbiota profile in weaned piglets1[J]. Journal of Animal Science, 2019, 97(5): 2125-2138. |
| [23] |
THIBODEAU A, FRAVALO P, YERGEAU É, et al. Chicken caecal microbiome modifications induced by Campylobacter jejuni colonization and by a non-antibiotic feed additive[J]. PLoS One, 2015, 10(7): e0131978. |
| [24] |
CANTAREL B L, LOMBARD V, HENRISSAT B. Complex carbohydrate utilization by the healthy human microbiome[J]. PLoS One, 2012, 7(6): e28742. |
| [25] |
JANDHYALA S M, TALUKDAR R, SUBRAMANYAM C, et al. Role of the normal gut microbiota[J]. World Journal of Gastroenterology, 2015, 21(29): 8787-8803. |
| [26] |
AHIR V B, KORINGA P G, BHATT V D, et al. Metagenomic analysis of poultry gut microbes[J]. Indian Journal of Poultry Science, 2010, 45(2): 111-114. |
| [27] |
MONTEILS V, CAUQUIL L, COMBES S, et al. Potential core species and satellite species in the bacterial community within the rabbit caecum[J]. FEMS Microbiology Ecology, 2008, 66(3): 620-629. |
| [28] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. |
| [29] |
XING Y, WANG S, FAN J, et al. Effects of dietary supplementation with lysine-yielding Bacillus subtilis on gut morphology, cecal microflora, and intestinal immune response of Linwu ducks[J]. Journal of Animal Science, 2015, 93(7): 3449-3457. |
| [30] |
YANG Q Z M, WEI C C, GUO S T, et al. Cloning and characterization of a L-lactate dehydrogenase gene from Ruminococcaceae bacterium CPB6[J]. World Journal of Microbiology & Biotechnology, 2020, 36(12): 182. DOI:10.1007/s11274-020-02958-4 |
| [31] |
WATERS J L, LEY R E. The human gut bacteria Christensenellaceae are widespread, heritable, and associated with health[J]. BMC Biology, 2019, 17(1): 83. |
| [32] |
SMITH B J, MILLER R A, ERICSSON A C, et al. Changes in the gut microbiome and fermentation products concurrent with enhanced longevity in acarbose-treated mice[J]. BMC Microbiology, 2019, 19(1): 130. |
| [33] |
ZHANG T, LI Q Q, CHENG L, et al. Akkermansia muciniphila is a promising probiotic[J]. Microbial Biotechnology, 2019, 12(6): 1109-1125. |




